扩展功能
文章信息
- 陈玲萌, 孟祥玥, 张艳, 桂玥, 吴霜, 李艳超, 谭百宏
- CHEN Lingmeng, MENG Xiangyue, ZHANG Yan, GUI Yue, WU Shuang, LI Yanchao, TAN Baihong
- 癫痫持续状态后小鼠海马组织神经元中微管蛋白和内体-溶酶体系统表达的变化及其意义
- Changes of expressions of tubulin and endosome-lysosome system in neurons in hippocampus tissue of mice after status epilepticus and their significances
- 吉林大学学报(医学版), 2020, 46(03): 470-475
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 470-475
- 10.13481/j.1671-587x.20200307
-
文章历史
- 收稿日期: 2019-10-15
2. 吉林医药学院基础医学院人体解剖教研室, 吉林吉林 132013;
3. 吉林大学基础医学院实验教学中心, 吉林 长春 130021;
4. 吉林大学生命科学公共技术中心, 吉林 长春 130021
2. Department of Human Anatomy, School of Basic Medical Sciences, Jilin Medical College, Jilin 132013, China;
3. Core Facilities For Life Science, Jilin University, Changchun 130021, China;
4. Laboratory Teaching Center, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
癫痫是大量中枢神经元突发性同步放电引起的暂时性脑功能失常,是一种常见的神经系统疾病[1]。癫痫持续状态(status epilepticus,SE)是患者或实验动物长时间持续性痫性抽搐导致的一种危及生命的病理状态。SE结束后数日到数周内,患者或动物脑内敏感区域神经元出现迟发性选择性死亡,进而形成反复自发性癫痫发作[2]。神经元结构和功能的维持高度依赖于微管骨架,研究[3]显示:SE后, 小鼠海马内微管结合蛋白MAP2出现减少趋势。然而到目前为止,神经元死亡与微管损伤的关系尚未见相关报道。
SE后突触间隙积聚了大量生物活性物质,这些活性物质被神经末梢吞进神经元胞体内,最终借助内体-溶酶体系统加以回收或降解[4]。微管作为细胞内运输轨道,与膜性细胞器的运输和定位密切相关。因此一旦微管骨架受损,神经元中的内体-溶酶体系统即发生瘫痪,从而可能导致神经元发生自溶性死亡[5-7]。本研究采用匹鲁卡品诱导的癫痫动物模型,通过检测SE后海马神经元中微管和内含体-溶酶体系统的变化,探讨神经元迟发性死亡与微管和内体-溶酶体系统损伤的关系,为癫痫治疗提供新的理论依据。
1 材料与方法 1.1 动物、主要试剂和仪器40只8周龄ICR雄性小鼠,体质量22~24 g,购于吉林大学实验动物中心,动物使用许可证号: SYXK (吉) 2013-0005。与本研究相关的所有实验均得到吉林大学动物委员会支持,所有动物相关操作均遵守吉林大学实验动物规则。匹鲁卡品、东莨菪碱、焦油紫和DPX防淬灭封片剂均购自美国Sigma公司,鼠抗微管蛋白β-tubulin单克隆抗体、兔抗Rab5单克隆抗体、兔抗LAMP1单克隆抗体和驴血清购自美国Abcam公司,Fluoro-Jade B(F-JB)购自美国Millipore公司,Immu-Mount封片剂购自美国Thermo公司,OCT包埋剂购自日本Tissue-Tek Sakura Finetek公司,Alexa-488标记驴抗鼠和Alexer-594标记驴抗兔等荧光二抗购自美国Molecular Probes公司,Leica-CM1900型低温恒冷切片机购自德国Leica公司,Ⅸ71倒置荧光显微镜和BX53荧光显微镜购自日本Olympus公司。
1.2 匹鲁卡品癫痫动物模型的制备选择每日上午8:00~12:00,实验环境保持安静。将40只小鼠随机分为实验组(n=33)和对照组(n=7)。2组小鼠均腹腔注射1 mg·kg-1东莨菪碱拮抗外周胆碱能不良反应,30 min后实验组小鼠腹腔注射匹鲁卡品(300 mg·kg-1),对照组小鼠腹腔注射生理盐水。匹鲁卡品注射后根据改良Racine分级方法进行小鼠行为学评估,实验小鼠出现4~5级癫痫发作,表现为不间断的持续抽搐2 h,达到SE标准。所有符合SE标准的小鼠在SE2 h后给予1 g·L-1安定终止癫痫发作,对照组小鼠在相同时间内给予相同剂量的安定。注射匹鲁卡品后未发生SE和未到达4~5级癫痫发作的小鼠不纳入本研究。随机将SE小鼠分为SE1d(n=5)、SE2d(n=5)、SE3d(n=5)和SE7d(n=5)组,每只鼠单独装笼,给予软质饮食和水,置于安静环境中。
1.3 实验动物分组和标本制备在不同给药时间后取材,采用10%水合氯醛麻醉小鼠,心脏灌流后将脑组织置入4%多聚甲醛中,4℃后固定2~6 h,随后放入梯度蔗糖中脱水直至沉底,采用OCT包埋剂冷冻包埋,采用恒冷切片机切成30 μm矢状切片。
1.4 各组小鼠海马神经元损伤情况检测Nissl染色:神经元死亡后胞质中核糖体减少,Nissl染色减弱甚至消失。将冷冻切片贴于防脱载玻片,室温自然晾干后放入100%氯仿中反应30 min;经过100%丙酮和梯度酒精处理后,放入焦油紫工作液中染色90 min,随后经酒精脱水、二甲苯透明,中性树脂封片,显微镜下观察各组小鼠海马神经无损伤情况。
F-JB染色:神经元变性后对F-JB亲和力显著增高而发出绿色荧光,因此F-JB染色可以用来检查神经元变性情况。将冷冻切片贴于防脱载玻片,室温自然晾干后置于1%NaOH-80%乙醇混合液中约5 min, 经过70%乙醇和0.06%高锰酸钾处理后,置于F-JB工作液避光反应20 min,经二甲苯透明后,采用DPX封片。Olympus BX53F(日本Tokyo公司)荧光显微镜观察神经元变性情况。
Nissl和F-JB染色结果按照TANAY等[8]方法进行统计分析。每组选择至少8张切片,在各组中分别选取相同位置、相同大小的3个相邻区域,每个区域均严格局限于锥体细胞层中,采用Image J软件计数细胞数,最终结果表示为单位毫米长度的细胞数(cells/mm)。
1.5 各组小鼠海马神经元中微管、早期内体和溶酶体蛋白表达水平检测在室温下采用含有0.3%Triton X-100的驴血清将冷冻切片封闭30 min后,分别加入鼠抗β-tubulin单克隆抗体、兔抗Rab5单克隆抗体或兔抗LAMP1单克隆抗体(均为1:500)4℃过夜;第二天采用0.1 mol·L-1PBS清洗后加入Alexa-488标记的驴抗鼠或Alexa-594标记的驴抗兔抗体(均为1:500)孵育1 h,采用IMMU-MOUNT封片, 荧光显微镜下观察。
含有微管的结构与Alexa-488结合之后发出绿色荧光,通过分析荧光信号的定位和面积可以检测微管蛋白表达水平的变化。早期内体的检测指标为Rab5,溶酶体的检测指标为LAMP1,采用含有Rab5或LAMP1的结构与Alexa-594结合后发出红色荧光,通过分析荧光信号的定位和面积可以检测Rab5或LAMP1表达的变化。β-tubulin、Rab5和LAMP1阳性面积按照ZHANG等[9]的方法进行统计分析。每组选择至少8张切片,在各组小鼠海马CA1区辐射层内分别选取相同位置、相同大小区域,采用Image-Pro Plus软件测量阳性区域面积,最终结果以阳性面积占所在区域面积的百分比表示。
1.6 双重荧光染色观察各组小鼠海马神经元中微管蛋白β-tubulin与早期内体蛋白Rab5和溶酶体结构蛋白LAMP1表达的关系冷冻切片,室温封闭1 h后,加入鼠抗β-tubulin单克隆抗体(1:500)、兔抗Rab5单克隆抗体(1:500)和兔抗LAMP1单克隆抗体(1:500),4℃过夜;24 h后采用0.1 mol·L-1PBS漂洗,加入Alexa-594标记的驴抗兔抗体和Alexa-488标记的驴抗鼠抗体室温反应2 h,采用IMMU-MOUNT封片, 并在荧光显微镜下观察。双重荧光染色将微管蛋白标记为绿色,将Rab5和LAMP1标记为红色,通过分析不同时间点红绿荧光信号分布的变化,检测微管蛋白β-tubulin与内体和溶酶体蛋白Rab5和LAMP1在时间轴上的关系。
1.7 统计学分析采用SPASS 22.0统计软件进行统计学分析。各组小鼠海马神经元中Nissl和F-JB阳性细胞数、海马神经元中β-tubulin、Rab5及LAMP1阳性面积百分比以x±s表示,组间比较采用单因素方差分析和Tukey多重比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠海马组织中神经元损伤情况Nissl染色结果显示:对照组小鼠海马组织中各区神经元排列规则、形态完整,无明显异常;与对照组比较,SE 1 d组小鼠海马组织中神经元变化不明显;在SE 2 d组小鼠海马CA1和CA3区锥体细胞中核糖体明显减少,Nissl染色程度明显降低;随着时间延长,SE3d和SE7d组小鼠海马CA1和CA3区Nissl染色进一步减弱,死亡神经元数相应增多,见图 1(插页三)。定量分析表明:与对照组比较,SE1d、SE2d、SE3d和SE7d组小鼠海马组织中Nissl阳性神经元数明显减少(P < 0.01)。见表 1。
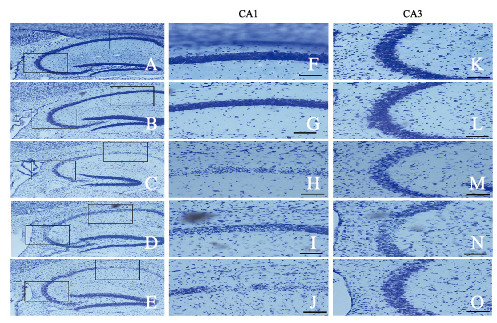
|
| A-E: ×100; F-O: ×400;F-J:CA1;K-O:CA3; A, F, K: Control group; B, G, L: SE 1 d group; C, H, M: SE 2 d group; D, I, N: SE3 d group; E, J, O: SE 7 d group. 图 1 Nissl染色观察不同时间点各组小鼠海马组织中神经元形态表现 Fig. 1 Morphology of neurons in hippocampal tissue of mice in various groups at different time points observed by Nissl staining |
|
|
| Group | n | Number of Nissl positive cells | Number of F-JB positive cells |
| Control | 7 | 270.30±7.90 | 0.04±0.03 |
| SE 1 d | 5 | 248.26±6.60* | 30.10±2.80* |
| SE 2 d | 5 | 170.37±1.10* | 63.80±1.80* |
| SE 3 d | 5 | 111.19±1.40* | 71.70±0.70* |
| SE 7 d | 5 | 98.96±0.73* | 82.70±1.60* |
| * P < 0.01 compared with control group. | |||
F-JB染色结果显示:对照组小鼠海马组织中未观察到F-JB阳性神经元。与对照组比较,SE1d组小鼠海马CA1和CA3区出现少量F-JB阳性神经元。随着时间的延长,SE2d和SE3d组小鼠海马组织中F-JB阳性神经元数明显增多,SE7d组小鼠海马组织中F-JB阳性神经元数最多。见图 2(插页三)。定量分析结果表明:与对照组比较,SE1d、SE2d和SE3d组小鼠海马CA1区F-JB阳性细胞数增多(P < 0.01),SE7d组小鼠海马组织中F-JB阳性细胞数明显增多(P < 0.01)。见表 1。
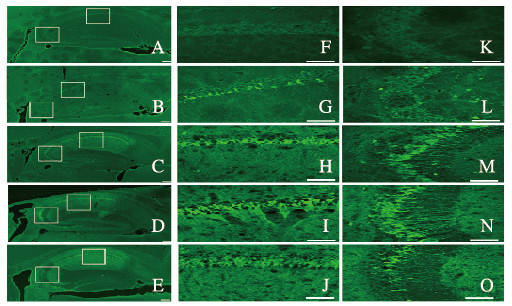
|
| A-E:×100; F-O: ×400;F-J:CA1; K-O:CA3;A, F, K:Control group; B, G, L: SE 1 d group; C, H, M: SE 2d group; D, I, N: SE3 d group; E, J, O: SE 7 d group. 图 2 F-JB染色观察不同时间点各组小鼠海马组织中神经元形态表现 Fig. 2 Morphology of neurons in hippocampus tissue of mice in various groups at different time points observed by F-JB staining |
|
|
对照组中微管蛋白β-tubulin主要分布在小鼠海马CA1和CA3区神经元的树突中。与对照组比较,SE1d组小鼠海马CA1和CA3区神经元树突中微管蛋白β-tubulin荧光强度均明显降低。随着时间的延长,SE2d、SE3d和SE7d各组小鼠海马组织中微管蛋白β-tubulin表达呈进行性降低,尤其SE7d组小鼠海马CA1和CA3区中几乎检测不到微管蛋白β-tubulin的表达,见图 3(插页三)。定量分析表明:SE1d组小鼠海马CA1区微管蛋白β-tubulin阳性面积百分比降低,与对照组比较差异无统计学意义(P>0.05);随着时间的延长,SE2d、SE3d和SE7d组小鼠海马组织中微管蛋白β-tubulin阳性面积百分比明显低于对照组(P < 0.05或P < 0.01)。见图 4。
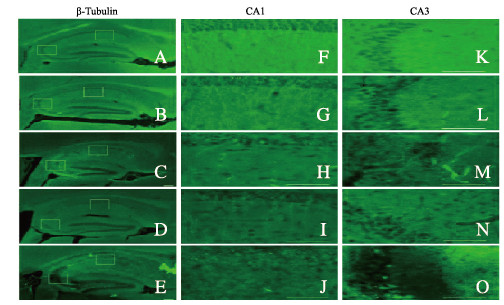
|
| A-E: ×100; F-O: ×400; F-J: CA1;K-O:CA3; A, F, K: Control group; B, G, L: SE 1 d group; C, H, M: SE 2 d group; D, I, N: SE3 d group; E, J, O: SE 7 d group. 图 3 免疫荧光染色观察不同时间点各组小鼠海马组织中β-微管蛋白表达 Fig. 3 Expressions of β-tubulin in hippocampus tissue of mice in various groups at different time points observed by fluorescence staining |
|
|
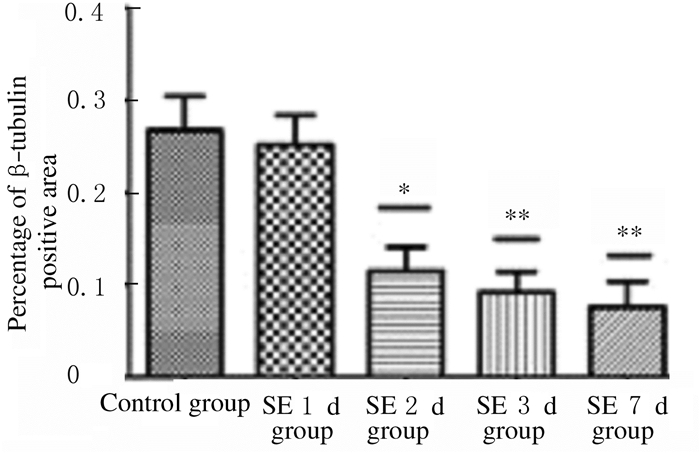
|
| *P < 0.05, * *P < 0.01 compared with control group. 图 4 免疫荧光染色检测各组小鼠海马组织中β-tubulin阳性面积百分比 Fig. 4 Percentages of β-tubulin positive areas in hippocampus tissue of mice in various groups detected by immunofluorescencestaining |
|
|
对照组小鼠海马组织中Rab5和LAMP1主要分布在海马神经元树突和细胞体中。与对照组比较,SE 1d组小鼠海马CA1和CA3区中Rab5表达强度轻微降低,而在同一区域内LAMP1表达强度却明显增加。但是随着时间的延长,SE2d和SE3d组小鼠海马CA1和CA3区中Rab5和LAMP1表达强度均出现进行性减少。在SE3d和SE7d组小鼠海马CA1和CA3区内多数胶质细胞中Rab5表达强度却明显增加。见图 5(插页三)。
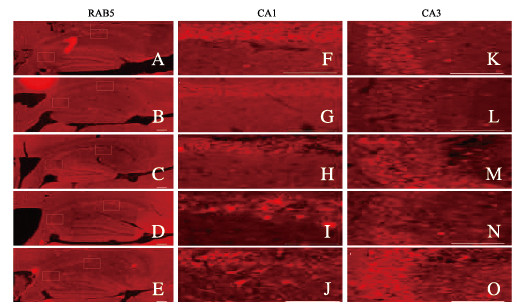
|
| A-E: ×100; F-O: X400;F-J:CA1;K-O:CA3;A, F, K: Control group; B, G, L: SE 1 d group; C, H, M: SE 2 d group; D, I, N: SE 3 d group; E, J, O: SE 7 d group. 图 5 免疫荧光染色观察不同时间点各组小鼠海马组织中Rab5表达 Fig. 5 Expression of Rab5 in hippocampus tissue of mice at different time points observed by fluorescence staining |
|
|
定量分析表明:SE2d、SE3d和SE7d组小鼠海马CA1区神经元中Rab5阳性面积百分比与对照组比较明显减少(P < 0.05或P < 0.01)。见图 6。与对照组比较,SE2 d、SE 3 d和SE7 d组小鼠海马CA1区LAMP1阳性面积百分比明显降低(P < 0.01);LAMP1阳性面积百分比在SE后第1天出现一过性增多,与对照组比较差异有统计学意义(P < 0.05)。见图 7和图 8(插页四)。
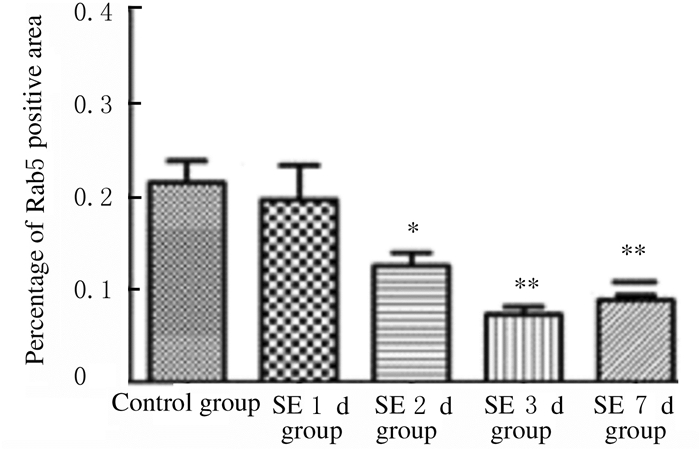
|
| *P < 0.05, * *P < 0.01 compared with control group. 图 6 免疫荧光染色检测各组小鼠海马CA1区Rab5阳性面积百分比 Fig. 6 Percentages of Rab5 positive areas in hippocampal CA1 region of mice in various groups detected by immunofluorescence staining |
|
|
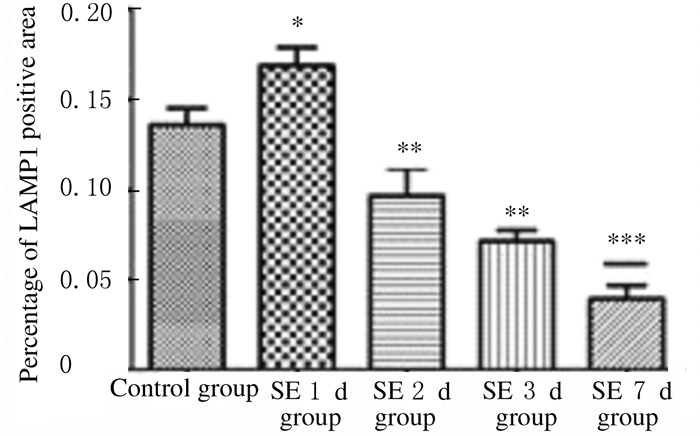
|
| *P < 0.05, * *P < 0.01 compared with control group. 图 7 免疫荧光染色检测各组小鼠海马CA1区LAMP1阳性面积百分比 Fig. 7 Percentages of LAMP1 positive areas in hippocampal CA1 region of mice in various groups detected by immunofluorescence staining |
|
|
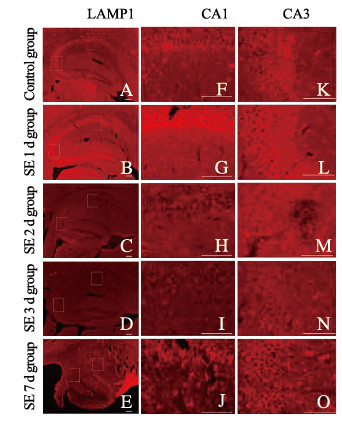
|
| A-E: ×100; F-O: ×400; F-J: CA1; K-O:CA3;A, F, K: Control group; B, G, L: SE 1 d group; C, H, M: SE 2 d group; D, I, N: SE 3 d group; E, J, O: SE 7 d group. 图 8 免疫荧光染色观察不同时间点各组小鼠海马组织中LAMP1表达 Fig. 8 Expressions of LAMP1 in hippocampus tissue of mice in various groups at different time points observed by fluorescence staining |
|
|
SE1d组小鼠海马CA1区神经元中微管蛋白β-tubulin表达强度下调与早期内体减少同时出现,而溶酶体结构蛋白LAMP1表达强度却增加。SE2d组小鼠海马CA1区神经元中微管蛋白β-tubulin出现严重解聚,同时树突内Rab5和LAMP1表达强度也明显降低。随着时间的延长,SE3d和SE7d组小鼠海马CA1区神经元中微管、Rab5和LAMP1的阳性结构几乎完全消失。见图 9(插页四)和图 10(插页四)。
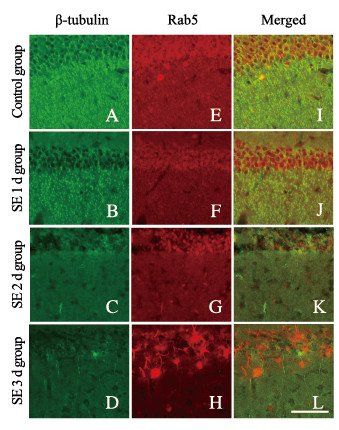
|
| 图 9 不同时间点各组小鼠海马组织CA1区β-tubulin/Rab5表达(双重染色,×400) Fig. 9 Expressions of β-Tubulin /Rab5 in CA1 region in hippocampus tissue of mice in various groups at different time points(Double staining, ×400) |
|
|
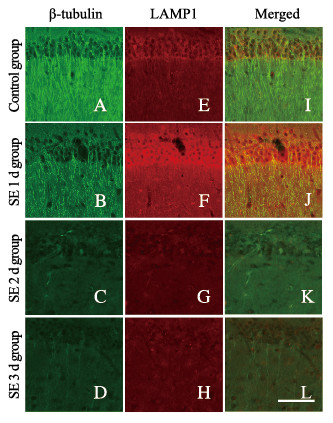
|
| 图 10 不同时间点各组小鼠海马CA1区β-tubulin/LAMP1表达(双重染色,×400) Fig. 10 Expressions of β-tubulin/LAMP1 in CA1 region in hippocampus tissue of mice in various groups at different time points (Double staining, ×400) |
|
|
神经元迟发性死亡是SE后脑内出现的重要病理特征,不仅启动了致痫分子级联反应,而且还能够激活胶质细胞引起神经系统二次损伤。本实验中Nissl和F-JB染色结果表明:SE结束后第1天实验组小鼠海马CA1和CA3区神经元开始出现死亡,并在第2天至第7天进行性加重。这一结果与以前的研究[9]结果一致。
作为神经元中细胞骨架成分之一,微管不仅分布在神经元胞体内,而且还广泛定位于轴突和树突内。由于微管具有一定刚性和弹性特征,因此其对于神经元极性结构的维持极为重要[10]。SE后,微管结合蛋白MAP2出现进行性减少[3]。本研究结果显示:SE1d组小鼠海马CA1和CA3区微管蛋白的荧光强度明显减弱,并随着时间的延长其荧光强度进行性减少,微管的这种损伤程度与死亡神经元的分布和出现在时间上一致。
除了维持细胞结构之外,微管还是神经元胞内物质运输的轨道,参与各种细胞器和大分子物质在神经元内的运输和定位[10]。SE后,神经元胞质外兴奋性氨基酸水平明显升高,突触后膜内吞和转运活动随之相应增强[11],因此神经元内体和溶酶体水平很可能也会发生改变。由于神经元微管受损,这些胞外摄取物质的运输受到负面影响。本研究结果显示:SE后第2天,海马CA1和CA3区神经元中早期内体和溶酶体水平明显减少。Rab5是早期内体的标志蛋白[12],其表达强度降低提示微管降解后突触后膜附近内吞活动也相应降低。本研究结果还显示:海马受损区域内胶质细胞中Rab5在SE后第3天和第7天明显增多。SE后,神经元死亡会进一步激活胶质细胞,已有研究[13-14]显示:SE3d后,海马中胶质细胞的数量和体积均明显升高,因此胶质细胞内Rab5的增多与反应性胶质细胞增强的内吞活动一致。
早期内体进入树突后,经过微管运输到达神经元胞体并最终进入溶酶体内进行降解或回收[12]。本研究结果显示:与Rab5相似,LAMP1在正常海马中也分布在神经元的树突和细胞质内[15],但是SE后第1天,神经元胞体内LAMP1却出现一过性增多,这一现象可能是突触后膜活动增强导致的结果。双重荧光检测结果显示:SE后第1天是早期内体减少和溶酶体一过性增多的关键时间点,这一时间点与神经元树突内微管损伤的出现一致。
内体-溶酶体系统损伤的结果是溶酶体膜通透性增强,内容物进入神经元内部,导致神经元发生自溶性死亡[16]。研究[17]表明:溶酶体通透性变化是决定细胞存亡和死亡方式的关键因素。溶酶体损伤与致病因素的强度呈正相关关系,轻度损伤会引起溶酶体膜通透性增强和内容物外渗,引发细胞凋亡;重度损伤则会引起溶酶体破裂,水解酶迅速进入胞质,导致细胞变性坏死。
神经元属于终极分化细胞,具有特殊的极性结构,需要依靠内体-溶酶体途径来清除错误蛋白和变性的膜性结构,因此该途径任何环节出现问题均会危及神经元生存。在神经元中微管不仅参与内吞活动和质膜小泡的转运,而且还是内体和溶酶体等膜性细胞器维持定位和发挥功能所必须。微管受损之后,内体-溶酶体系统内错误蛋白和受损细胞器未得到及时处理,引起溶酶体通透性增强、甚至破裂[18-20]。
综上所述,SE后海马神经元发生迟发性死亡过程中,神经中微管骨架严重受损,并影响到内体-溶酶体系统的定位和功能,而微管-内体-溶酶体途径紊乱反过来很可能会进一步加速神经元死亡进程。
| [1] |
AYDIN-ABIDIN S, YILDIRIM M, ABIDIN I, et al. Comparison of focally induced epileptiform activities in C57BL/6 and BALB/c mice by using in vivo EEG recording[J]. Neurosci Lett, 2011, 504(2): 165-169. DOI:10.1016/j.neulet.2011.09.030 |
| [2] |
EPSZTEIN J, BEN-ARI Y, REPRESA A, et al. Late-onset epileptogenesis and seizure genesis:lessons from models of cerebral ischemia[J]. Neuroscientist, 2008, 14(1): 78-90. DOI:10.1177/1073858407301681 |
| [3] |
SCHARTZ N D, HERR S A, MADSEN L, et al. Spatiotemporal profile of Map2 and microglial changes in the hippocampal CA1 region following pilocarpine-induced status epilepticus[J]. Sci Rep, 2016, 6: 24988. DOI:10.1038/srep24988 |
| [4] |
UCHIYAMA Y, SHIBATA M, KOIKE M, et al. Autophagy-physiology and pathophysiology[J]. Histochem Cell Biol, 2008, 129(4): 407-420. DOI:10.1007/s00418-008-0406-y |
| [5] |
GHAVAMI S, SHOJAEI S, YEGANEH B, et al. Autophagy and apoptosis dysfunction in neurodegenerative disorders[J]. Prog Neurobiol, 2014, 112: 24-49. DOI:10.1016/j.pneurobio.2013.10.004 |
| [6] |
DONG F, YAO R, YU H, et al. Neuroprotection of Ro25-6981 against ischemia/reperfusion-induced brain injury via inhibition of autophagy[J]. Cell Mol Neurobiol, 2017, 37(4): 743-752. DOI:10.1007/s10571-016-0409-5 |
| [7] |
LIU J D, SUN Y, OSTER G F, et al. Mechanochemical crosstalk during endocytic vesicle formation[J]. Curr Opin Cell Biol, 2010, 22(1): 36-43. DOI:10.1016/j.ceb.2009.11.009 |
| [8] |
TANAY E, MUNDEL P, SOMMER C. Short-term ischemia usually used for ischemic preconditioning causes loss of dendritic integrity after long-term survival in the gerbil hippocampus[J]. Brain Res, 2006, 1112(1): 222-226. DOI:10.1016/j.brainres.2006.07.004 |
| [9] |
ZHANG Y F, Li S L, XIONG T Q, et al. The rearrangement of filamentous actin in mossy fiber synapses in pentylenetetrazol-kindled C57BL/6 mice[J]. Epilepsy Res, 2014, 108(1): 20-28. DOI:10.1016/j.eplepsyres.2013.10.019 |
| [10] |
DENT E W. Of microtubules and memory:implications for microtubule dynamics in dendrites and spines[J]. Mol Biol Cell, 2017, 28(1): 1-8. |
| [11] |
ALI S O, SHAHIN N N, SAFAR M M, et al. Therapeutic potential of endothelial progenitor cells in a rat model of epilepsy:Role of autophagy[J]. J Adv Res, 2019, 18: 101-112. DOI:10.1016/j.jare.2019.01.013 |
| [12] |
LANGEMEYER L, FROHLICH F, UNGERMANN C, et al. Rab GTPase function in endosome and lysosome biogenesis[J]. Trends Cell Biol, 2018, 28(11): 957-970. DOI:10.1016/j.tcb.2018.06.007 |
| [13] |
JUPP B, WILLIAMS J, BINNS D, et al. Hypometabolism precedes limbic atrophy and spontaneous recurrent seizures in a rat model of TLE[J]. Epilepsia, 2012, 53(7): 1233-1244. DOI:10.1111/j.1528-1167.2012.03525.x |
| [14] |
ROSSI A R, ANGELO M F, VILLARREAL A, et al. Gabapentin administration reduces reactive gliosis and neurodegeneration after pilocarpine-induced status epilepticus[J]. PLoS One, 2013, 8: 78516. DOI:10.1371/journal.pone.0078516 |
| [15] |
HASSIOTIS S, MANAVIS J, BLUMBERGS P C, et al. Lysosomal LAMP1 immunoreactivity exists in both diffuse and neuritic amyloid plaques in the human hippocampus[J]. Eur J Neurosci, 2018, 47(9): 1043-1053. DOI:10.1111/ejn.13913 |
| [16] |
TOOZE S A, SCHIAVO G. Liaisons dangereuses:autophagy, neuronal survival and neurodegeneration[J]. Curr Opin Neurobiol, 2008, 18(5): 504-515. DOI:10.1016/j.conb.2008.09.015 |
| [17] |
ZENG L H, XU L, RENSING N R, et al. Kainate seizures cause acute dendritic injury and actin depolymerization in vivo[J]. J Neurosci, 2007, 27(43): 11604-11613. DOI:10.1523/JNEUROSCI.0983-07.2007 |
| [18] |
SIERRA-PAREDES G, OREIRO-GARCIA T, NUNEZ-RODRIGUEZ A, et al. Seizures induced by in vivo latrunculin a and jasplakinolide microperfusion in the rat hippocampus[J]. J Mol Neurosci, 2006, 28(2): 151-160. DOI:10.1385/JMN:28:2:151 |
| [19] |
OUYANG Y, YANG X F, HU X Y, et al. Hippocampal seizures cause depolymerization of filamentous actin in neurons independent of acute morphological changes[J]. Brain Res, 2007, 1143: 238-246. DOI:10.1016/j.brainres.2007.01.077 |
| [20] |
FUJIKAWA D G. Prolonged seizures and cellular injury:understanding the connection[J]. Epilepsy Behav, 2005, 7: S3-S11. DOI:10.1016/j.yebeh.2005.08.003 |
 2020, Vol. 46
2020, Vol. 46


