扩展功能
文章信息
- 孔雯聪, 贺武斌, 苏荣健, 贾答淇, 谷艳娇, 王月, 杜晓媛
- KONG Wencong, HE Wubin, SU Rongjian, JIA Daqi, GU Yanjiao, WANG Yue, DU Xiaoyuan
- MST1R抑制剂BMS-777607对乳腺癌MCF-7细胞增殖的抑制和凋亡诱导作用
- Inhibitory effect and apoptosisinduction of MST1R inhibitor BMS-777607 on proliferation of breast cancer MCF-7 cells
- 吉林大学学报(医学版), 2020, 46(03): 451-457
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 451-457
- 10.13481/j.1671-587x.20200304
-
文章历史
- 收稿日期: 2019-09-11
2. 锦州医科大学附属第一医院, 辽宁 锦州 121001;
3. 锦州医科大学基础医学院细胞生物学教研室, 辽宁 锦州 121000
2. First Affiliated Hospital, Jinzhou Medical University, Jinzhou 121001, China;
3. Department of Cell Biology, School of Basic Medical Sciences, Jinzhou Medical University, Jinzhou 121000, China
乳腺癌是女性常见的恶性肿瘤,其发病率呈逐年上升趋势,分布也趋于年轻化,据统计,美国乳腺癌患病人数在所有癌症患者中最多[1],我国亦是乳腺癌高发国家,因此深入研究乳腺癌的靶向治疗至关重要。研究[2]表明:乳腺癌发生发展涉及多种基因的改变,包括原癌基因激活和抑癌基因失活等。巨噬细胞刺激1受体(macrophage stimulating 1 receptor,MST1R)是c-MET原癌基因家族的一员。识别结合MST1R的唯一配体是巨噬细胞刺激1(macrophage stimulating 1,MST1),也称为巨噬细胞刺激蛋白(macrophage stimulating protein,MSP)或肝细胞生长因子样蛋白(hepatocyte growth factor-like protein,HGFP)[3]。MST1R基因编码具有酪氨酸激酶活性的MSP细胞表面受体。研究[4]表明:MST1R高表达可能与乳腺癌的发生有关联。BMS777607是MST1R的特异性抑制剂,能够靶向抑制MST1R表达,其在肝癌、胰腺癌、鼻咽癌和胃肠道肿瘤[5-8]等癌组织中有抑制癌细胞增殖的作用。研究[9-11]显示:BMS-777607对乳腺癌细胞诱导凋亡的作用很小,但能显著诱导乳腺癌T-47D和ZR-75-1细胞早期衰老,但对MCF-7细胞的诱导衰老效果不明显。目前,国内外有关MST1R抑制剂BMS-777607对乳腺癌MCF-7细胞作用的研究较少,因此本实验探讨MST1R抑制剂BMS-777607对乳腺癌MCF-7细胞生长的抑制和凋亡诱导作用,为其临床应用提供实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人乳腺癌MCF-7细胞购于中国科学院细胞库。高糖DMEM培养基、1%青-链霉素和胎牛血清购于美国Hyclone公司,蛋白酶抑制剂苯甲基磺酰氟(benzenesulfonyl fluoride,PMSF)购于美国Sigma公司,胰酶消化液、RIPA裂解液和蛋白浓度测定试剂盒均购于中国上海碧云天公司,BMS-777607购于美国Selleckchem公司,MTT购于华美生物技术有限公司,EDU试剂盒购于广州锐博生物科技有限公司,一抗抗体PARP、Bax和p-ERK购于美国Cell Signaling Technology公司。低速离心机购于美国Thermo公司。
1.2 细胞培养人乳腺癌MCF-7细胞培养于含有10%FBS和1%青-链霉素的高糖DMEM培养基中,在37℃、5% CO2条件下传代培养。
1.3 MTT法检测MCF-7细胞增殖率取对数生长期MCF-7细胞,按每孔5×103个细胞的密度接种于96孔板中,置于37 ℃、5% CO2孵箱中培养,4~6 h后细胞贴壁,加入不同浓度(0、0.5、1.0、2.0、5.0和10.0 μmol·L-1)BMS-777607,作为0、0.5、1.0、2.0、5.0和10.0 μmol·L-1 BMS-777607组,每组设置5个复孔,继续培养48 h,然后每孔加入20 μLMTT,再继续孵育4 h,终止培养,弃培养液,每孔加入150 μL DMSO,低速震荡10 min,采用酶联检测仪检测490 nm处每孔吸光度(A)值,计算细胞增殖率。细胞增殖率=实验组A值/对照组A值×100%。每组实验重复3次。
取对数生长期MCF-7细胞,按每孔5×103个细胞的密度接种于96孔板中,置于37℃、5%CO2孵箱中培养,4~6 h后细胞贴壁,加入不同浓度(0、5和10 μmol·L-1)BMS-777607,作为对照组和5及10 μmol·L-1 BMS-777607组,每组设置5个复孔,继续培养24、48和72 h,每孔加入20 μLMTT,再继续孵育4 h,终止培养,弃培养液,每孔加入150 μL DMSO,低速震荡10 min,采用酶联检测仪测定490 nm处每孔A值,计算细胞增殖率。细胞增殖率=实验组A值/对照组A值× 100%。每组实验重复3次。
1.4 克隆形成实验检测各组MCF-7细胞存活率将对数生长期MCF-7细胞接种于6孔板中,每孔1×103个细胞,使细胞均匀分布,置于37℃、5% CO2的孵箱中培养24 h,每孔加入终浓度分别0、1、5、10、15和20 μmol·L-1 BMS-777607作为对照组和1、5、10、15及20 μmol·L-1 BMS-777607组,继续培养2周,PBS洗涤2次,加入4%多聚甲醛固定,结晶紫染色,最后将6孔板倒置拍照,DMSO溶解结晶紫,观察结晶紫染色后的细胞克隆群,并检测各组细胞在波长为570 nm时的A值,计算细胞存活率。细胞存活率=实验组A值/对照组A值×100%。每组实验重组3次。
1.5 EDU成像和EDU流式细胞术检测各组细胞增殖率取对数生长期MCF-7细胞接种于3个共聚焦培养皿中,每个培养皿3×104个细胞,使细胞均匀分布,置于37℃、5% CO2孵箱中培养24 h,设置对照组(加入DMSO)和实验组(加入BMS-777607),对照组细胞正常培养且只加入DMSO,实验组加入10和20 μmol·L-1 BMS-777607,同时按1:5 000比例将EDU加入每个培养皿中,于37℃、5% CO2孵箱中培养48 h后取出,按EDU说明书清洗渗透剂、打孔和染色,采用共聚焦显微镜观察。每组实验重复3次。通过ImageJ软件分析得出荧光强度,计算细胞增殖率。细胞增殖率=实验组荧光强度/对照组荧光强度×100%。
取对数生长期MCF-7细胞接种于7个培养皿内,培养至正常生长阶段,设置对照组(加入DMSO)和实验组(加入不同浓度BMS-777607),实验组BMS-777607浓度分别为1.0、2.5、5.0、10.0和20.0 μmol·L-1,并按比例(1:5 000)加入EDU稀释液,37℃、5% CO2孵箱中培养48 h后取出,按EDU说明书收集细胞,固定,加入渗透剂染色,在避光条件下立即采用流式细胞仪检测EDU掺入率,即细胞增殖率。每组实验重复3次。
1.6 Hoechst33342染色检测各组细胞凋亡形态表现取对数生长期MCF-7细胞接种于培养皿,每个培养皿中3×104个细胞,设置对照组(加入DMSO,即0 μmol·L-1BMS-777607组)和10及20 μmol·L-1BMS-777607组,置于37℃、5% CO2孵箱中培养48 h后,弃去培养基,均加入1 mLHoechst33342稀释液染色,37℃、5% CO2孵箱中培养20~30 min后荧光显微镜下观察。观察是否存在细胞皱缩、染色质凝集和凋亡小体形成等现象。每组实验重复3次。
1.7 流式细胞术检测各组MCF-7细胞凋亡率取对数生长期MCF-7细胞接种于6个培养皿中,置于37℃、5% CO2孵箱中培养24 h,设置对照组(加入DMSO)和实验组(加入不同浓度BMS-777607),实验组BMS-777607浓度分别为1、5、10、15和20 μmol·L-1,培养48 h后收集细胞,采用不含EDTA的胰酶对其消化,离心后采用100 μL结合缓冲液轻柔吹打,在避光条件下采用10 Ul Annexin Ⅴ和5 Ul PI标记,震荡混匀室温孵育15 min后加入400 μL结合缓冲液吹打混匀,在1 h内采用流式细胞术检测各组细胞凋亡率。每组实验重复3次。
1.8 Western blotting法检测各组细胞中ERK、p-ERK、Akt、p-Akt、PRAR、Cleaved PARP、Bax、Caspase-3、Cleaved Caspase-3、Caspase-9和Cleaved Caspase-9蛋白表达水平将生长至80%~90%融合的乳腺癌MCF-7细胞以不同浓度(0、1.0、2.5、5.0、10.0和20.0 μmol·L-1)BMS-777607处理48 h,作为对照组和1.0、2.5、5.0、10.0及20.0 μmol·L-1BMS-777607组,随后PBS冲洗3次,采用细胞刮刀收集细胞,再根据细胞沉淀量适量加入RIPA细胞裂解液(1%PMSF),4℃、12 000 r·min-1离心20 min,采用BCA定量,沸水煮沸5 min, 进行SDS-PAGE,转膜,5%BSA封闭2 h, 按要求稀释一抗,4℃摇床过夜,TBST洗膜3次后加入一定体积二抗,室温孵育1 h,TBST洗膜3次,每次10 min,使用ECL显影液显影。通过ImageJ软件测量条带灰度值。目标蛋白表达水平=目标条带灰度值/β-actin条带灰度值× 100%。每组实验重复3次。
1.9 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组乳腺癌MCF-7细胞增殖率,乳腺癌MCF-7细胞凋亡率,各组乳腺癌MCF-7细胞中ERK、p-ERK、Akt、p-Akt、PARP、Cleaved PARP、Bax、Caspase-3、Cleaved Caspase-3、Caspase-9和CleavedCaspase-9蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 MTT法检测各组MCF-7细胞增殖率MTT法检测结果显示:在相同作用时间时,与对照组(0 μmol·L-1 BMS-777607组)比较,0.5、1.0、2.0、5.0和10 μmol·L-1BMS-777607组MCF-7细胞增殖率明显降低(P < 0.05或P < 0.01)。在相同剂量条件下,与0 h比较,24、48和72时,5和10μmol·L-1BMS-777607组MCF-7细胞增殖率明显降低(P < 0.05或P < 0.01)。见图 1。

|
| A:Proliferation rates of cells after treated with different concentrations of BMS-777607;B, C:Proliferation rates of MCF-7 cells in 5 and 10 μmol ·L-1 BMS-777607 group; *P < 0.05, * *P < 0.01 compared with 0 μmol·L-1 BMS-777607 group; △P < 0.05, △△P < 0.01 compared with 0 h. 图 1 MTT法检测各组MCF-7细胞增殖率 Fig. 1 Proliferation rates of MCF-7cells in various groupsdetected by MTT method |
|
|
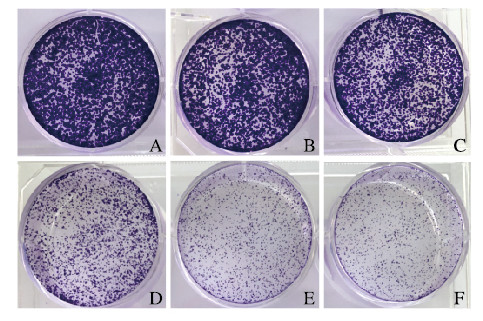
克隆形成结果显示:与对照组比较,10 μmol·L-1 BMS-777607组乳腺癌MCF-7细胞克隆数减少,20 μmol·L-1 BMS-777607组乳腺癌MCF-7细胞克隆数明显减少。与对照组(100.00%±5.30%)比较,1、5、10、15和20 μmol·L-1BMS-777607组MCF-7细胞存活率(96.17%±6.30%、65.27%±0.75%、42.63%±4.30%、32.81%±2.50%、28.27%±2.90%)均明显降低(P < 0.05或P < 0.01)。见图 2(插页二)。
|
| A-F: 0, 1, 5, 10, 15, and 20 μmol·L-1 BMS 777607 groups. 图 2 克隆形成实验观察各组MCF-7细胞形态表现 Fig. 2 Morphology of MCF-7 cells in various groups observed by colony formation assay |
|
|
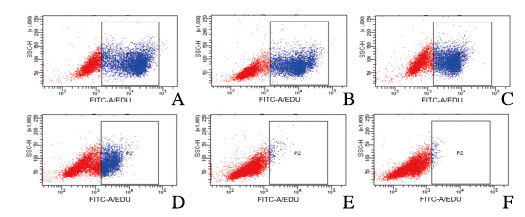
EDU掺入成像结果显示:与对照组(0 μmol·L-1 BMS-777607组)(100.0%±5.3%)比较,10和20 μmol·L-1 BMS-777607组MCF-7细胞增殖率(42.6%±4.3%和28.3%±2.9%)均明显降低(P < 0.05或P < 0.01)。见图 3(插页二)。流式细胞数检测结果显示:与对照组(0 μmol·L-1 BMS-777607组) (61.2%±3.3%)比较,10和20 μmol·L-1 BMS-777607组MCF-7细胞EDU掺入率(34.3%±5.8%和1.0%±0.3%)均明显降低(P < 0.05或P < 0.01)。见图 4(插页二)。

|
| A-C:Control group; D-F:10 μmol·L-1 BMS-777607 group; G-I:20 μmol·L-1 BMS-777607 group; A, D, G: DAPI; B, E, H: EDU; C, F, I: Merge. 图 3 共聚焦显微镜下各组MCF-7细胞增殖情况(Bar=50μm) Fig. 3 Proliferation of MCF-7 cells in various groups under confocal microscope(Bar= 50 μm) |
|
|
|
| A-F: 0, 1, 5, 10, 15, and 20 μmol·L-1 BMS-777607 groups. 图 4 流式细胞术检测各组MCF-7细胞增殖率 Fig. 4 Proliferation rates of MCF-7 cells in various groups detected by flow cytometry |
|
|
48 h时荧光显微镜观察显示:对照组细胞核被染成均匀的浅蓝色,细胞呈正常形态;实验组细胞呈浓染的亮蓝色细胞核,形态不规则,出现核固缩。见图 5(插页二)。

|
| A:0 μmol·L-1 BMS-777607 group; B:10 μmol·L-1 BMS-777607 group; C:20 μmol·L-1 BMS-777607 group. 图 5 荧光显微镜观察各组MCF-7细胞凋亡形态表现(Hoechst33342, ×100) Fig. 5 Apoptotic morphology of MCF-7 cells in various groups observed under fluorescence microscope (Hoechst33342, ×100) |
|
|
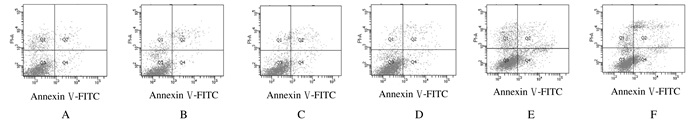
与对照组(0 μmol·L-1 BMS-777607组) (3.5%±1.2%)比较,48 h时10和20 μmol·L-1 BMS-777607组细胞凋亡率(8.3%±2.1%和23.9%±3.6%)均明显升高(P < 0.05或P < 0.01)。见图 6。
|
| A:Control group(0 μmol·L-1 BMS-777607 group); B-F: 1, 5, 10, 15 and 20 μmol·L-1 BMS-777607 groups. 图 6 Annexin Ⅴ-FITC/PI双染法检测各组MCF-7细胞凋亡率 Fig. 6 Apoptotic rates of MCF-7 cells in various groups detected by Annexin Ⅴ-FITC/PI double staining method |
|
|
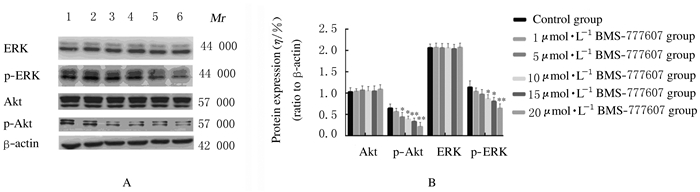
与对照组比较,1、5、10、15和20 μmol·L-1BMS-777607组MCF-7细胞中p-ERK和p-Akt蛋白表达水平明显降低(P < 0.05或P < 0.01),Akt和ERK蛋白表达水平差异无统计学意义(P>0.05)。与对照组比较,10、15和20μmol·L-1BMS-777607组MCF-7细胞中PARP、CleavedPARP、Bax、CleavedCaspase-3和CleavedCaspase-9蛋白表达水平明显升高(P < 0.05或P < 0.01),1和5 μmol·L-1 BMS-777607组MCF-7细胞中上述蛋白表达水平差异无统计学意义(P>0.05);各组MCF-7细胞中Caspase-3和Caspase-9蛋白表达水平比较差异无统计学意义(P>0.05)。见图 7和图 8。
|
| Lane 1:Control group; Lane 2-6:1, 5, 10, 15, and 20 μmol·L-1 BMS-777607 groups. *P < 0.05, * *P < 0.01 compared with control group. 图 7 各组MCF-7细胞中ERK、p-ERK、Akt和p-Akt蛋白表达电泳图(A)和直条图(B) Fig. 7 Electrophoregram(A) and histogram(B) of expressions of ERK, p-ERK, Akt, and p-Akt proteins in MCF-7 cells in various groups |
|
|
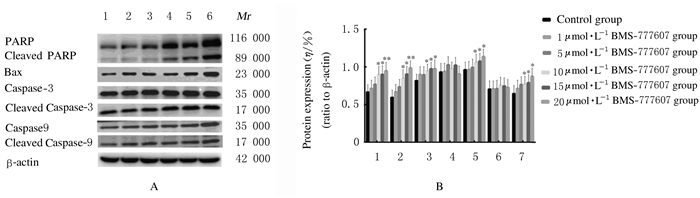
|
| Lane 1:Control group; Lane 2-6:1, 5, 10, 15, and 20 μmol·L-1 BMS-777607 groups. 1:PARP; 2:Cleaved PARP; 3:Bax; 4:Caspase-3;5:Cleaved Caspase-3;6:Caspase-9;7:Cleaved Caspase-9;*P < 0.05, * *P < 0.01 compared with control group. 图 8 各组MCF-7细胞中PARP、Cleaved PARP、Bax、Caspase-3、CleavedCaspase-3、Caspase-9和Cleaved Caspase-9蛋白表达电泳图(A)和直条图(B) Fig. 8 Electrophoregram(A) and histogram(B) of expressions of PARP, Cleaved PARP, Bax, Caspase-3, Cleaved Caspase-3, Caspase-9, and Cleaved Caspase-9 proteins in MCF-7 cells in various groups |
|
|
自20世纪末以来, 中国乳腺癌发病率逐年上升, 预计到2021年, 55~69岁妇女乳腺癌总患病人数将达到250万[9]。乳腺癌是严重威胁女性健康的恶性肿瘤, 随着个体化治疗和精准医疗概念的提出,特异性分子靶向治疗成为当前肿瘤研究的热点。
MST1R是C-MET原癌基因家族中酪氨酸激酶受体,是与恶性肿瘤有关的致病因子。MST1R在多种癌症中发挥作用,目前已有研究[12]证明:其在乳腺癌、胰腺癌和舌癌中的高表达与肿瘤形成有关,MST1R可能成为研究肿瘤形成和迁移的潜在靶点。鉴于MST1R抑制剂的有效性[13],本研究采用BMS-777607抑制MCF-7细胞中MST1R表达。本研究结果表明:BMS-777607可有效抑制MCF-7细胞增殖,促进其凋亡;且BMS-777607对MCF-7细胞增殖的抑制作用且呈剂量依赖性和时间依赖性。克隆形成实验和EDU掺入实验结果亦证明:较高浓度BMS-777607具有明显抑制MCF-7细胞增殖的作用。Hoechst33342染色检测结果显示:较高浓度BMS-777607可明显促进MCF-7细胞凋亡。流式细胞术检测也得出相同结论。
研究[14-16]表明:ERK和Akt均可引起细胞反应,通过影响基因的转录和调控,调节多种细胞的生物学行为,其磷酸化成为p-ERK和p-Akt后对细胞增殖、生长、分化和抗凋亡等方面有重要调节作用。另有研究[16-22]表明:PARP、Cleaved PARP、Bax、Cleaved Caspase-9和CleavedCaspase-3均参与细胞凋亡过程,Caspase-3激活对于凋亡细胞死亡的启动至关重要[23-25]。本研究结果显示:与对照组比较,10、15和20 μmol·L-1 BMS-777607组MCF-7细胞中p-ERK和p-Akt蛋白表达水平均降低,20 μmol·L-1 BMS-777607组MCF-7细胞中p-ERK和p-Akt蛋白表达水平更低,10、15和20 μmol·L-1 BMS-777607 MCF-7细胞中PARP、CleavedPARP、Bax、CleavedCaspase-9及CleavedCaspase-3蛋白表达水平均升高,20 μmol·L-1 BMS-777607组MCF-7细胞中PARP、CleavedPARP、Bax、CleavedCaspase-9及CleavedCaspase-3蛋白表达水平升高更加明显。因此本文作者认为:BMS-777607可以抑制人乳腺癌MCF-7细胞的增殖能力,促进其凋亡,且高浓度效果更显著;BMS-777607可通过抑制MST1R表达抑制人乳腺癌MCF-7细胞的增殖能力,促进其凋亡。
综上所述,BMS-777607有一定的抑癌作用,而且随着浓度的增加,其对乳腺癌细胞增殖的抑制能力和凋亡诱导能力逐渐加强。关于BMS-777607的作用机制还有待后续研究,且其在动物体内是否具有抑癌作用并减少不良反应还需要深入研究。
| [1] |
MILLER K D, NOGUEIRA L, MARIOTTO A B, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. DOI:10.3322/caac.21565 |
| [2] |
HUFF J L, JELINEK M A, BORGMAN C A, et al. The protooncogene c-sea encodes a transmembrane protein-tyrosine kinase related to the Met/hepatocyte growth factor/scatter factor receptor[J]. Proc Natl Acad Sci U S A, 1993, 90(13): 6140-6144. DOI:10.1073/pnas.90.13.6140 |
| [3] |
BAIRD A M, EASTY D, JARZABEK M, et al. When ron met tam in mesothelioma:all druggable for one, and one drug for all?[J]. Front Endocrinol (Lausanne), 2019, 10: 89. DOI:10.3389/fendo.2019.00089 |
| [4] |
赵海鸥, 范慧文, 单毅, 等. 乳腺癌中c-Met和RON蛋白的表达及临床意义[J]. 南通大学学报(医学版), 2018, 38(3): 210-213. |
| [5] |
LAUTER M, WEBER A, TORKA R. Targeting of the AXL receptor tyrosine kinase by small molecule inhibitor leads to AXL cell surface accumulation by impairing the ubiquitin-dependent receptor degradation[J]. Cell Commun Signal, 2019, 17(1): 59. DOI:10.1186/s12964-019-0377-8 |
| [6] |
ZHU C J, WEI Y Q, WEI X W. AXL receptor tyrosine kinase as a promising anti-cancer approach:functions, molecular mechanisms and clinical applications[J]. Mol Cancer, 2019, 18(1): 153. DOI:10.1186/s12943-019-1090-3 |
| [7] |
ENNIS K, SARMA P, WETZEL C, et al. Cbmt-16. a combination strategy to counteract pten-deficiency by targeting the s6 and tam kinases in glioblastoma[J]. Neurol Oncol, 2018, 20(Suppl6): vi35. |
| [8] |
赵静, 谭文华, 刘巍. RON基因在肿瘤中的研究及其靶向治疗进展[J]. 中国优生与遗传杂志, 2009, 17(1): 126-127. |
| [9] |
杜建姝. 中国乳腺癌现状[J]. 世界最新医学信息文摘, 2019, 19(46): 371-372. |
| [10] |
SHARMA S, YAO H P, ZHOU Y Q, et al. Prevention of BMS-777607-induced polyploidy/senescence by mTOR inhibitor AZD8055 sensitizes breast cancer cells to cytotoxic chemotherapeutics[J]. Mol Oncol, 2014, 8(3): 469-482. DOI:10.1016/j.molonc.2013.12.014 |
| [11] |
FAHAM N, ZHAO L, WELM A L. mTORC1 is a key mediator of RON-dependent breast cancer metastasis with therapeutic potential[J]. NPJ Breast Cancer, 2018, 4: 36. DOI:10.1038/s41523-018-0091-5 |
| [12] |
BABICKY M L, HARPER M M, CHAKEDIS J, et al. MST1R kinase accelerates pancreatic cancer progression via effects on both epithelial cells and macrophages[J]. Oncogene, 2019, 38(28): 5599-5611. DOI:10.1038/s41388-019-0811-9 |
| [13] |
EKIZ H A, LAI S A, GUNDLAPALLI H, et al. Inhibition of RON kinase potentiates anti-CTLA-4 immunotherapy to shrink breast tumors and prevent metastatic outgrowth[J]. Oncoimmunology, 2018, 7(9): e1480286. DOI:10.1080/2162402X.2018.1480286 |
| [14] |
CHEN M, CHOI S, JUNG O, et al. The specificity of EGF-stimulated IQGAP1 scaffold towards the PI3K-Akt pathway is defined by the IQ3 motif[J]. Sci Rep, 2019, 9(1): 9126. DOI:10.1038/s41598-019-45671-5 |
| [15] |
龙哲, 王旭, 侯伟建, 等. 工频电磁场对小鼠海马神经元细胞系HT22增殖、凋亡及磷酸化JNK、ERK表达的影响[J]. 中国医科大学学报, 2019, 48(9): 782-785. |
| [16] |
江波, 胡芬, 何标. 松乳菇多糖通过PI3K/Akt信号通路对人骨肉瘤细胞MG-63裸鼠移植瘤生长的抑制作用[J]. 中国药师, 2019, 22(9): 1591-1595. DOI:10.3969/j.issn.1008-049X.2019.09.004 |
| [17] |
张晓璇, 马征, 于宁, 等. 丁苯酞对缺血性脑卒中大鼠海马神经元凋亡的抑制作用及其对p38 MAPK信号通路的影响[J]. 吉林大学学报(医学版), 2019, 45(5): 1086-1091. |
| [18] |
刘苗, 申睿, 朱向东, 等. 痛泻要方对肝郁脾虚型溃疡性结肠炎模型大鼠TNF-α、Casepase3、Chop的影响[J]. 中医学报, 2019, 34(7): 1436-1441. |
| [19] |
孙海燕, 陈勇华, 王绍光. 子宫动脉灌注栓塞化疗治疗对宫颈癌组织caspase-9表达的影响[J]. 妇产与遗传(电子版), 2016, 6(3): 23-26. |
| [20] |
LIU M, FANG G, YIN S, et al. Caffeic acid prevented lps-induced injury of primary bovine mammary epithelial cells through inhibiting NF-κB and MAPK activation[J]. Mediators Inflamm, 2019, 1897820. |
| [21] |
CHAO X, WANG G, TANG Y, et al. The effects and mechanism of peiminine-induced apoptosis in human hepatocellular carcinoma HepG2 cells[J]. PLoS One, 2019, 14(1): e0201864. DOI:10.1371/journal.pone.0201864 |
| [22] |
KANAZAWA H, IMOTO K, OKADA M, et al. Canstatin inhibits hypoxia-induced apoptosis through activation of integrin/focal adhesion kinase/Akt signaling pathway in H9c2 cardiomyoblasts[J]. PLoS One, 2017, 12(2): e0173051. DOI:10.1371/journal.pone.0173051 |
| [23] |
张静玲, 王克利, 闫双宝. 槲皮素对骨肉瘤细胞MG-63细胞色素C、Bcl-2及bax表达影响[J]. 中国实验诊断学, 2018, 22(9): 1629-1631. DOI:10.3969/j.issn.1007-4287.2018.09.054 |
| [24] |
王晓庚, 刘林, 左健, 等. 沉默FoxM1通过促进线粒体释放细胞色素C诱导口腔鳞癌细胞凋亡[J]. 中国病理生理杂志, 2019, 35(3): 430-435. DOI:10.3969/j.issn.1000-4718.2019.03.008 |
| [25] |
杨超, 石琦, 马建斌, 等. KLF5转录因子抑制TRAIL诱导PC-3前列腺癌细胞凋亡的分子机制[J]. 西安交通大学学报(医学版), 2020, 41(2): 206-209. |
 2020, Vol. 46
2020, Vol. 46


