扩展功能
文章信息
- 王岚, 朱国双, 孙龙, 王小琴
- WANG Lan, ZHU Guoshuang, SUN Long, WANG Xiaoqin
- 肾元颗粒对db/db糖尿病肾病小鼠血管钙化的改善作用及其机制
- Improvement effect of Shenyuan Granule on vascular calcification in db/db diabetic nephropathy mice and its mechanism
- 吉林大学学报(医学版), 2020, 46(03): 431-438
- Journal of Jilin University (Medicine Edition), 2020, 46(03): 431-438
- 10.13481/j.1671-587x.20200301
-
文章历史
- 收稿日期: 2019-11-20
2. 湖北省中医院肾内科湖北省中医药研究院肾病研究所, 湖北 武汉 430061
2. Department of Nephrology, Hubei Provincial Hospitalof Traditional Chinese Medicine, Hubei Academy of Chinese Medicine, Wuhan 430061, China
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病(diabetic mellitus,DM)最严重的微血管并发症之一[1],在发达国家是终末期肾脏病(end stage renal disease, ESRD)患者的首要病因[2]。在中国,DN发病率逐年升高,而在DN中普遍存在的心血管并发症与血管钙化密切相关,是影响患者生存质量和生存时间的独立危险因素[3]。关注并加强DN血管钙化发病机制的研究具有重要临床意义。钙磷代谢异常是导致DN患者血管钙化的重要环节,其发生与肾脏产生的克老素(Klotho)蛋白和骨骼分泌的成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)表达异常有关联[4-5]。由于FGF23主要作用于肾脏,因此伴随着肾脏受损,肾脏中Klotho蛋白随之减少,导致体内钙磷代谢出现紊乱,最终诱发血管钙化的形成。肾元颗粒是由黄芪、淫羊藿和酒制大黄组成,方中以黄芪为君,补先天元气以助肾填精,健后天脾气以助运化水谷,推动血液运行作用。本课题组前期研究[6-7]证实:肾元颗粒(批号:20190602)可以上调肾脏组织中Klotho蛋白表达,降低体内异常升高的FGF23水平,还可以调控体内钙磷代谢。本研究的侧重点从前期的钙磷代谢延伸到血管钙化,通过建立db/dbDN小鼠血管钙化模型,探讨给予肾元颗粒药物后,小鼠胸主动脉病理形态改变以及血清中FGF23水平变化, 并观察肾脏和胸主动脉组织中Klotho、Pit1、Runx2和SM22α表达水平,为肾元颗粒治疗DN胸主动脉钙化提供实验依据。
1 材料与方法 1.1 实验动物SPF级7周龄db/dbDM小鼠20只,动物使用许可证号:SCXK(苏)2015-0001,动物合格证号:32002100006025。同系背景野生型(wild type,WT)小鼠10只,动物生产许可证号:SCXK(苏)-2015-0001,动物合格证号:32002100006026,均购自南京大学南京生物医药研究院。
1.2 药品、主要试剂和仪器肾元颗粒(湖北省中医院,批号:20190602);FGF23 ELISA试剂盒(武汉贝茵莱生物有限公司,批号:201812),兔抗小鼠Klotho(北京博奥森生物技术有限公司,批号:AH08097988),兔抗小鼠SM22α (英国Abcam公司,批号:ab14106),兔抗小鼠Runx2(英国Abcam公司,批号:ab23981),内参β-actin(上海优宁维生物科技股份有限公司,批号:SV25),兔抗小鼠Pit-1(美国Novus,批号:NBP1-32252),山羊抗兔二抗HRP、ABScript Ⅱ cDNA第一链合成试剂盒和2×通用型SYBR Green快速qPCR预混液(武汉爱博泰克生物科技有限公司,批号:9300014001、9619580410和9619030716),荧光驴抗兔二抗CY3(武汉赛维尔生物技术有限公司,批号:GB22403),总RNA提取试剂盒(武汉谷歌生物科技有限公司,批号:HP192402)。Clear First-1000核酸蛋白仪(上海闪谱生物科技有限公司),MA-6000实时荧光定量PCR(Real-time PCR)仪(加拿大Molarray生物科技公司),TGL-16M型高速冷冻离心机(湖南湘仪离心机设备有限公司),Supply Mini-Protean3电泳仪、Trans Blor Turho Mini Trans-Blot转移系统和Universal Hood 11CCD成像系统(美国Bio-Rad公司),BX43+DP2b Olympus光学显微镜、照相系统和Fluoview FV500型激光共聚焦扫描显微镜(日本Olympus公司),EG1150H型自动生物组织包埋机和RM2255型切片机(德国Leica公司)。
1.3 动物分组和给药实验开始前,db/db和WT小鼠于湖北中医药大学SPF级屏障环境动物房适应性喂养1周,饲养温度为(23±2)℃,湿度为44%~65%,日照和夜照比为12 h:12 h。适应性喂养1周后,将20只db/db小鼠随机分为模型组和肾元颗粒组,每组10只,另取WT小鼠10只作为空白组,以连续3次空腹静脉血糖≥16.7 mmol·L-1、尿量大于空白组150%且持续出现白蛋白尿判定为DN造模成功[8],造模成功后,模型组和肾元颗粒组小鼠给予高磷饲料(含磷1.2%和钙1.6%),空白组小鼠给予普通饲料。肾元颗粒组小鼠给予肾元颗粒混悬液(6.0 g·kg-1,按临床用药剂量经动物与人体间的等效剂量换算公式所得[9],并且在前期动物实验[7]中已得到验证),给药剂量均为20 mL·kg-1,模型组和空白组小鼠给予等量双蒸水,连续灌胃12周。
1.4 样本采集和处理在给药第12周后,将3组小鼠摘眼球取血,并以4 200 r·min-1离心15 min,取上层血清,保存于-80℃超低温冰箱中,待用。取血完成后,脱颈处死小鼠,暴露腹腔,摘下左侧肾脏组织,置于-80℃超低温冰箱中保存,备用;移除腹腔组织,沿小鼠脊柱小心快速取下胸主动脉,并剪切取1/3置于4%多聚甲醛中固定保存,用于组织病理形态表现观察和免疫组织化学及免疫荧光检测,将剩余部分胸主动脉置于-80℃超低温冰箱中保存。
1.5 ELISA法检测各组小鼠血清FGF23水平取各组小鼠血清,按FGF23试剂盒说明书操作。取出FGF23试剂盒,室温放置20 min。对标准品、生物抗原和亲和素-HRP进行稀释,配置洗涤液。于标准孔及样品孔中分别加入稀释好的标准品和样品各100 μL,然后分别加入100 μL抗原工作液。洗涤液重复洗板5次,加入亲和素-HRP,37℃培养箱中孵育30 min。再次洗涤液洗涤5次,拍干,加入显色液90 μL,37℃显色10 min,再加入终止液50 μL。空白孔中不加样,仅加入显色剂和终止液。将加样后的96孔板放入酶标仪中,于450 nm波长处依次读取各孔的吸光度(A)值。以标准品的浓度为横坐标,A值为纵坐标描绘标准曲线,求出回归方程,根据各样品A值计算各样品浓度。
1.6 HE染色和von Kossa染色检测各组小鼠胸主动脉组织病理形态表现取各组小鼠胸主动脉,行乙醇梯度脱水,二甲苯透明,石蜡包埋、切片,60℃烤箱中烘烤0.5 h,脱蜡、乙醇水化处理,苏木素浸泡5 min,乙醇分化,自来水冲洗,1%伊红浸泡1 min,乙醇脱水,二甲苯透明,中性树脂封片,镜下观察拍照。将包埋好的小鼠胸主动脉石蜡切片脱蜡、脱水。2%硝酸银液浸泡,紫外线下照射25 min,5%硫代硫酸钠液中浸泡1 min,伊红溶液复染。再次酒精梯度脱水,二甲苯透明,中性树脂封片,光镜下拍照,观察各组小鼠胸主动脉组织病理形态表现。
1.7 Real-time PCR法检测各组小鼠肾脏组织中Klotho mRNA和胸主动脉组织中Runx2、Pit-1及SM22α mRNA表达水平每组取5只小鼠肾脏和胸主动脉组织(质量均为50 mg),根据TRIzol试剂盒说明书进行总RNA提取,并采用核酸蛋白分析仪测定各待测样本RNA纯度。采用逆转录试剂盒进行逆转录,得到扩增前cDNA。以1 μL cDNA为模板按扩增流程进行扩增分析。采用2-△△CT法进行定量分析,每组实验至少重复3次。本实验所需引物均由武汉谷歌生物科技有限公司合成提供,选取小鼠β-actin作为内参。本研究所用引物序列见表 1。
| Gene | Primer sequence(5′-3′) | Product length(bp) |
| Klotho | Forward primer: GGCCGACCATTTCAGGGATT Reverse primer: GGCGGAAAGAGGTGTTGTAGAG | 138 |
| Runx2 | Forward primer: AGGCGTATTTCAGATGATGACACT Reverse primer: GGATGAAATGCTTGGGAACTG | 219 |
| Pit-1 | Forward primer: GGAACGGCTTGATAGATGTGGA Reverse primer: GAGACGAACCACGACATCACAA | 238 |
| SM22α | Forward primer: GGCAAAAGAATAAATGG Reverse primer: CTGTGGTAGATGGAGCA | 319 |
| β-actin | Forward primer: GTGACGTTGACATCCGTAAAGA Reverse primer: GTAACAGTCCGCCTAGAAGCAC | 287 |
每组取5只小鼠肾脏和胸主动脉组织,质量均为50 mg,加入蛋白裂解液,放入组织匀浆机中匀浆,离心,吸取上清,进行蛋白定量分装,并采用BCA法测定蛋白浓度。SDS-PAGE凝胶电泳分离目的蛋白,将电泳分离后的蛋白转移至NC膜上,脱脂奶粉封闭,分别加入Klotho、Runx2、Pit-1和SM22α一抗稀释液(1:500),4℃摇床过夜,TBST清洗,每次10 min,洗涤3次,二抗室温孵育2 h。TBST洗膜,滴加A、B显色液,凝胶电泳图像分析仪显影成像,采用Image J软件定量分析,以小鼠β-actin作为内参蛋白。计算各组小鼠肾脏组织中Klotho蛋白和胸主动脉组织中Runx2、Pit-1及SM22α蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.9 免疫组织化学法检测各组小鼠胸主动脉组织中Pit-1蛋白表达水平取各组小鼠胸主动脉组织石蜡块切片,厚度约为4 μm,常规脱蜡,EDTA高压锅煮沸抗原修复10 min,3%H2O2消除内源性过氧化物酶20 min,山羊血清37℃封闭45 min后,甩掉封闭液,滴加一抗Pit-1,放入4℃过夜;滴加二抗工作液,37℃恒温箱孵育30 min;再滴加辣根酶标记链酶卵白素工作液,37℃温箱内孵育30 min,DAB显色45 s,显微镜下观察。随机选取5个高倍视野,检测免疫组织化学A值。Pit-1蛋白表达水平=A值/组织面积。
1.10 免疫荧光法检测各组小鼠胸主动脉组织中SM22α和Runx2蛋白表达水平取各组小鼠胸主动脉组织石蜡块切片,厚度约为4 μm,2%双氧水浸泡10 min,TBST漂洗10次,0.3%Triton X-100破膜,3%双氧水灭活,血清封闭,加入一抗Runx2和SM22α,4℃过夜,加入荧光二抗CY3,避光孵育1 h,DA磷封片,激光共聚焦镜下拍照,计算胸主动脉组织中Runx2和SM22α免疫荧光A值。SM22α和Runx2蛋白表达水平=A值/组织面积。
1.11 统计学分析采用Graphpad Prism 6和SPSS 20.0统计软件进行统计学分析。各组小鼠血清FGF23水平和肾脏组织中Klotho及胸主动脉组织中Pit-1、Runx2、SM22α mRNA和蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组小鼠血清FGF23水平给药12周后, 与空白组比较,模型组小鼠血清FGF23水平升高(P < 0.01);给药12周后,与模型组比较,肾元颗粒组小鼠血清FGF23水平明显降低(P < 0.05)。见表 2。
| [n=10, x±s, cB/(ng·L-1)] | |||||||||||||||||||||||||||||
| Group | FGF23 | ||||||||||||||||||||||||||||
| Blank | 271.27±35.27 | ||||||||||||||||||||||||||||
| Model | 386.84±41.89* | ||||||||||||||||||||||||||||
| Shenyuan Granule | 334.23±24.41△ | ||||||||||||||||||||||||||||
| * P < 0.01 vs blank group;△ P<0.05 vs model group. | |||||||||||||||||||||||||||||
空白组小鼠血管内膜平整,中膜细胞排列整齐,中膜弹性纤维和胶原纤维未出现断裂,无钙盐沉积;与空白组比较,模型组小鼠血管内膜不平整,中膜细胞核排列紊乱,弹性纤维断裂,同时伴有明显的血管钙化灶;与模型组比较,肾元颗粒组小鼠血管内膜稍不平整,中膜弹性纤维未出现明显断裂,细胞核排列较不齐整,中膜钙化灶较模型组少。见图 1(插页一)和图 2(插页一)。
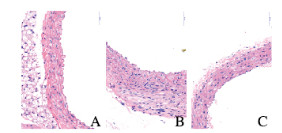
|
| A: Blank group; B: Model group; C: Shenyuan Granule group. 图 1 HE染色观察各组小鼠胸主动脉组织形态表现(×400) Fig. 1 Morphology of thoracic aorta tissue of mice in various groups observed by HE staining (×400) |
|
|
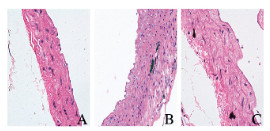
|
| A: Blank group; B: Model group; C: Shenyuan Granule group. 图 2 vonKossa染色观察各组小鼠胸主动脉组织形态表现(×400) Fig. 2 Morphology of thoracic aorta tissue of mice in various groups observed byvon Kossa staining(×400) |
|
|
与空白组比较,模型组小鼠肾脏组织中Klotho mRNA表达水平明显降低(P < 0.05),胸主动脉组织中Runx2和Pit-1 mRNA表达水平均明显升高(P < 0.01),SM22α mRNA表达水平明显降低(P < 0.01)。与模型组比较,肾元颗粒组小鼠肾脏组织中Klotho mRNA表达水平明显升高(P < 0.01),胸主动脉组织中Runx2和Pit-1 mRNA表达水平降低(P < 0.05),SM22α mRNA表达水平明显升高(P < 0.01)。见表 3。
| (n=5, x±s) | |||||||||||||||||||||||||||||
| Group | Klotho | Pit-1 | SM22α | Runx2 | |||||||||||||||||||||||||
| Blank | 2.46±0.37 | 0.90±0.28 | 0.98±0.15 | 1.01±0.11 | |||||||||||||||||||||||||
| Model | 1.06±0.22* | 2.61±0.40* | 0.38±0.06* | 1.95±0.21* | |||||||||||||||||||||||||
| Shenyuan Granule | 1.49±0.33△ | 1.77±0.47△ | 0.54±0.07△△ | 1.72±0.16△ | |||||||||||||||||||||||||
| * P < 0.01 vs blank group; △ P < 0.05, △△ P < 0.01 vs model group. | |||||||||||||||||||||||||||||
与空白组比较,模型组小鼠肾脏组织中Klotho蛋白表达水平明显降低(P < 0.01),胸主动脉组织中Pit-1和Runx2蛋白表达水平明显升高(P < 0.01),SM22α蛋白表达水平明显降低(P < 0.01);给药12周后,与模型组比较,肾元颗粒组小鼠肾脏组织中Klotho蛋白表达水平升高(P < 0.05),胸主动脉组织中Pit-1和Runx2蛋白表达水平降低(P < 0.01),SM22α蛋白表达水平升高(P < 0.01)。见图 3和表 4。
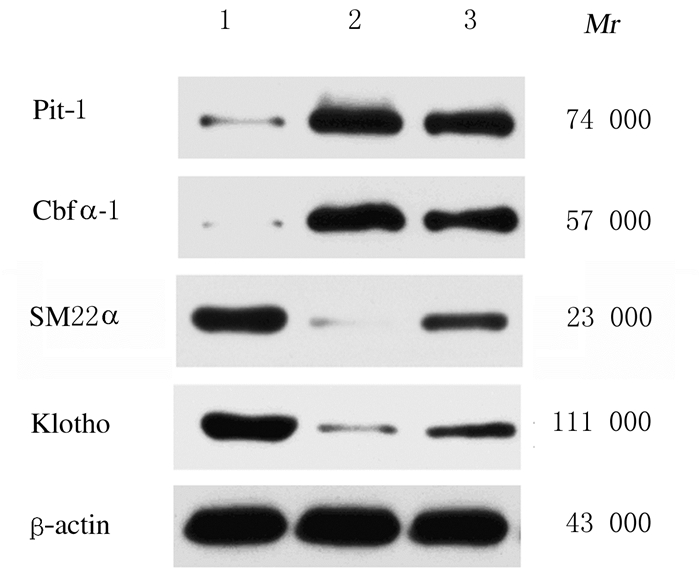
|
| Lane 1: Blank group; Lane 2: Model group; Lane 3: Shenyuan Granule group. 图 3 各组小鼠肾脏组织中Klotho蛋白和胸主动脉组织中Pit-1、Runx2及SM22α蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of Klotho protein in kidney tissue and Pit-1, Runx2, SM22α proteins in thoracic aorta tissue of mice in various groups |
|
|
| (n=5, x±s) | |||||||||||||||||||||||||||||
| Group | Klotho protein | Pit-1protein | Runx2protein | SM22αprotein | |||||||||||||||||||||||||
| Blank | 0.75±0.08 | 0.12±0.01 | 0.03±0.01 | 0.73±0.09 | |||||||||||||||||||||||||
| Model | 0.17±0.02* | 0.72±0.051* | 0.72±0.03* | 0.03±0.01* | |||||||||||||||||||||||||
| Shenyuan Granule | 0.47±0.06△ | 0.64±0.01△△ | 0.60±0.03△ | 0.40±0.03△△ | |||||||||||||||||||||||||
| * P < 0.01 vs blank group; △ P < 0.05, △△ P < 0.01 vs model group. | |||||||||||||||||||||||||||||
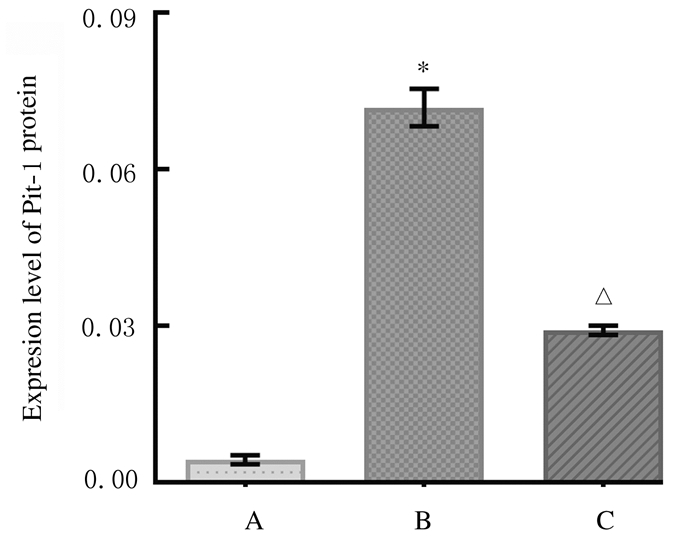
与空白组比较,模型组小鼠胸主动脉组织中Pit-1蛋白表达水平明显升高(P < 0.05);与模型组比较,肾元颗粒组小鼠胸主动脉组织中Pit-1蛋白表达水平明显降低(P < 0.01)。见图 4(插页一)和图 5。
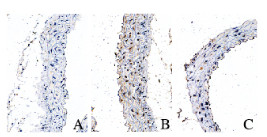
|
| A: Blank group; B: Model group; C: Shenyuan Granule group. 图 4 各组小鼠胸主动脉组织中Pit-1.蛋白表达(免疫组织化学, ×400) Fig. 4 Expression of Pit-1 protein in thoracic aorta tissue of mice in various groups(Immunohistochemistry, ×400) |
|
|
|
| A:Blank group; B:Model group; C:Shenyuan Granule group. *P < 0.05 vs blank group; △P < 0.01 vs model group. 图 5 免疫组织化学法检测各组小鼠胸主动脉组织中Pit-1蛋白表达水平 Fig. 5 Expression levels of Pit-1 protein in thoracic aorta tissue of mice in various groups |
|
|
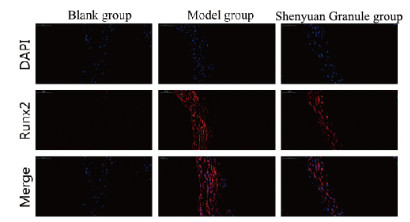
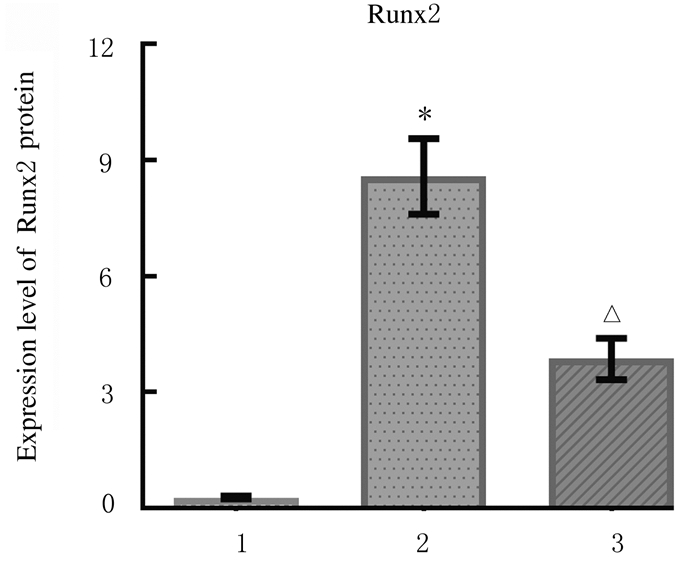
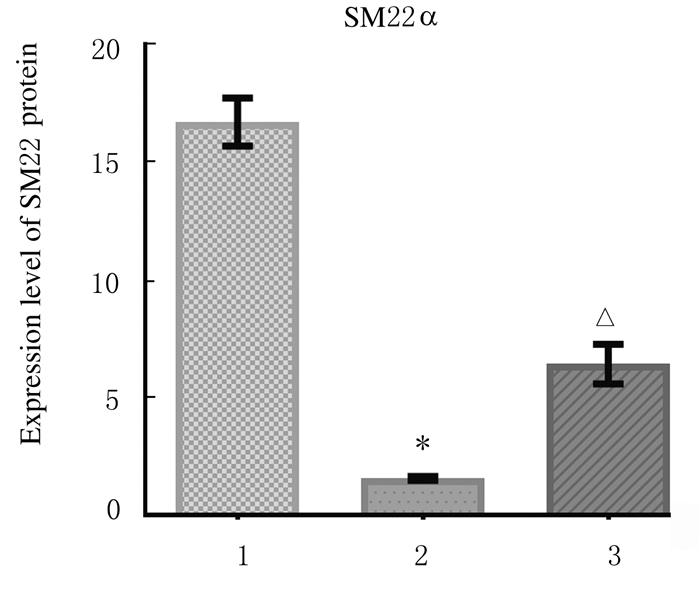
与空白组比较,模型组小鼠胸主动脉组织中Runx2蛋白表达水平明显升高(P < 0.01),SM22α蛋白表达水平明显降低(P < 0.01);与模型组比较,肾元颗粒组小鼠胸主动脉组织中Runx2蛋白表达水平降低(P < 0.01),SM22α蛋白表达水平明显升高(P < 0.01)。各组小鼠胸主动脉组织中Runx2蛋白表达见图 6(插页一)和图 7,SM22α蛋白表达见图 8(插页一)和图 9。
|
| 图 6 各组小鼠胸主动脉组织中Runx2表达(免疫荧光,×400) Fig. 6 Expressions of Runx2 in thoracic aorta tissue of mice in various groups(Immunofluorescence, ×400) |
|
|
|
| *P < 0.05 vs blank group; △P < 0.01 vs model group. 图 7 各组小鼠胸主动脉组织中Runx2蛋白表达水平 Fig. 7 Expression levels of Runx2 protein in thoracic aorta tissue of mice in various groups |
|
|

|
| 图 8 各组小鼠胸主动脉组织中SM22a表达(免疫荧光, ×400) Fig. 8 Expressions of SM22a in thoracic aorta tissue of mice in various groups(Immunofluorescence, ×400) |
|
|
|
| *P < 0.05 vs blank group; △P < 0.01 vs model group. 图 9 各组小鼠胸主动脉组织中SM22α蛋白表达水平 Fig. 9 Expression levels of SM22α protein in thoracic aorta tissue of mice in various groups |
|
|
DM发生的基本机制为阴虚为本,燥热为标。随着病程进展,累及于肾,发为DN。此时,肾精亏虚,肾气不足,脾运不健,无力推动血液运行,则易脉络瘀阻,表现为钙和磷在血管壁异位沉积诱发血管钙化。针对DN患者血管钙化肾精亏虚、脾运无力、脉络瘀阻的病机,治以健脾补肾,活血化浊之法。肾元颗粒(原名肾安颗粒)是湖北中医药大学第一临床学院用于治疗多种慢性肾脏病的制剂(批号:鄂药制字Z20070209), 由黄芪、淫羊藿和酒制大黄组成。方中以黄芪为君,补先天元气以助肾填精,健后天脾气以助运化水谷,推动血液运行;淫羊藿为臣,补肾化气,强筋健骨;佐以酒制大黄,取其行瘀破积,荡涤浊毒之功。三药共奏健脾补肾,活血化浊之效。本课题组在前期研究[10]中将药物的有效作用部位大黄蒽醌、淫羊藿苷和黄芪苷分离提取后,加工成无糖颗粒。随机对照临床研究[11-12]显示:肾元颗粒在保护肾功能、改善钙磷代谢和缓解临床症状方面明显优于对照组药物爱西特。对肾性骨病大鼠模型研究显示:模型组大鼠肾组织中Klotho蛋白、股骨组织中骨保护素(osteoprotegerin,OPG)、骨形态发生蛋白7(bone morphogenetic protein-7,BMP-7)表达水平较空白组明显降低,并伴有血钙水平降低,血磷水平升高。采用肾元颗粒干预后,模型组大鼠肾脏组织中Klotho蛋白表达水平升高,股骨组织中OPG和BMP-7表达水平升高,说明肾元颗粒通过调控Klotho基因表达及骨代谢,从而实现对钙和磷的调节[13-15]。
血管钙化是DM最常见的血管病变之一[16]。血管钙化并非钙磷被动沉积的过程,其由活跃细胞介导,涉及血管平滑肌细胞(vascular smooth muscle cell,VSMC)凋亡和囊泡释放机制,可使VSMC从收缩型分化为成骨细胞,并使血管中高效的骨诱导因子和成骨细胞形成的早期标志物表达增加。Pit-1作为Ⅲ型钠磷协同转运子,主要表达于肾脏、脑、心脏、肺部、肝脏、平滑肌细胞和成骨细胞中[17-18]。在体外,沉默VSMC中Pit-1表达可明显抑制高磷诱导的VSMC钙化发生[19],表明血管中Pit-1高表达是血管发生钙化的主要原因之一。在体内,肾脏表达的Klotho蛋白与FGF23结合非常紧密,并与其受体形成三元复合物,参与调节体内活性维生素D的合成和降解,促进尿磷的排泄,增加钙离子(Ca2+)吸收,调控体内钙磷代谢[20]。当肾脏受损时,不仅伴随着Klotho蛋白表达减少,而且还出现血清中FGF23水平明显升高,这时血管钙化发生率随着Klotho蛋白表达减少而急剧增加[21-22]。研究[23]显示:Klotho基因敲除小鼠中,小鼠不仅伴随着明显早衰和脏腑功能减退等表型,同时还伴有血管钙化表型出现。腹腔注射Klotho蛋白后, 小鼠血管钙化表型可得到明显的改善[24], 表明在血管钙化的机制中,Klotho具有明显的抑制作用。研究[25]显示:这种钙化表型的出现与体内急剧升高的FGF23水平相关。当肾脏受损时,体内水平升高的FGF23在失去Klotho蛋白的调控后,形成脱靶效应。有研究[26]显示:向VSMC中加入外源性FGF23可明显激活Pit-1表达,介导血管平滑肌细胞对磷的吸收,使得血管上磷离子内流增加,导致VSMC向成骨样细胞转化[27-28],并形成血管钙化。
本研究通过高磷饮食,构建的小鼠体内高磷环境以加速db/db小鼠胸主动脉血管钙化发生。胸主动脉的von Kossa染色结果显示:模型组小鼠在高磷饮食条件下,小鼠胸主动脉出现了钙盐沉积;血清ELISA检测结果显示:模型组小鼠血清FGF23水平明显升高;Real-time PCR、Western blotting、免疫组织化学和免疫荧光法检测结果显示:模型组小鼠胸主动脉组织中Pit-1蛋白表达水平明显升高,而该结果与YAMAZAKI等[26]的研究结果相符。在本研究中随着FGF23/Pit-1信号通路的激活,模型组小鼠血管中高效的骨诱导因子和成骨细胞形成的早期标志蛋白Runx2表达水平明显升高,且血管平滑肌标记物SM22α蛋白表达水平明显降低,表明通过高磷饮食诱导的高磷环境可以诱导db/db小鼠出现胸主动脉钙化,而这种钙化的出现与FGF23/Pit-1信号通路的激活有关。经过肾元颗粒干预后,小鼠血清FGF23水平降低,肾脏组织中Klotho蛋白表达水平明显升高,胸主动脉组织中Pit-1蛋白表达水平降低,成骨细胞形成的早期标志蛋白Runx2表达水平亦减少,血管平滑肌标记物SM22α表达水平升高表明肾元颗粒对小鼠胸主动脉钙化具有明显的改善作用,其作用机制可能是肾元颗粒通过增加肾脏组织中Klotho蛋白表达水平,抑制血清FGF23水平,降低胸主动脉中被激活的Pit-1蛋白的表达水平,最终达到改善胸主动脉血管钙化的作用。
综上所述,通过高磷饮食可诱导db/db小鼠胸主动脉发生血管钙化,而其作用机制可能与FGF23/Pit-1信号通路的激活有关。肾元颗粒可通过增加肾脏组织中Klotho蛋白的表达,并抑制FGF23/Pit-1信号通路,并抑制VSMC向成骨样细胞的表型转化,抑制进而减少钙化的发生而发挥对血管的保护作用。
| [1] |
SIKORA A G, GELBARD A, DAVIES M A, et al. Targeted inhibition of inducible nitric oxide synthase inhibits growth of human melanoma in vivo and synergizes with chemotherapy[J]. Clin Cancer Res, 2010, 16(6): 1834-1844. DOI:10.1158/1078-0432.CCR-09-3123 |
| [2] |
DE BOER I H, RUE T C, HALL Y N, et al. Temporal trends in the prevalence of diabetic kidney disease in the United States[J]. JAMA, 2011, 305(24): 2532-2539. DOI:10.1001/jama.2011.861 |
| [3] |
MAZZONE T. Increased prevalence of significant coronary artery calcification in patients with diabetes[J]. Diabetes Care, 2001, 24(8): 1508. |
| [4] |
QUARLES L D. Role of FGF23 in vitamin D and phosphate metabolism:implications in chronic kidney disease[J]. Exp Cell Res, 2012, 318(9): 1040-1048. DOI:10.1016/j.yexcr.2012.02.027 |
| [5] |
IBRAHIM S, RASHED LA. Serum fibroblast growth factor-23 levels in chronic haemodialysis patients[J]. Int Urol Nephrol, 2009, 41(1): 163-169. DOI:10.1007/s11255-008-9466-0 |
| [6] |
詹理睿, 王小琴, 邹新蓉, 等. 肾元颗粒影响糖尿病小鼠肾脏中miR-199b-5p与钙磷代谢的研究[J]. 中华中医药学刊, 2017, 35(11): 2819-2823. |
| [7] |
陈立, 王小琴. Klotho基因调控的FGF23/FGFR1信号通路对人肾小管上皮细胞羟化酶表达的影响及肾元颗粒的干预作用[J]. 中华中医药杂志, 2019, 34(10): 4547-4552. |
| [8] |
宋纯东, 张霞, 宋丹丹, 等. 益气养阴活血方对糖尿病肾病大鼠肾组织WT1影响的实验研究[J]. 中国中医基础医学杂志, 2016, 22(5): 626-627. |
| [9] |
黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004(9): 1069-1072. DOI:10.3969/j.issn.1009-2501.2004.09.026 |
| [10] |
贺薇薇, 冯汉鸽, 汪琦, 等. 肾安颗粒中淫羊藿和黄芪半仿生提取工艺研究[J]. 医药导报, 2010, 29(8): 1060-1062. DOI:10.3870/yydb.2010.08.031 |
| [11] |
王小琴, 谭大琦, 金劲松. 肾安颗粒治疗慢性肾衰竭的临床研究[J]. 中国中西医结合肾病杂志, 2003, 4(7): 393-395. DOI:10.3969/j.issn.1009-587X.2003.07.009 |
| [12] |
邵朝弟, 王小琴, 李勇, 等. 肾安片治疗慢性肾功能衰竭30例临床研究[J]. 中医杂志, 2003, 44(3): 194-196. |
| [13] |
邹新蓉, 王小琴, 王长江, 等. 肾安颗粒对肾性骨病模型大鼠骨组织骨保护素表达的影响[J]. 江苏中医药, 2014, 46(7): 71-73. |
| [14] |
邹新蓉, 王小琴, 王长江. Klotho基因在残余肾模型大鼠肾脏的表达及淫羊藿、黄芪、大黄复方的干预作用研究[J]. 华南国防医学杂志, 2015, 29(3): 196-200. |
| [15] |
邹新蓉, 王小琴, 王长江, 等. 肾安颗粒对肾性骨病模型大鼠骨组织BMP-7表达及骨代谢的影响[J]. 湖北中医杂志, 2013, 35(4): 11-13. DOI:10.3969/j.issn.1000-0704.2013.04.004 |
| [16] |
SHAO J S, SIERRA O L, COHEN R, et al. Vascular calcification and aortic fibrosis:a bifunctional role for osteopontin in diabetic arteriosclerosis[J]. Arterioscler Thromb Vasc Biol, 2011, 31(8): 1821-1833. DOI:10.1161/ATVBAHA.111.230011 |
| [17] |
WERNER A, DEHMELT L, NALBANT P. Na+-dependent phosphate cotransporters:the NaPi protein families[J]. J Exp Biol, 1998, 201(Pt 23): 3135-3142. |
| [18] |
TAKEDA E, TAKETANI Y, MORITA K, et al. Sodium-dependent phosphate co-transporters[J]. Int J Biochem Cell Biol, 1999, 31(3/4): 377-381. |
| [19] |
WU Y, HAN X, WANG L, et al. Indoxyl sulfate promotes vascular smooth muscle cell calcification via the JNK/Pit-1 pathway[J]. Ren Fail, 2016, 38(10): 1-9. |
| [20] |
GOETZ R, NAKADA Y, HU M C, et al. Isolated C-terminal tail of FGF23 alleviates hypophosphatemia by inhibiting FGF23-FGFR-Klotho complex formation[J]. Proc Natl Acad Sci U S A, 2010, 107(1): 407-412. DOI:10.1073/pnas.0902006107 |
| [21] |
KURO O M. Klotho and endocrine fibroblast growth factors:markers of chronic kidney disease progression and cardiovascular complications[J]. Nephrol Dial Transplant, 2019, 34(1): 15-21. DOI:10.1093/ndt/gfy126 |
| [22] |
LINDERGL K, OLAUSON H, AMIN R, et al. Arterial Klotho Expression and FGF23 Effects on Vascular Calcification and Function[J]. PLoS One, 2013, 8(4): e60658. DOI:10.1371/journal.pone.0060658 |
| [23] |
KAN S, ISHIZAKA N, MITANI H, et al. Iron chelation and a free radical scavenger suppress angiotensin Ⅱ-induced downregulation of klotho, an anti-aging gene, in rat[J]. FEBS Lett, 2003, 551(1): 58-62. |
| [24] |
HU M C, SHI M, ZHANG J, et al. Klotho deficiency causes vascular calcification in chronic kidney disease[J]. J Am Soc Nephrol, 2011, 22(1): 124-136. |
| [25] |
SMITH E R, HOLT S G, HEWITSON T D. FGF23 activates injury-primed renal fibroblasts via FGFR4-dependent signalling and enhancement of TGF-beta autoinduction[J]. Int J Biochem Cell Biol, 2017, 92: 63-78. DOI:10.1016/j.biocel.2017.09.009 |
| [26] |
YAMAZAKI M, OZONO K, OKADA T, et al. Both FGF23 and extracellular phosphate activate Raf/MEK/ERK pathway via FGF receptors in HEK293 cells[J]. J Cell Biochem, 2010, 111(5): 1210-1221. DOI:10.1002/jcb.22842 |
| [27] |
ZHANG L, XIE P, WANG J, et al. Impaired peroxisome proliferator-activated receptor-gamma contributes to phenotypic modulation of vascular smooth muscle cells during hypertension[J]. J Biol Chem, 2010, 285(18): 13666-13677. DOI:10.1074/jbc.M109.087718 |
| [28] |
ABDEL-RAHMAN E M, OKUSA M D. Effects of aging on renal function and regenerative capacity[J]. Nephron Clin Pract, 2014, 127(1-4): 15-20. DOI:10.1159/000363708 |
 2020, Vol. 46
2020, Vol. 46


