扩展功能
文章信息
- 杨文强, 何鑫, 白雪, 于露, 李宗泽, 张家悦, 杨菁
- YANG Wenqiang, HE Xin, BAI Xue, YU Lu, LI Zongze, ZHANG Jiayue, YANG Jing
- 肌肽对血管性认知障碍大鼠氧化应激及NF-κB信号途径的影响
- Effects of carnosine on oxidative stress and NF-κB signaling pathway in rats with vascular cognitive impairment
- 吉林大学学报(医学版), 2020, 46(02): 329-334
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 329-334
- 10.13481/j.1671-587x.20200220
-
文章历史
- 收稿日期: 2019-06-26
血管性痴呆(vascular dementia, VD)是由于脑出血、脑缺血和脑区低灌注等脑血管病引起脑组织血液供应障碍导致脑功能减退而出现的学习记忆能力下降和严重认知功能障碍[1]。VD是第2位常见的认知功能障碍,是由血管性认知障碍(vascular cognitive impairment, VCI)发展而来[1-2]。研究VCI的发病机制,找出早期防治的有效方法,具有重要的临床意义和社会价值。VCI的发生发展是一个复杂的过程,包括诸多环节,其中氧自由基的累积和炎症反应等发挥重要的作用[2]。
肌肽是一种由β-丙氨酸和L-组氨酸组成的水溶性二肽。研究[3-4]表明:肌肽对低氧所致大鼠内皮细胞及脑片损伤具有保护作用,其机制可能与其改善脑组织能量代谢,增强抗氧化能力有关。肌肽还具有抗炎及稳定细胞内pH值等作用。但肌肽对VCI的影响却鲜有报道。本研究以双侧颈总动脉夹闭再灌注配合腹腔注射硝普钠减压法建立VCI大鼠模型,观察肌肽对VCI大鼠学习记忆能力的影响,探讨肌肽对VCI大鼠的保护作用及其机制,为肌肽的利用提供理论和实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康雄性SD大鼠50只,体质量250~280 g,由锦州医科大学实验动物中心提供,动物合格证号:SCXK(辽) 2017-0004。肌肽(纯度>99.0%,批号:1703061,由苏州富士莱医药股份公司惠赠)。胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)(sc-58766,盛克鲁斯生物技术有限公司),磷酸化核因子-κB p56(phosphate nuclear factor-kappaB p65, p-NF-κB p65)抗体(货号AB11014,美国ABsci公司),β-actin、辣根过氧化物酶标记山羊抗兔IgG(H+L)、ECL化学发光显色试剂盒和BCA试剂盒(北京鼎国昌盛生物技术有限公司),哺乳动物组织总蛋白抽提试剂(货号AR0101-100,武汉博士德生物工程有限公司),SP-9000检测试剂盒、ZLI-9018和DAB显色试剂盒(20×)(北京中杉金桥生物技术有限公司),肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白细胞介素1β(interleukin-1β, IL-1β)ELISA试剂盒(上海通蔚实业有限公司)。Morris水迷宫(中国医学科学院药物研究所),LC-10Avp高效液相色谱仪(日本岛津公司)。
1.2 实验动物分组大鼠适应性喂养3d后,置于Morris水迷宫中学习训练2d。于第3天,选择4次均能在90 s内找到平台的大鼠为合格实验动物。合格的50只大鼠,按照随机原则分为假手术组、模型组和100、300及900 mg·kg-1肌肽组。每组10只,自由觅食饮水,室温22℃~25℃,每笼2只。肌肽组灌胃给药。于造模前21d至造模后12d,每天8:00~9:00给药1次,共33d。手术当日,术前2 h灌胃给药。假手术组与模型组大鼠给予相同体积生理盐水。
1.3 VCI模型制备大鼠腹腔注射10%水合氯醛350 mg·kg-1麻醉,仰卧位固定于鼠台上,常规消毒,颈正中切口,分离双侧颈总动脉,穿线备用。腹腔注射2.5 mg·kg-1硝普钠造成低血压,立刻采用无创动脉夹关闭双侧颈总动脉10 min后, 再通10 min, 再夹闭10 min,造成大脑的缺血再灌注损伤,再通后缝合伤口,放回笼中保温饲养。假手术组只分离双侧颈总动脉,腹腔不注射硝普钠,不进行缺血再灌注手术[6]。按上述方法造模后2 h观察模型大鼠的行为学表现和死亡情况,并对动物进行脑卒中指数评分。评分标准为毛蓬乱竖起、动作缓慢或活动减少、触耳反应加强、眼睑下垂,每一项计1分;头翘起、不闭眼、两后肢向后向外伸展、转圈、抽搐或阵挛,每一项计1分;四肢无力或腹部着地计6分。选择符合脑缺血征象(>10分)并无肢体残疾和视力受损的大鼠作为合格的实验动物。300和900 mg·kg-1肌肽组各有1只动物不符合脑缺血征象,予以剔除。实验过程无动物死亡。
1.4 Morris水迷宫实验术后第7天开始水迷宫实验,分为定位航行和空间探索实验[7]。水迷宫为直径120 cm、高50 cm的水池,水深30 cm,水温控制在22.5℃~23.5℃。在水池边缘等距离标有4个入水点,将水池分为4个象限,直径9 cm的平台位于第一象限中央水下1 cm处。每天每只大鼠训练4次,每次采用不同象限入水点。训练时将大鼠面朝池壁轻轻放入水池,记录大鼠寻找平台所用时间,如果120 s内未找到,则将其放置于平台上10 s。术后第7天进行定位航行实验,每天每只大鼠训练4次,每次采用不同象限入水点。训练时将大鼠面朝池壁轻轻放入水池,同时启动记录装置,记录大鼠寻找平台所用时间,如果120 s内未找到,则将其放置于平台上10 s,逃避潜伏期记为120 s,4次所用时间均值为大鼠当日潜伏期。连续训练5d,后3d结果为定位航行实验结果。术后第12天进行空间探索实验,训练3次后,撤除平台,从第二象限将大鼠放入水中,记录120 s内的游泳轨迹,记录大鼠在平台所在象限的时间,为空间探索实验结果,以检验大鼠的记忆能力。水迷宫实验完成后立即取双侧海马,一侧用于GSH和肌肽含量测定,另一侧用于组织学实验,-80℃冻存。
1.5 免疫组织化学法检测大鼠海马组织中GFAP蛋白表达水迷宫实验后,采用10%水合氯醛350 mg·kg-1麻醉,断头后每组迅速选取5个右侧海马置于新配置4%多聚甲醛液中固定。切片常规脱蜡脱水,A液(柠檬酸)18 mL+B液(柠檬酸钠)82 mL+双蒸水900 mL于高压锅内进行抗原的高压修复2 min,3%的过氧化氢孵育15 min,滴加GFAP一抗,4℃过夜,生物素化二抗工作液(IgG/Bio),置于恒温水浴箱中37℃、30 min,加入辣根酶标记链霉卵白素工作液(S-A/HRP),37℃、30 min,DAB显色,苏木素复染,酒精脱水,二甲苯透明,封片。GFAP阳性表达为棕黄色。
1.6 高效液相色谱法(high performance liquid chromatography, HPLC)测定大鼠海马组织中肌肽和还原性谷胱甘肽(glutathione, GSH)水平水迷宫实验后,采用10%水合氯醛350 mg·kg-1麻醉,断头后每组迅速选取海马组织放于液氮中,转移到-80℃冰箱保存。检测于1周内完成。取海马组织10~20 mg,加1 mL蒸馏水后,超声粉碎5个循环,每个循环为10 s,间隔10 s,强度为90%。再加入三氟乙酸10 μL,混匀,4℃、12000g离心20 min,分离上清,上清过0.22 μm微孔滤膜,为供试品溶液。利用邻苯二甲醛衍生法和HPLC外标法测定海马组织中肌肽水平[8]。
取海马组织10~20 mg,加入0.3 mL的10 mmol·L-1DTNB磷酸缓冲液,超声粉碎5个循环,每个循环为10 s,间隔10 s,强度为90%。4℃、12 000g离心20 min,取上清后加入等体积无水乙醇,静置30 min后,上清过0.22 μm微孔滤膜,为供试品溶液。外标法测定海马组织中还原性GSH水平[9]。
1.7 Western blotting法检测大鼠海马组织中p-NF-κB p65蛋白表达水平水迷宫实验后,采用10%水合氯醛350 mg·kg-1麻醉,断头后迅速选取海马组织放于液氮中,然后转移到-80℃冰箱保存。称取湿重约30 mg的海马组织,按照组织总蛋白抽提试剂盒操作提取细胞总蛋白。BCA法对蛋白进行定量。样品加入Loading Buffer后煮沸变性5~10 min,再进行电泳和转膜,5%脱脂牛奶封闭1 h,然后一抗4℃孵育过夜和二抗室温孵育1 h,用ECL化学发光显影液,于化学发光凝胶成像系统中显影成像,采用Image Lab 6.0软件进行灰度扫描分析,以β-actin为内参,以各蛋白条带灰度值与β-actin灰度值的比值表示蛋白表达水平。
1.8 大鼠海马组织中IL-1β和TNF-α水平测定水迷宫实验后,采用10%水合氯醛350 mg·kg-1麻醉,断头后迅速选取海马组织放于液氮中,然后转移到-80℃冰箱保存。取约30 mg海马组织置于9倍的预冷的生理盐水,制备匀浆,于4℃、3000 g离心20 min,取上清液。按照ELISA试剂盒说明书检测并计算海马组织中TNF-α和IL-1β水平。
1.9 统计学分析采用SPSS22.0统计软件进行统计学分析。各组大鼠逃避潜伏期、平台象限停留时间、肌肽和GSH含量、p-NF-κB p65蛋白表达水平及IL-1β、TNF-α水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠水迷宫逃避潜伏期和平台象限停留时间模型组大鼠逃避潜伏期较假手术组明显延长(P < 0.01)。与模型组比较,不同剂量肌肽组大鼠逃避潜伏期明显缩短(P < 0.01);且随着肌肽剂量的增加,逃避潜伏期逐渐缩短。与假手术组比较,模型组大鼠平台象限停留时间明显缩短(P < 0.01);与模型组比较,不同剂量肌肽组大鼠平台象限停留时间明显延长(P < 0.05或P < 0.01)。见表 1。
| (x±s, t/s) | |||||||||||||||||||||||||||||
| Group | Dose (mg·kg-1) |
n | Escape latency | Time staying in platform quadrant on 12th day | |||||||||||||||||||||||||
| (t/d) 9 | 10 | 11 | |||||||||||||||||||||||||||
| Sham operation | 0 | 10 | 27.9±3.9 | 22.6±2.1 | 14.8±2.0 | 53.2±7.1 | |||||||||||||||||||||||
| Model | 0 | 10 | 54.9±4.6* | 43.9±2.9* | 35.2±2.5* | 24.9±2.9* | |||||||||||||||||||||||
| Carnosine | 100 | 10 | 49.5±4.4△ | 39.7±3.1△ | 30.5±2.7△△ | 28.9±3.4 | |||||||||||||||||||||||
| 300 | 9 | 42.2±3.1△△ | 35.4±4.7△△ | 27.6±4.7△△ | 32.8±3.4△ | ||||||||||||||||||||||||
| 900 | 9 | 37.4±3.8△△ | 30.9±2.2△△ | 24.8±2.7△△ | 37.1±3.5△△ | ||||||||||||||||||||||||
| * P < 0.01 compared with sham operation group; △ P < 0.05, △△ P < 0.01 compared with model group. | |||||||||||||||||||||||||||||
GFAP是星形胶质细胞特有的细胞骨架蛋白,在活化的星形胶质细胞中表达明显增加。假手术组大鼠海马CA1区可见到少量GFAP阳性表达的星形胶质细胞。与假手术组比较,模型组海马CA1区GFAP阳性表达的星形胶质细胞数量明显增多,其形态也稍长,分支稍多; 与模型组比较,肌肽组GFAP阳性细胞数量减少,胞体减小、突起细长。同时可见模型组海马CA1区锥体细胞排列紊乱,部分缺失;肌肽组海马CA1区锥体细胞排列及数目基本恢复正常。见图 1(插页四)。
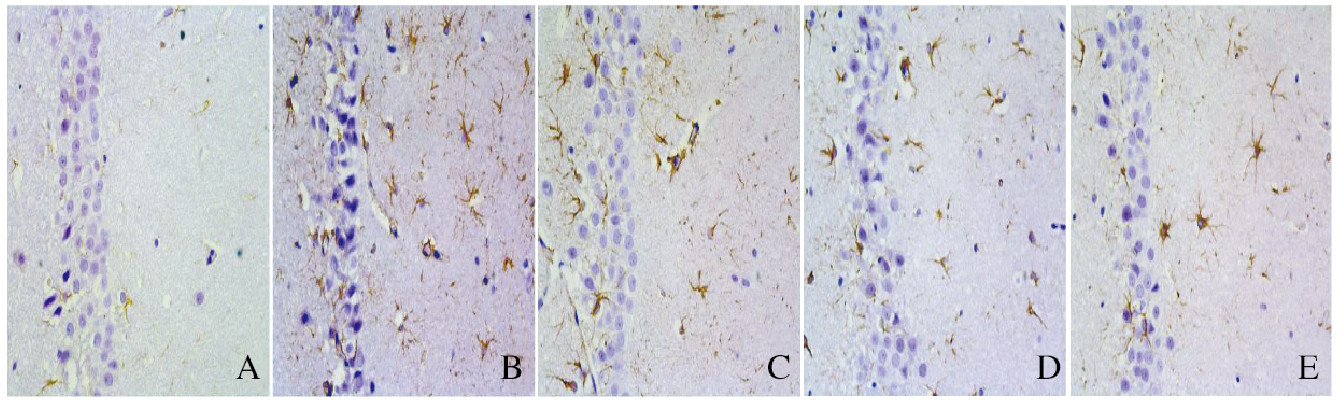
|
| A: Sham operation group; B:Model group; C: 100 mg·kg-1 carnosine group; D: 300 mg·kg-1 carnosine group; E:900 mg·kg-1 carnosine group. 图 1 免疫组织化学法检测各组大鼠海马组织中GFAP蛋白表达(×200) Fig. 1 Expressions of GFAP protein in hippocampus tissue of rats in various groups detected by immunohistochemistry method (×200) |
|
|
与假手术组比较,模型组大鼠海马组织中肌肽水平明显降低(P < 0.01);与模型组比较,不同剂量肌肽组大鼠海马组织中肌肽水平明显升高(P < 0.01)。与假手术组比较,模型组大鼠海马组织中GSH水平明显降低(P < 0.01);与模型组比较,不同剂量肌肽组大鼠海马组织中GSH水平明显升高(P < 0.05或P < 0.01)。见表 2。
| [n=8, x±s, mB/(μmol·g-1)] | |||||||||||||||||||||||||||||
| Group | Dose (mg·kg-1) |
Carnosine | GSH | ||||||||||||||||||||||||||
| Sham operation | 0 | 0.39±0.05 | 1.68±0.19 | ||||||||||||||||||||||||||
| Model | 0 | 0.18±0.04* | 0.22±0.03* | ||||||||||||||||||||||||||
| Carnosine | 100 | 0.32±0.04△△ | 0.40±0.03△ | ||||||||||||||||||||||||||
| 300 | 0.44±0.04△△ | 0.73±0.09△△ | |||||||||||||||||||||||||||
| 900 | 0.55±0.05△△ | 1.42±0.13△△ | |||||||||||||||||||||||||||
| * P < 0.01 compared with sham operation group; △ P < 0.05, △△ P < 0.01 compared with model group. | |||||||||||||||||||||||||||||
与假手术组比较,模型组大鼠海马组织中p-NF-κB p65蛋白表达水平明显升高(P < 0.01);与模型组比较,不同剂量肌肽组大鼠海马组织中p-NF-κB p65蛋白表达水平明显降低(P < 0.05或P < 0.01)。见图 2。
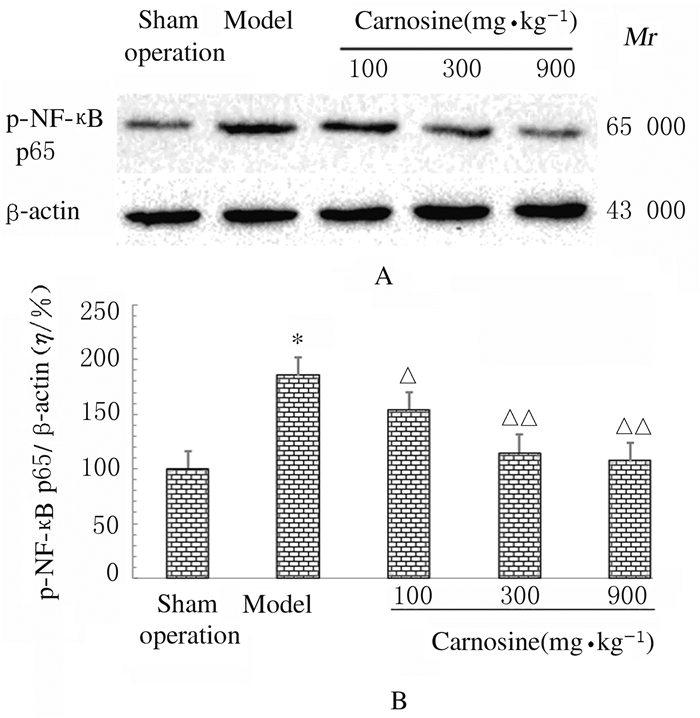
|
| *P < 0.01 compared with sham operation group; △P < 0.05, △△P < 0.01 compared with model group. 图 2 Western blotting法检测各组大鼠海马组织中p-NF-κB p65蛋白表达电泳图(A)和直条图(B) Fig. 2 Electrophoregram(A)and histogram (B) of expressions of p-NF-κB p65 protein in hippocampus tissue of rats in various groups detected by Western blotting method |
|
|
与假手术组比较,模型组大鼠海马组织中IL-1β和TNF-α水平明显升高(P < 0.01);与模型组比较,不同剂量肌肽组大鼠海马组织中IL-1β和TNF-α水平明显降低(P < 0.01)。见表 3。
| [n=8, x±s, ρB/(ng·L-1)] | |||||||||||||||||||||||||||||
| Group | Dose (mg·kg-1) |
IL-1β | TNF-α | ||||||||||||||||||||||||||
| Sham operation | 0 | 54.4±4.0 | 69.9±5.1 | ||||||||||||||||||||||||||
| Model | 0 | 121.4±14.1* | 321.3±24.8* | ||||||||||||||||||||||||||
| Carnosine | 100 | 96.2±7.3△ | 235.0±22.6△ | ||||||||||||||||||||||||||
| 300 | 82.7±7.5△ | 193.4±17.7△ | |||||||||||||||||||||||||||
| 900 | 75.1±5.8△ | 137.2±15.8△ | |||||||||||||||||||||||||||
| * P < 0.01 compared with sham operation group; △ P < 0.01 compared with model group. | |||||||||||||||||||||||||||||
脑缺血再灌注损伤是致VCI的重要原因[10],本研究采用血管缺血再灌注方法制备大鼠VCI模型,水迷宫实验结果显示:模型组大鼠出现明显的空间学习记忆障碍,表现为大鼠逃避潜伏期明显延长,平台象限停留时间明显减少,表明模型复制成功;与模型组比较,肌肽组大鼠逃避潜伏期明显缩短,平台象限停留时间明显增加,表明肌肽对缺血再灌引起的认知功能障碍具有保护作用。
海马与学习记忆密切相关,同时也是脑组织中对缺血最敏感、最易受损的部位之一,其损伤程度与缺血再灌注后认知功能障碍密切相关[11]。本文作者通过对海马组织的研究来探究肌肽对VCI的保护机制。氧化应激是由机体内产生的活性氧(reactive oxygen species, ROS)介导的组织和细胞的氧化损伤,在脑缺血再灌损伤中起重要作用[12]。星形胶质细胞能为神经元提供抗氧化的GSH。GSH可清除体内的超氧离子及其他自由基,是大脑中发现的重要的抗氧化剂。本研究结果显示:模型组大鼠海马组织中GSH蛋白表达水平明显下降,说明缺血再灌注损伤可以使星形胶质细胞合成GSH的能力下降或消耗增加;而灌胃给予肌肽可增加海马组织中肌肽水平,并可增加海马组织中GSH水平。由于肌肽具有很强的抗氧化能力,因此推测肌肽灌胃可能是通过升高海马组织中肌肽水平来发挥保护作用的。
NF-κB是一种能调节多种炎症反应的核转录因子。静息状态时NF-κB与其抑制蛋白结合成非活性的复合物停留于胞浆。当细胞受到炎症信号刺激时,抑制蛋白发生降解,随后NF-κB P65被磷酸化激活并进入胞核内,从而发挥调节基因转录表达的功能。本研究结果显示:与假手术组比较,模型组p-NF-κB p65蛋白表达水平明显升高,说明NF-κB途径被激活;灌胃给予肌肽后p-NF-κB p65蛋白表达水平明显降低,说明NF-κB途径受到抑制。由于ROS可激活NF-κB[13],推测肌肽可能是通过增加GSH水平而降低ROS水平来发挥作用的。
星形胶质细胞在中枢神经系统占有重要地位。NF-κB途径可激活星形胶质细胞,表现为星形胶质细胞胞体肥大,突起增粗、延长,细胞数目增多。GFAP表达水平升高是活化星形胶质细胞增生的主要特征[14-15]。本研究结果显示:与假手术组比较,模型组大鼠海马CA1区活化的星形胶质细胞数量明显增多,突起延长,分支增多;而肌肽组可见增多的活化星形胶质细胞数量明显降低,形态也接近正常。活化的星形胶质细胞通过提高清除自由基、释放营养因子等途径发挥神经保护作用[16],但过度激活的星形胶质细胞往往会产生大量的炎症因子对神经有损伤作用[17-18]。
激活的星形胶质细胞可分泌炎性相关因子,如TNF-α和IL-1β等[19-20]。本研究结果显示:与假手术组比较,模型组大鼠海马组织中TNF-α和IL-1β水平明显升高,而肌肽组海马组织中TNF-α和IL-1β水平明显降低。升高的IL-1β和TNF-α可以进一步激活星形胶质细胞,释放更多的炎症因子,反过来激活NF-κB途径,形成恶性循环。敲除NF-κB基因大鼠缺血区神经元受损数量明显降低,且TNF-α等表达水平均下降[21],推测肌肽可能通过抑制NF-κB途径,降低TNF-α和IL-1β的生成来发挥保护作用。
综上所述,肌肽可以明显改善缺血再灌注损伤引起的大鼠空间认知功能障碍,其机制可能与其增加大鼠海马组织中肌肽和GSH水平,提高大鼠的抗氧化能力,抑制NF-κB途径的异常激活,进而抑制星形胶质细胞的激活,减少炎症细胞因子IL-1β和TNF-α的释放有关。
| [1] |
KALARIA R N. Neuropathological diagnosis of vascular cognitive impairment and vascular dementia with implications for Alzheimer's disease[J]. ActaNeuropathol, 2016, 131(5): 659-685. |
| [2] |
RAZ L, KNOEFEL J, BHASKAR K. The neuropathology and cerebrovascular mechanisms of dementia[J]. J Cereb Blood Flow Metab, 2016, 36(1): 172-186. DOI:10.1038/jcbfm.2015.164 |
| [3] |
方超, 李晴, 鲁美丽, 等. 肌肽对大鼠脑片缺氧缺糖/再灌损伤的保护作用[J]. 中国生化药物杂志, 2015, 35(9): 41-47. |
| [4] |
白剑, 迟戈, 张俊, 等. 肌肽对低氧所致大鼠血管内皮细胞损伤的保护作用[J]. 中国应用生理学杂志, 2010, 26(1): 30-32. |
| [5] |
XIE RX, LI DW, LIU XC, et al. Carnosine attenuates brain oxidative stress and apoptosis after intracerebral hemorrhage in rats[J]. Neurochem Res, 2017, 42(2): 541-551. DOI:10.1007/s11064-016-2104-9 |
| [6] |
王蕊, 杨秦飞, 唐一鹏, 等. 大鼠拟血管性痴呆模型的建立及中药9602防治作用初探[J]. 北京中医药大学学报, 2000, 23(5): 30-32. DOI:10.3321/j.issn:1006-2157.2000.05.010 |
| [7] |
MORRIS R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods, 1984, 11(1): 47-60. DOI:10.1016/0165-0270(84)90007-4 |
| [8] |
杨菁, 吴国强, 白剑, 等. 邻苯二甲醛柱前衍生化高效液相色谱法测定组织中肌肽含量[J]. 中国生化药物杂志, 2009, 30(4): 258-260. |
| [9] |
魏斌, 李鹏, 崔胜云. HPLC法测定莲子中还原型谷胱甘肽(GSH)和总巯基(-SH)含量[J]. 食品研究与开发, 2015, 36(8): 68-72. DOI:10.3969/j.issn.1005-6521.2015.08.019 |
| [10] |
HORT J, VALIS M, KUC A, et al. Vascular cognitive impairment:Information from animal models on the pathogenic mechanisms of cognitive deficits[J]. Int J Mol Sci, 2019, 20(10): E2405. DOI:10.3390/ijms20102405 |
| [11] |
HOSSEINI AA, MENG D, SIMPSON RJ, et al. Mesiotemporal atrophy and hippocampal diffusivity distinguish amnestic from non-amnestic vascular cognitive impairment[J]. Eur J Neurol, 2017, 24(7): 902-911. DOI:10.1111/ene.13299 |
| [12] |
PENG T M, JIANG Y Z, FARHAN M, et al. Anti-inflammatory effects of traditional Chinese medicines on preclinical in vivo models of brain ischemia-reperfusion-injury:Prospects for neuroprotective drug discovery and therapy[J]. Front Pharmacol, 2019, 10: 204. DOI:10.3389/fphar.2019.00204 |
| [13] |
YANG CM, LIN CC, HSIEH HL. High-glucose-derived oxidative stress-dependent heme oxygenase-1 expression from astrocytes contributes to the neuronal apoptosis[J]. MolNeurobiol, 2017, 54(1): 470-483. |
| [14] |
ROY CHOUDHURY G, RYOU M G, POTEET E, et al. Involvement of p38 MAPK in reactive astrogliosis induced by ischemic stroke[J]. Brain Res, 2014, 1551: 45-58. DOI:10.1016/j.brainres.2014.01.013 |
| [15] |
BAO Y, QIN L Y, KIM E, et al. CD36 is involved in astrocyte activation and astroglial scar formation[J]. J Cereb Blood Flow Metab, 2012, 32(8): 1567-1577. DOI:10.1038/jcbfm.2012.52 |
| [16] |
ABEYSINGHE H C, PHILLIPS E L, CHIN-CHENG H, et al. Modulating astrocyte transition after stroke to promote brain rescue and functional recovery:emerging targets include rho kinase[J]. Int J MolSci, 2016, 17(3): 288. |
| [17] |
LIU Z, CHOPP M. Astrocytes, therapeutic targets for neuroprotection and neurorestoration in ischemic stroke[J]. ProgNeurobiol, 2016, 144: 103-120. |
| [18] |
JAYARAJ R L, AZIMULLAH S, BEIRAM R, et al. Neuroinflammation:friend and foe for ischemic stroke[J]. J Neuroinflammation, 2019, 16(1): 142. DOI:10.1186/s12974-019-1516-2 |
| [19] |
KEMPURAJ D, THANGAVEL R, NATTERU P A, et al. Neuroinflammation induces neurodegeneration[J]. J Neurol Neurosurg Spine, 2016, 1(1): 1003. |
| [20] |
THOMPSON W L, VAN ELDIK L J. Inflammatory cytokines stimulate the chemokines CCL2/MCP-1 and CCL7/MCP-7 through NF-κB and MAPK dependent pathways in rat astrocytes[J]. Brain Res, 2009, 1287: 47-57. DOI:10.1016/j.brainres.2009.06.081 |
| [21] |
DVORIANTCHIKOVA G, BARAKAT D, BRAMBILLA R, et al. Inactivation of astroglial NF-kappaB promotes survival of retinal neurons following ischemic injury[J]. Eur J Neurosci, 2009, 30(2): 175-185. |
 2020, Vol. 46
2020, Vol. 46


