扩展功能
文章信息
- 肖华, 姚声涛
- XIAO Hua, YAO Shengtao
- 转染TRIM29-siRNA对胶质瘤U87MG细胞周期和凋亡的影响
- Effects of TRIM29-siRNA transfection on cell cycle and apoptosis of glioma U87MG cells
- 吉林大学学报(医学版), 2020, 46(02): 323-328
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 323-328
- 10.13481/j.1671-587x.20200219
-
文章历史
- 收稿日期: 2019-08-16
三结构域蛋白(tripartitemotif,TRIM)家族是一类成员超过70种的大家族,具有典型的锌指结构域、卷曲螺旋结构域和B-box结构域,在细胞生长、信号传导和固有免疫等过程中发挥着重要作用,与胶质瘤的发生发展密切相关[1-3]。研究[4-6]显示:TRIM家族成员三结构域蛋白29 (tripartitemotifcontaining 29,TRIM29)在鼻咽癌、骨肉瘤和结肠癌等肿瘤中异常高表达,且可通过调控细胞增殖、周期、侵袭、迁移和凋亡等在肿瘤的发生发展过程中发挥着类似原癌基因的作用。研究[7]显示:TRIM29在胶质瘤中亦高表达,与患者病理分级密切相关,且抑制其表达可抑制肿瘤细胞增殖和迁移;然而,TRIM29在胶质瘤细胞周期和凋亡中的作用及调控机制并不清楚。本研究观察干扰TRIM29表达对胶质瘤U87MG细胞周期和凋亡的影响,旨在进一步阐明TRIM29在胶质瘤发生发展中的作用。
1 材料与方法 1.1 细胞、主要试剂和仪器人胶质瘤细胞系U87MG(中科院上海细胞库),兔抗人TRIM29、GAPDH抗体和鼠抗人CyclinD1、P21、Bax、Bcl-2抗体(美国SantaCruz公司),辣根过氧化酶标记的二抗(美国Thermo Scientific公司),RIPA裂解液(上海碧云天公司),细胞周期试剂盒(美国BD公司),碘化丙啶、胎牛血清、RPMI培养基、胰蛋白酶和青-链霉素双抗(美国Gibco公司),BSA蛋白定量检测试剂盒(美国Bio-Rad公司),PVDF膜和ECL检测试剂盒(美国Millipore公司),荧光定量PCR试剂盒和逆转录试剂盒(大连TaKaRa公司),Annexin Ⅴ-FITC细胞凋亡试剂盒(南京建成生物公司),TRIzol试剂和脂质体2000(美国Invitrogen公司)。CO2细胞培养箱(日本SONYO公司),ChemiDoc XRS System成像仪(美国Bio-Rad公司),FACSCantoⅡ流式细胞仪(美国BD公司)。
1.2 细胞培养、分组和转染将解冻复苏后的U87MG细胞接种至含10%胎牛血清和100U·mL-1青-链霉素双抗的RPMI培养基上,并于37℃、5%CO2和饱和湿度的细胞培养箱内常规培养。实验分为对照组(未转染)、NC-siRNA组(转染阴性对照NC-siRNA)和TRIM29-siRNA组(转染TRIM29-siRNA),每组设置3个复孔。将对数生长期的U87MG细胞以每孔1×106个接种至6孔细胞培养板上,细胞培养箱内常规培养。待细胞生长至约75%融合时,参照脂质体2000说明书将NC-siRNA或TRIM29-siRNA根据实验分组转至U87MG细胞中。转染5 h后更新培养液继续培养,48 h后胰蛋白酶消化收集各组细胞进行后续实验。TRIM29干扰序列由上海吉玛生物公司合成,TRIM29-siRNA序列为5′-CCGG-ACCTGAGCCGTAACTTCATTGCTCGAGCAA-TGAAGTTACGGCTCAGGTTTTTG-3′,阴性对照NC-siRNA序列为5′-CCGGGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAAC-TCGAGTTCTTTTTG-3′。
1.3 实时荧光定量PCR法检测各组细胞中TRIM29 mRNA表达水平采用TRIzol法提取对照组、NC-siRNA组和TRIM29-siRNA组细胞的总RNA后,参照逆转录试剂盒说明书将RNA逆转录合成单链cDNA,再以cDNA为模板,参照实时荧光定量PCR试剂盒说明书进行PCR扩增,以GAPDH为内参,采用2-ΔΔCt法计算各组细胞中TRIM29 mRNA的表达水平。PCR引物序列:TRIM29上游引物,5′-TGCGAGCTGCATCTCAAGC-3′,TRIM29下游引物,5′-GGTGCTATGATTCTTGTGCTCC-3′; GAPDH上游引物,5′-GGGAAACTGTGGCGTGAT-3′,GAPDH下游引物,5′-GAGTGGGTGTCGCTGTTGA-3′。
1.4 Western blotting法检测各组细胞中TRIM29、CyclinD1、P21、Bcl-2和Bax蛋白表达水平向收集到的各组U87MG细胞中加入RIPA裂解液提取细胞总蛋白后,参照BSA蛋白定量检测试剂盒说明书检测总蛋白的浓度。将热变性的蛋白样品上样到SDS-PAGE凝胶中行电泳分离。分离结束后转至PVDF膜。以5%脱脂奶粉封膜2 h后,加入稀释1000倍的TRIM29一抗工作液于4℃下孵育过夜。次日,再以稀释5000倍的二抗工作液室温孵育2 h。根据ECL检测试剂盒说明书暗室内显影曝光后,采用凝胶成像分析仪检测,以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白表达水平。
1.5 流式细胞术检测各组细胞的细胞周期以磷酸缓冲液将收集到的TRIM29-siRNA组、NC-siRNA组和对照组细胞洗涤3次后,于4℃加入预冷的70%乙醇固定细胞24 h。胰酶消化收集各组细胞后,调整细胞浓度为1×105 mL-1。取细胞悬液200 μL,根据细胞周期试剂盒说明书采用流式细胞仪检测各组细胞的周期分布情况。实验重复3次。
1.6 Annexin Ⅴ-FITC法检测各组细胞凋亡率以磷酸缓冲液洗涤各组细胞后,制成浓度为1×104mL-1的细胞悬液,取细胞悬液200 μL,根据Annexin Ⅴ-FITC细胞凋亡检测试剂盒说明书检测各组细胞凋亡率。实验重复3次。细胞凋亡率=(早期凋亡细胞+晚期凋亡细胞)/细胞总数×100%。
1.7 统计学分析采用SPSS22.0统计软件进行统计学分析。各组U87MG细胞中TRIM29 mRNA和TRIM29、CyclinD1、P21、Bcl-2和Bax蛋白表达水平,不同细胞周期U87MG细胞百分率和细胞凋亡率均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组U87MG细胞中TRIM29 mRNA和蛋白表达水平实时荧光定量PCR法检测结果显示:对照组、NC-siRNA组和TRIM29-siRNA组细胞中TRIM29 mRNA表达水平比较差异有统计学意义(F=311.31,P < 0.05);与对照组比较,NC-siRNA组U87MG细胞中TRIM29 mRNA表达水平差异无统计学意义(P>0.05);与对照组和NC-siRNA组比较,TRIM29-siRNA组U87MG细胞中TRIM29 mRNA表达水平明显降低(P < 0.05)。Western blotting法检测结果显示:各组细胞中TRIM29蛋白表达水平比较差异有统计学意义(F=404.74,P < 0.05);与对照组比较,NC-siRNA组U87MG细胞中TRIM29蛋白表达水平差异无统计学意义(P>0.05);与对照组和NC-siRNA组比较,TRIM29-siRNA组U87MG细胞中TRIM29蛋白表达水平明显降低(P < 0.05)。见图 1和表 1。

|
| Lane 1:Control group; Lane 2:NC-siRNA group; Lane 3:TRIM29-siRNA group. 图 1 Western blotting法检测各组U87MG细胞中TRIM29蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of TRIM29 protein in U87MG cells in various groups detected by Western blotting method |
|
|
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | TRIM29 mRNA | TRIM29 protein | |||||||||||||||||||||||||||
| Control | 1.00±0.11 | 0.73±0.06 | |||||||||||||||||||||||||||
| NC-siRNA | 0.95±0.06 | 0.77±0.05 | |||||||||||||||||||||||||||
| TRIM29-siRNA | 0.23±0.02*△ | 0.19±0.03*△ | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group;△ P < 0.05 compared with NC-siRNA group. | |||||||||||||||||||||||||||||
Western blotting法检测结果显示:各组细胞中CyclinD1和P21蛋白表达水平比较差异有统计学意义(F=196.59,P < 0.05;F=267.62,P < 0.05)。与对照组比较,NC-siRNA组U87MG细胞中CyclinD1和P21蛋白表达水平差异无统计学意义(P>0.05);与对照组和NC-siRNA组比较,TRIM29-siRNA组U87MG细胞中P21蛋白表达水平明显升高(P < 0.05),而CyclinD1蛋白表达水平明显降低(P < 0.05)。见图 2和表 2。

|
| Lane 1:Control group; Lane 2:NC-siRNA group; Lane 3:TRIM29-siRNA group. 图 2 Western blotting法检测各组U87MG细胞中CyclinD1和P21蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of CyclinD1 and P21 proteins in U87MG cells in various groups detected by Western blotting method |
|
|
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | CyclinD1 protein | P21 protein | |||||||||||||||||||||||||||
| Control | 0.69±0.05 | 0.21±0.03 | |||||||||||||||||||||||||||
| NC-siRNA | 0.72±0.07 | 0.26±0.03 | |||||||||||||||||||||||||||
| TRIM29-siRNA | 0.28±0.03*△ | 0.55±0.04*△ | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group;△ P < 0.05 compared with NC-siRNA group. | |||||||||||||||||||||||||||||
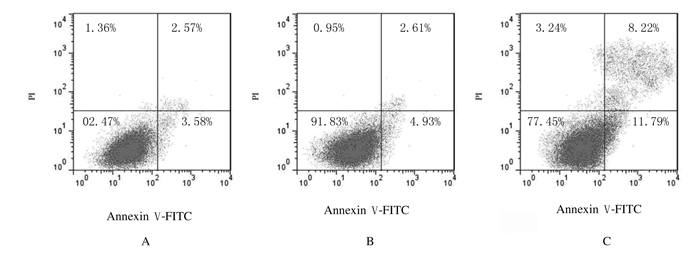
Western blotting检测结果显示:3组细胞中Bax和Bcl-2蛋白表达水平比较差异有统计学意义(F=208.48,P < 0.05;F=345.27,P < 0.05)。与对照组比较,NC-siRNA组U87MG细胞中Bax和Bcl-2蛋白表达水平差异无统计学意义(P>0.05);与对照组和NC-siRNA组比较,TRIM29-siRNA组U87MG细胞中Bax蛋白表达水平明显升高(P < 0.05),而Bcl-2蛋白表达水平明显降低(P < 0.05)。见图 3和表 3。
|
| Lane 1:Control group; Lane 2:NC-siRNA group; Lane 3:TRIM29-siRNA group. 图 3 Western blotting法检测各组U87细胞中Bcl-2和Bax蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of Bcl-2 and Bax proteins in U87MG cells in various groups detected by Western blotting method |
|
|
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | Bcl-2 | Bax | |||||||||||||||||||||||||||
| Control | 0.67±0.04 | 0.18±0.02 | |||||||||||||||||||||||||||
| NC-siRNA | 0.70±0.06 | 0.20±0.03 | |||||||||||||||||||||||||||
| TRIM29-siRNA | 0.31±0.03*△ | 0.48±0.03*△ | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group;△ P < 0.05 compared with NC-siRNA group. | |||||||||||||||||||||||||||||
流式细胞术检测结果显示:各组G0/G1期、S期和G2/M期U87MG细胞百分率比较差异有统计学意义(F=29.12,P < 0.05;F=16.10,P < 0.05;F=9.60,P < 0.05)。与对照组比较,NC-siRNA组G0/G1期、S期和G2/M期U87MG细胞百分率差异无统计学意义(P>0.05);与对照组和NC-siRNA组比较,TRIM29-siRNA组G0/G1期U87MG细胞百分比明显升高(P < 0.05),而S期和G2/M期U87MG细胞百分率明显降低(P < 0.05)。见表 4。
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Percentage of U87MG cells | ||||||||||||||||||||||||||||
| G0/G1 | S | G2/M | |||||||||||||||||||||||||||
| Control | 48.38±3.25 | 27.86±3.22 | 23.64±3.03 | ||||||||||||||||||||||||||
| NC-siRNA | 47.65±3.16 | 28.48±3.35 | 23.85±2.72 | ||||||||||||||||||||||||||
| TRIM29-siRNA | 59.26±4.32*△ | 21.36±2.12*△ | 19.38±1.15*△ | ||||||||||||||||||||||||||
| * P < 0.05 compared with control group;△ P < 0.05 compared with NC-siRNA group. | |||||||||||||||||||||||||||||
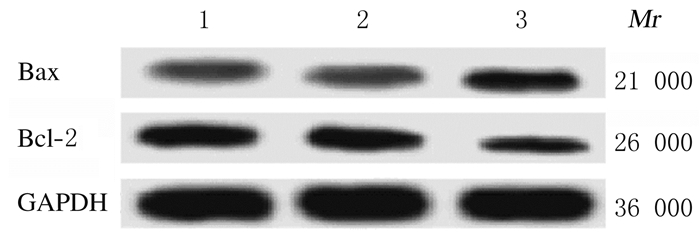
流式细胞术检测结果显示:3组细胞凋亡率比较差异有统计学意义(F=187.88,P < 0.05)。与对照组(6.12%±1.03%)比较,NC-siRNA组U87MG细胞凋亡率(7.54%±1.25%)差异无统计学意义(P>0.05);与对照组和NC-siRNA组比较,TRIM29-siRNA组U87MG细胞凋亡率(19.85%±2.36%)明显升高(P < 0.05)。见图 4。
|
| A:Control group; B:NC-siRNA group; C:TRIM29-siRNA group. 图 4 流式细胞术检测各组U87MG细胞凋亡率 Fig. 4 Apoptotic rates of U87MG cells in various groups detected by flow cytometry |
|
|
胶质瘤是一种常见的恶性原发性脑肿瘤,尽管近几十年来传统疗法如外科手术技术与设备、新化疗药物开发和放射外科治疗等得到了快速发展,但寻找新的分子靶点和开发新的靶点疗法以实现患者的长期生存仍然很重要[8-11]。
TRIM29属于TRIM家族成员,位于人类染色体11q23上,可编码588个氨基酸,被证实在胶质瘤组织和细胞中异常高表达,而干扰其表达可通过调控AKT信号通路抑制肿瘤细胞增殖[7]。细胞周期紊乱是细胞过度增殖促进胶质瘤恶性进展的重要机制[12-14]。TAN等[15]利用siRNA靶向抑制TRIM29表达通过调控PKC-NF-κB信号通路引起周期相关蛋白CyclinD1和CyclinE表达下降,导致细胞阻滞于G0/G1期,进而抑制膀胱癌5637细胞生长速率。HUANG等[16]研究显示:敲低TRIM29表达诱导胃癌细胞阻滞于G0/G1期的机制与上调细胞周期密切相关蛋白P53和P21的表达有关。本研究转染TRIM29-siRNA成功下调TRIM29表达后,G0/G1期胶质瘤U87MG细胞百分率和P21蛋白表达水平明显升高,而CyclinD1蛋白表达水平明显降低。这表明TRIM29沉默可通过调控CyclinD1和P21蛋白的表达诱导胶质瘤细胞周期阻滞于G0/G1期。提示TRIM29在胶质瘤细胞周期调控中发挥着重要作用。
细胞凋亡是一种正常的生理性死亡过程,与细胞增殖相似,其发生异常与胶质瘤发生发展有密切关联[17-20]。聂宇等[21]研究发现:靶向沉默TRIM29可诱导骨肉瘤细胞凋亡。XU等[22]对甲状腺癌的研究发现:敲低TRIM29表达可通过增强促凋亡相关基因Bax、caspase-3和caspase-9活性,降低抑凋亡基因Bcl-2活性,诱导细胞凋亡,以增强顺铂的化学敏感性。本研究转染TRIM29-siRNA可使胶质瘤U87MG细胞凋亡率明显升高;此外,转染TRIM29-siRNA亦引起胶质瘤U87MG细胞中Bax表达升高和Bcl-2表达降低。本研究结果表明:TRIM29沉默可促进胶质瘤U87MG细胞发生凋亡,提示TRIM29可通过调控Bax和Bcl-2的表达在胶质瘤细胞凋亡过程中发挥着重要的调控作用,沉默其表达可诱导胶质瘤U87MG细胞凋亡。
综上所述,转染TRIM29-siRNA可诱导U87MG细胞周期阻滞和凋亡,其作用机制可能与下调CyclinD1、Bcl-2蛋白表达和上调P21、Bax蛋白表达有关。本研究结果进一步丰富了TRIM29调控胶质瘤发生发展的分子机制,但TRIM29是通过何种信号途径发挥调控作用的还需后续深入研究。
| [1] |
陈艳清, 曹树辉, 李传友. 三结构域蛋白(TRIM)家族结构及功能的研究进展[J]. 中华微生物学和免疫学杂志, 2017, 37(6): 479-484. DOI:10.3760/cma.j.issn.0254-5101.2017.06.013 |
| [2] |
TANG S, GAO Y, HU W. TRIM22 functions as an oncogene in gliomas through regulating the Wnt/β-catenin signaling pathway[J]. RSC Adv, 2018, 8(54): 30894-30901. DOI:10.1039/C8RA05684F |
| [3] |
TAN Z Y, SONG L B, WU W J, et al. TRIM14 promotes chemoresistance in gliomas by activating Wnt/β-catenin signaling via stabilizing Dvl2[J]. Oncogene, 2018, 37(40): 5403-5415. DOI:10.1038/s41388-018-0344-7 |
| [4] |
ZHOU X M, SUN R, LUO D H, et al. Upregulated TRIM29 promotes proliferation and metastasis of nasopharyngeal carcinoma via PTEN/AKT/mTOR signal pathway[J]. Oncotarget, 2016, 7(12): 13634-13650. |
| [5] |
ZENG S X, CAI Q C, GUO C H, et al. High expression of TRIM29(ATDC) contributes to poor prognosis and tumor metastasis by inducing epithelial mesenchymal transition in osteosarcoma[J]. Oncol Rep, 2017, 38(3): 1645-1654. DOI:10.3892/or.2017.5842 |
| [6] |
SUN J T, ZHANG T, CHENG M M, et al. TRIM29 facilitates the epithelial-to-mesenchymal transition and the progression of colorectal cancer via the activation of the Wnt/β-catenin signaling pathway[J]. J Exp Clin Cancer Res, 2019, 38(1): 104. DOI:10.1186/s13046-019-1098-y |
| [7] |
王雨涛, 周济, 杨冬, 等. TRIM29基因在胶质瘤中的表达及其对胶质母细胞瘤细胞U-87MG增殖与迁移的影响[J]. 第三军医大学学报, 2018, 40(11): 959-965. |
| [8] |
冯基高, 莫业和, 徐鹏翔, 等. SNAI2在人脑恶性胶质瘤中的表达情况及其与细胞增殖转移的关系[J]. 河北医科大学学报, 2017, 38(11): 1265-1270. DOI:10.3969/j.issn.1007-3205.2017.11.006 |
| [9] |
STURM D, PFISTER S M, JONE D T W. Pediatric gliomas:current concepts on diagnosis, biology, and clinical management[J]. J Clin Oncol, 2017, 35(21): 2370-2377. DOI:10.1200/JCO.2017.73.0242 |
| [10] |
张成刚. CPEB4对脑胶质瘤细胞增殖、迁移的影响[J]. 郑州大学学报(医学版), 2018, 53(5): 599-603. |
| [11] |
王莹, 宋凡. 富亮氨酸胶质瘤失活1蛋白抗体相关自身免疫性脑炎6例临床分析[J]. 中国实用内科杂志, 2018, 38(8): 749-752. |
| [12] |
王潇. miR-205通过靶向调控caspase-3表达调节神经胶质瘤的生物学行为[J]. 河北医科大学学报, 2017, 38(9): 1024-1028, 1032. DOI:10.3969/j.issn.1007-3205.2017.09.008 |
| [13] |
HAO C Y, DUAN H B, LI H, et al. Knockdown of MRPL42 suppresses glioma cell proliferation by inducing cell cycle arrest and apoptosis[J]. Biosci Rep, 2018, 38(2): BSR20171456. DOI:10.1042/BSR20171456 |
| [14] |
SHEN F Z, CHANG H G, GAO G J, et al. Long noncoding RNA FOXD2-AS1 promotes glioma malignancy and tumorigenesis via targeting miR-185-5p/CCND2 axis[J]. J Cell Biochem, 2019, 120(6): 9324-9336. DOI:10.1002/jcb.28208 |
| [15] |
TAN S T, LIU S Y, WU B. TRIM29 overexpression promotes proliferation and survival of bladder cancer cells through NF-κB signaling[J]. Cancer Res Treat, 2016, 48(4): 1302-1312. DOI:10.4143/crt.2015.381 |
| [16] |
HUANG J, ZHOU Y, WANG C, et al. TRIM29 promotes gastric cancer cell proliferation, migration, invasion and predicts the prognosis of patients[J]. Int J Clin Exp Med, 2018, 11(8): 7936-7944. |
| [17] |
LI F, JIN D, TANG C, et al. CEP55 promotes cell proliferation and inhibits apoptosis via the PI3K/Akt/p21 signaling pathway in human glioma U251 cells[J]. Oncol Lett, 2018, 15(4): 4789-4796. |
| [18] |
孙光雨, 李昊, 裴艳涛. 靶向SOX4基因的慢病毒感染对骨肉瘤MG63细胞凋亡的影响[J]. 郑州大学学报(医学版), 2018, 53(6): 759-763. |
| [19] |
LI Z J, XU C Y, DING B Q, et al. Long non-coding RNA MALAT1 promotes proliferation and suppresses apoptosis of glioma cells through derepressing Rap1B by sponging miR-101[J]. J Neurooncol, 2017, 134(1): 19-28. DOI:10.1007/s11060-017-2498-5 |
| [20] |
弓晶, 解新科. 内质网应激和细胞自噬对肝细胞凋亡的影响[J]. 临床肝胆病杂志, 2019, 35(12): 2828-2832. |
| [21] |
聂宇, 周纳新. 沉默TRIM29对骨肉瘤细胞增殖、凋亡及侵袭的影响[J]. 临床肿瘤学杂志, 2016, 21(12): 1079. |
| [22] |
XU JK, LI ZY, SU QH, et al. TRIM29 promotes progression of thyroid carcinoma via activating P13K/AKT signaling pathway[J]. Oncol Rep, 2017, 37(3): 1555-1564. DOI:10.3892/or.2017.5364 |
 2020, Vol. 46
2020, Vol. 46


