扩展功能
文章信息
- 陈州华, 龚辉, 冯磊, 肖玉洁, 黄立中
- CHEN Zhouhua, GONG Hui, FENG Lei, XIAO Yujie, HUANG Lizhong
- LPS对乳腺癌MDA-MB-231细胞上皮间质转化的诱导作用及其对β-catenin表达的影响
- Induction of LPS on epithelial mesenchymal transition in breast cancer MDA-MB-231 cells and its effect on β-catenin expression
- 吉林大学学报(医学版), 2020, 46(02): 309-315
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 309-315
- 10.13481/j.1671-587x.20200217
-
文章历史
- 收稿日期: 2019-06-13
2. 湖南省中医药研究院附属医院肿瘤科, 湖南 长沙 410006;
3. 湖南中医药大学中西医结合学院内科教研室, 湖南 长沙 410208
2. Department of Oncology, Affiliated Hospital, Hunan Provincial Institute of Tranditional Chinese Medicine, Changsha 410006, China;
3. Department of Internal Medicine, College of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
乳腺癌位居女性恶性肿瘤发病的首位,2014年我国女性乳腺癌发病率为41.82/10万,位居女性恶性肿瘤死亡的第5位,死亡率为9.90/10万[1]。尽管目前认为乳腺癌是一种可以控制的疾病,但每年约有52.2人万死于乳腺癌,主要是出现了复发及转移。因此,阐明促进乳腺癌侵袭转移的机制,采取针对性的治疗,具有重要的意义和应用价值。研究[2]表明:乳腺癌的侵袭转移与上皮间质转化(epithelial mesenchymal transition,EMT)密切相关。EMT过程中,细胞失去极性、与周围基质和细胞的接触减少,细胞的迁移及运动能力增强,同时细胞表型发生改变,出现间质细胞的特性,使肿瘤细胞侵袭和迁移能力增强。脂多糖(lipopolysaccharide,LPS)不仅是重要的炎性细胞因子,LPS诱导可增加前列腺癌细胞[3]、乳腺癌MCF-7细胞[4]、结肠癌细胞[5]、肝细胞癌细胞[6]迁移和侵袭,又是影响EMT的关键调控分子,可以诱导肿瘤微环境中的肿瘤细胞发生EMT,进而促进肿瘤细胞的侵袭和转移能力[7]。三阴性乳腺癌占所有乳腺癌病理类型的15%左右,具有特殊的生物性行为和临床病理特征,其侵袭性高,预后差。本研究探讨LPS对三阴性乳腺癌MDA-MB-231细胞的诱导作用,观察诱导EMT后细胞的形态及EMT标志物及β-catenin表达情况,为进一步控制三阴性乳腺癌的侵袭性生长提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人乳腺癌细胞系MDA-MB-231细胞(ER-、PR-、Her2-)来源于中南大学湘雅医学院细胞中心。LPS、PBS和青-链霉素(双抗)购自美国Solarbio公司,DMEM培养液、胎牛血清和胰蛋白酶购自美国Gibco公司,DMSO购自美国Amresco公司,Alexa Fluor 488购自美国Proteintech公司,Transwell insert购自美国Costar公司,CCK-8购自美国Sigma公司,兔抗人E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、β-catenin和β-actin多克隆抗体购自美国ImmunoWay公司,5×SDS-PAGE Loading Buffer和羊抗鼠二抗购自美国Vazyme公司,TRIzol购自美国Invitrogen公司,RIPA蛋白裂解液和超敏化学放光显色试剂盒购自江苏碧云天公司,DAPI和BCA蛋白定量试剂盒购自美国Wellbio公司,彩色预染蛋白Marker购自美国Fermentas公司,PVDF膜购自美国Amersham公司,逆转录试剂盒购自美国Promega公司,无水乙醇购自长沙华康消毒剂有限公司,多聚甲醛购自天津市科密欧化学试剂有限公司,氯仿购自上海化学试剂公司,异丙醇购自上海化学试剂公司,引物购自生工生物工程(上海)股份有限公司。实时荧光定量PCR(RT-qPCR)仪、Chemi DOC XRS凝胶成像系统、iMark酶标仪和Smart Spec Plus核酸蛋白测定仪购自美国Bio-Rad公司,CO2培养箱购自美国Thermo公司,高速冷冻离心机购自美国Beckman Coulter公司,低温低速离心机购自长沙英泰仪器有限公司,倒置显微镜购自日本Olympus公司,荧光显微镜购自日本Nikon公司,GG112-10B恒温水浴箱购自上海医疗器械厂,ADX-35B高压蒸汽消毒器购自上海申安器械厂,三气培养箱购自美国Forma公司,细胞培养瓶和细胞培养板购自美国Crystalgen公司,电泳仪、垂直板电泳槽、水平摇床和水平电转槽购自北京六一仪器厂,紫外可见分光光度计购自上海Spectrum公司,台式高速冷冻离心机、台式高速冷冻离心机和-80℃超低温冰箱购自美国Thermo公司,精密分析天平购自瑞士Mettler公司,医用净化工作台购自江苏省吴江净化设备总厂,超微量分光光度计购自德国Implen公司,微量移液器购自德国Eppendorf公司,无RNA酶EP管、无RNA酶Tip头和PCR管购自美国Axgene公司。
1.2 细胞培养在5%CO2、37℃培养条件下,采用含10%胎牛血清、1%青-链霉素双抗的DMEM培养液培养细胞,2 d换液1次。取对数生长期MDA-MB-231细胞接种于细胞培养皿中,细胞密度为每孔5×105个,待细胞生长至60%融合时,分为5组:0 mg·L-1 LPS组(对照组)、5 mg·L-1 LPS组、10 mg·L-1LPS组、20 mg·L-1 LPS组和40 mg·L-1 LPS组,继续培养。每组设3个复孔,实验重复3次。
1.3 LPS的配制取10mgLPS加10 mL PBS缓冲液溶解,以0.22μm微孔过滤膜除菌,分装于15mL离心管中4℃保存备用,使用时用细胞培养基稀释成5、10、20和40 mg·L-1。
1.4 细胞形态学观察不同浓度(0、5、10、20和40 mg·L-1)LPS处理乳腺癌MDA-MB-231细胞,培养24h后倒置显微镜观察细胞形态的改变。
1.5 免疫荧光定位实验将22 mm玻片放入6孔培养板中,单细胞悬液滴到玻片上,将6孔板放入37℃、5%CO2培养箱中培养4 h,细胞贴壁后,按分组加入2 mL不同浓度的LPS,继续放入培养箱中培养24 h。取出爬片,PBS缓冲液清洗2~3次;将爬片用4%多聚甲醛固定30 min;PBS缓冲液冲洗5 min×3次;0.3% Triton X-100通透37℃、30 min;PBS缓冲液冲洗5 min×3次;5% BSA 37℃封闭1 h;孵育一抗:滴加适当稀释的一抗(β-catenin),4℃过夜,PBS缓冲液冲洗5 min×3次;孵育二抗:滴加100~200 μL抗兔-IgG标记荧光抗体,37℃孵育90 min,PBS缓冲液冲洗5 min×3次;DAPI染核:DAPI工作液37℃孵育10 min,PBS缓冲液冲洗5 min×3次;90%甘油封片。避光保存,荧光显微镜下观察。
1.6 RT-qPCR法检测E-cadherin、Vimentin和β-catenin mRNA表达水平取各组MDA-MB-231细胞采用RNAiso Plus提取总RNA,逆转录为cDNA,RT-qPCR法检测各组细胞中E-cadherin、Vimentin和β-catenin mRNA表达水平。实验过程按试剂盒说明书进行,E-cadherin和Vimentin PCR反应条件:94℃预变性4 min,94℃变性40 s,60℃退火30 s,70℃延伸30 s,循环40次,70℃延伸10 min。β-catenin PCR反应条件:94℃预变性4 min,94℃变性40 s,58℃退火30 s,70℃延伸30 s,循环40次,70℃延伸10 min。反应结束后,取扩增得到的PCR产物5 μL于2%琼脂糖凝胶电泳,应用凝胶成像系统进行扫描。以目的基因与β-actin基因灰度值比值表示mRNA相对表达水平。引物设计:在NCBI上搜索目的基因的序列,采用Primer 5软件设计引物,由生工生物工程(上海)股份有限公司合成引物。见表 1。
| Primer | Sequence(5′-3′) | Size(bp) |
| E-cadherin | F:AAAGGCCCATTTCCTAAAAACCT R:TGCGTTCTCTATCCAGAGGCT |
133 |
| Vimentin | F:TCGTGAATACCAAGACCTGCTCAATG R:AATCCTGCTCTCCTCGCCTTCC |
94 |
| β-catenin | F:GGCTCTTGTGCGTACTGTCCTTC R:GCTTCTTGGTGTCGGCTGGTC |
99 |
| β-actin | F:ACGTTGCTATCCAGGCTGT R:CTCGGTGAGGATCTTCATG |
161 |
细胞用PBS缓冲液洗3次,应用细胞裂解液冰上裂解细胞,4℃振荡,15000 r·min-1离心20 min,提取细胞总蛋白,吸取上清液。按照BCA蛋白定量试剂盒使用说明书操作,测定蛋白浓度。等量蛋白加入缓冲液,煮沸变性。清洗玻璃板,晾干,固定在制胶槽上,点样(8%SDS-PAGE分离胶和4%浓缩胶)。电泳至溴酚兰刚跑出即可终止电泳,转至PVDF膜,TBS配制5%脱脂奶粉封闭2 h,加入一抗E-cadherin(1:500)、Vimentin(1:1 000)、β-catenin(1:5 000)和β-actin(1:1 000)4℃冰箱孵育过夜,次日TBST漂洗10 min×3次。加入1:2000辣根过氧化物酶标记二抗(1:2 000),室温孵育2 h,TBST漂洗10 min×3次。使用ECL化学发光液与膜孵育3 min,显色。凝胶成像分析仪采集图像,以β-actin为内参,测定目的蛋白条带灰度值,以目的蛋白条带灰度值与内参蛋白条带灰度值的比值表示目的蛋白的相对表达水平。实验重复3次。
1.8 统计学分析采用SPSS22.0统计软件进行统计学分析。各组细胞中Vimentin、E-cadherin和β-catenin mRNA及蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组乳腺癌MDA-MB-231细胞形态表现对照组细胞形态为圆形、椭圆形,细胞表现为上皮细胞表型,呈鹅卵石样;LPS作用后,细胞形态发生改变,细胞拉长、间隙变宽,表现为间质细胞表型,呈纺锤体形,且随着LPS浓度的增加,细胞间连接结构破坏,细胞形态由纺锤体形逐渐伸出触角。见图 1。

|
| A:Control group; B:5 mg·L-1 LPS group; C:10 mg·L-1 LPS group; D:20 mg·L-1 LPS group; E:40 mg·L-1 LPS group. 图 1 各组乳腺癌MDA-MB-231细胞形态表现(×200) Fig. 1 Morphology of breast cancer MDA-MB-231 cells in various groups (×200) |
|
|
与对照组比较,5、10、20和40 mg·L-1 LPS组MDA-MB-231细胞中β-catenin表达增加;与5和10 mg·L-1LPS组比较,20 mg·L-1 LPS组MDA-MB-231细胞中β-catenin表达增加;与20 mg·L-1 LPS组比较,40 mg·L-1 LPS组MDA-MB-231细胞中β-catenin表达降低。免疫荧光检测结果提示β-catenin的表达主要在细胞核。见图 2(插页四)。
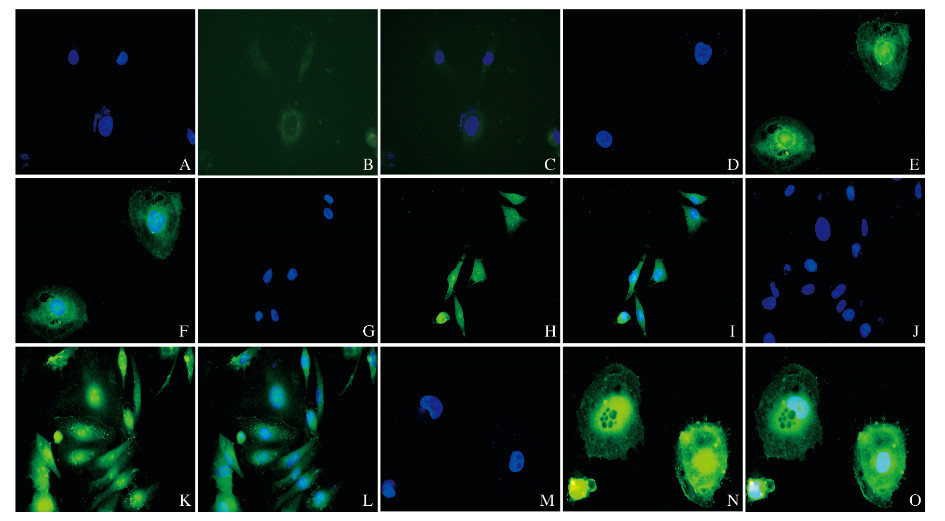
|
| A-C:Control group; D-F:5 mg·L-1 LPS group; G-I:10 mg·L-1 LPS group; J-L:20 mg·L-1 LPS group; M- O:40 mg·L-1 LPS group; A, D, G, J, M:DAPI; B, E, H, K, N:β-catenin; C, F, I, L, O: Merge. 图 2 各组MDA-MB-231细胞中βcatenin表达和定位(免疫荧光,×400) Fig. 2 Expression and localization of β-catenin in MDA- MB- 231 cells in various groups (Immunofluoresence, × 400) |
|
|
与对照组比较,不同浓度LPS组MDA-MB-231细胞中Vimentin和β-catenin mRNA表达水平升高(P < 0.05或P < 0.01),E-cadherin mRNA表达水平降低(P < 0.05或P < 0.01),并且随着LPS浓度的升高呈现一定的剂量依赖性,20 mg·L-1 LPS组最明显。见图 3。
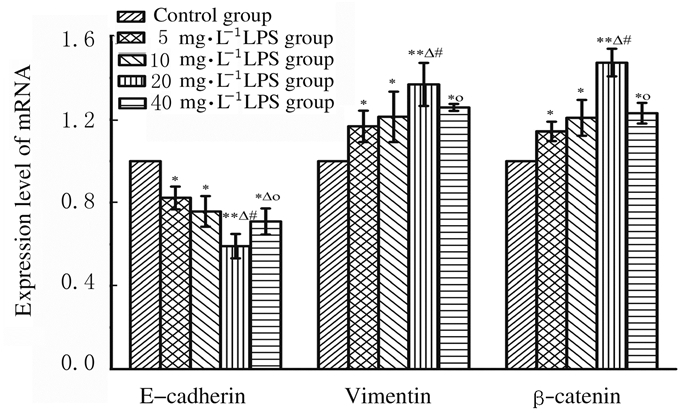
|
| n=3. *P < 0.05, **P < 0.01 compared with control group; △P < 0.05 compared with 5 mg·L-1LPS group; #P < 0.05 compared with 10 mg·L-1 LPS group; ○P < 0.05 compared with 20 mg·L-1LPS group. 图 3 各组MDA-MB-231细胞中E-cadherin、Vimentin和β-catenin mRNA表达水平 Fig. 3 Expression levels of E-cadherin, Vimentin and β-catenin mRNA in MDA-MB-231 cells in various groups |
|
|
与对照组比较,不同浓度LPS组MDA-MB-231细胞中Vimentin和β-catenin蛋白表达水平升高(P < 0.05或P < 0.01),E-cadherin蛋白表达水平降低(P < 0.05或P < 0.01),并且随着LPS浓度的升高呈现一定的剂量依赖性,20 mg·L-1 LPS组最明显。见图 4和图 5。
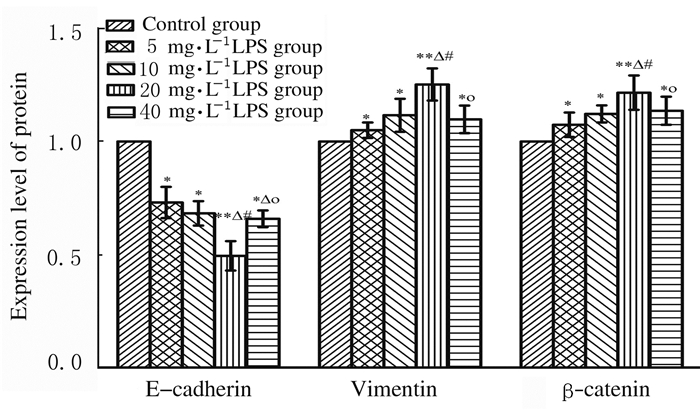
|
| n=3. *P < 0.05, **P < 0.01 compared with control group; △P < 0.05 compared with 5 mg·L-1 LPS group; #P < 0.05 compared with 10 mg·L-1 LPS group; ○P < 0.05 compared with 20 mg·L-1 LPS group. 图 4 各组MDA-MB-231细胞中E-cadherin、Vimentin和β-catenin蛋白表达水平 Fig. 4 Expression levels of E-cadherin, Vimentin and β-catenin proteins in MDA-MB-231 cells in various groups |
|
|
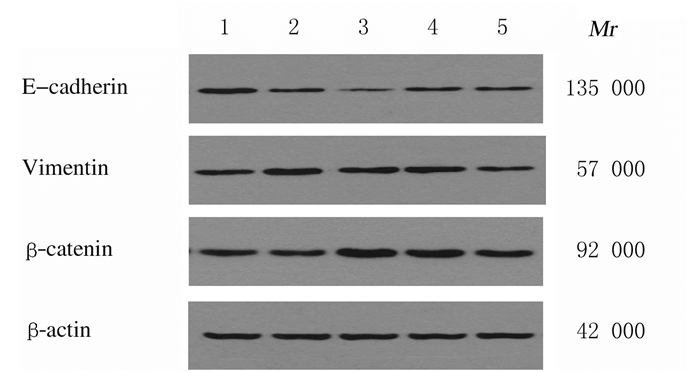
|
| Lane 1: Control group; Lane 2: 5 mg·L-1 LPS group; Lane 3: 10 mg·L-1 LPS group; Lane 4: 20 mg·L-1 LPS group; Lane 5: 40 mg·L-1 LPS group. 图 5 Western blotting法检测各组MDA-MB-231细胞中蛋白表达电泳图 Fig. 5 Electrophoregram of expressions of proteins in MDA-MB-231 cells in various groups detected by Western blotting method |
|
|
乳腺癌的迁移、侵袭和转移与EMT有密切关系,EMT是上皮细胞向间质细胞转化的过程,上皮源性恶性肿瘤侵袭和转移的关键步骤之一,被称为肿瘤中“沉睡的胚胎发育程序”,一旦该沉睡的程序被唤醒,便意味着肿瘤恶性转化的开始。主要表现为细胞形态学的改变,上皮细胞的极性丧失,细胞间连接结构破坏,由鹅卵石样上皮细胞表型向纺锤样间质细胞表型转换。EMT过程中,细胞失去极性、与周围基质和细胞的接触减少,细胞的迁移及运动能力增强,同时细胞表型发生改变,出现间质细胞的特性。以往实验[8]证明:维持细胞连接稳定需要E-cadherin的存在,抗E-cadherin抗体可破坏细胞间连接,并可诱发上皮细胞向间质细胞表型转化;Vimentin在EMT发生后表达增多,且具有促进肿瘤细胞运动和转移的作用。
LPS是组成革兰阴性细菌的细胞壁成分之一,具有广泛的生物学活性[9],研究[7, 10-11]发现:LPS不仅是重要的炎性细胞因子,又是影响EMT的关键调控分子,可以诱导肿瘤微环境中的肿瘤细胞发生EMT,进而促进肿瘤细胞的侵袭和转移,LPS刺激乳腺癌细胞发生侵袭或转移。
LPS能促进胃癌细胞[12]和膀胱癌细胞[13]的增殖,能促进胶质瘤细胞[14]和前列腺癌细胞[3]的增殖、迁移和侵袭,可增加乳腺癌MCF-7细胞[4]、结肠癌细胞[5]和肝细胞癌细胞[6]迁移、侵袭,可诱导乳腺癌MDA-MB-231[8]和MCF-7[15]细胞发生EMT。KIM等[16]研究显示:LPS通过获得间质细胞标志物(Vimentin和N-cadherin),抑制上皮细胞标志物(E-cadherin),诱导胆管上皮细胞EMT。ZHANG等[17]研究发现:LPS可诱导小鼠肺组织EMT,促进纤维化。HE等[18]研究发现:LPS可诱导口腔鳞状细胞癌细胞迁移和EMT,从而诱导肿瘤细胞转移。也正是考虑到LPS在肿瘤细胞侵袭和转移相关的EMT分子机制中所发挥的重要角色[19],LPS作为各种上皮细胞的EMT诱导因子而广泛应用于上皮细胞间质化的研究过程中[20]。EMT的进程在乳腺癌细胞侵袭和转移中发挥着重要的作用,近年来,许多研究集中在EMT的诱导机制,研究者[21]发现Wnt/β-catenin与调控EMT过程中的分子调节有关。
Wnt/β-catenin信号通路激活的关键是β-catenin降解障碍,从而使胞浆内游离的β-catenin聚集,当积聚到一定浓度时开始向胞核转移,与LEF/TCF结合进入胞内,激活下游的靶基因转录,导致肿瘤发生发展[22]。Wnt/β-catenin信号通路的失调与乳腺癌的发生密切相关[23],在乳腺癌中β-catenin可发生突变、聚集,激活Wnt/β-catenin信号通路,可促进乳腺癌细胞增殖、侵袭和转移。
研究[24]显示:乳腺癌EMT与Wnt/β-catenin信号通路有关,在浸润性乳腺导管癌的EMT中,Wnt/β-catenin信号通路表达上调。体外实验[25]发现:β-catenin的敲低导致上皮E-cadherin表达的减少,MDA-MB-231细胞中细胞迁移率和Vimentin蛋白表达的升高。国内研究[26]显示:下调β-catenin组细胞穿膜细胞数和迁移距离明显少于MDA-MB-231组和对照组。通过下调β-catenin阻止Wnt/β-catenin信号通路的激活,可降低乳腺癌MDA-MB-231细胞间质表型的表达,促进上皮表型的表达,从而降低细胞的体外侵袭和迁移能力。
本研究结果显示:LPS作用后三阴性乳腺癌MDA-MB-231细胞出现典型的EMT形态改变,细胞拉长、间隙变宽,表现为间质细胞表型,呈纺锤体形,且随着LPS浓度的升高,细胞间连接结构破坏,细胞形态由纺锤体形逐渐伸出触角。有实验[27]证明LPS能刺激小鼠黑色素瘤细胞系(B16F10)增殖,呈时间和剂量的依赖性,5 mg·L-1LPS作用24 h后活性较强。本研究免疫荧光实验检测结果显示:β-catenin的表达主要在细胞核,且20 mg·L-1 LPS组β-catenin表达最明显;RT-qPCR法和Western blotting法检测结果显示,LPS诱导后MDA-MB-231细胞中EMT的上皮细胞标记物E-cadherin表达下调,间质细胞标记物Vimentin表达上调,使其获得间质化表型,即乳腺癌MDA-MB-231细胞在LPS的诱导下发生EMT,与金一等[15]的研究结果一致,与LPS诱导乳腺癌细胞MCF-7发生EMT[8]的研究结论相似。
综上所述,LPS诱导MDA-MB-231细胞通过下调E-cadherin表达与上调Vimentin和β-catenin表达调控EMT,而乳腺癌的侵袭和转移是多因素多步骤的复杂过程,对于LPS调控EMT的机制及可能存在的Wnt/β-catenin信号通路信号分子还有待进一步探讨。
| [1] |
李贺, 郑荣寿, 张思维, 等. 2014年中国女性乳腺癌发病与死亡分析[J]. 中华肿瘤杂志, 2018, 40(3): 166-171. DOI:10.3760/cma.j.issn.0253-3766.2018.03.002 |
| [2] |
郭鱼波, 王春晖, 裴晓华. 乳腺癌细胞上皮间质转化的分子机制及其防治的研究进展[J]. 中国肿瘤, 2018, 27(12): 933-943. DOI:10.11735/j.issn.1004-0242.2018.12.A008 |
| [3] |
ZHANG Z H, XIE D D, XU S, et al. Total glucosides of paeony inhibits lipopolysaccharide-induced proliferation, migration and invasion in androgen insensitive prostate cancer cells[J]. PLoS One, 2017, 12(8): e0182584. DOI:10.1371/journal.pone.0182584 |
| [4] |
SEOL M A, PARK J H, JEONG J H, et al. Role of TOPK in lipopolysaccharide-induced breast cancer cell migration and invasion[J]. Oncotarget, 2017, 8(25): 40190-40203. |
| [5] |
CHENG G, YANG S, ZHANG G, et al. Lipopolysaccharide-induced α-catenin downregulation enhances the motility of human colorectal cancer cells in an NF-κB signaling-dependent manner[J]. Oncotargets Ther, 2016, 9: 7563-7571. DOI:10.2147/OTT.S123986 |
| [6] |
WANG L L, ZHU R, HUANG Z Q, et al. Lipopolysaccharide-induced toll-like receptor 4 signaling in cancer cells promotes cell survival and proliferation in hepatocellular carcinoma[J]. Dig Dis Sci, 2013, 58(8): 2223-2236. DOI:10.1007/s10620-013-2745-3 |
| [7] |
PARK G S, KIM J H. LPS Up-regulates ICAM-1 expression in breast cancer cells by stimulating a MyD88-BLT2-ERK-linked cascade, which promotes adhesion to monocytes[J]. Mol Cells, 2015, 38(9): 821-828. DOI:10.14348/molcells.2015.0174 |
| [8] |
HUANG T, CHEN Z J, FANG L P. Curcumin inhibits LPS-induced EMT through downregulation of NF-κB-Snail signaling in breast cancer cells[J]. Oncol Rep, 2013, 29(1): 117-124. |
| [9] |
WONG J H, HO K H, NAM S, et al. Store-operated Ca2+ entry facilitates the lipopolysaccharide-induced cyclooxygenase-2 expression in gastric cancer cells[J]. Sci Rep, 2017, 7(1): 12813. DOI:10.1038/s41598-017-12648-1 |
| [10] |
HE M Q, LIU Y H, SHEN J B, et al. Upregulation of PLZF is associated with neuronal injury in lipopolysaccharide-induced Neuroinflammation[J]. Neurochem Res, 2016, 41(11): 3063-3073. DOI:10.1007/s11064-016-2027-5 |
| [11] |
雷莉妍, 王瑞成, 周瑞, 等. 基于NF-κB通路的芒果苷干预脂多糖诱导的细胞炎症作用机制研究[J]. 中国中西医结合杂志, 2019, 39(5): 597-602. |
| [12] |
LIU W M, FAN Y Y, SHI Y, et al. Knockdown of TIPE2 increases the proliferation in lipopolysaccharide-stimulated gastric cancer cells[J]. BMC Cancer, 2018, 18(1): 857. DOI:10.1186/s12885-018-4761-3 |
| [13] |
迟强, 艾晓林, 王志勇, 等. 脂多糖经TLR4介导Cx43的表达对膀胱癌细胞增殖和凋亡的影响[J]. 实用医学杂志, 2017, 33(5): 701-705. |
| [14] |
CHE F Y, XIE X L, WANG L, et al. B7-H6 expression is induced by lipopolysaccharide and facilitates cancer invasion and metastasis in human gliomas[J]. Int Immunopharmacol, 2018, 59: 318-327. DOI:10.1016/j.intimp.2018.03.020 |
| [15] |
金一, 马特, 蒋书玲. JNK/MAPK在LPS诱导乳腺癌细胞MCF-7上皮间质转化过程中的作用[J]. 现代肿瘤医学, 2014, 22(6): 1272-1275. DOI:10.3969/j.issn.1672-4992.2014.06.12 |
| [16] |
KIM Y, LEE E J, JANG H K, et al. Statin pretreatment inhibits the lipopolysaccharide-induced epithelial-mesenchymal transition via the downregulation of toll-like receptor 4 and nuclear factor-κB in human biliary epithelial cells[J]. J Gastroenterol Hepatol, 2016, 31(6): 1220-1228. DOI:10.1111/jgh.13230 |
| [17] |
ZHANG Y Q, LIU Y J, MAO Y F, et al. Resveratrol ameliorates lipopolysaccharide-induced epithelial mesenchymal transition and pulmonary fibrosis through suppression of oxidative stress and transforming growth factor-β1 signaling[J]. Clin Nutr, 2015, 34(4): 752-760. DOI:10.1016/j.clnu.2014.08.014 |
| [18] |
HE Z F, DENG R Z, HUANG X F, et al. Lipopolysaccharide enhances OSCC migration by promoting epithelial-mesenchymal transition[J]. J Oral Pathol Med, 2015, 44(9): 685-692. DOI:10.1111/jop.12285 |
| [19] |
HONG D R, JANG S Y, JANG E H, et al. Shikonin as an inhibitor of the LPS-induced epithelial-to-mesenchymal transition in human breast cancer cells[J]. Int J Mol Med, 2015, 36(6): 1601-1606. DOI:10.3892/ijmm.2015.2373 |
| [20] |
CHO I H, JANG E H, HONG D R, et al. Suppression of LPS-induced epithelial-mesenchymal transition by aqueous extracts of Prunella vulgaris through inhibition of the NF-κB/Snail signaling pathway and regulation of EMT-related protein expression[J]. Oncol Rep, 2015, 34(5): 2445-2450. DOI:10.3892/or.2015.4218 |
| [21] |
WU C N, ZHUANG Y W, JIANG S, et al. Interaction between Wnt/β-catenin pathway and microRNAs regulates epithelial-mesenchymal transition in gastric cancer (Review)[J]. Int J Oncol, 2016, 48(6): 2236-2246. DOI:10.3892/ijo.2016.3480 |
| [22] |
HE Y J, LIU Z X, QIAO C, et al. Expression and significance of Wnt signaling components and their target genes in breast carcinoma[J]. Mol Med Rep, 2014, 9(1): 137-143. |
| [23] |
BAYERLOVÁ M, KLEMM F, KRAMER F, et al. Newly constructed network models of different WNT signaling cascades applied to breast cancer expression data[J]. PLoS One, 2015, 10(12): e0144014. DOI:10.1371/journal.pone.0144014 |
| [24] |
ZHANG L N, HUANG Y H, ZHAO L. Fusion of macrophages promotes breast cancer cell proliferation, migration and invasion through activating epithelial-mesenchymal transition and Wnt/β-catenin signaling pathway[J]. Arch Biochem Biophys, 2019, 676: 108137. DOI:10.1016/j.abb.2019.108137 |
| [25] |
CAI K, JIANG L W, WANG J, et al. Downregulation of β-catenin decreases the tumorigenicity, but promotes epithelial-mesenchymal transition in breast cancer cells[J]. J Cancer Res Ther, 2014, 10(4): 1063. DOI:10.4103/0973-1482.139378 |
| [26] |
许光伟, 曹旭晨. β-catenin下调对乳腺癌MDA-MB-231细胞上皮间质转化及侵袭迁移能力的影响[J]. 天津医药, 2015, 43(9): 981-984, 1093. |
| [27] |
DANA N, JAVANMARD S H, VASEGHI G. Effect of lipopolysaccharide on toll-like receptor-4 signals in mouse cancer cells[J]. Bratisl Lek Listy, 2017, 118(10): 598-601. |
 2020, Vol. 46
2020, Vol. 46


