扩展功能
文章信息
- 周亚宾, 华进, 戚伶俐, 代露, 庞晓丽
- ZHOU Yabin, HUA Jin, QI Lingli, DAI Lu, PANG Xiaoli
- 姜黄素预处理对急性缺血再灌注模型大鼠肝脏的保护作用
- Protective effect of curcumin pre-treatment on liver of acute ischemia-reperfusion model rats
- 吉林大学学报(医学版), 2020, 46(02): 297-301
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 297-301
- 10.13481/j.1671-587x.20200215
-
文章历史
- 收稿日期: 2019-07-02
2. 吉林大学第一医院小儿消化科, 吉林 长春 130021
2. Department of Paediatrics, First Hospital, Jilin University, Changchun 130021, China
肝脏缺血再灌注多见于肝脏严重创伤手术、肝脏肿瘤切除和肝脏移植术等临床情况[1]。肝脏缺血再灌注的损伤机制涉及自由基损伤、脂质过氧化、细胞内钙超载和细胞凋亡等多环节[2-3]。肝脏缺血再灌注可使肝代谢解毒功能降低,微循环阻力升高,严重者可导致肝功能衰竭,并直接影响到手术成功率和患者存活率。如何保护缺血的肝细胞、减少肝脏缺血再灌注的发生是亟待解决的重要课题。近年来研究[4-6]表明:姜黄素对重要器官(肠和脑)缺血再灌注有保护作用。然而研究主要集中在心肌、脑、肾和肠等器官,对肝脏的保护研究[7]较少。姜黄素是从姜科姜黄属姜黄根茎中提取的一种酚类色素[8],其具有潜在的抑制细胞凋亡、抗氧化和抗炎症的作用[9-11]。本实验通过建立姜黄素预处理的大鼠急性肝脏缺血再灌注模型,采用超高效液相色谱-质谱(ultra performance liquid chromatography-mass specteum, UPLC-MS)联用法、胆管导管术和荧光分析检测法检测大鼠血清中姜黄素水平、大鼠胆汁分泌量和大鼠肝脏组织中丙二醛(malondialdehyde, MDA)水平,探讨姜黄素对大鼠肝脏缺血再灌注保护作用的有效性及其作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器Sprague-Dawlley(SD)大鼠10只,体质量200~300g,雌雄不限,购自成都达硕生物技术有限公司,动物合格证号:SCXK(川)2015-030;室内饲养条件为22℃,相对湿度65%,光照周期12h:12h (L:D)。姜黄素(C1386)和羧甲基纤维素钠(CMC)(C9481)购于美国Sigma公司;MDA试剂盒(Cat#10010263)购于美国Cayman公司。动物麻醉呼吸机(AAS Iso Tec 5, 美国Datex-Ohmeda GE Healthcare公司),手术显微镜(西德Carl Zeiss公司),离心机(Eppendorf 5417R,美国Eppendorf公司),UPLC-MS(美国Waters公司),均质机(Precellys 24,法国Bertin Technologies公司),荧光分析仪(2030 Multilabel Reader, 美国PerkinElmer公司)
1.2 实验动物分组将SD大鼠随机分为实验组(4只大鼠,手术前90 min腹腔注射200 mg·kg-1姜黄素和1%CMC)、溶剂对照组(3只大鼠,手术前90 min腹腔注射1%CMC)和假手术组(3只大鼠, 术前不做处理)。
1.3 胆管导管术将大鼠接上动物麻醉呼吸机进行异氟烷(2%)麻醉后,将大鼠仰卧于手术台上并固定四肢,从腹部备皮,暴露腹中线。采用70%酒精消毒大鼠腹部后,沿腹中线至剑突做切口,暴露腹腔。将肝脏轻轻翻起,在手术显微镜下分离出胆总管,对大鼠实施胆管导管术,在胆总管靠近十二指肠处剪开小切口,插入聚乙烯导管[外直径(OD) 0.8 mm, 内直径(ID) 0.5 mm],向上直至肝总管,用细绳绑紧插入胆总管的聚乙烯导管,随后收集肝脏左外侧叶、左内侧叶和中叶分泌的胆汁。见图 1(插页三)。
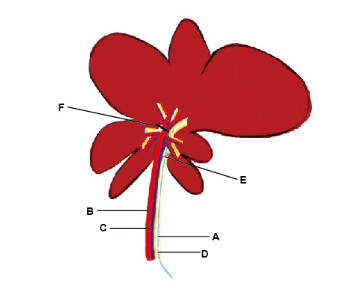
|
| A: Bile duct; B: Hepatic artery; C: Portal vein ; D: Cannula; E: Ligature; F: Microvascular clamp. 图 1 大鼠胆管导管术示意图 Fig. 1 Schematic diagram of bile duction cannulation of rat |
|
|
采用无损伤止血夹夹闭大鼠肝脏左叶和中叶的肝动脉和门静脉造成急性肝缺血(左叶和中叶,占肝总量的60%~70%)[12]。45 min后,释放结扎使肝脏再灌注60 min,随后心脏取血并摘取肝组织。
实验组:大鼠腹腔注射溶于1%CMC的姜黄素,在注射50 min后用已氟醚将动物麻醉,并在麻醉10 min后开始进行胆管导管术和大鼠尾部取血,在姜黄素注射后70 min时开始收集胆汁。胆汁收集时间为125 min,每隔5 min收集一管,先收集20 min胆汁作为基线,然后从20 min开始使用无损伤止血夹结扎血管造成缺血,45 min后释放结扎血管造成血液再灌注,再灌注进行60 min,然后停止胆汁收集,进行大鼠心脏取血并摘取肝脏。溶剂对照组:大鼠腹腔注射1%CMC,其余实验步骤与实验组相同。假手术组:大鼠不进行任何药物注射的情况下采用已氟醚麻醉,并在麻醉10 min后开始进行胆管导管术和大鼠尾部取血,在麻醉后20 min时开始收集胆汁。胆汁收集时间为125 min,在此期间只进行胆汁收集,不引发急性肝缺血和血液再灌注。在停止胆汁收集后进行大鼠心脏取血并摘取肝脏。根据每5min收集的胆汁计算胆汁流量,以μL·g-1·min-1为单位。以第1个20min的胆汁流量平均值为基线(作为100%),把每个时间点的胆汁流量表达为基线值的百分数作为最后的结果。
1.5 UPLC-MS法检测大鼠血清中姜黄素水平大鼠尾部静脉取血0.5mL, 心脏取血2mL。以3000 r·min-1、4℃离心10min,取血清。随后采用UPLC-MS法检测大鼠血清中姜黄素水平(mg·L-1)。
1.6 大鼠肝脏组织中MDA水平检测取大鼠肝脏组织,按照MDA试剂盒说明书方法检测大鼠肝组织中MDA水平,单位为μmol·g-1。
1.7 统计学分析采用SPSS20.0统计软件进行统计学分析。各组大鼠血清中姜黄素水平、胆汁分泌量和肝脏组织中MDA水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠腹腔注射姜黄素后吸收情况实验组大鼠姜黄素腹腔注射后,打开大鼠腹腔可见在腹膜内和胃肠道浆膜外有黄色的姜黄素,表明姜黄素成功注射入大鼠腹腔中,见图 2(插页三)。在腹腔中的姜黄素会被较快地吸收并进入大鼠血液。
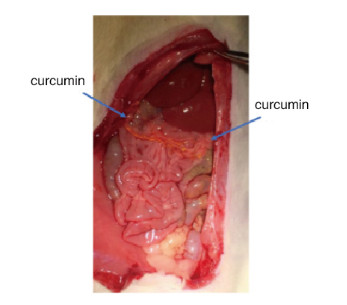
|
| 图 2 大鼠腹腔注射姜黄素结果影像图 Fig. 2 Image of result of intraperitoneal 1nject1on of curcumin in rat |
|
|
在大鼠腹腔注射200mg·kg-1姜黄素1和3h后,采用UPLC-MS法检测实验组大鼠血清姜黄素水平, 结果显示:注射后1h大鼠血清姜黄素水平为(0.17±0.05) mg·L-1, 但在注射3h后,血清姜黄素水平在检测线以下。
2.3 各组大鼠胆汁流量在导管接入胆管后,假手术组大鼠显示胆汁流量基本保持在基线值附近,无明显变化。实验组大鼠在结扎血管制造缺血后胆汁分泌量迅速降低至0,在结扎血管释放进行血液再灌注后,胆汁流量缓慢增加,在约60min后达到最高点,约为基线值40%。溶剂对照组大鼠胆汁流量在缺血再灌注后的前3个时间点恢复水平略低于实验组,但差异不明显,在其余时间点其变化趋势和流量水平与实验组基本一致,胆汁流量最高点达到基线值的40%。见图 3。
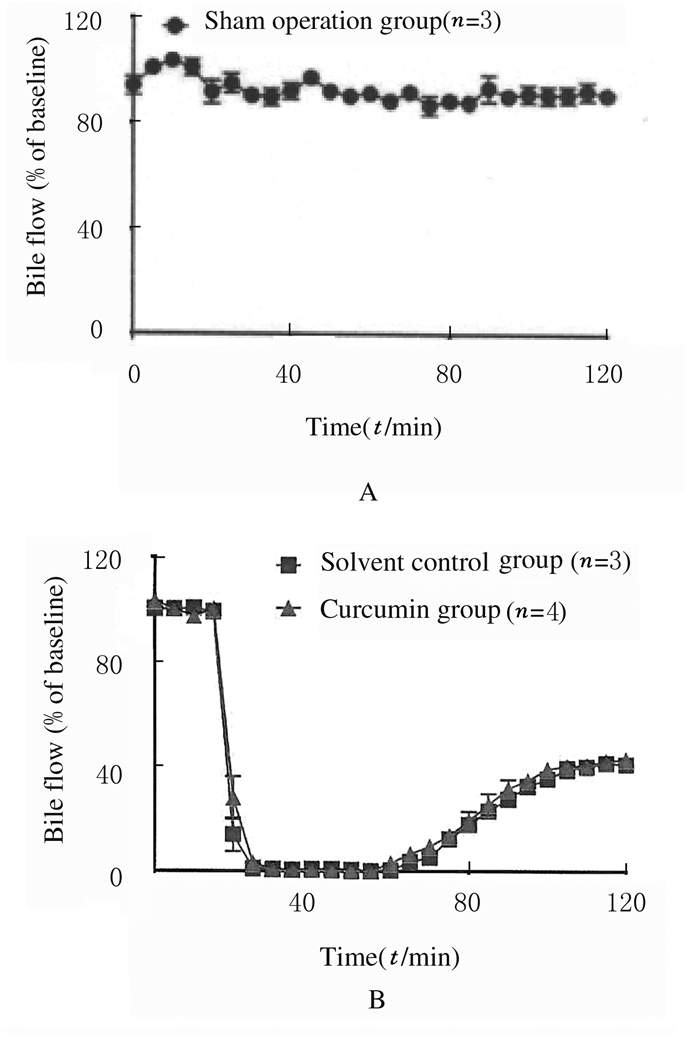
|
| A:Sham operation group; B:Solvent control group and Curcumin group. 图 3 各组大鼠肝脏缺血再灌注后胆汁流量 Fig. 3 Bile flows of rats in various groups after liver ischemia-reperfusion |
|
|
缺血再灌注后,假手术组大鼠肝脏中MDA水平为(162.73± 90.50)mmol·g-1;实验组大鼠肝脏组织中MDA水平最低,为(9.18±1.78)mmol·g-1;溶剂对照组大鼠肝脏中MDA水平最高,为(527.54±237.38)mmol·g-1,约为实验组的57倍、假手术组的3倍,但差异无统计学意义(P>0.05);假手术组大鼠肝脏中MDA水平约为实验组的18倍,但差异无统计学意义(P>0.05)。
3 讨论缺血再灌注损伤是肝脏移植手术中造成肝损伤的重要原因之一[13]。研究[14]显示:肝脏在缺血状况下会产生三磷酸腺苷(adenosine triphosphate,ATP)枯竭,产生大量活性氧(reactive oxygen species,ROS),且在再灌注后进一步恶化。姜黄素是姜黄的提取物,来源广,无毒。在过去五十余年的研究中证实姜黄素是姜黄中最主要的功能性物质,抗氧化是其重要的功能之一[15]。姜黄素作为一种有护肝作用的物质,其护肝机制被认为是其抗氧化、降低ROS和脂质过氧化、抗炎症和抗纤维化[16]。作为氧自由基与生物膜不饱和脂肪酸反应的代谢产物,MDA能反映体内脂质过氧化水平[17]。本研究结果显示:与溶剂对照组比较,实验组大鼠肝脏组织中MDA水平明显降低,溶剂对照组大鼠肝组织中MDA水平是实验组的57倍。这与姜黄素的抗氧化、降低ROS和脂质过氧化的功能相符。虽然使用Student T双尾检验值为0.09,大于0.05,在统计学意义上不具备显著差异性,这有可能由如下原因造成:一是两组样品均数的标准误差值都高,尤其是溶剂对照组;二是由于本研究使用的动物数量较少。本研究结果显示:假手术组大鼠肝脏组织中的MDA水平约为实验组的18倍,与本文作者的预期不符。本文作者预期实验组MDA水平应接近假手术组,这表明姜黄素在肝脏中能有效降低脂质的过氧化水平。
胆汁是由肝实质细胞分泌的。胆汁流能反应肝脏功能的状态,并被作为缺血再灌注引起的肝功能受损的指标。结扎血管造成肝脏缺血的情况下,胆汁分泌下降直到胆汁流量为0,取消血管结扎,造成血液再灌注,胆汁分泌恢复,理想状态下,肝脏未受到损伤,胆汁流量应该回升到缺血再灌注前的水平。但在实际中缺血再灌注会造成肝脏功能受损从而导致胆汁流量降低,因此在缺血再灌注后胆汁流量通常明显低于再灌注前。本研究中假手术组大鼠胆汁流量在整个125min收集时间段中保持在基线附近,表明在整个手术过程中肝脏功能未受到损伤,胆管导管术本身不会影响胆汁流量。实验组大鼠胆汁流量在缺血再灌注后恢复到基线的40%左右,但实验组与溶剂对照组在此阶段的胆汁流量无明显差异,实验组胆汁流量未如预期较对照组明显提高,这可能是在给药80min后即进行缺血再灌注(注射1h后进行手术,再经过20min的基线测量进入缺血再灌注),时间过短,姜黄素还未在肝脏充分发挥作用。一方面,作为肝功能的一项指标,胆汁流量取决于胆汁酸转运蛋白的活性、肝实质细胞内ATP含量、细胞内钙离子通道和其他相关的信号通路的作用。虽然在本实验时间内,姜黄素已通过其抗氧化性明显降低肝组织中MDA水平,但要使姜黄素通过对上述影响胆汁流量的因素中一至数个因素产生作用以提高胆汁流量,可能需要更长的时间。有探讨姜黄素作用的研究[18-19]采取每日给药并持续数周时间。另一方面,姜黄素具有生物利用率低和降解快的特点[20-22]。本研究结果显示:200mg·kg-1姜黄素腹腔给药后3h,未能在血清中检测到姜黄素。另有研究[23]认为姜黄素的某些代谢产物与其生物活性类似且更稳定和更容易吸收,其对肝脏的保护作用主要是来自其有活性的代谢产物。因此,在动物实验中如能增加姜黄素的吸收并增加其在血液中的浓度,或通过持续给药等其他方法,保持姜黄素或其有生物活性的代谢产物在血液中的浓度,可能会取得更好的保护肝脏的效果,并增加缺血再灌注后的胆汁流量。姜黄素不溶于水,但溶于碱性溶液和pH值低的溶液(如冰醋酸)[24],把姜黄素混合在1%的食品添加剂CMC中[25],再使用均质器进行均质,进而获得均匀的姜黄素悬浮液, 同时采用腹腔注射的方式,这样有利于姜黄素在大鼠体内的吸收[26]。本实验获得了姜黄素对缺血再灌注损伤肝脏保护的部分正面预期,为了取得更全面和确实的实验数据,可以在后续的实验中适当增加实验动物样本量。
综上所述,姜黄素预处理急性缺血再灌注的大鼠肝脏能有效抑制大鼠肝脏中MDA水平升高,对肝脏起到一定的保护作用。由于本实验中姜黄素预处理时间过短,并且未能持续给药以保持其在血液中的浓度,对恢复胆汁分泌效果不明显。
| [1] |
麻勇, 姜洪池. 肝脏缺血再灌注损伤的实验研究现状与展望[J]. 中华实验外科杂志, 2012, 29(10): 1880-1882. DOI:10.3760/cma.j.issn.1001-9030.2012.10.002 |
| [2] |
ABUAMARA W, YANG S Y, TAPURIA N, et al. Liver ischemia/reperfusion injury:Processes in inflammatory networks-a review[J]. Liver Transplant, 2010, 16(9): 1016-1032. DOI:10.1002/lt.22117 |
| [3] |
岳媛媛, 冯志杰. 肝脏缺血再灌注损伤与钙超载[J]. 世界华人消化杂志, 2008, 16(32): 3654-3658. DOI:10.3969/j.issn.1009-3079.2008.32.013 |
| [4] |
廖美娟, 梁桦, 梁幸甜, 等. 姜黄素抑制诱导型一氧化氮合酶活性减轻大鼠肠缺血再灌注损伤[J]. 实用医学杂志, 2015, 31(20): 3302-3303. DOI:10.3969/j.issn.1006-5725.2015.20.005 |
| [5] |
SHUKLA P K, KHANNA V K, ALI M M, et al. Anti-ischemic effect of curcumin in rat brains[J]. Neurochem Res, 2008, 33(6): 1036-1043. DOI:10.1007/s11064-007-9547-y |
| [6] |
刘莉, 谭波涛, 李昱, 等. 姜黄素对大鼠大脑皮质缺血再灌注损伤的保护作用及其机制研究[J]. 解放军医学杂志, 2013, 38(3): 190-194. |
| [7] |
李明芬. 姜黄素对缺血再灌注损伤器官的保护作用[J]. 海峡药学, 2016, 28(2): 139-141. DOI:10.3969/j.issn.1006-3765.2016.02.062 |
| [8] |
李彩新, 张永强, 王丹, 等. 姜黄素和东莨菪内酯对朱砂叶螨形态变化和水分损失的影响[J]. 西南大学学报(自然科学版), 2017, 39(11): 10-15. |
| [9] |
陈思砚, 潘静, 陈生弟. 姜黄素在神经系统疾病治疗中的应用[J]. 上海交通大学学报(医学版), 2010, 30(6): 732-734, 741. DOI:10.3969/j.issn.1674-8115.2010.06.030 |
| [10] |
臧卫周, 杨红旗, 徐军, 等. 姜黄素对缺氧复氧损伤PC12细胞的影响[J]. 郑州大学学报(医学版), 2009, 44(3): 594-596. DOI:10.3969/j.issn.1671-6825.2009.03.044 |
| [11] |
成扬, 平键, 徐列明, 等. 姜黄素上调PPAR抑制肝星状细胞活化标志表达的研究[J]. 中国实用内科杂志, 2006, 26(24): 1937-1940. DOI:10.3969/j.issn.1005-2194.2006.24.007 |
| [12] |
NIEUWENHUIJS V B, DE BRUIJN M T, SCHIESSER M, et al. Ischemic preconditioning and intermittent ischemia preserve bile flow in a rat model of ischemia/reperfusion injury[J]. Dig Dis Sci, 2007, 52(11): 3029-3037. DOI:10.1007/s10620-006-9501-x |
| [13] |
ZHAO Q H, HAN F, WU K, et al. Protective effects of apoptosis of kupffer cells induced by zoledronate liposomes following hepatic ischemia-reperfusion injury[J]. Ann Transplant, 2018, 23: 815-821. DOI:10.12659/AOT.909982 |
| [14] |
AKHTAR M Z, HENDERSON T, SUTHERLAND A, et al. Novel approaches to preventingischemia-reperfusion injury during liver transplantation[J]. Transplant Proc, 2013, 45(6): 2083-2092. DOI:10.1016/j.transproceed.2013.04.004 |
| [15] |
赵秀峰, 常超, 信栓力, 等. 姜黄素在大鼠心肌缺血再灌注中的作用研究[J]. 中西医结合心脑血管病杂志, 2010, 8(8): 956. DOI:10.3969/j.issn.1672-1349.2010.08.035 |
| [16] |
GHOSH N, GHOSH R, MANDAL V, et al. Recent advances in herbal medicine for treatment of liver diseases[J]. Pharm Biol, 2011, 49(9): 970-988. DOI:10.3109/13880209.2011.558515 |
| [17] |
USTUN Y B, KOKSAL E, KAYA C, et al. The effects of dexketoprofen on endogenous leptin and lipid peroxidation during liver ischemia reperfusion injury[J]. Int Surg, 2014, 99(6): 757-763. DOI:10.9738/INTSURG-D-14-00121.1 |
| [18] |
冯敬媛, 李舒承, 王虹, 等. 姜黄素对慢性心力衰竭大鼠肾素-血管紧张素-醛固酮系统和心功能的改善作用[J]. 吉林大学学报(医学版), 2019, 45(2): 325-330. |
| [19] |
许东亮, 彭朝晖, 熊美才. 姜黄素对骨质疏松大鼠种植体骨结合的促进作用[J]. 吉林大学学报(医学版), 2019, 45(4): 877-881, 987. |
| [20] |
RAVINDRANATH V, CHANDRASEKHARA N. In vitro studies on the intestinal absorption of curcumin in rats[J]. Toxicology, 1981, 20(2/3): 251-257. |
| [21] |
RAVINDRANATH V, CHANDRASEKHARA N. Metabolism of curcumin-studies with[3H]curcumin[J]. Toxicology, 1981, 22(4): 337-344. DOI:10.1016/0300-483X(81)90027-5 |
| [22] |
YANG K Y, LIN L C, TSENG T Y, et al. Oral bioavailability of curcumin in rat and the herbal analysis from Curcuma longa by LC-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 853(1/2): 183-189. |
| [23] |
XU X Y, MENG X, LI S, et al. Bioactivity, health benefits, and related molecular mechanisms of curcumin:current progress, challenges, and perspectives[J]. Nutrients, 2018, 10(10): E1553. DOI:10.3390/nu10101553 |
| [24] |
RAO E V, SUDHEER P. Revisiting curcumin chemistry part Ⅰ:A new strategy for the synthesis of curcuminoids[J]. Indian J Pharm Sci, 2011, 73(3): 262-270. |
| [25] |
王鲁慧, 徐同成, 刘丽娜, 等. 羧甲基纤维素钠对番茄红素复凝聚微胶囊性能的影响[J]. 食品科学, 2018, 39(1): 105-110. |
| [26] |
JOSHI R P, NEGI G, KUMAR A, et al. SNEDDS curcumin formulation leads to enhanced protection from pain and functional deficits associated with diabetic neuropathy:an insight into its mechanism for neuroprotection[J]. Nanomed-Nanotechnol Biol Med, 2013, 9(6): 776-785. DOI:10.1016/j.nano.2013.01.001 |
 2020, Vol. 46
2020, Vol. 46


