扩展功能
文章信息
- 聂蔓, 岳军
- NIE Man, YUE Jun
- TP53 G199X和V157fs点突变对卵巢癌A2780细胞功能的影响
- Effects of TP53 G199X and V157fs on function of ovarian cancer A2780 cells
- 吉林大学学报(医学版), 2020, 46(02): 292-296
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 292-296
- 10.13481/j.1671-587x.20200214
-
文章历史
- 收稿日期: 2019-06-20
卵巢癌(ovarian cancer, OC)是女性常见的五大癌症之一,并且是导致女性死亡的第一位生殖系统癌症[2]。20%~25%卵巢癌的发生发展与遗传因素有关[3]。癌症基因组研究计划[4]研究显示:在96%的卵巢癌肿瘤组织中存在TP53基因突变。TP53是人类的一个重要的抑癌基因,其失活在肿瘤的形成和发展过程中起着重要的作用[5]。当TP53基因发生突变后,所对应蛋白质空间结构发生变化,细胞的生长、凋亡和DNA修复的调节功能部分或完全丧失。TP53基因由此从一个抑癌基因转变成一个致癌基因[6]。研究[7]显示:TP53基因的R273H、R248Q、R175H和R248W点突变为热点突变,在膀胱癌、肺癌、肝癌、乳腺癌、喉癌和皮肤癌等多种癌症中是突变频率最高的4个点突变。根据本文作者前期的全外显子测序和Sanger测序结果,本研究在TP53基因中筛选出了6个点突变,其中4个点突变为热点突变,还有2个为新发现的点突变,即G199X和V157fs。G199X是终止突变,V157fs是移码突变。本研究通过细胞实验对致病候选基因TP53进行功能实验,探讨TP53G199X和V157fs点突变对卵巢癌A2780细胞蛋白表达、增殖、迁移和侵袭的影响。
1 材料与方法 1.1 细胞、主要试剂和仪器人卵巢癌细胞株A2780购自苏州北纳创联生物技术有限公司。野生型TP53质粒和空载体购自长沙优宝生物科技有限公司,Q5点突变试剂盒购自美国NEB公司,培养基购自美国HyClone公司,胎牛血清购自乌拉圭Cell-Box公司,青链霉素混合液购自美国Gibco公司,Lipofectamine3000购自美国Invitrogen公司,小鼠抗P53单抗购自美国Cell Signaling Technology公司,兔抗GAPDH单抗和HRP标记的山羊抗小鼠IgG购自北京全式金生物技术有限公司,CCK-8试剂购自美国Boster公司,基质胶购自美国Corning公司。Fusion FX7光谱仪购自法国Vilber公司,Model 680酶标仪购自美国Bio-Rad公司,Olympus IX71倒置显微镜购自日本Olympus公司。
1.2 质粒的构建2个突变型TP53质粒G199X和V157fs使用Q5点突变试剂盒在实验室进行合成并进行测序验证。突变引物:G199X正向引物5′-CGAGTGGAAtGAAATTTGCG-3′, 反向引物5′-ATAAGATGCTGAGGAGGG-3′;V157fs正向引物5′- TCCGCGCCATGGCCATCTACAAGCAG- TCAC-3′,反向引物5′-ACGCGGGTGCCGGGCG- GG-3′。
1.3 细胞培养和转染使用常规手段维持细胞生长:湿润环境,37℃恒温,5%CO2。完全培养基由90%DMEM培养基、10%胎牛血清及1%青链霉素混合液组成。当细胞生长至80%的密度时,根据操作说明使用Lipofectamine3000将野生型、2个突变型和空载体质粒转染进细胞中。
1.4 Western blotting法检测各组细胞中P53蛋白表达细胞经转染相关的质粒后放入细胞培养箱中48h。使用细胞裂解缓冲液(1×磷酸盐缓冲液+1%蛋白酶抑制剂混合物)提取细胞总蛋白。使用15%的超声强度促进细胞的进一步裂解,蛋白溶液使用二喹啉甲酸试剂测定总蛋白浓度。然后以1:3的比例加入上样缓冲液,用金属浴95℃加热10min。冷却后加样到10% SDS-PAGE凝胶电泳直至目标条带清晰分离。然后使用半干法转膜至硝酸纤维素膜(nitrocellulose filter membrane,NC)上。脱脂牛奶封闭膜30min后,加入一抗P53,在4℃条件下反应过夜。第2天使用TBST缓冲液清洗NC膜3次,每次5min。再加入二抗溶液室温孵育1~2h。之后用TBST缓冲液清洗3次,每次5min。曝光液A和曝光液B以体积比1:1配置,混匀后均匀滴加于NC膜上。使用Fusion FX7光谱仪暗室曝光后显影并采集蛋白条带图像。实验重复3次以上。
1.5 细胞增殖实验检测各组细胞增殖活性细胞经转染相关质粒后放入细胞培养箱中48h。细胞经消化、离心、重悬后用细胞计数板计数,将调整好数目的细胞悬液100μL接种于96孔培养板中,每组4孔。将96孔培养板放入细胞培养箱中4h使其贴壁,然后每个孔加入10 μLCCK-8溶液,放入细胞培养箱中孵育1h,采用Model 680酶标仪在450nm波长处测量溶液0、12、24、36和48h时的吸光度(A)值。实验重复3次以上。以A值表示细胞增殖活性。
1.6 细胞迁移实验检测各组细胞划痕愈合率用Marker笔在6孔板背后均匀地划横线,每孔3条。将细胞接种于6孔板中,当细胞生长至80%的密度时,转染相应质粒并放进细胞培养箱中孵育48h。然后使用10μL的移液枪枪头按照直尺垂至于背后的横线划线,每孔3条,采用PBS缓冲液洗细胞2次,加入无血清培养基以防止细胞的进一步增殖,使用Olympus IX71倒置显微镜于0、12、24和48h时观察并拍照。实验重复3次以上。使用Image J软件测定划痕愈合率。划痕愈合率=(当前时间点空白面积-上一时间点空白面积)/上一时间点空白面积×100%。
1.7 细胞侵袭实验检测各组侵袭细胞数用无血清培养基以1:8的比例稀释基质胶,然后将混合液铺满Transwell小室上室的底部,放入细胞培养箱4h使其凝固。细胞经转染相关质粒后放入细胞培养箱中48h。细胞经消化、离心,用无血清培养基重悬后用细胞计数板计数,将调整好数目的细胞悬液100μL接种于小室上室。小室下室加入600mL含20%血清的培养基,然后将培养皿放入细胞培养箱中孵育48h。取出Transwell小室,用棉棒擦去上室中的培养基和基质胶,采用PBS缓冲液冲洗1次,用甲醇固定细胞30min。将小室适当风干后,用0.1%结晶紫染色20 min,再用PBS缓冲液冲洗1次。使用Olympus IX71倒置显微镜随机寻找10个视野观察细胞并拍照,使用Image J软件进行细胞计数。实验重复3次以上。
1.8 统计学分析采用GraphPad Prism 6软件进行统计学分析。各组细胞增殖活性、细胞划痕愈合率和侵袭细胞数均呈正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组A2780细胞中P53蛋白表达情况转染野生型TP53基因的A2780细胞中P53蛋白有表达,而转染2个突变型和空载体质粒的细胞中无P53蛋白的表达。见图 1。

|
| Lane 1: Wild-type group; Lane 2: G199X group; Lane 3: V157fs group; Lane 4: Empty vector group. 图 1 各组A2780细胞中P53蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of P53 protein in A2780 cells in various groups |
|
|
A2780细胞转染后的12、24、36和48 h时2个突变型组和空载体组A2780细胞增殖活性明显高于同一时间点野生型组(P < 0.01)。见表 1。
| (n=4, x±s) | |||||||||||||||||||||||||||||
| Group | Proliferation activityof A2780 cells | ||||||||||||||||||||||||||||
| (t/h) | 12 | 24 | 36 | 48 | |||||||||||||||||||||||||
| Wild-type | 0.482±0.033 | 0.764±0.057 | 0.973±0.071 | 1.144±0.081 | |||||||||||||||||||||||||
| G199X | 0.815±0.091* | 1.355±0.020* | 1.772±0.021* | 2.084±0.028* | |||||||||||||||||||||||||
| V157fs | 0.701±0.029* | 1.207±0.012* | 1.584±0.003* | 1.865±0.012* | |||||||||||||||||||||||||
| Empty vector | 0.723±0.045* | 1.197±0.029* | 1.510±0.039* | 1.761±0.030* | |||||||||||||||||||||||||
| *P < 0.01 compared with wild-type group. | |||||||||||||||||||||||||||||
与野生型组(14.730%±1.937%)比较,G199X组(34.850%± 1.703%)和V157fs组A2780细胞划痕愈合率(20.590%±0.534%)明显升高(P < 0.05或P < 0.01),但空载体组划痕愈合率(13.610%±1.122%)差异无统计学意义(P>0.05)。见图 2。

|
| 图 2 不同时间点各组A2780细胞迁移情况 Fig. 2 Migration of A2780 cells in various groups at different time points |
|
|
与野生型组(32.700±2.161)比较,G199X组(130.200±4.114)、V157fs组(104.200±2.969)和空载体组侵袭细胞数(84.700±5.416)均明显升高(P < 0.01)。见图 3(插页三)。
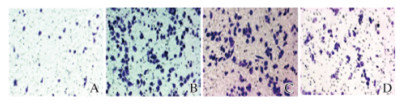
|
| A: Wild-type group; B: G199X group; C: V157fs group; D: Empty-vector group. 图 3 各组A2780细胞的侵袭情况(结晶紫,×200) Fig. 3 3 Migration of A2780 cells in various groups (Crystal violet, ×200)(seen on page 295 in paragraph) |
|
|
TP53基因在预防肿瘤发展过程中起着至关重要的作用。野生型TP53基因可能会因在致癌或遗传毒性条件下通过诱导细胞周期凋亡或停滞过程而被激活以抑制肿瘤细胞的生长[8]。超过50%的肿瘤组织中会有TP53的体细胞突变[9],突变体TP53不仅失去了肿瘤抑制功能,还获得了促进肿瘤发生的新转化能力[10]。有研究[11]显示:核磷酸肌醇信号对p53的稳定性起着重要的调控作用。而另一研究[12]显示一些微小RNA与原发性胶质母细胞瘤患者中TP53表达水平呈负相关关系。研究[13]显示:R273和G245是IARC数据库中最常见的2个突变点。现已经证明这2种突变消除了野生型TP53基因的功能,包括TP53介导的细胞周期停滞和细胞凋亡,以及通过调节一些下游基因促进肿瘤发生。错义突变可能将TP53基因从肿瘤抑制基因转化为致癌基因,因此了解突变TP53基因功能活性的获得具有重要的科学和临床意义[14]。
研究[15]显示:突变会产生特殊的转录调节变化,突变P53蛋白通常在肿瘤中以极高水平积累,这部分是由于鼠双微基因2(murine double minute, MDM2)反式激活的破坏,MDM2作为负反馈环,在无DNA损伤信号的情况下下调P53蛋白水平并维持野生型P53在正常组织中处于低水平的状态。KANG等[16]集中于2个高频突变(TP53 G245C和R273H)研究其在ESCC细胞系、p53缺陷细胞系H1299和HCT116 p53-/-中的致癌作用,结果表明突变体TP53G245C和R273H可导致更具攻击性的表型并增强癌细胞恶性度。DONG等[17]通过转染子宫内膜癌细胞HHUA产生了稳定共表达野生型TP53、R273H显性阴性突变体TP53和R213Q隐性突变体TP53,然后进行体外实验,结果表明R273H突变体可通过增加HHUA细胞的侵袭和迁移来促进肿瘤转移。CHEN等[18]研究发现P53的Ser392磷酸化会使年轻个体的肿瘤生长速度加快。这些研究均表明发生了突变的TP53基因会增强肿瘤细胞的恶性程度,提示TP53基因突变与癌症的发生发展有着密切的关系。
综上所述,本文作者通过全外显子测序结合Sanger测序结果在临床卵巢癌患者的样本中发现了2个点突变,并研究了其在卵巢癌A2780细胞中的致癌作用。TP53G199X和V157fs 2个点突变会终止P53蛋白在A2780细胞中的表达并促进卵巢癌A2780细胞的增殖、迁移和侵袭功能。本研究进一步揭示了TP53基因在癌症发生中的作用,并可能有助于由于TP53基因突变引起癌症的临床诊断和治疗。本研究还表明了2个突变的不同生物学特性,G199X突变的细胞较V157fs细胞更具恶性,但其在体内实验中是否能够发挥同样作用还需要进一步的实验明确, 且本研究测序样本量较少,还需扩大样本量进行进一步的验证实验。
| [1] |
BEAUFORT CM, HELMIJR J C, PISKORZ A M, et al. Ovarian Cancer Cell Line Panel (OCCP):Clinical importance of in vitro morphological subtypes[J]. PLoS One, 2014, 9(9): e103988. DOI:10.1371/journal.pone.0103988 |
| [2] |
CANNISTRA S. Cancer of the ovary[J]. N Engl J Med, 2004, 351(24): 2519-2529. DOI:10.1056/NEJMra041842 |
| [3] |
MEANEY-DELMAN D, BELLCROSS C A. Hereditary breast/ovarian cancer syndrome:A primer for obstetricians/gynecologists[J]. Obstet Gynecol Clinics North Am, 2013, 40(3): 475. DOI:10.1016/j.ogc.2013.05.009 |
| [4] |
CANCER GENOME ATLAS RESEARCH NETWORK. Integrated genomic analyses of ovarian carcinoma[J]. Nature, 2011, 474(7353): 609-615. DOI:10.1038/nature10166 |
| [5] |
YU X, RILEY T, LEVINE A J. The regulation of the endosomal compartment by p53 the tumor suppressor gene[J]. FEBS J, 2009, 276(8): 2201-2212. DOI:10.1111/j.1742-4658.2009.06949.x |
| [6] |
HOLLSTEIN M C, SIDRANSKY D, VOGELSTEIN B, et al. P53 mutations in human cancers[J]. Science, 1991, 253(5015): 49-53. DOI:10.1126/science.1905840 |
| [7] |
BROSH R, ROTTER V. When mutants gain new powers:news from the mutant p53 field[J]. Nat Rev Cancer, 2009, 9(10): 701-713. DOI:10.1038/nrc2693 |
| [8] |
VOUSDEN K H, PRIVES C. Blinded by the light:The growing complexity of p53[J]. Cell, 2009, 137(3): 413-431. |
| [9] |
MADDOCKS O, VOUSDEN K. Metabolic regulation by p53[J]. J Mol Med, 2011, 89(3): 237-245. |
| [10] |
WILLIS A, JUNG E J, WAKEFIELD T, et al. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes[J]. Oncogene, 2004, 23(13): 2330-2338. DOI:10.1038/sj.onc.1207396 |
| [11] |
CHOI S, CHEN M, CRYNS V L, et al. A nuclear phosphoinositide kinase complex regulates p53[J]. Nat Cell Biol, 2019, 21(4): 462-475. |
| [12] |
JESIONEK-KUPNICKA D, BRAUN M, TRABSKA-KLUCH B, et al. MiR-21, miR-34a, miR-125b, miR-181d and miR-648 levels inversely correlate with MGMT and TP53 expression in primary glioblastoma patients[J]. Arch Med Sci, 2019, 15(2): 504-512. DOI:10.5114/aoms.2017.69374 |
| [13] |
XU J, QIAN J, HU Y, et al. Heterogeneity of Li-Fraumeni syndrome links to unequal gain-of-function effects of p53 mutations[J]. Sci Rep, 2014, 4: 4223. |
| [14] |
DITTMER D P, PATI S, ZAMBETTI G P, et al. Gain of function mutations in P53[J]. Nat Genet, 1993, 4(1): 42-46. DOI:10.1038/ng0593-42 |
| [15] |
HAUPT Y, MAYA R, KAZAZ A, et al. Mdm2 promotes the rapid degradation of p53[J]. Nature, 1997, 387(6630): 296-299. DOI:10.1038/387296a0 |
| [16] |
KANG N, WANG Y, GUO S C, et al. Mutant TP53 G245C and R273H promote cellular malignancy in esophageal squamous cell carcinoma[J]. BMC Cell Biol, 2018, 19(11): 16. |
| [17] |
DONG P, TADA M, HAMADA J, et al. p53 dominant-negative mutant R273H promotes invasion and migration of human endometrial cancer HHUA cells[J]. Clin Exp Metastasis, 2007, 24(6): 471-483. DOI:10.1007/s10585-007-9084-8 |
| [18] |
CHEN H S, HUANG H, ZHAO J J, et al. Age-dependent copy number variations of TP53 tumour suppressor gene associated with altered phosphorylation status of p53 protein in sporadic schwannomas[J]. J Neurooncol, 2019, 143(3): 369-379. DOI:10.1007/s11060-019-03176-1 |
 2020, Vol. 46
2020, Vol. 46


