扩展功能
文章信息
- 王亚洲, 何鹏, 王丹虹
- WANG Yazhou, HE Peng, WANG Danhong
- 孟鲁司特钠通过抑制TLR4/NF-κB信号通路影响哮喘大鼠气道平滑肌细胞增殖和凋亡
- Effects of montelukast on proliferation and apoptosis of airway smooth muscle cells in asthmatic rats by inhibiting TLR4/NF-κB signaling pathway
- 吉林大学学报(医学版), 2020, 46(02): 274-279
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 274-279
- 10.13481/j.1671-587x.20200211
-
文章历史
- 收稿日期: 2019-06-03
2. 广西壮族自治区人民医院儿科, 广西 南宁 530021;
3. 中南大学湘雅医学院附属海口医院儿科, 海南 海口 570208
2. Department of Pediatrics, People's Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China;
3. Department of Pediatrics, Affiliated Haikou Hospital, Xiangya Medical College, Central South University, Haikou 570208, China
半胱氨酰白三烯是一种强效的炎症介质,可与分布在人体气道平滑肌细胞中的Ⅰ型半胱氨酰白三烯受体相结合,参与支气管收缩、嗜酸性粒细胞聚集、黏液分泌和血管通透性增加等气道反应,与哮喘的病理生理过程密切相关。孟鲁司特钠(montelukast,Mon)是一种白三烯受体拮抗剂,能特异性抑制气道中的半胱氨酰白三烯受体,在改善哮喘气道重塑及炎症方面具有良好的作用[1]。气道平滑肌细胞的恶性增殖是哮喘气道重塑的重要基础,在气道重塑时,气道平滑肌细胞受到如生长因子和炎性递质等外界信号刺激后,可引起气道增生肥大和收缩、释放细胞因子及产生蛋白酶等,加重气道重塑。Toll样受体4(Toll-like receptor-4,TLR4)是Toll样受体家族成员,而核因子κB(nuclear factor-κB, NF-κB)是位于Toll样受体家族下游的核转录因子,两者均在调控免疫反应、炎症反应和细胞增殖及凋亡过程中发挥重要作用[2-6]。然而,Mon影响气道平滑肌细胞增殖凋亡及炎症反应的分子机制是否与TLR4/NF-κB信号通路有关尚不明确。因此,本研究从TLR4/NF-κB信号通路角度出发,探讨Mon对气道平滑肌细胞增殖、凋亡及炎症因子分泌的影响,以期为Mon更好地治疗哮喘提供新的实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器8只SPF级雄性SD大鼠购于广西医科大学动物实验中心, 动物合格证号:SCXK(桂)2009-0002。Mon购于杭州默沙东公司。噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂、卵清蛋白和胰蛋白酶购于美国Sigma公司,胎牛血清购于杭州四季青公司,DMEM培养基购于美国Gibco公司,增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体和细胞周期蛋白D1(CyclinD1)抗体购于美国Promega公司,B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体、TLR4抗体和β肌动蛋白(β-actin)抗体购于美国Santa Cruz公司,NF-κB p65抗体和辣根过氧化酶标记的二抗购于美国Abcam公司,蛋白裂解液和细胞凋亡检测试剂盒购于上海碧云天公司,总RNA提取试剂盒购于美国Biomiga公司,逆转录试剂盒购[JP3]于日本TaKaRa公司,白细胞介素6(interleukin-6[JP], IL-6)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)法检测试剂盒购于美国ADL公司,转化生长因子β1(transforming growth factor-β1, TGF-β1) ELISA检测试剂盒购于美国R&D公司。聚合酶链反应(polymerase chain reaction, PCR)引物由生工生物工程(上海)股份有限公司合成。
1.2 哮喘大鼠模型的建立5只SD大鼠适应性培养7 d,在第1天腹腔注射含100 μg的1%卵清蛋白和200 mg氢氧化铝的致敏液1 mL,于第8天重复致敏1次;从第15天开始,将大鼠置于不完全密闭的容器内,以给予1%卵清蛋白激发液雾化吸入激发气道20 min,以每天1次的频率持续4周,建立哮喘大鼠模型。其中,对照组大鼠以生理盐水代替卵清蛋白进行致敏和激活处理。
1.3 细胞的纯化、传代和分组采用10%水合氯醛(40 mg·kg-1)麻醉2只SD大鼠,于无菌条件下分离气道平滑肌组织,以组织贴壁法分离培养气道平滑肌细胞,差速贴壁法纯化细胞。小鼠平滑肌α-actin免疫细胞化学染色鉴定为气道平滑肌细胞[7]。经纯化后的细胞接种至含DMEM培养基的培养瓶中,培养至细胞融合度约为80%时以胰蛋白酶消化传代。取第5代气道平滑肌细胞,以含10%胎牛血清的培养液在5%CO2、37℃的恒温培养箱中培养至细胞融合度达90%时,更换无血清培养基继续培养使细胞同步于G0期,培养24 h后,更换含血清培养液。将细胞随机分为对照组(加入含胎牛血清的培养液),模型组(加入含致敏大鼠血清的培养液[8])和治疗组(加入终浓度为1×10-6mol·L-1Mon和含致敏大鼠血清的培养液)。
1.4 MTT法检测气道平滑肌细胞增殖活性将气道平滑肌细胞以每孔200 μL(浓度为4×105 mL -1)的细胞悬液接种至96孔细胞培养板上,置于恒温培养箱内培养48 h后,加入20 μL的5 g·L-1MTT溶液孵育4 h,吸取培养基后加入150 μL二甲基亚枫,待紫色结晶充分溶解后,以酶联检测仪检测各组细胞的吸光度(A)值,以A值表示细胞的增殖活性。
1.5 流式细胞术检测气道平滑肌细胞凋亡率收集培养48 h后的对照组、模型组和治疗组细胞,调整细胞密度为1×106 mL-1。严格按照细胞凋亡检测试剂盒说明书操作,流式细胞仪检测各组细胞凋亡率,结果以早期凋亡率与晚期凋亡率之和表示。
1.6 ELISA法测定气道平滑肌细胞上清液中IL-6和TGF-β1水平收集培养48 h后的对照组、模型组和治疗组细胞上清液,1000 r·min-1离心5min后,参照ELISA检测试剂盒说明书检测气道平滑肌细胞上清液中IL-6和TGF-β1的水平。
1.7 Western blotting法检测气道平滑肌细胞中PCNA、CyclinD1、Bax、Bcl-2、TLR4和NF-κB p65蛋白表达水平以磷酸缓冲液洗涤收集各组细胞,加入蛋白裂解液提取细胞总蛋白,Bradford法对所提总蛋白进行定量。采用10% SDS-PAGE凝胶进行电泳分离,半干式电转移仪转至PVDF膜后,浸入封闭液中封闭。以特异性一抗(PCNA、CyclinD1、Bax、Bcl-2、TLR4和NF-κB p65抗体)和辣根过氧化物酶标记二抗进行孵育,经封闭液漂洗后,加显色剂显色,凝胶成像系统成像,以β-actin为内参,采用QuantityOne图像分析软件对目的蛋白灰度值进行分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白灰度值/β-actin灰度值。
1.8 [JP3]逆转录-聚合酶链反应(reverse transcription-[JP]polymerase chain reaction,RT-PCR)检测气道平滑肌细胞中TLR4和NF-κB p65 mRNA表达水平采用总RNA提取试剂盒提取对照组、模型组和治疗组细胞的总RNA,并以蛋白核酸仪进行浓度定量。以RNA为模板,参照逆转录试剂盒步骤合成cDNA。以20 μL反应体系进行PCR扩增,采用2-△△Ct法计算气道平滑肌细胞中TLR4和NF-κB p65 mRNA表达水平。反应条件:94℃、3 min(1×),94℃、30 s(30×),58℃、30 s[JP3](30×),72℃、1 min(30×), 72℃、5 min(1×)[JP]。内参β-actin引物F:[HQ]5′-TCAGGTCATCACTATCGGCAAT-3′, R:5′-AAAGAAAGGGTGTCGCA-3′;TLR4引物F:5′-CATCCAAAGGAATACTGCAACA- 3′,R:5′[JP]-GTTTC- TCACCCAGTCCTCATTC-3′;NF-κB p65引物F:5′-GATTCCTCGGGGTCCTAC-3′,R:5′-GCTGCTATGTGTAGAGGTGTCG-3′。[HQK]
1.9 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组细胞增殖活性、细胞凋亡率、细胞上清液中IL-6与TGF-β1水平、细胞中PCNA、CyclinD1、Bcl-2、Bax、TLR4、NF-κB p65蛋白表达水平和TLR4、NF-κB p65 mRNA表达水平均以x±s表示,两组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间多重比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组细胞增殖活性对照组、模型组和治疗组细胞的增殖活性分别为0.31±0.04、0.68±0.06和0.42±0.02,3组细胞增殖活性比较差异有统计学意义(F=58.018, P < 0.05)。与对照组比较,模型组和治疗组细胞增殖活性明显升高(P < 0.05);与模型组比较,治疗组细胞增殖活性明显降低(P < 0.05)。
2.2 各组细胞凋亡率流式细胞术检测结果显示:对照组细胞凋亡率为(9.58±0.46)%,模型组细胞凋亡率为(3.06±0.12)%,治疗组细胞凋亡率为(6.72±0.39)%,3组细胞凋亡率比较差异有统计学意义(F=254.241, P < 0.05)。与对照组比较,模型组和治疗组细胞凋亡率均明显降低(P < 0.05);与模型组比较,治疗组细胞凋亡率明显升高(P < 0.05)。见图 1。
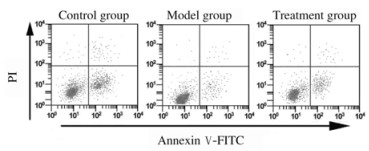
|
| 图 1 流式细胞术检测各组细胞凋亡率 Fig. 1 Apoptotic rates of cells in various groups detected by flow cytometry |
|
|
对照组、模型组和治疗组细胞上清液中炎症因子IL-6水平分别为(457.66±28.25)、(1785.54±85.96)和(982.65±56.89)ng·L-1,TGF-β1水平分别为(156.28±28.65)、(682.75±66.58)和(417.26±32.43)ng·L-1。各组细胞上清液中IL-6和TGF-β1水平分别整体比较差异均有统计学意义(F=352.363,P < 0.05;F=98.907, P < 0.05)。与对照组比较,模型组和治疗组细胞上清液中IL-6和TGF-β1水平均明显升高(P < 0.05);与模型组比较,治疗组细胞上清液中IL-6和TGF-β1水平明显降低(P < 0.05)。
2.4 各组平滑肌细胞中PCNA和CyclinD1蛋白表达水平对照组、模型组和治疗组细胞中PCNA蛋白表达水平分别为0.55±0.02、0.76±0.05和[JP3]0.65±0.03;CyclinD1蛋白表达水平分别为0.41[JP]±0.03、0.83±0.06和0.53±0.03。各组细胞中PCNA和CyclinD1蛋白表达水平分别整体比较差异均有统计学意义(F=26.132, P=0.01;F=78.000, P < 0.05)。与对照组比较,模型组和治疗组细胞中PCNA和CyclinD1蛋白表达水平均明显升高(P < 0.05);与模型组比较,治疗组细胞中PCNA和CyclinD1蛋白表达水平均明显降低(P < 0.05)。见图 2。

|
| Lane 1:Control group; Lane 2:Model group; Lane 3:Treatment group. 图 2 各组细胞中PCNA和CyclinD1蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of PCNA and CyclinD1 proteins in cells in various groups |
|
|
对照组、模型组和治疗组细胞中Bcl-2蛋白表达水平分别为0.31±0.02、0.68±0.03和0.54±0.03,Bax蛋白表达水平分别为0.61±0.03、0.37±0.02和0.45±0.03,各组细胞中Bcl-2和Bax蛋白表达水平分别整体比较差异有统计学意义(F=142.773,P < 0.05;F=61.091,P < 0.05)。与对照组比较,模型组和治疗组细胞中Bcl-2蛋白表达水平升高(P < 0.05),Bax蛋白表达水平降低(P < 0.05);与模型组比较,治疗组细胞中Bcl-2蛋白表达水平降低(P < 0.05),而Bax蛋白表达水平升高(P < 0.05)。见图 3。

|
| Lane 1:Control group; Lane 2:Model group; Lane 3:Treatment group. 图 3 各组细胞中Bax和Bcl-2蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of Bax and Bcl-2 proteins in cells in various groups |
|
|
对照组、模型组和治疗组细胞中TLR4蛋白表达水平分别为0.20±0.02、0.91±0.06和0.48±0.03,NF-κB p65蛋白表达水平分别为0.25±0.03、0.67±0.04和0.34±0.03,各组细胞中TLR4和NF-κB p65蛋白表达水平分别整体比较差异均有统计学意义(F=234.918, P < 0.05;F=129.441, P < 0.05)。与对照组比较,模型组和治疗组细胞中TLR4和NF-κB p65蛋白表达水平均明显升高(P < 0.05);与模型组比较,治疗组细胞中TLR4和NF-κB p65蛋白表达水平明显降低(P < 0.05)。见图 4。

|
| Lane 1:Control group; Lane 2:Model group; Lane 3:Treatment group. 图 4 各组细胞中TLR4和NF-κB p65蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of TLR4 and NF-κB p65 proteins in cells in various groups |
|
|
对照组、模型组和治疗组细胞中TLR4 [JP3]mRNA表达水平分别为1.00±0.08、5.22±0.15和[JP]3.35±0.23,NF-κB mRNA表达水平分别为1.00±0.05、4.16±0.26和2.63±0.12,各组细胞中TLR4和NF-κB p65 mRNA表达水平分别整体比较差异均有统计学意义(F=491.952, P < 0.05;F=265.978, P < 0.05)。与对照组比较,模型组和治疗组中TLR4和NF-κB p65 mRNA表达水平明显升高(P < 0.05);与模型组比较,治疗组细胞中TLR4和NF-κB p65 mRNA表达水平明显降低(P < 0.05)。
3 讨论作为半胱氨酰白三烯受体的Mon,商品名为顺尔宁,对哮喘具有较好的治疗作用[9-10]。研究[11-12]显示:Mon可通过降低炎症相关因子的表达,减轻炎症的发生,改善肺功能。Toll受体家族是一类与炎症反应密切相关的蛋白质分子,TLR4是该家族中的重要成员,可通过识别外源性或内源性配体,激活NF-κB参与机体内血管重塑、炎症、免疫反应和细胞增殖及凋亡等多种病理生理过程,与多种疾病的发生发展密切相关[13]。例如在实验性创伤性脑损伤神经元自噬和炎性损伤过程中,TLR4/NF-κB信号通路发挥着重要的促进作用[14];抑制TLR4/NF-κB信号通路的活化可减轻小胶质细胞的炎症反应,改善神经胶质细胞损伤[15];同时,抑制TLR4/NF-κB活化还可降低脂多糖对鼻咽癌5-8F细胞增殖和凋亡的作用[16]。另外,Mon还可通过改善气道重塑,改善肺功能[17]。气道平滑肌细胞的恶性增殖是哮喘气道重塑的重要基础,探讨Mon调控气道平滑肌细胞增殖的分子机制对Mon更好地应用于临床哮喘治疗具有重要意义。
研究[7, 18-19]显示:Mon可抑制NF-κB活化改善小鼠的心肌损伤,TLR4可通过NF-κB参与哮喘大鼠气道平滑肌细胞的增殖和凋亡过程。然而,Mon影响气道平滑肌的细胞增殖、凋亡及炎症反应是否与TLR4/NF-κB信号通路有关尚不清楚。闫新星等[20]和魏蔚等[21]研究发现:TLR4可通过调控PCNA和CyclinD1的表达参与细胞的增殖过程;CHEN等[22]研究显示:TLR4能够调控炎性因子IL-6、TNF-α和IL-1水平以及凋亡相关蛋白Bax和Bcl-2的表达。NF-κB p65是NF-κB蛋白家族成员,可调控CyclinD1、Bax、Bcl-2、IL-6和TGF-β1等多种基因参与细胞的增殖、凋亡过程和炎症反应[23-27]。本研究结果表明:Mon能够明显抑制哮喘诱导的气道平滑肌细胞增殖。这一结果与王力宁等[19]发现的Mon可抑制哮喘气道平滑肌细胞增殖、减缓气道重构的结果相吻合。同时,Mon能够抑制哮喘引起的PCNA和CyclinD1蛋白表达水平升高;可通过调控Bax和Bcl-2的表达减轻哮喘对气道平滑肌细胞凋亡的抑制作用;还可降低气道平滑肌细胞上清液中IL-6和TGF-β1水平。另外,Mon可从转录和翻译水平抑制TLR4和NF-κB p65表达。本研究结果显示:Mon影响气道平滑肌细胞增殖和凋亡、改善气道重塑、减轻炎症反应的分子机制可能与抑制TLR4/NF-κB信号通路有关。
综上所述,Mon可抑制哮喘大鼠气道平滑肌细胞增殖促进细胞凋亡,减轻哮喘气道炎症反应,其作用机制可能与抑制TLR4/NF-κB信号通路有关。
| [1] |
HOSHINO M, OHTAWA J, AKITSU K, et al. Effect of the addition of montelukast on airway inflammation and remodeling in symptomatic asthma[J]. Respirology, 2017, 50(61): PA4680. |
| [2] |
李莲梅, 余博文, 毕建朋, 等. TLR4对肺炎链球菌诱导的A549细胞凋亡的影响[J]. 郑州大学学报(医学版), 2019, 54(1): 73-77. |
| [3] |
DAI J P, WANG Q W, SU Y, et al. Oxymatrine inhibits influenza a virus replication and inflammation via TLR4, p38 MAPK and NF-κB Pathways[J]. Int J Mol Sci, 2018, 19(4): E965. |
| [4] |
鲍晓, 何成松. 沉默TLR4对类风湿关节炎滑膜成纤维细胞增殖和侵袭的影响[J]. 郑州大学学报(医学版), 2019, 54(2): 44-47. |
| [5] |
CHEN G, SUN W, YAN L, et al. Maternal diabetes modulates offspring cell proliferation and apoptosis during odontogenesis via the TLR4/NF-κB signalling pathway[J]. Cell Prolif, 2017, 50(3): e12324. DOI:10.1111/cpr.12324 |
| [6] |
鲍璐璐, 崔立红. IBS-D大鼠结肠TLR4、NF-κB的表达变化及机制[J]. 解放军医学杂志, 2019, 44(8): 648-651. |
| [7] |
韦江红, 莫碧文, 黄剑伟. TLR4/NF-κB对哮喘大鼠气道平滑肌细胞增殖、凋亡的影响[J]. 中国现代医学杂志, 2011, 21(25): 3110-3115. |
| [8] |
余建玮, 薛汉荣, 付向春. 小青龙汤干预哮喘大鼠气道平滑肌细胞增殖作用的研究[J]. 四川中医, 2011, 29(10): 23-25. |
| [9] |
YE K. Observation on clinical effects of tuina plus montelukast sodium tablets for children with cough variant asthma[J]. J Acupunct Tuina Sci, 2017, 15(5): 349-353. |
| [10] |
WEI Y, LI D, LIU J, et al. Therapeutic effect and safety of montelukast sodium combined with budesonide in children with cough variant asthma:a Meta analysis[J]. Chin J Contemp Pediatr, 2016, 18(11): 1100. |
| [11] |
吴玲玲. 布地奈德吸入联合孟鲁司特钠对小儿哮喘疗效及炎症因子的影响[J]. 中国妇幼保健, 2017, 32(1): 191-194. |
| [12] |
LIN B S. Effect of glucocorticoid inhalation combined with oral montelukast on airway function and serum inflammatory cytokines in patients with bronchial asthma[J]. J Hainan Med Univ, 2017, 23(3): 54-57. |
| [13] |
王兮, 母前途, 冯思嘉. 基于TLR4/MyD88/NF-κB通路探讨乌司他丁减轻脂多糖诱导的大鼠急性肺损伤的作用[J]. 河北医学, 2019, 25(8): 1299-1304. |
| [14] |
FENG Y, CUI Y, GAO J L, et al. Resveratrol attenuates neuronal autophagy and inflammatory injury by inhibiting the TLR4/NF-κB signaling pathway in experimental traumatic brain injury[J]. Int J Mol Med, 2016, 37(4): 921-930. |
| [15] |
HAN B, LU Y, ZHAO H, et al. Electroacupuncture modulated the inflammatory reaction in MCAO rats via inhibiting the TLR4/NF-κB signaling pathway in microglia[J]. Int J Clin Exp Pathol, 2015, 8(9): 11199-11205. |
| [16] |
LI Y, XIE G, LI L, et al. The effect of TLR4/MyD88/NF-κB signaling pathway on proliferation and apoptosis in human nasopharyngeal carcinoma 5-8F cells induced by LPS[J]. J Chin Otorhinolaryngol Head Neck Surg, 2015, 29(11): 1012-1015. |
| [17] |
LI L, LOU C Y, LI M, et al. Effect of montelukast sodium intervention on airway remodeling and percentage of Th17 cells/CD4+ CD25+ regulatory T cells in asthmatic mice[J]. Chin J Comtemp Pediatr, 2016, 18(11): 1174. |
| [18] |
周洁, 黄星原, 魏丽, 等. 孟鲁司特钠对柯萨奇B3病毒感染小鼠心肌的保护作用[J]. 现代生物医学进展, 2017, 17(12): 2209-2213. |
| [19] |
王力宁, 黄小琪, 李志峰, 等. 中医分期序贯治疗对哮喘气道平滑肌细胞增殖周期调控的影响[J]. 广西中医药, 2015, 38(4): 65-68. |
| [20] |
闫新星, 王晶, 张巍, 等. Toll样受体4在淋巴瘤细胞株中的表达及其对细胞增殖和耐药的影响[J]. 肿瘤防治研究, 2016, 43(6): 437-441. |
| [21] |
魏蔚, 刘玉华, 刘守燕. Toll样受体4特异性拮抗剂TAK-242对人卵巢癌细胞株SKOV-3增殖、凋亡的影响及其机制[J]. 山东医药, 2017, 57(19): 37-39. |
| [22] |
CHEN W, HU Y Q, JIANG L F, et al. Mechanism of action of Zhuyu Annao pill in mice with cerebral intrahemorrhage based on TLR4[J]. Asian Pac J Trop Med, 2016, 9(11): 1095-1100. |
| [23] |
LI S F, ZHOU Y, ZHENG X D, et al. Sphk1 promotes breast epithelial cell proliferation via NF-κB-p65-mediated cyclin D1 expression[J]. Oncotarget, 2016, 7(49): 80579-80585. DOI:10.18632/oncotarget.13013 |
| [24] |
LI L, WU W J, HUANG W J, et al. NF-κB RNAi decreases the Bax/Bcl-2 ratio and inhibits; TNF-α-induced apoptosis in human alveolar epithelial cells[J]. Inflamm Res, 2013, 62(4): 387-397. DOI:10.1007/s00011-013-0590-7 |
| [25] |
孙婷婷, 李京涛, 魏海梁, 等. TNFα/NF-κB信号通路调控非酒精性脂肪性肝病的研究现状[J]. 临床肝胆病杂志, 2019, 35(9): 2095-2098. |
| [26] |
SHI L, LI L I, YUANG W F, et al. Inhibition of NF-κB p65 expression by RNAi affects production of inflammatory mediators in LPS-activated mouse marcophages[J]. Chin J Pathophysiol, 2011, 27(7): 1264-1269. |
| [27] |
SHIMIZU H, BOLATI D, ADIJIANG A, et al. NF-κB plays an important role in indoxyl sulfate-induced cellular senescence, fibrotic gene expression, and inhibition of proliferation in proximal tubular cells[J]. Am J Physiol-Cell Physiol, 2011, 301(5): C1201-C1212. DOI:10.1152/ajpcell.00471.2010 |
 2020, Vol. 46
2020, Vol. 46


