扩展功能
文章信息
- 吴晓燕, 孙紫薇, 侯晓琳, 宿莹, 刘战, 孙金, 姜雨昕, 翁丽丽
- WU Xiaoyan, SUN Ziwei, HOU Xiaolin, SU Ying, LIU Zhan, SUN Jin, JIANG Yuxin, WENG Lili
- 龙胆生品及龙胆酒制品给药后龙胆苦苷在大鼠主要器官组织中的浓度分布
- Concentration distribution of gentiopicrin in main organs and tissues of rats after administration of gentian raw products and gentian wine products
- 吉林大学学报(医学版), 2020, 46(02): 254-259
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 254-259
- 10.13481/j.1671-587x.20200208
-
文章历史
- 收稿日期: 2019-04-28
龙胆为龙胆科植物条叶龙胆(Gentiana manshuric Kitag.)、龙胆(Gentiana scabra Bge.)、三花龙胆(Geniana triflora Pall.)或坚龙胆(Gentiana rigesceras Franch.)的干燥根及根茎[1]。龙胆为传统常用大宗药材,性味苦、寒;归肝、胆经;龙胆主要化学成分为环烯醚萜类化合物,如龙胆苦苷、獐牙菜苦苷、马钱苷酸和獐牙菜苷等[2-4],具有清火燥湿、泻肝胆火、清热健胃、改善脾胃消化功能、保护神经中枢系统、抗炎和抗氧化等作用,可用于肝胆类疾病及高血压等疾病的防治[5-7],疗效显著,也是常用中成药的原料药。目前对于中药龙胆的研究主要集中在其化学成分、临床应用和药理作用等方面,近年对龙胆中的化学成分及炮制后有机成分的含量变化有一些研究[8-10]报道,但对其炮制前后主要化学成分在动物主要器官组织中分布情况比较分析的研究少见报道。炮制是中药加工过程中常用的传统方法,适当的炮制方法具有改变或缓和药物性能,削弱或消除药物不良反应,增强药物疗效等作用[9]。龙胆的炮制品包括酒制、甘草汁制、胆汁制、蜜制和生姜汁制等,目前临床上广泛应用龙胆生品和龙胆酒制品[11-14]。龙胆酒制品在现代研究中多以增加有效成分提取率、提高生物利用度和制定相关质量控制标准为目的[15]。本实验采用液相色谱-质谱联用(high-performance liquid chromatography-mass spectrometry,HPLC-MS)法对龙胆生品及龙胆酒制品灌胃给药后其主要药效成分龙胆苦苷在大鼠主要器官组织中的分布进行测定,探讨其酒制前后龙胆苦苷在大鼠体内分布的规律。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器Wistar大鼠,雄性,体质量180~220 g,购自吉林省长春市亿斯实验动物技术有限责任公司,动物合格证号:SCXK(吉)2016-0003。甲酸为色谱级,乙腈为色谱级,均购自西陇科学股份有限公司;龙胆苦苷对照品(规格:20 mg,纯度97.6%,批号:110770-201716,中国食品检定研究院)。三重四级杆液相色谱质谱联用仪LC-MC-8040[岛津企业管理(中国)有限公司],AUW120D分析天平(西安精大检测设备有限公司),FA1004B电子天平(上海佑科仪器仪表有限公司),JA2603B电子天平(上海天美天平仪器有限公司),TDL80-2B台式离心机(上海安亭科学仪器厂)。
1.2 HPLC-MS法测定大鼠器官组织中龙胆苦苷 1.2.1 色谱条件液相色谱条件:采用Agilent ZORBAX Eclipse XDB-C18(4.6×250 mm,5-Micron)色谱柱,流动相:乙腈(A)-0.1%甲酸水(B);梯度洗脱(0~15.00 min,7%~40% A;15.00~15.01 min,40%~100% A;15.01~27.00 min,100% A;27.00~27.01 min,100%~7%A;27.01~30.00 min,7%A);体积流量:1 mL·min-1;柱温:35℃,进样量:10 μL。质谱条件:采用负离子多反应检测(MRM)模式下设定的离子对条件;电喷雾电离(ESI)Nebulizing Gas:3.0L·min-1;Drying Gas Flow:15.0L·min-1;DL Temperature:250℃;Heat Block Temp:400℃;CID Gas:230kPa;MRM(-)龙胆苦苷m/z:401→59。
1.2.2 对照品溶液配制取龙胆苦苷对照品适量,精密称定,加甲醇制成每1mL含0.2mg的对照品溶液。
1.2.3 水提液制备样品加水煎煮2次,每次1 h,过滤,合并2次滤液,浓缩至含生药量0.1g·mL-1的药液,4℃保存备用。
1.2.4 给药和组织样品制备将雄性SD大鼠随机分为龙胆生品组和龙胆酒制品组,实验前12h禁食不禁水,按0.63 g·kg-1体质量灌胃给药,给药后分别于15、30、60、120、240和360min处死大鼠(每时间点10只大鼠,每组各5只),迅速取出心、肝、脾、肺、肾和脑,用生理盐水冲洗表面,吸干水分,称质量,加入2倍量冰生理盐水,用组织匀浆器匀浆,即得组织匀浆液,-80℃保存,备用。
1.2.5 组织样品处理精密吸取大鼠组织匀浆液1.5 mL,置于10 mL离心管中,加入等体积甲醇,涡旋5min,于2000r·min-1离心30 min,取出上清液备用,沉淀部分再次加入3 mL甲醇,涡旋5 min,于2 000 r·min-1离心30 min,合并2次滤液,于40℃水浴蒸干,残留物用甲醇溶解,定容至1 mL,0.22 μm滤膜滤过,HPLC-MS法测定,进样量10 μL,记录色谱图和龙胆苦苷峰面积。
1.3 HPLC-MS方法学考察 1.3.1 专属性分别吸取空白组织和灌胃给药后15min时的肝组织样品,在上述色谱和质谱条件下测定,考察方法的专属性。
1.3.2 标准曲线和线性范围取空白组织匀浆1mL,加入龙胆苦苷混合溶液,分别配制成浓度为50、150、2500、5000、10000和20000μg·L-1的溶液,按“1.2.5”方法操作,进行分析测定,以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,计算回归方程,以线性范围最低浓度定为定量限。
1.3.3 精密度精密度实验中,精密吸取1 mL空白肝脏组织匀浆,配制低、中和高3个浓度样品(50、500和12500μg·L-1龙胆苦苷)的含药组织样品,按“1.2.5”操作,进行分析测定,每日内3组浓度各测6次,计算日内精密度;3组浓度各6份,连续测定3d,计算日间精密度。
1.3.4 提取回收率精密吸取1 mL空白肝脏组织匀浆,配制低、中和高3个浓度的3组质量控制样品(50、500和12500μg·L-1龙胆苦苷),每个浓度进行6样本分析,按“1.2.5”操作,计算每组平均回收率。
1.3.5 稳定性吸取1mL空白肝脏组织匀浆,精密加入龙胆苦苷对照品溶液,配制低、中和高3个浓度的3组质量控制样品(50、500和12500μg·L-1龙胆苦苷),每个浓度平行处理5份,室温下放置24 h、3次冻融循环和-80℃存放30d后,按“1.2.5”操作,进行分析测定,考察室温、-80℃和反复冻融条件对组织样品的影响。
1.4 龙胆生品及酒制品中龙胆苦苷在大鼠主要器官组织中质量浓度检测将灌胃后15、30、60、120、240和360min分离的各种组织制成匀浆,按“1.2.5”方法处理,测定大鼠组织样品中质量浓度,以外标法计算不同时间点大鼠主要器官组织中龙胆苦苷的质量浓度。
1.5 统计学分析采用SPSS 22.0统计软件进行统计学分析。各组龙胆炮制前后龙胆苦苷于各时间点在大鼠主要器官组织中质量浓度以x±s表示,两组间样本均数比较采用两独立样本t检验。以P < 0.05为差异有统计学意义。
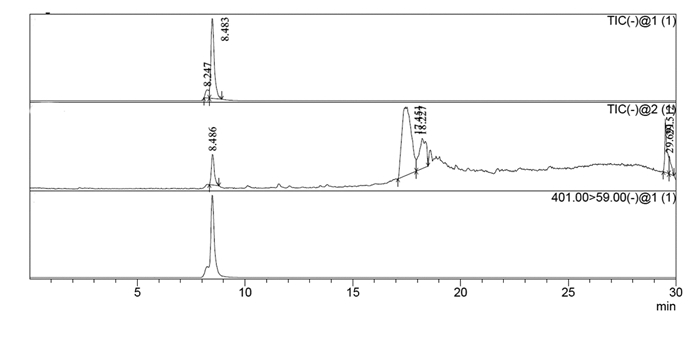
2 结果 2.1 HPLC-MS法的专属性专属性考察结果显示:大鼠组织中内源性物质及其他成分均不干扰龙胆苦苷的测定。组织样品以肝组织为例。见图 1~3。
|
| 图 1 龙胆苦苷色谱图 Fig. 1 Chromatogram of gentiopicrin |
|
|

|
| 图 2 灌胃给药15 min后肝组织样品色谱图 Fig. 2 Chromatogram of liver tissue sample after intragastric administration for 15 min |
|
|

|
| 图 3 空白肝组织样品色谱图 Fig. 3 Chromatogram of blank liver tissuesample |
|
|
龙胆苦苷在50~20 000 μg·L-1范围内呈良好线性关系,相关系数(r)均大于0.99。见表 1。
| Sample | Regression equation | Linear range[ρB/(μg·L-1)] | r | Quantitative limit |
| Heart | y= 66.83x-2 393.30 | 50-20 000 | 0.998 8 | 50 |
| Liver | y= 67.80x-6 887.80 | 50-20 000 | 0.998 6 | 50 |
| Spleen | y= 66.16x+19 105.00 | 50-20 000 | 0.996 9 | 50 |
| Lung | y= 68.10x-7 223.00 | 50-20 000 | 0.998 7 | 50 |
| Kidney | y= 70.67x+28 467.00 | 50-20 000 | 0.998 3 | 50 |
| Brain | y=77.41x-19 257.00 | 50-20 000 | 0.997 9 | 50 |
测得日内精密度的RSD分别为2.7%、2.9%和3.2%,日间精密度的RSD分别为9.4%、10.7%和10.6%。结果表明:该方法精密度良好,符合生物样品分析精密度要求。
2.4 HPLC-MS法的提取回收率各组平均回收率分别为87.2%、77.4%和80.1%,RSD分别为9.4%、10.7%和10.6%。结果表明:该方法提取回收率符合生物样本分析的质量控制要求。
2.5 HPLC-MS法的稳定性3个浓度质量控制样品测得的平均RSD值分别为7.93%、8.61%和8.06%,均小于10.00%。结果表明:龙胆苦苷在室温、-80℃和反复冻融3个条件下较为稳定。
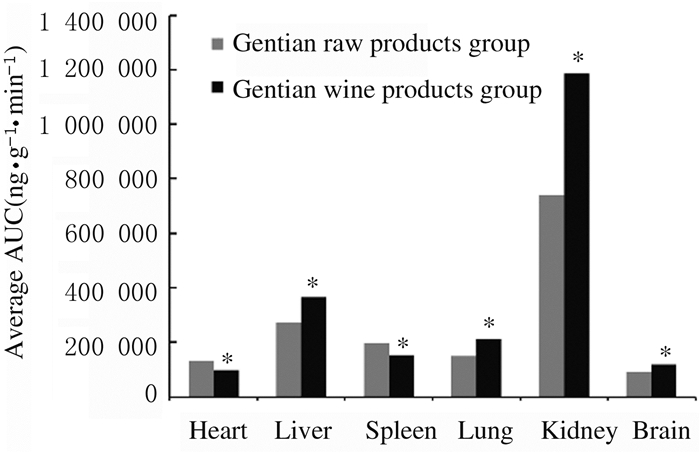
2.6 龙胆生品及酒制品给药后龙胆苦苷在大鼠主要器官组织中质量浓度分布大鼠灌胃给予龙胆生品及龙胆酒制品后,待测成分龙胆苦苷在大鼠体内不同时间点(15、30、60、120、240和360min)各组织中的质量浓度见表 2。根据表 2中各时间点龙胆苦苷在各组织中质量浓度分布,计算其在不同器官组织中的药-时曲线下面积(AUC0→360min),结果见图 4。结果表明:龙胆酒制前后其化学成分龙胆苦苷在大鼠心、肝、脾、肺、肾和脑组织中均有分布,在肝和肾组织中质量浓度均明显高于其他器官组织,且酒制后龙胆苦苷在大鼠肝、肺和肾组织中质量浓度明显升高(P < 0.01)。
| [n=5, x±s, wB/(ng·g-1)] | |||||||||||||||||||||||||||||
| Time(min) | Group | Mass concentration of gentiopicrin | |||||||||||||||||||||||||||
| Heart | Liver | Spleen | Lung | Kidney | Brain | ||||||||||||||||||||||||
| 15 | Raw products | 171.8±14.3 | 555.6±130.6 | 299.1±22.5 | 361.0±17.3 | 786.8±20.1 | 191.8±14.2 | ||||||||||||||||||||||
| Wine products | 149.9±8.4* | 1 142.1±161.3** | 375.5±31.9* | 225.3±25.4** | 3 637.1±203.1** | 245.4±17.3** | |||||||||||||||||||||||
| 30 | Raw products | 928.5±12.5 | 1 113.7±48.5 | 307.3±11.3 | 696.3±23.1 | 9 673.6±1123.8 | 234.0±6.3 | ||||||||||||||||||||||
| Wine products | 983.5±47.5* | 1 440.3±87.6** | 305.5±20.1 | 857.6±45.2** | 7 927.1±75.7** | 725.2±68.3** | |||||||||||||||||||||||
| 60 | Raw products | 386.3±20.8 | 1 850.7±20.7 | 1 265.1±56.1 | 785.5±33.6 | 4 949.2±296.4 | 293.4±7.8 | ||||||||||||||||||||||
| Wine products | 505.9±40.7* | 2 156.2±162.5** | 1 502.4±237.5 | 1 110.4±432.8 | 9 247.5±1 435.7** | 733.6±66.3** | |||||||||||||||||||||||
| 120 | Raw products | 312.5±24.8 | 1 433.3±118.7 | 683.7±12.8 | 597.5±36.2 | 1 641.9±187.1 | 403.5±86.7 | ||||||||||||||||||||||
| Wine products | 219.1±55.8* | 1 815.9±63.4** | 525.9±112.0* | 720.3±16.4** | 4 006.6±315.2** | 563.0±21.4** | |||||||||||||||||||||||
| 240 | Raw products | 386.3±15.6 | 213.1±13.9 | 473.5±23.6 | 230.8±31.8 | 1 060.5±237.5 | 253.7±24.9 | ||||||||||||||||||||||
| Wine products | 167.8±61.4** | 446.5±47.5** | 146.1±33.2 | 511.0±35.6** | 1 506.4±24.7** | 107.3±10.6** | |||||||||||||||||||||||
| 360 | Raw products | 295.0±11.2 | 120.7±15.7 | 202.8±9.7 | 260.9±14.0 | 299.8±13.8 | 79.0±22.7 | ||||||||||||||||||||||
| Wine products | 190.0±71.8* | 188.0±35.2** | 196.5±11.9 | 241.8±23.9 | 348.5±38.4* | 73.6±6.6 | |||||||||||||||||||||||
| *P < 0.05,** P < 0.01 vs gentian raw products group. | |||||||||||||||||||||||||||||
|
| *P < 0.05, * *P < 0.01 compared with gentian raw products group. 图 4 龙胆生品及酒制品灌胃给药后龙胆苦苷在大鼠不同器官组织中平均AUC Fig. 4 Average AUC of gentiopicrin in different organs and tissues of rats after intragastric administration of gentian raw products and wine products |
|
|
将龙胆生品及龙胆酒制品对大鼠进行灌胃给药后,药物在大鼠体内迅速分布。给药30 min后,在体内即可检测到较高的药物浓度,在心、肝、脾、肺、肾和脑等组织中均检测出龙胆苦苷,说明龙胆苦苷可以透过血脑屏障[16]。龙胆苦苷在肝和肾组织中分布明显多于其他器官组织,这与《雷公炮制药性解》中龙胆归肝经和肾经的结论相一致。其中,龙胆苦苷含量在肾脏中达到最高,推测龙胆苦苷可能主要从肾脏排泄。《神农本草经》中曾记载:“龙胆若复以酒炮制之,则酒性走窜,无所不至,可助龙胆清除游走之肝火”。酒制能明显改变龙胆苦苷在大鼠主要器官组织中的浓度分布情况,酒制后,龙胆苦苷在大鼠主要器官组织的质量浓度分布整体呈增加趋势,在肝、肺和肾组织中的分布明显增加,在脑组织中有小幅度增加;在心和脾组织中龙胆苦苷的分布有较小幅度降低,但变化不大。这些结果表明酒制能够增加龙胆苦苷的溶出度[17-21],增加龙胆苦苷含量,促进龙胆苦苷的吸收利用,为临床合理用药提供了参考依据。
本实验建立了测定龙胆苦苷在大鼠组织中含量的HPLC-MS法,并比较了龙胆生品及酒制品中龙胆苦苷在大鼠主要器官组织中分布的差异。HPLC-MS法简便、快速、准确,本研究为临床应用龙胆酒制品泻肝胆火等疾病提供了科学依据,此外,更有助于进一步探讨龙胆药材的炮制方法与其功效的相关性,提高龙胆药材及其炮制品的有效利用率。
| [1] |
国家药典委员会.中华人民共和国药典.一部[S].北京: 中国医药科技出版社, 2015: 96.
|
| [2] |
蔡爱华.关龙胆化学成分及抗肿瘤活性研究[D].延吉: 延边大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10184-1014359908.htm
|
| [3] |
周艳丽, 王大利, 张艳, 等. 三花龙胆化学成分及抗肿瘤活性研究[J]. 中国医药导报, 2019, 16(1): 20-23. |
| [4] |
李黎, 韩辉, 唐焕伟. 东北龙胆草研究进展[J]. 黑龙江科学, 2013, 4(6): 22-23. |
| [5] |
黄晓巍, 刘玥欣, 翁丽丽, 等. 酒龙胆化学成分及药理作用研究进展[J]. 吉林中医药, 2018, 38(2): 195-197. |
| [6] |
王建中, 雷有杰, 蒋红英, 等. 龙胆苦苷对新生大鼠氧糖剥夺再灌注损伤海马神经元细胞Caspase-3、Bax和Bcl-2表达的影响[J]. 解剖学报, 2016, 47(1): 28-33. |
| [7] |
褚博文, 张霁, 李智敏, 等. 滇龙胆化学成分和药理作用研究进展[J]. 中国实验方剂学杂志, 2016, 22(13): 213-222. |
| [8] |
沈涛, 杨美权, 赵振玲, 等. 滇龙胆中萜类物质积累的动态变化[J]. 植物学报, 2011, 46(6): 652-657. |
| [9] |
李小芳, 李敏, 蒋卫, 等. 龙胆炮制品中龙胆苦苷的HPLC含量测定研究[J]. 中成药, 2006, 28(10): 1449-1451. |
| [10] |
李小芳, 蒋卫. 应用药物动力学数学模型研究酒龙胆炮制过程中龙胆苦苷的化学稳定性[J]. 世界科学技术, 2006, 8(6): 43-45. |
| [11] |
雷敩. 雷公炮炙论[M]. 上海: 上海中医学院出版社, 1955: 19.
|
| [12] |
(清)杨时泰.本草述钩元:32卷[M].上海:科技卫生出版社, 1958:145-146.
|
| [13] |
国家中医药管理局《中华本草》编委会. 中华本草-6[M]. 上海: 上海科学技术出版社, 1999: 6.
|
| [14] |
张堇訸, 尹海波, 张建逵, 等. 中药龙胆的本草考证[J]. 中国实验方剂学杂志, 2019, 25(13): 163-169. |
| [15] |
董晓蕾, 张霁, 赵艳丽, 等. 龙胆炮制前后化学成分变化的比较研究[J]. 药物分析杂志, 2015, 35(4): 620-626. |
| [16] |
邓雅婷, 王艳丽, 王运维, 等. 龙胆苦苷的血脑屏障通透性研究[J]. 时珍国医国药, 2018, 29(1): 14-17. |
| [17] |
王彩君, 王智民, 王维皓, 等. 酒制龙胆的最佳炮制工艺研究[J]. 中国中药杂志, 2008, 33(20): 2335-2338. |
| [18] |
徐宏亮, 刘玉强, 才谦. 酒制前后龙胆中龙胆苦苷和獐牙菜苦苷的含量变化研究[J]. 中成药, 2009, 31(8): 1237-1239. |
| [19] |
吕新, 孙建之, 徐士钊, 等. HPLC法同时测定不同产地龙胆酒炙前后3种环烯醚萜苷[J]. 中成药, 2019, 41(5): 1106-1109. |
| [20] |
赵红岩. 龙胆酒炙前后整体化学成分变化研究[J]. 陕西教育学院学报, 2010, 26(1): 107-109. |
| [21] |
张涛. 龙胆及其炮制品中龙胆苦苷的含量比较[J]. 中药材, 2000, 23(7): 387-388. |
 2020, Vol. 46
2020, Vol. 46


