扩展功能
文章信息
- 王会俞, 张天夫, 郝苗, 张楚, 王晓峰
- WANG Huiyu, ZHANG Tianfu, HAO Miao, ZHANG Chu, WANG Xiaofeng
- 人参果多糖对人舌鳞癌CAL27细胞增殖的抑制作用及其机制
- Inhibitory effect of polysaccharides from panax ginseng fruit on proliferation of human lingual squamous cell carcinoma CAL27 cells and its mechanism
- 吉林大学学报(医学版), 2020, 46(02): 248-253
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 248-253
- 10.13481/j.1671-587x.20200207
-
文章历史
- 收稿日期: 2019-10-20
2. 吉林大学中日联谊医院科研中心, 吉林 长春 130033
2. Scientific Research Center, China-Japan Union Hospital, Jilin university, Changchun 130033, China
口腔癌(oral cancer,OC)是世界第6位常见癌症,其中90%以上为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)[1-2]。由于口腔颌面部解剖结构复杂,位置特殊,手术治疗可能会导致面部变形、咀嚼困难、发音问题和美学问题,降低患者生存质量[3];手术联合放化疗会产生一些不良反应(呕吐、脱发和肌肉萎缩等)[4]。因此,开发一种效果明确、不良反应少的新型抗OSCC药物,对提高患者生存质量和改善患者预后具有重要的科学意义和临床价值。
中药多糖是中药的主要活性成分之一,可通过调节机体免疫功能,发挥其抗肿瘤作用,且具有不良反应少等优点[5-8]。有研究[9-10]显示:水溶性人参果多糖(water soluble ginseng berry polysaccharide,WGBP)可预防肠道肿瘤,抑制黑色素瘤生长和转移。但目前对于WGBP的研究仅限于对肿瘤细胞增殖抑制作用的探讨,其抑制肿瘤的具体作用机制尚不清楚,特别是关于WGBP对OSCC的抗肿瘤作用和机制报道较少。因此,本研究以人舌鳞状细胞癌(简称舌鳞癌)CAL27细胞为研究对象,明确WGBP抑制CAL27细胞增殖的作用和潜在机制,为开发以WGBP为主要原料的抗OSCC药物或功能性食品提供数据参考。
1 材料与方法 1.1 细胞、主要试剂和仪器人舌鳞癌CAL27细胞株(美国ATCC细胞库)。人参果(中国吉林省抚松县),单糖标准品(中国上海Sigma-Aldrich公司),层析柱和C1 6/26 DEAE-Sepharose Fastflow凝胶(美国GE公司),DMEM培养基(美国Corning公司),胎牛血清和青霉素-链霉素(美国Gibco公司),CCK-8检测试剂盒(日本Dojindo公司),RIPA细胞裂解液(南京碧云天公司),TRIzol(美国Invitrogen公司), Western blotting蛋白预染Marker[生工生物技术(上海)有限公司],细胞凋亡试剂盒(中国天津三箭生物技术有限公司),PI和RNase (美国Sigma公司),β肌动蛋白(β-actin)抗体、半胱氨酸蛋白酶-3酶原(pro-Caspase-3)抗体、多聚ADP-核糖聚合酶酶原(poly ADP-ribose polymerase zymogen,pro-PARP)抗体(美国CST公司)。Odyssey红外成像系统(Licor Odyssey,美国Li-cor公司),流式细胞仪(FC 500MCL,美国Beckman公司)
1.2 细胞培养人舌鳞癌CAL27细胞采用含10%胎牛血清和1%青霉素-链霉素的DMEM培养基,在37℃、5% CO2的湿化环境中培养。
1.3 WGBP的提取和单糖组成分析将人参果于100℃沸水煮提4 h, 过滤, 沉淀重复提取2次,合并3次提取所得滤液,利用单煎机保持微沸状态浓缩, 离心, 弃去沉淀。取上清于60℃水浴浓缩, 至室温后, 加入95%乙醇调节乙醇终浓度为80%, 沉淀过夜。离心, 收集沉淀。向沉淀中加入蒸馏水, 充分溶解, 重复醇沉1次。沉淀用蒸馏水复溶后冷冻干燥, 获得WGBP,再将WGBP冻干粉称质量后加入超纯水溶解,配置成不同质量浓度的水溶液。单糖组成分析:称取多糖样品, 依次用盐酸、甲醇溶液和三氟乙酸溶液水解, 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生化后高效液相色谱法(high pressure liquid chromatography,HPLC)检测。检测波长为245 nm。
1.4 CCK-8法检测各组CAL27细胞增殖率将CAL27细胞以8×103mL-1的密度接种于96孔培养板培养过夜,再以不同浓度(0、1、2和5g·L-1)WGBP处理24 h,分别作为对照组和1、2及5g·L-1WGBP组,每孔加10 μL CCK-8溶液, 避光,37℃孵育2 h,采用酶标仪检测450 nm处吸光度(A)值,计算细胞增殖率。细胞增殖率= (实验组A值-空白对照组A值)/(对照组A值-空白对照组A值) ×100%。
1.5 流式细胞术检测细胞周期将CAL27细胞以6×105 mL-1的密度接种于6孔培养板培养过夜,再以不同浓度(0、1、2和5g·L-1)WGBP处理24 h,预冷PBS缓冲液清洗2次,无EDTA的胰蛋白酶消化后收集细胞,预冷PBS缓冲液清洗细胞1次,70%乙醇固定, PBS缓冲液清洗2次后重悬加入PI溶液和RNase, 避光30 min,流式细胞仪检测各组细胞周期分布。
1.6 流式细胞术检测细胞凋亡率将CAL27细胞以6×105 mL-1的密度接种于6孔培养板培养过夜,再以不同浓度(0、1、2和5g·L-1)WGBP处理24 h,消化并收集细胞,Binding Buffer重悬细胞,按照细胞凋亡试剂盒说明书向每管中依次加入Annexin Ⅴ-FITC/PI结合液,室温避光孵育15 min,流式细胞仪检测各组细胞凋亡率。
1.7 蛋白免疫印迹法检测各组细胞中pro-Caspase-3和pro-PARP蛋白表达量将CAL27细胞以6×105 mL-1的密度接种于6孔培养板培养过夜,再以不同浓度(0、1、2和5g·L-1)WGBP处理24 h,消化并收集细胞,加入RIPA超声裂解细胞,收集上清并测定蛋白浓度,12% SDS-PAGE以80~100 V恒压电泳分离蛋白,采用湿转法以100 V恒压将蛋白转至PVDF膜上,加入封闭液孵育1 h,β-actin、pro-Caspase-3和pro-PARP一抗孵育过夜(稀释比例均为1:1 000),二抗室温避光孵育1 h(稀释比例为1:30 000)。TBST清洗3次,以β-actin为内参蛋白,Odyssey红外成像系统检测分析蛋白条带。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组CAL27细胞增殖率、不同细胞周期CAL27细胞百分比和细胞凋亡率均以x±s表示, 多组间样本均数比较采用单因素方差分析,两组间样本均数多重比较采用LSD检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 WGBP单糖组成HPLC检测结果显示:WGBP多糖由(51.2±3.9)%的半乳糖、(19.1±1.9)%的半乳糖醛酸、(11.3±2.1)%的葡萄糖、(10.5±1.2)%的阿拉伯糖、(5.4±1.2)%的鼠李糖和(2.5±0.7)%的甘露糖组成。
2.2 各组CAL27细胞增殖率与对照组比较,不同浓度WGBP组CAL27细胞增殖率明显降低(P < 0.05或P < 0.01),且呈浓度依赖性。见图 1。
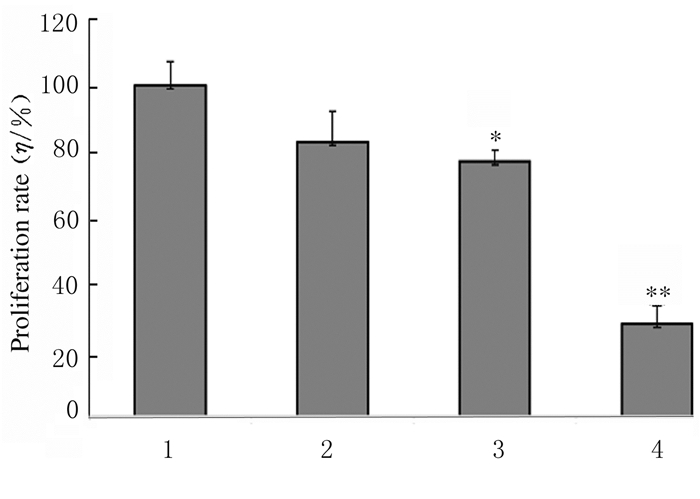
|
| *P < 0.05, **P < 0.01 compared with control group. 1:Control group; 2-4: 1, 2 and 5g·L-1 WGBP groups. 图 1 CCK-8法检测各组CAL27细胞增殖率 Fig. 1 Proliferation rates of CAL27 cells in various groups detected by CCK-8 method |
|
|
与对照组比较,1 g·L-1WGBP组细胞周期分布无明显变化;2和5 g·L-1WGBP组S期CAL27细胞百分比明显降低(P < 0.05或P < 0.01),G2/M期CAL27细胞百分比明显升高(P < 0.05或P < 0.01),且呈浓度依赖性。见图 2和表 1。
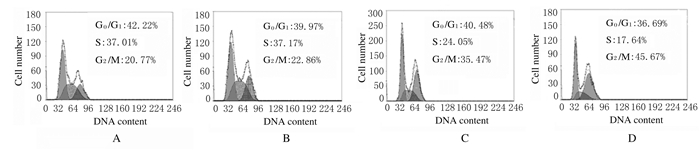
|
| A:Control group; B:1 g·L-1WGBP group; C:2 g·L-1WGBP group; D:5 g·L-1WGBP group. 图 2 各组CAL27细胞周期分布 Fig. 2 Cell cycle distribution of CAL27 in various groups |
|
|
| (n=6, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Percentage of CAL27 cells | ||||||||||||||||||||||||||||
| G0/G1 | S | G2/M | |||||||||||||||||||||||||||
| Control | 42.22±1.02 | 37.01±2.23 | 20.77±1.98 | ||||||||||||||||||||||||||
| WGBP(g·L-1) | |||||||||||||||||||||||||||||
| 1 | 39.97±2.05 | 37.17±1.89 | 22.86±2.75 | ||||||||||||||||||||||||||
| 2 | 40.48±1.12 | 24.05±3.42* | 35.47±3.02* | ||||||||||||||||||||||||||
| 5 | 36.69±2.56 | 17.64±2.56** | 45.67±1.76** | ||||||||||||||||||||||||||
| *P < 0.05,** P < 0.01 compared with control group. | |||||||||||||||||||||||||||||
1 g·L-1 WGBP组细胞总凋亡率为(19.48±1.28)%,以早期凋亡(16.89%±3.29%)为主。随着WGBP作用浓度增加,细胞凋亡率也逐渐升高。2 g· L-1WGBP组细胞总凋亡率为(56.10±3.25)%,仍以早期凋亡(53.25%±2.16%)为主。5 g·L-1 WGBP组细胞总凋亡率为(88.86±3.49)%,其中早期凋亡率为(83.17±5.32)%,晚期凋亡率为(5.69±3.21)%。与对照组(12.73%±3.84%)比较,各剂量WGBP组CAL27细胞总凋亡率明显升高(P<0.05),且呈浓度依赖性。见图 3。
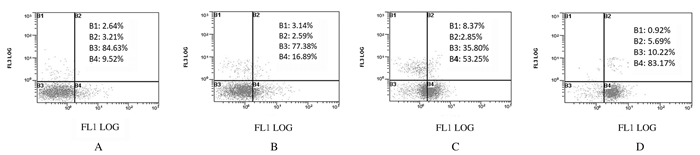
|
| A:Control group; B:1 g·L-1WGBP group; C:2 g·L-1WGBP group; D:5 g·L-1WGBP group. 图 3 流式细胞术检测各组CAL27细胞凋亡率 Fig. 3 Apoptotic rates of CAL27 cells in various groups detected by flow cytometry |
|
|
与对照组比较,不同浓度WGBP组CAL27细胞中pro-Caspase-3蛋白表达量逐渐下降,即pro-Caspase-3发生降解,而pro-PARP表达量也逐渐减少,且二者均具有浓度依赖性。见图 4。

|
| Lane 1:Control group; Lane 2:1 g·L-1WGBP group; Lane 3:2 g·L-1WGBP group; Lane 4:5 g·L-1WGBP group. 图 4 各组CAL27细胞中pro-PARP和pro-Caspase-3蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of pro-PARP and pro-Caspase-3 proteins in CAL27 cells in various groups |
|
|
中药多糖是一类由单糖组成的天然高分子化合物,近年来研究者对中药多糖的抗肿瘤效果广泛关注。研究[11-13]发现:香菇多糖可导致线粒体去极化或激活非线粒体途径中诱导细胞中活性氧簇(reactive oxygen species, ROS)生成,引起人膀胱癌细胞T24凋亡;灵芝多糖可通过激活Caspase、线粒体和JNK通路,诱导结肠癌HCT-116细胞凋亡;人参多糖可通过调控MAPK/NF-κB/cyclin D1信号通路诱导细胞周期阻滞和凋亡,最终抑制K562细胞增殖。
我国是生产人参的大国,具有丰富的人参资源。随着人参资源的深入开发,发现人参果也同样具有很高的营养和药用价值[14]。人参果是人参植株的人参(Panax ginseng C.A.Meyer)的果实,主要含有皂苷、多糖、挥发油和生物碱等活性成分,具有抗疲劳、降血糖、抗衰老和抗肿瘤等多种功效,能提高机体对环境的适应能力和防御能力[15-17]。最近研究[10]发现:人参果多糖能显著抑制人结肠癌HCT-116和HT-29细胞增殖;冯孟鑫[18]发现人参果多糖二级级分(WPGFH-0.04和WPGFH-0.8)在给药量达到3g·L-1时表现出较强的抑制肝癌HepG2细胞增殖的能力。然而目前的研究仅限于WGBP对肿瘤增殖抑制作用的基础研究,并未深入探讨WGBP抑制肿瘤细胞增殖的潜在机制。有关中药多糖对OSCC的相关研究也少有报道。本研究利用人舌鳞癌CAL27细胞,从细胞增殖、细胞周期和细胞凋亡等方面观察WGBP对OSCC的抗肿瘤作用及潜在机制。
Caspase-3是凋亡反应的关键调控因子[19]。活化的Caspase-3可裂解DNA修复中重要的多聚(adp-核糖)聚合酶-1 (PARP-1)等蛋白,从而促进细胞凋亡[20]。有研究[21-23]表明:多种中药多糖能通过激活下游的Caspase-3启动子级联,发挥其肿瘤杀伤效果,如茯苓多糖通过激活下游的Caspase-3诱导小鼠肉瘤180细胞凋亡,甘草根多糖可以激活Caspase-3和Caspase-9从而降解PARP诱导SCC-25细胞凋亡,以及当归多糖通过上调促凋亡蛋白Bax、cleaved-Caspase-3表达抑制U251细胞增殖。本研究结果显示:WGBP可通过激活Caspase-3级联反应以及降解PARP诱导CAL27细胞凋亡,表明在此过程中,Caspase-3是WGBP发挥细胞毒性的关键靶分子。研究[24]表明:WGBP主要由半乳糖和半乳糖醛酸组成,可能是一种阿拉伯半乳聚糖型果胶。在本实验中该结果得到进一步验证。此外,已有研究[25-27]表明:多糖的组成和结构与其抗肿瘤活性密切相关,如党参多糖对HepG2细胞的抑制作用与其单糖种类有关, 含有半乳糖醛酸较高的党参多糖对HepG2细胞的抑制作用较强,不同组分的枸杞多糖可通过阻断细胞周期的不同阶段抑制人肝癌SMMC-7721细胞增殖。因此本文作者推测WGBP的抗肿瘤活性也可能与其单糖组成成分有关,具体的构效关系尚需进一步探究。
综上所述,WGBP能诱导CAL27细胞发生G2/M期阻滞,通过激活Caspase-3引起级联反应,降解PARP诱导细胞凋亡,最终发挥肿瘤杀伤效果,抑制CAL27细胞增殖且具有浓度依赖性。本研究结果将为开发以WGBP为主的功能性保健食品或治疗OSCC药物提供新的参考。
| [1] |
ZHENG C M, GE M H, ZHANG S S, et al. Oral cavity cancer incidence and mortality in China, 2010[J]. J Cancer Res Ther, 2015, 11(Suppl 2): C149-C154. |
| [2] |
SCHWAM Z G, SOSA J A, ROMAN S, et al. Complications and mortality following surgery for oral cavity cancer:analysis of 408 cases[J]. Laryngoscope, 2015, 125(8): 1869-1873. DOI:10.1002/lary.25328 |
| [3] |
HAN H Y, LEE H E, KIM H J, et al. Kochia scoparia induces apoptosis of oral cancer cells in vitro and in heterotopic tumors[J]. J Ethnopharmacol, 2016, 192: 431-441. DOI:10.1016/j.jep.2016.09.019 |
| [4] |
CARNEIRO-NETO J N, DE-MENEZES J D, MOURA L B, et al. Protocols for management of oral complications of chemotherapy and/or radiotherapy for oral cancer:Systematic review and meta-analysis current[J]. Med Oral Patol Oral Cir Bucal, 2017, 22(1): e15-e23. |
| [5] |
CAO J F, HOU D, LU J B, et al. Anti-tumor activity of exopolysaccharide from Rhizopus nigricans Ehrenb on S180 tumor-bearing mice[J]. Bioorg Med Chem Lett, 2016, 26(8): 2098-2104. DOI:10.1016/j.bmcl.2016.02.012 |
| [6] |
MAO G H, ZHANG Z H, FEI F, et al. Effect of Grifola frondosa polysaccharide on anti-tumor activity in combination with 5-Fu in Heps-bearing mice[J]. Int J Biol Macromol, 2019, 121: 930-935. DOI:10.1016/j.ijbiomac.2018.10.073 |
| [7] |
ZHU L, CAO J F, CHEN G C, et al. Anti-tumor and immunomodulatory activities of an exopolysaccharide from Rhizopus nigricans on CT26 tumor-bearing mice[J]. Int Immunopharmacol, 2016, 36: 218-224. DOI:10.1016/j.intimp.2016.04.033 |
| [8] |
LIU L, JIA J, ZENG G, et al. Studies on immunoregulatory and anti-tumor activities of a polysaccharide from Salvia miltiorrhiza Bunge[J]. Carbohydr Polym, 2013, 92(1): 479-483. DOI:10.1016/j.carbpol.2012.09.061 |
| [9] |
LEE D Y, PARK C W, LEE S J, et al. Immunostimulating and antimetastatic effects of polysaccharides purified from ginseng berry[J]. Am J Chin Med, 2019, 47(4): 823-839. DOI:10.1142/S0192415X19500435 |
| [10] |
WAN J Y, HUANG W H, ZHENG W, et al. Multiple effects of ginseng berry polysaccharides:plasma cholesterol level reduction and enteric neoplasm prevention[J]. Am J Chin Med, 2017, 45(6): 1293-1307. DOI:10.1142/S0192415X17500719 |
| [11] |
BAO L D, WANG Y, MA R L, et al. Apoptosis-inducing effects of lentinan on the proliferation of human bladder cancer T24 cells[J]. Pak J Pharm Sci, 2015, 28(5): 1595-1600. |
| [12] |
SOHRETOGLU D, HUANG S L. Ganoderma lucidum polysaccharides as an anti-cancer agent[J]. Anticancer Agents Med Chem, 2018, 18(5): 667-674. DOI:10.2174/1871520617666171113121246 |
| [13] |
XIONG W, LI J, JIANG R, et al. Research on the effect of ginseng polysaccharide on apoptosis and cell cycle of human leukemia cell line K562 and its molecular mechanisms[J]. Exp Ther Med, 2017, 13(3): 924-934. DOI:10.3892/etm.2017.4087 |
| [14] |
施明毅, 赵姝婷, 温川飙, 等. 人参果产品开发研究现状[J]. 亚太传统医药, 2018, 14(1): 59-61. |
| [15] |
KIM J, CHO S Y, KIM S H, et al. Effects of Korean ginseng berry on skin antipigmentation and antiaging via FoxO3a activation[J]. J Ginseng Res, 2017, 41(3): 277-283. DOI:10.1016/j.jgr.2016.05.005 |
| [16] |
LI Z P, KIM H J, PARK M S, et al. Effects of fermented ginseng root and ginseng berry on obesity and lipid metabolism in mice fed a high-fat diet[J]. J Ginseng Res, 2018, 42(3): 312-319. DOI:10.1016/j.jgr.2017.04.001 |
| [17] |
KIM M, YI Y S, KIM J, et al. Effect of polysaccharides from a Korean ginseng berry on the immunosenescence of aged mice[J]. J Ginseng Res, 2018, 42(4): 447-454. DOI:10.1016/j.jgr.2017.04.014 |
| [18] |
冯孟鑫.人参果多糖的分级分离纯化及理化性质与抗肿瘤活性初探[D].北京: 北京中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10026-1016070010.htm
|
| [19] |
PU X, STORR S J, ZHANG YM, et al. Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 357-368. |
| [20] |
SAIRANEN T, SZEPESI R, KARJALAINEN-LINDSBERG M L, et al. Neuronal caspase-3 and PARP-1 correlate differentially with apoptosis and necrosis in ischemic human stroke[J]. Acta Neuropathol, 2009, 118(4): 541-552. DOI:10.1007/s00401-009-0559-3 |
| [21] |
SHI C Y, MA Q H, REN M Y, et al. Antitumorpharmacological mechanism of the oral liquid of Poriacocos polysaccharide[J]. J Ethnopharmacol, 2017, 209: 24-31. DOI:10.1016/j.jep.2017.07.003 |
| [22] |
ZENG G, SHEN H, TANG G, et al. A polysaccharide from the alkaline extract of Glycyrrhiza inflata induces apoptosis of human oral cancer SCC-25 cells via mitochondrial pathway[J]. Tumour Biol, 2015, 36(9): 6781-6788. DOI:10.1007/s13277-015-3359-5 |
| [23] |
ZHANG W F, YANG Y, LI X, et al. Angelica polysaccharides inhibit the growth and promote the apoptosis of U251 glioma cells in vitro and in vivo[J]. Phytomedicine, 2017, 33: 21-27. DOI:10.1016/j.phymed.2017.06.007 |
| [24] |
李珊珊, 祝贺, 祁玉丽, 等. 人参果多糖的分离纯化及体外抗氧化活性研究[J]. 食品工业科技, 2018, 39(4): 73-76. |
| [25] |
ZHANG M, TANG XL, WANG F, et al. Characterization of Lycium barbarum polysaccharide and its effect on human hepatoma cells[J]. Int J Biol Macromol, 2013, 61: 270-275. DOI:10.1016/j.ijbiomac.2013.06.031 |
| [26] |
张培, 郑晓萍, 马玉玲, 等. 党参多糖单糖组成与其对HepG2细胞毒活性的相关分析[J]. 中草药, 2016, 47(15): 2684-2692. |
| [27] |
ZHANG Q, LV X, WU T, et al. Composition of Lycium barbarum polysaccharides and their apoptosis-inducing effect on human hepatoma SMMC-7721 cells[J]. Food Nutr Res, 2015, 59: 28696. DOI:10.3402/fnr.v59.28696 |
 2020, Vol. 46
2020, Vol. 46


