扩展功能
文章信息
- 张楚, 郝苗, 王会俞, 王晓峰, 张天夫
- ZHANG Chu, HAO Miao, WANG Huiyu, WANG Xiaofeng, ZHANG Tianfu
- 奥沙利铂对人舌鳞癌CAL27细胞增殖和凋亡的影响及其机制
- Effect of Oxaliplatin on proliferation and apoptosis of human tongue squamous cell carcinoma CAL27 cells and its mechanism
- 吉林大学学报(医学版), 2020, 46(02): 233-239
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 233-239
- 10.13481/j.1671-587x.20200205
-
文章历史
- 收稿日期: 2019-10-20
2. 吉林大学中日联谊医院科研中心, 吉林 长春 130033
2. Scientific Research Center, China-Japan Union Hospital, Jilin University, Changchun 130033, China
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)占口腔癌的90%以上[1-2],好发于舌部, 其次为唇部、颊部和口底部[3-4]。目前临床上对OSCC的治疗主要以手术为主,辅以放化疗[5]。但由于口腔独特的结构特点,术后重建困难,放疗和化疗药物均有不良反应,通常导致患者术后生活质量差[6]。因此, 寻找和开发能够有效治疗OSCC且不良反应轻的化疗药物并明确其作用机制具有重要意义。铂类药物是一种DNA损伤剂,通过形成DNA加合物,诱导肿瘤细胞发生凋亡而发挥细胞毒性,是近几十年来治疗实体肿瘤的重要化疗药物之一。顺铂已成为治疗头颈部肿瘤包括OSCC的一线药物[7]。奥沙利铂(Oxaliplatin)是第3代铂配位复合物,其不良反应轻于顺铂引起肾毒性和卡铂引起的骨髓抑制[8]。研究表明:Oxaliplatin对多种肿瘤细胞系具有抗肿瘤活性,如结直肠癌[9]、肝癌[10]和卵巢癌[11]等,是一种理想的化疗药物。然而,目前国际上有关Oxaliplatin对OSCC作用的研究报道较少,且多为从联合用药及耐药性角度探讨其抗肿瘤活性,关于Oxaliplatin抑制OSCC细胞增殖的作用及机制尚不明确。因此,本研究通过探讨Oxaliplatin对人舌鳞状细胞癌(简称舌鳞癌)CAL27细胞增殖、周期和凋亡的影响,揭示Oxaliplatin的作用机制,从而为临床应用化疗药物治疗舌鳞癌提供新的理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人舌鳞癌CAL27细胞株(美国ATCC细胞库),DMEM培养基(美国Corning公司),青霉素-链霉素和胎牛血清(美国Gibco公司),Oxaliplatin [赛诺菲(杭州)制药有限公司],CCK-8检测试剂盒、TRIzol、结晶紫染液和RIPA细胞裂解液(南京碧云天生物技术有限公司),细胞凋亡相关检测试剂盒(天津三箭生物技术有限公司),PI和RNase(美国Sigma公司),GAPDH、survivin和Bax抗体(美国CST公司),逆转录试剂盒和SYBR Green[莫纳(苏州)生物技术有限公司],Western blotting蛋白预染Marker和GAPDH、周期蛋白依赖性激酶2(CDK2)以及细胞周期蛋白E (cyclin E)引物(上海生工生物技术有限公司)。实时荧光定量PCR仪(Mastercyclereprealplex 2S,德国Ependoff公司),流式细胞仪(FC 500MCL,美国Beckman公司),Odyssey红外成像系统(Licor Odyssey,美国Li-cor公司)。
1.2 细胞培养人舌鳞癌CAL27细胞采用含有10%胎牛血清及含1%双抗的DMEM培养基,置于5% CO2、37℃孵箱中培养,每隔48 h传代或更换培养基。
1.3 结晶紫染色观察细胞形态将CAL27细胞(5×104 mL-1)接种于24孔板,过夜培养后,分别用0、40和80 mg·L-1 Oxaliplatin处理细胞24 h(对照组、40 mg·L-1 Oxaliplatin组和80 mg·L-1 Oxaliplatin组)。弃去原有培养基,加入PBS缓冲液漂洗1次,然后每孔缓慢加入500 μL甲醇固定细胞15 min。弃去甲醇并干燥后,每孔加入500 μL结晶紫染液细胞染色10 min。弃去结晶紫染液,PBS缓冲液漂洗3次,待其干燥后,在400×的显微镜观察细胞染色后形态并拍照。
1.4 CCK-8法检测各组CAL27细胞增殖率将CAL27细胞(1×104 mL-1)接种于96孔培养板并设置空白组,过夜培养后,采用不同浓度(0、10、20、40和80 mg· L-1) Oxaliplatin处理细胞24 h(对照组和10、20、40及80 mg·L-1 Oxaliplatin组)。然后,每孔加入10 μL CCK-8溶液,避光,37℃条件下孵育2 h,采用酶标仪检测细胞在450 nm处的吸光度(A)值,计算细胞增殖率。细胞增殖率=(实验组A值-空白组A值)/(对照组A值-空白组A值) ×100%。
1.5 流式细胞术检测各组CAL27细胞周期按5×105 mL-1密度接种CAL27细胞于6孔培养板中,过夜培养至细胞完全贴壁,采用不同浓度(0和80 mg·L-1)Oxaliplatin处理24 h(对照组和80 mg·L-1Oxaliplatin组)。预冷PBS缓冲液清洗2次后,加入胰酶(不含EDTA)消化并收集细胞,离心后使用PBS缓冲液清洗1次,加入70%的预冷乙醇冰上固定30 min。PBS缓冲液洗涤2次,每个样品中加入含20 mg· L-1 PI和200 mg·L-1 RNase的染色液,避光孵育30 min后上机,流式细胞术检测各组细胞周期分布情况。
1.6 实时荧光定量PCR法检测CAL27细胞中CDK2和cyclin EmRNA表达水平采用上述方法处理并收集细胞,应用TRIzol法提取出细胞的总RNA,使用逆转录试剂盒将部分总RNA逆转录至cDNA,逆转录条件:37℃、2 min,55℃、15 min,85℃、10 s。PCR引物序列设计如下:GAPDH上游引物5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物5′-AGGGGCCATCCACAGTCTTC-3′; CDK2上游引物5′-GCTAGCAGACTTTGGACTAGCCAG-3′,下游引物5′-AGCTCGGTACCACAGGGTCA-3′; cyclin E上游引物5′- TTCTTGAGCAACACCCTCTTCTGCAGCC-3′,下游引物5′-TCGCCATATACCGGTCAAAGAAATCTTGTGCC-3′。使用实时荧光定量PCR仪进行扩增,扩增条件:95℃、10 min,95℃、15 s,60℃、30 s,循环40次。采用2-ΔΔCt法计算mRNA表达水平。
1.7 流式细胞术检测细胞凋亡率采用上述方法处理并收集细胞,根据Annexin Ⅴ- FITC/PI双染色凋亡检测试剂盒说明测定细胞凋亡情况,每个样品加入5 μLAnnexin Ⅴ溶液避光孵育15 min,再加入5 μLPI溶液避光孵育5 min,最后各加入400 μLPBS缓冲液,流式细胞术检测细胞凋亡率。细胞总凋亡率=早期凋亡率+晚期凋亡率。
1.8 Western blotting法检测CAL27细胞中Bax和survivin蛋白表达水平采用0、40和80 mg·L-1Oxaliplatin处理并收集细胞,冰上RIPA处理后超声15 s,离心收集蛋白,蛋白质定量后在样品中加入加样缓冲液,金属浴煮沸10 min。采用15% SDS-PAGE凝胶在80~120 V的电压条件下电泳分离蛋白条带,然后在100 V恒压下将蛋白转移至PVDF膜上。室温条件下使用含有5%脱脂牛奶的TBST溶液封闭PVDF膜1 h,然后分别放入1:1 000浓度稀释后的GAPDH、Bax和survivin抗体,4℃孵育过夜。TBST洗涤3次,室温条件下,在1:30 000稀释的二抗中避光孵育1 h,TBST洗涤3次,采用Odyssey红外成像系统扫描结果。使用Image J软件进行灰度分析,以目的蛋白条带灰度值与GAPDH蛋白条带灰度值的比值表达目的蛋白表达水平。
1.9 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组CAL27细胞增殖率、不同细胞周期CAL27细胞百分比、细胞中CDK2和cyclin E mRNA表达水平、细胞凋亡率以及Bax和survivin蛋白表达水平均为正态分布,以x±s表示, 多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组CAL27细胞形态表现随着药物作用浓度的升高,CAL27细胞形态发生明显的变化。对照组细胞形态与ATCC细胞库中的数据相似,细胞呈多边形,贴壁良好,胞间连接紧密,细胞核深染;40 mg·L-1 Oxaliplatin组细胞出现一定程度的皱缩,细胞间连接不紧密;80 mg·L-1 Oxaliplatin组细胞明显皱缩,部分胞膜溶解破裂,失去原有形态,细胞间连接丧失,平均染色强度低。见图 1(插页二)。
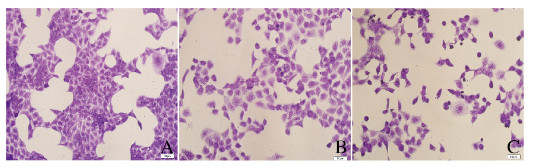
|
| A: Control group; B: 40 mg·L-1 Oxaliplatin group; C: 80 mg·L-1 Oxaliplatin group. 图 1 结晶紫染色法检测各组CAL27细胞形态表现(×400) Fig. 1 Morphology of CAL27 cells in various groups detected by crystal violet staining(×400) |
|
|
与对照组比较,不同浓度Oxaliplatin组CAL27细胞增殖率明显降低(P < 0.05或P < 0.01),且呈浓度依赖性。见图 2。
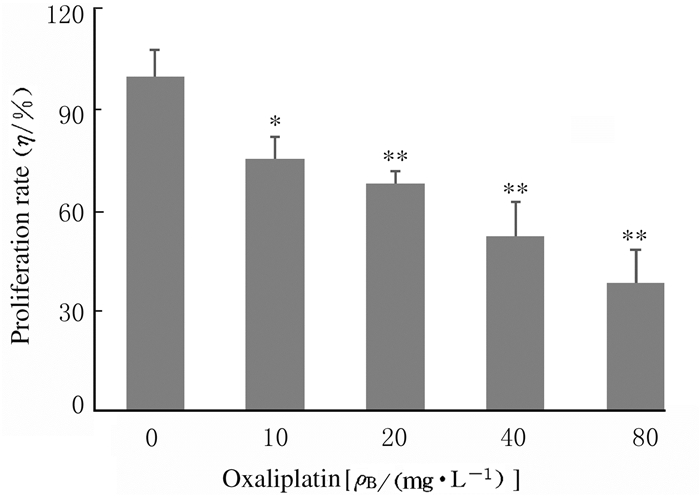
|
| *P < 0.05, **P < 0.01 compared with control group(0 mg·L-1 Oxaliplatin group). 图 2 CCK-8法检测各组CAL27细胞增殖率 Fig. 2 Proliferation rates of CAL27 cells in various groups detected by CCK-8 assay |
|
|
与对照组比较,40 mg·L-1 Oxaliplatin组G0/G1期和G2/M期CAL27细胞百分比明显升高(P < 0.01),S期CAL27细胞百分比明显降低(P < 0.05),表明CAL27细胞出现了G0/G1期阻滞。见表 1和图 3。
| (x±s, η/ %) | |||||||||||||||||||||||||||||
| Group | Percentage of CAL27 cells | ||||||||||||||||||||||||||||
| G0/G1 | S | G2/M | |||||||||||||||||||||||||||
| Control | 23.99±0.52 | 45.61±0.74 | 30.40±0.23 | ||||||||||||||||||||||||||
| 40 mg·L-1 Oxaliplatin | 28.49±0.39** | 38.97±0.87* | 32.45±0.48* | ||||||||||||||||||||||||||
| *P < 0.05,** P < 0.01 compared with control group. | |||||||||||||||||||||||||||||
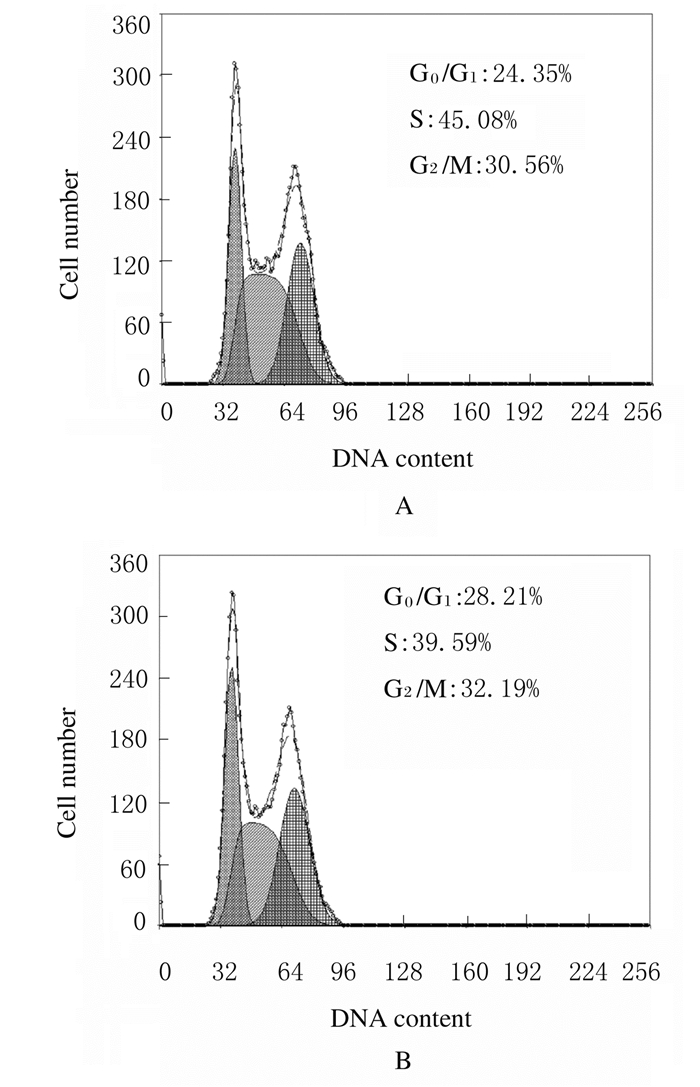
|
| A:Control group; B:40 mg·L-1 Oxaliplatin group. 图 3 流式细胞术检测各组CAL27细胞周期分布情况 Fig. 3 Cell cycle distribution of CAL27 cells in two groups detected by flow cytometry |
|
|
与对照组比较,40 mg·L-1 Oxaliplatin组CAL27细胞中CDK2和cyclin E mRNA表达水平明显降低(P < 0.05)。见图 4。
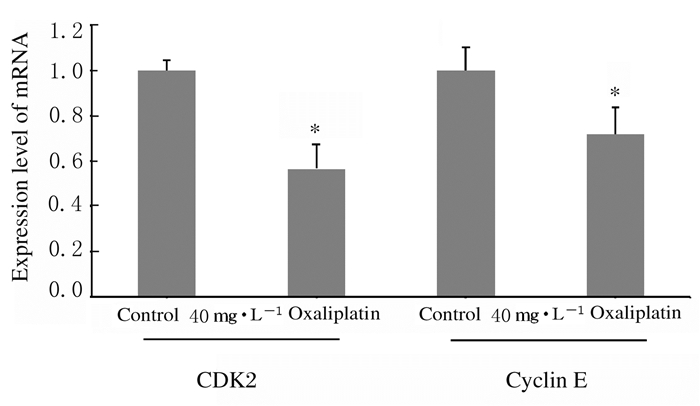
|
| *P < 0.05 compared with control group. 图 4 实时荧光定量qPCR法检测各组CAL27细胞中CDK2和cyclin E mRNA表达水平 Fig. 4 Expression levels of CDK2 and cyclin E mRNA in CAL27 cells in various groups detected by Real-time fluoresence quantitative PCR |
|
|
与对照组比较,40和80 mg·L-1 Oxaliplatin组均发生细胞凋亡。40 mg·L-1 Oxaliplatin组主要呈现为早期凋亡,与对照组比较,总凋亡率(16.10 %±0.42%)明显降低(P < 0.01)。80 mg·L-1 Oxaliplatin组8.1%的细胞呈现早期凋亡,12.0%的细胞呈现晚期凋亡;与对照组比较,总凋亡率(20.70%±0.84%)明显降低(P < 0.01)。见图 5。
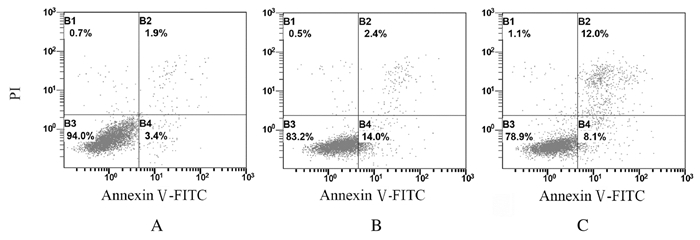
|
| A: Control group; B: 40 mg·L-1 Oxaliplatin group; C: 80 mg·L-1 Oxaliplatin group. 图 5 流式细胞术检测各组CAL27细胞凋亡率 Fig. 5 Apoptotic rates of CAL27 cells in various groups detected by flow cytometry |
|
|
与对照组比较,40和80mg·L-1 Oxaliplatin组CAL细胞中Bax蛋白表达水平明显升高(P < 0.05或P < 0.01),survivin蛋白表达水平则明显降低(P < 0.01)。见图 6。
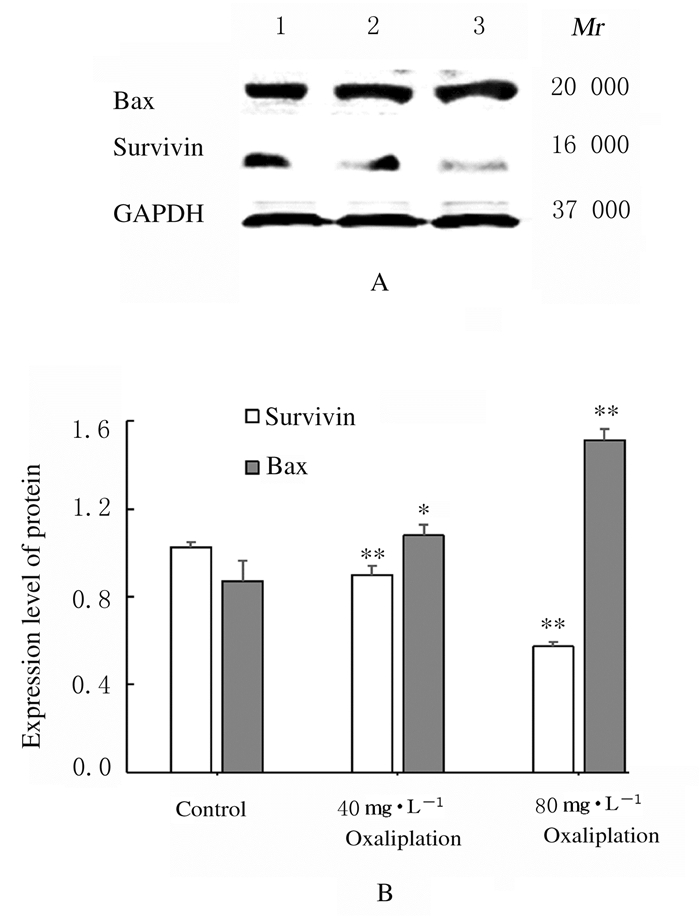
|
| Lane 1: Control group; Lane 2: 40 mg·L-1 Oxaliplatin group; Lane 3: 80 mg·L-1 Oxaliplatin group; *P < 0.05, * *P < 0.01 compared with control group. 图 6 各组CAL27细胞中Bax和survivin蛋白表达电泳图(A)和直条图(B) Fig. 6 Electrophoregram (A) and histogram (B) of Bax and survivin protein expressions in CAL27 cells in various groups |
|
|
OSCC是头颈部常见恶性肿瘤类型之一,恶性程度高,死亡率高,患者生存质量较差[12-13]。铂类药物是当前临床治疗头颈部肿瘤包括OSCC的主要化疗药物之一[8],Oxaliplatin是第3代铂类药物[9],目前临床广泛应用于治疗消化道肿瘤[14]。但Oxaliplatin对OSCC的作用效果和作用机制还不够明确。因此,本文作者通过研究不同浓度Oxaliplatin作用于OSCC CAL27细胞,观察其对细胞形态、增殖、周期和凋亡等的影响,探讨Oxaliplatin体外对CAL27细胞的潜在作用机制。
本研究结果显示:Oxaliplatin能明显改变细胞形态,使细胞失去紧密连接;同时,Oxaliplatin能明显抑制CAL27细胞增殖;通过调节CDK2和cyclin E的表达水平,诱导G0/G1期阻滞;通过下调survivin的表达及上调Bax的表达,最终诱导CAL27细胞发生凋亡。
肿瘤发生是一种细胞周期调控异常所导致的细胞增殖失控的现象,因此阻滞细胞周期通常是肿瘤治疗的重要手段之一[15]。已有研究[16]表明:Oxaliplatin在体内活化后,形成铂化的DNA化合物, 从而造成DNA损伤并抑制DNA的修复及合成,诱导细胞发生凋亡。许多化疗药物也是通过引起DNA损伤的方式,诱导细胞发生周期阻滞或凋亡,进而发挥抗肿瘤作用,如顺铂[17]、博莱霉素[18]和环磷酰胺[19]等。
本研究采用的Oxaliplatin是一种细胞周期非特异性化疗药,具有细胞种属特异性。ATALLAH等[20]研究发现:15 mg·L-1 Oxaliplatin联合热疗可诱导人卵巢癌IGROV-1细胞出现短暂的G2/M阻滞;而对于Caco-2和HT-292种结肠癌细胞,则出现G0/G1期细胞减少,G1/S阻滞。本研究结果显示:Oxaliplatin可诱导CAL27细胞发生G0/G1期阻滞,表明Oxaliplatin在不同细胞中所发挥的周期阻滞调控作用有所差异。在维持正常细胞周期调控中,细胞周期蛋白(cyclins)和细胞周期蛋白依赖性激酶(CDKS)间的相互作用起着重要的作用[21]。哺乳动物细胞由G1期转化到S期的调控主要包括cyclin E/CDK2以及cyclin D/CDK4的激活[22]。本研究结果显示:Oxaliplatin能下调CDK2与cyclin E的表达,该结果与G0/G1期细胞百分比增多而S期细胞百分比减少结果一致,表明在CAL27细胞中,Oxaliplatin能通过下调cyclin E及CDK2的表达调控细胞周期,抑制细胞增殖。
细胞凋亡是抗癌药物抑制癌细胞生长增殖的重要机制, 线粒体通路则是诱导凋亡发生的主要信号通路之一。Bcl-2家族蛋白通常是线粒体凋亡通路上的重要相关因子,抗凋亡蛋白及促凋亡蛋白通过调节线粒体膜的通透性来控制细胞的凋亡[23]。Bax是存在于线粒体外膜的一种促凋亡蛋白,Bax能有效促进细胞色素C的释放,刺激Caspase-9蛋白的水解,从而激活凋亡关键蛋白Caspase-3[24]。SHEN等[25]研究发现:细梗香草皂苷C(capilliposide C,CPS-C)能明显增强Oxaliplatin对人食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)细胞的敏感性,诱导细胞凋亡,Oxaliplatin联合CPS-C可明显提高Bax蛋白的表达。本研究结果显示:Oxaliplatin能上调Bax蛋白的表达,表明Oxaliplatin可能是通过激活线粒体通路诱导CAL27细胞凋亡。
此外,survivin是一种新型的抗凋亡蛋白,是重要的肿瘤相关抗原。已有研究[26]显示:在口腔相关癌前病变及OSCC中均发现高表达的survivin。因此,下调survivin能够增强肿瘤细胞对凋亡的敏感性。研究[27]显示:Oxaliplatin对survivin的抑制作用能够提高头颈部鳞癌对紫杉醇化疗的敏感性。KHAN等[28]发现高表达的survivin能抑制部分头颈部鳞癌细胞的凋亡,促进细胞对放疗产生抗性,而Oxaliplatin则能够通过下调survivin的表达,增敏放疗诱导的细胞毒性。本研究结果显示:随着Oxaliplatin浓度增加,survivin表达明显降低,且细胞凋亡率升高。
综上所述,Oxaliplatin能够引起人OSCC CAL27细胞形态的改变,抑制细胞增殖,通过下调CDK2与cyclin E的表达水平诱导细胞发生G0/G1期阻滞,并在一定程度上通过对Bax和survivin的调节诱导细胞凋亡,本研究结果将为临床应用Oxaliplatin治疗OSCC提供可行性和有效性依据。
| [1] |
OMURA K. Current status of oral cancer treatment strategies:surgical treatments for oral squamous cell carcinoma[J]. Int J Clin Oncol, 2014, 19(3): 423-430. DOI:10.1007/s10147-014-0689-z |
| [2] |
LU C C, YANG J S, YANG J H. Inhibition of invasion and migration by newly synthesized quinazolinone MJ-29 in human oral cancer CAL 27 cells through suppression of MMP-2/9 expression and combined down-regulation of MAPK and AKT signaling[J]. Anticancer Res, 2012, 32(7): 2895-2903. |
| [3] |
THOMSON P J. Perspectives on oral squamous cell carcinoma prevention-proliferation, position, progression and prediction[J]. J Oral Pathol Med, 2018, 47(9): 803-807. DOI:10.1111/jop.12733 |
| [4] |
MARKOPOULOS A K. Current aspects on oral squamous cell carcinoma[J]. Open Dent J, 2012, 6: 126-130. DOI:10.2174/1874210601206010126 |
| [5] |
ADELSTEIN D, GILLIISON M L, PFISTER D G, et al. NCCN Guideline Insights:Head and Neck Cancers, Version 2.2017[J]. J Nat Compr Canc Netw, 2017, 15(6): 761-770. DOI:10.6004/jnccn.2017.0101 |
| [6] |
MOUW K W, HARAF D J, STENSON K M, et al. Factors associated with long-term speech and swallowing outcomes after chemoradiotherapy for locoregionally advanced head and neck cancer[J]. Arch Otolaryngol Head Neck Surg, 2010, 136(12): 1226-1234. DOI:10.1001/archoto.2010.218 |
| [7] |
RU P, STEELE R, HSUEH E C, et al. Anti-miR-203 upregulates SOCS3 expression in breast cancer cells and enhances cisplatin chemosensitivity[J]. Genes Cancer, 2011, 2(7): 720-727. DOI:10.1177/1947601911425832 |
| [8] |
MATHEÉ G, KIDANI Y, SEGIGUCHI M, et al. Oxalato-platinum or 1-OHP, a third-generation platinum complex:an experimental and clinical appraisal and preliminary comparison with cis-platinum and carboplatinum[J]. Biomed Pharmacother, 1989, 43(4): 237-250. DOI:10.1016/0753-3322(89)90003-6 |
| [9] |
XU R, YIN J, ZHANG Y, et al. Annexin A3 depletion overcomes resistance to oxaliplatin in colorectal cancer via the MAPK signaling pathway[J]. J Cell Biochem, 2019, 120(9): 14585-14593. DOI:10.1002/jcb.28720 |
| [10] |
LI D, ZHANG B, HU C. Oxaliplatin inhibits proliferation and migration of human hepatocellular carcinoma cells via GAS7C and the N-WASP/FAK/F-actin pathway[J]. Acta Biochim Biophys Sin (Shanghai), 2017, 49(7): 581-587. DOI:10.1093/abbs/gmx046 |
| [11] |
DENG Y L, ZHANG J H, WANG Z L, et al. Antibiotic monensin synergizes with EGFR inhibitors and oxaliplatin to suppress the proliferation of human ovarian cancer cells[J]. Sci Rep, 2015, 5: 17523. DOI:10.1038/srep17523 |
| [12] |
王珍珍, 杜文治, 贾如, 等. 基于生物信息学分析SOX12在口腔鳞状细胞癌中的表达及验证[J]. 西安交通大学学报(医学版), 2020, 41(1): 64-68. |
| [13] |
杨春雪, 张圆, 汪园圆, 等. 肿瘤内神经新生在口腔鳞状细胞癌进展中的作用及机制[J]. 同济大学学报(医学版), 2019, 40(2): 162-168. |
| [14] |
ATTOUB S, ARAFAT K, KHALAF T, et al. Frondoside A enhances the anti-cancer effects of Oxaliplatin and 5-fluorouracil on colon cancer cells[J]. Nutrients, 2018, 10(5): E560. DOI:10.3390/nu10050560 |
| [15] |
LIN A B, MCNEELY S C, BECKMANN R P. Achieving precision death with cell cycle inhibitors that target DNA replication and repair[J]. Clin Cancer Res, 2017, 23(13): 3232-3240. DOI:10.1158/1078-0432.CCR-16-0083 |
| [16] |
PARK S B, LIN C S, KRISHNAN A V, et al. Dose effects of oxaliplatin on persistent and transient Na+ conductances and the development of neurotoxicity[J]. PLoS One, 2011, 6(4): e18469. DOI:10.1371/journal.pone.0018469 |
| [17] |
BERNO C R, RÓS BDE T, DA SILVERIRA I O, et al. 4-Aminoantipyrine reduces toxic and genotoxic effects of doxorubicin, cisplatin, and cyclophosphamide in male mice[J]. Mutat Res Genet Toxicol Environ Mutagen, 2016, 805: 19-24. DOI:10.1016/j.mrgentox.2016.05.009 |
| [18] |
HE Y L, LAN Y, LIU Y, et al. Pingyangmycin and bleomycin share the same cytotoxicity pathway[J]. Molecules, 2016, 21(7): E862. DOI:10.3390/molecules21070862 |
| [19] |
TUORKEY M J. Therapeutic potential of nigella sativa oil against cyclophosphamide-Induced DNA damage and hepatotoxicity[J]. Nutr Cancer, 2017, 69(3): 498-504. DOI:10.1080/01635581.2017.1285408 |
| [20] |
ATALLAH D, MARSAUD V, RADANYI C, et al. Thermal enhancement of oxaliplatin-induced inhibition of cell proliferation and cell cycle progression in human carcinoma cell lines[J]. Int J Hyperthermia, 2004, 20(4): 405-419. DOI:10.1080/02656730310001637325 |
| [21] |
LIM S, KALDIS P. Cdks, cyclins and CKIs:roles beyond cell cycle regulation[J]. Development, 2013, 140(15): 3079-3093. DOI:10.1242/dev.091744 |
| [22] |
LI X L, ZHANG Q H, FAN K, et al. Overexpression of TRPV3 correlates with tumor progression in non-small cell lung cancer[J]. Int J Mol Sci, 2016, 17(4): 437. DOI:10.3390/ijms17040437 |
| [23] |
PFEFFER C, SINGH A. Apoptosis:a target for anticancer therapy[J]. Int J Mol Sci, 2018, 19(2): 448. DOI:10.3390/ijms19020448 |
| [24] |
LIU Z Q, DING Y, YE N, et al. Direct activation of Bax protein for cancer therapy[J]. Med Res Rev, 2016, 36(2): 313-341. DOI:10.1002/med.21379 |
| [25] |
SHEN Z P, XU L X, LI J, et al. Capilliposide C sensitizes esophageal squamous carcinoma cells to oxaliplatin by inducing apoptosis through the PI3K/Akt/mTOR pathway[J]. Med Sci Monit, 2017, 23: 2096-2103. DOI:10.12659/MSM.901183 |
| [26] |
KHAN Z, TIWARI R P, MULHERKAR R, et al. Detection of survivin and p53 in human oral cancer:correlation with clinicopathologic findings[J]. Head Neck, 2009, 31(8): 1039-1048. DOI:10.1002/hed.21071 |
| [27] |
KHAN Z, KHAN N, VARMA A K, et al. Oxaliplatin-mediated inhibition of survivin increases sensitivity of head and neck squamous cell carcinoma cell lines to paclitaxel[J]. Curr Cancer Drug Targets, 2010, 10(7): 660-669. DOI:10.2174/156800910793605866 |
| [28] |
KHAN Z, KHAN N, TIWARI R P, et al. Down-regulation of survivin by oxaliplatin diminishes radioresistance of head and neck squamous carcinoma cells[J]. Radiother Oncol, 2010, 96(2): 267-273. DOI:10.1016/j.radonc.2010.06.005 |
 2020, Vol. 46
2020, Vol. 46


