扩展功能
文章信息
- 刘东慧, 付文亮, 付秀美, 宋成军, 陈志宏
- LIU Donghui, FU Wenliang, FU Xiumei, SONG Chengjun, CHEN Zhihong
- 丝胶对2型糖尿病大鼠肝脏胰岛素PI3K/Akt信号通路的调节作用及其机制
- Regulatory effect of sericin on liver insulin PI3K/Akt signaling pathway in rats of type 2 diabetes mellitus and its mechanism
- 吉林大学学报(医学版), 2020, 46(02): 228-232
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 228-232
- 10.13481/j.1671-587x.20200204
-
文章历史
- 收稿日期: 2019-01-16
2型糖尿病以胰岛素抵抗为主要特征,而胰岛素信号转导障碍是导致胰岛素抵抗的重要原因之一[1-2]。胰岛素与胰岛素受体(insulin receptor,IR)结合后主要通过磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/Akt)通路调节葡萄糖的摄取、糖原合成和降解,从而发挥降低血糖的作用[3-5]。目前临床用于糖尿病治疗的西药虽有较好的降糖效果,但不良反应较多,且不能有效改善胰岛素抵抗。因此,在天然药物中寻找一种安全有效的降糖药物十分必要。丝胶(蚕茧水提取物)是一种天然水溶性蛋白,民间有蚕茧泡水降血糖的验方,本课题组[4, 6-8]前期进行糖尿病的中医药防治研究时也发现:丝胶能有效降低2型糖尿病大鼠的血糖,并对肝脏、肾脏和胰腺等脏器具有保护作用,但具体降血糖机制尚不清楚。目前国内外对于丝胶的研究[9-10]主要集中在纺织、化妆品和生物材料等方面,在糖尿病治疗方面尚无相关研究报道。肝脏是胰岛素作用的重要靶器官之一,同时在调节糖脂代谢方面具有重要作用。因此,为深入了解丝胶降血糖的机制,本研究通过观察大鼠肝组织中IR、胰岛素受体底物1(insulin receptor substrate-1,IRS-1)、PI3K和Akt蛋白表达的变化来探讨丝胶是否通过影响肝脏胰岛素PI3K/Akt信号通路发挥降血糖的作用,以期为糖尿病的中医药防治提供新思路。
1 材料与方法 1.1 实验动物、主要试剂和仪器36只雄性SPF级SD大鼠,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2012-0001。链脲佐菌素(streptozotocin,STZ)(美国Sigma公司),临用前用柠檬酸钠-柠檬酸缓冲液(pH4.4)配制成2%的溶液;丝胶,将彩色蚕茧(承德医学院桑蚕所提供)经浸泡、煮沸、浓缩、透析等步骤后冻干至粉末所得,灌胃前用生理盐水溶解至相应浓度[11];浓缩型DAB显色试剂盒和生物素-链霉卵白素免疫组织化学检测试剂盒(北京中杉金桥生物技术有限公司);兔抗PI3K多克隆抗体(美国BD公司);兔抗IR单克隆抗体、Akt单克隆抗体和兔抗IRS-1多克隆抗体(美国Abcam公司);BCA法蛋白定量试剂盒(北京康为世纪生物科技有限公司);糖原染色液(珠海贝索生物技术有限公司)。Leica RM2235切片机(德国Leica公司),BH-2型Olympus显微镜和摄像装置(日本Olympus公司),DYY-7型转移电泳仪(北京市六一仪器厂)。
1.2 糖尿病动物模型的建立将SD大鼠高脂高糖饲料喂养4周后,连续2 d腹腔注射STZ,剂量为35 mg·kg-1·d-1,以STZ注射结束后72 h的空腹血糖≥11.1 mmol·L-1作为2型糖尿病大鼠模型的成模标准[12]。
1.3 实验动物分组和处理将36只大鼠随机分为正常组、模型组和实验组,每组12只。实验组和模型组大鼠在造模成功后分别给予2.4 g·kg-1·d-1的丝胶和等体积生理盐水连续灌胃35 d,正常组大鼠给予等体积生理盐水灌胃相同时间。用药结束,所有大鼠禁食12 h后麻醉、采集血液标本、断头处死、取肝组织进行相关检测。
1.4 各组大鼠血糖水平检测将所取血液标本3 000 r·min-1离心20 min后分离血清,采用葡萄糖氧化酶法检测各组大鼠血糖水平。
1.5 免疫组织化学法检测各组大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达肝组织固定、包埋后以厚度5 μm连续切片。将切片脱蜡、37℃、3% H2O2-甲醇孵育30 min、微波抗原修复后,加入一抗(浓度:IR 1:100、IRS-1 1:100、PI3K 1:100和Akt 1:200)4℃过夜(用PBS代替一抗作为阴性对照),二抗37℃孵育30 min,DAB染色,苏木精复染肝细胞核,阳性表现为细胞膜和(或)细胞质出现棕黄色和(或)棕褐色颗粒。定量分析:每只大鼠随机选取10张非连续切片,每张切片随机选取5个200倍视野,采用Image-ProPlus 6.0软件测定每个视野中阳性表达产物的积分光密度(integrated optical density, IOD)值,以IOD值作为目的蛋白表达水平。
1.6 Western blotting法检测各组大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达水平取100 mg液氮中保存的肝组织,提取总蛋白并测定浓度。取100 μg总蛋白上样,10%(IR、IRS-1和PI3K)或12%(Akt和β-actin)SDS-PAGE凝胶电泳,转膜,封闭后一抗(β-actin 1:1 000,IR 1:1 000,IRS-1 1:1 000,PI3K 1:500,Akt 1:1 000)、二抗(1:5 000)室温摇床分别孵育2.0和1.5 h,显影、扫描胶片后应用Quantity One-v4.6.2软件分析目的蛋白和β-actin条带的灰度值,以目的蛋白条带灰度值与β-actin条带灰度值的比值表示目的蛋白表达水平。
1.7 过碘酸-Schiff染色法检测各组大鼠肝糖原含量肝组织固定、包埋后以厚度5 μm连续切片。用淀粉酶处理过的肝切片作为阴性对照。切片脱蜡,高碘酸溶液氧化,雪夫试剂避光染色,苏木精复染细胞核,阳性表现为胞质中出现红色或紫红色颗粒。定量分析同免疫组织化学方法。
1.8 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组大鼠血糖,肝组织中IR、IRS-1、PI3K和Akt蛋白表达水平及肝糖原含量符合正态分布,均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠血糖水平正常组、模型组和实验组大鼠血糖水平分别为(10.83±2.03)、(29.45±4.82)和(13.20±4.09) mmol·L-1。模型组大鼠血糖水平明显高于正常组(P < 0.05),实验组大鼠血糖水平明显低于模型组(P < 0.05)。
2.2 各组大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达水平免疫组织化学法检测结果显示:各组大鼠肝组织中均可见IR、IRS-1、PI3K和Akt蛋白的表达,表现为棕黄色和(或)棕褐色颗粒,其中IR、IRS-1和Akt蛋白主要表达于肝细胞胞膜和胞质,PI3K蛋白主要表达于肝细胞胞质(图 1,见插页二)。免疫印迹法检测结果显示:在蛋白相对分子质量95000、131000、110000、56000和43000处可见清晰的IR、IRS-1、PI3K、Akt和β-actin条带。见图 2。
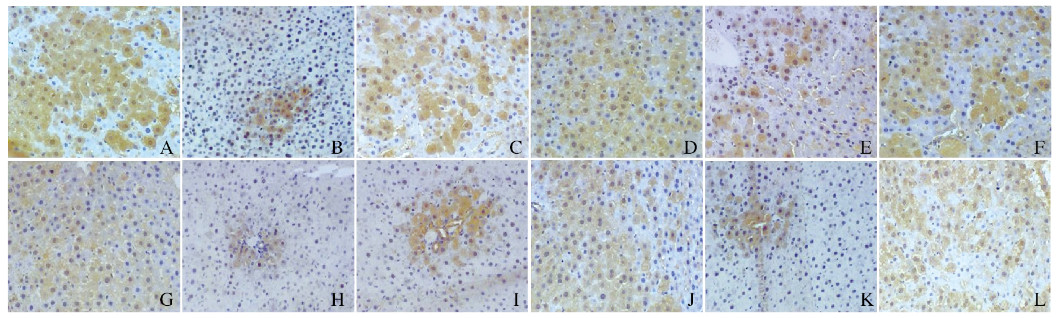
|
| A, D, G, J: Normal group; B, E, H, K: Model group; C, F, I, L: Experimental group. 图 1 各组大鼠肝组织中IR(A~C)、IRS-1(D~F)、PI3K(G~I)和Akt蛋白(J~L)的表达(免疫组织化学,×200) Fig. 1 Expressions of IR (A-C), IRS-1 (D-F), PI3K (G-I) and Akt(J-L) proteins in liver tissue of rats in various groups (Immunohistochemistry, ×200) |
|
|

|
| Lane 1:Normal group; Lane 2:Model group; Lane 3:Experimental group. 图 2 各组大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of IR, IRS-1, PI3K and Akt proteins in liver tissue of rats in various groups |
|
|
免疫组织化学法和免疫印迹法定量分析结果显示:模型组大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达水平明显低于正常组(P < 0.05);实验组大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达水平明显高于模型组(P < 0.05)。见表 1。
| (n=12, x±s) | |||||||||||||||||||||||||||||
| Group | Method | IR | IRS-1 | PI3K | Akt | ||||||||||||||||||||||||
| Normal | Immunohistochemical staining | 615.24±101.26 | 380.29±35.43 | 185.22±22.53 | 435.21±52.01 | ||||||||||||||||||||||||
| Western blotting | 1.00±0.09 | 1.04±0.04 | 0.73±0.03 | 0.84±0.10 | |||||||||||||||||||||||||
| Model | Immunohistochemical staining | 148.12±140.88* | 157.12±43.50* | 47.79±15.87* | 135.44±15.78* | ||||||||||||||||||||||||
| Western blotting | 0.64±0.06* | 0.80±0.03* | 0.32±0.01* | 0.47±0.06* | |||||||||||||||||||||||||
| Experimental | Immunohistochemical staining | 332.12±22.04△ | 359.37±58.99△ | 163.01±11.61△ | 381.56±27.12△ | ||||||||||||||||||||||||
| Western blotting | 0.89±0.09△ | 0.95±0.03△ | 0.60±0.03△ | 0.79±0.11△ | |||||||||||||||||||||||||
| *P < 0.05 compared with normal group; △ P < 0.05 compared with model group. | |||||||||||||||||||||||||||||
各组大鼠肝组织切片均可见胞质中出现红色或紫红色颗粒。其中模型组大鼠肝组织中肝糖原含量(105.11±13.20)明显低于正常组(465.45±23.40)(P < 0.05),而实验组大鼠肝组织中肝糖原含量(380.76±12.10)明显高于模型组(P < 0.05)。见图 3(插页二)。
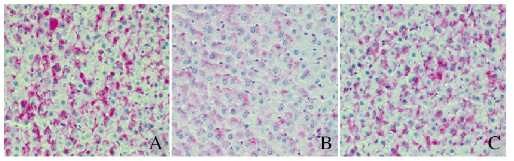
|
| A: Normal group; B:Model group; C: Experimental group. 图 3 各组大鼠肝组织中肝糖原的表达(过碘酸-Schiff,×200) Fig. 3 Expressions of liver glucogen in liver tissue of rats in various groups (Periodic acid-Schiff, ×200) |
|
|
肝脏是胰岛素作用的重要靶器官之一,其在调节糖类代谢方面具有重要的作用。胰岛素与肝细胞膜上的IR结合后激活胰岛素受体底物(insulin receptor substrate,IRS),活化的IRS与PI3K调节亚基p85结合,进一步活化催化亚基p110从而激活PI3K,PI3K产生的第二信使磷脂酰肌醇3磷酸(phosphatidylinositol-3, 4, 5-triphosphate, PIP3)能促进下游Akt的活化[13-14]。Akt活化后可通过促进葡萄糖转运蛋白囊泡向细胞膜转运,进而将胞外的葡萄糖转运至胞内[15-16],还可促进糖原合成酶激酶3(glycogen synthase kinase3,GSK3)介导糖原合成[17-18],同时还能使转录因子-过氧化物酶刺激因子受体协作子α磷酸化而抑制肝细胞糖异生[19],从而起到调节血糖的作用。因此,在肝调节糖类代谢的过程中,胰岛素PI3K/Akt信号通路具有十分重要的作用。
本研究结果显示:模型组大鼠肝组织中IR蛋白表达水平低于正常组,与钱俊文等[20]的胰岛素抵抗机制实验研究结果一致,即IR在肝脏胰岛素PI3K/Akt信号通路中起着十分重要的作用,其表达水平降低或基因突变均可导致肝细胞膜表面IR数目减少,从而降低胰岛素敏感性而引发胰岛素抵抗。同时本研究结果显示:PI3K/Akt信号通路中下游关键因子IRS-1、PI3K和Akt的变化趋势与IR相同。而对实验组大鼠进行丝胶蛋白灌胃治疗后发现:大鼠肝组织中IR、IRS-1、PI3K和Akt蛋白表达水平及肝糖原含量均明显升高,提示丝胶可通过提高IR表达水平引发IRS-1酪氨酸磷酸化水平升高,进而刺激下游PI3K和Akt的活化。Akt活化水平升高后,一方面可通过影响囊泡中葡萄糖转运蛋白的作用加速对葡萄糖的转运;另一方面还可促进GSK3介导的肝糖原合成,使大鼠肝糖原含量明显升高;同时还可通过促进转录因子-过氧化物酶刺激因子受体协作子α磷酸化来增强对糖异生的抑制作用。因此,上述3个方面通过增加葡萄糖的利用效率、减少葡萄糖的来源使得实验组大鼠血糖水平明显降低。
综上所述,在高血糖状态下,肝脏胰岛素PI3K/Akt信号通路中相关因子表达水平下降影响了胰岛素正常生理作用的发挥,而丝胶蛋白可通过上调肝组织中IR、IRS-1、PI3K和Akt等关键因子的表达来增强肝脏胰岛素PI3K/Akt信号通路的转导效应,进而影响葡萄糖的来源和利用效率而起到降低血糖的效果,这可能是丝胶蛋白降低血糖的作用机制之一。
| [1] |
高啸, 彭旖旎, 朱琳, 等. 硫化氢对2型糖尿病大鼠肝脏胰岛素抵抗的影响[J]. 华中科技大学学报(医学版), 2016, 45(5): 490-495. DOI:10.3870/j.issn.1672-0741.2016.05.003 |
| [2] |
金美英, 朴春丽, 赵宗江, 等. 2型糖尿病ZDF大鼠模型的最佳成模时间及解毒通络调肝方的干预作用[J]. 中国老年学杂志, 2018, 38(1): 3-6. DOI:10.3969/j.issn.1005-9202.2018.01.002 |
| [3] |
戴悦萱, 李月春, 梁芙茹. PI3K/AKT/GSK3β通路影响糖代谢与认知过程的研究进展[J]. 中西医结合心血管病电子杂志, 2018, 6(6): 28-29. DOI:10.3969/j.issn.2095-6681.2018.06.018 |
| [4] |
刘美晓, 孙一婵, 侯丽娜, 等. 丝胶对2型糖尿病大鼠胰腺胰岛素PI3K-Akt信号通路的调节作用[J]. 解剖学报, 2016, 47(6): 807-811. |
| [5] |
李斌, 范源, 李鑫. 基于PI3K/Akt信号通路的中药治疗2型糖尿病胰岛素抵抗研究进展[J]. 中成药, 2017, 39(1): 151-154. DOI:10.3969/j.issn.1001-1528.2017.01.030 |
| [6] |
付秀美, 钟美蓉, 付文亮, 等. 丝胶对2型糖尿病大鼠血糖和血脂的影响[J]. 中国老年学杂志, 2011, 31(1): 103-105. DOI:10.3969/j.issn.1005-9202.2011.01.044 |
| [7] |
张艳, 王福, 乔志燕, 等. 丝胶对2型糖尿病大鼠肝糖原含量的影响[J]. 承德医学院学报, 2013, 30(5): 365-367. DOI:10.3969/j.issn.1004-6879.2013.05.002 |
| [8] |
宋成军, 郝祥俊, 陈志宏. 丝胶对糖尿病肾病大鼠肾功能和肾脏TIMP-1表达的影响[J]. 中国老年学杂志, 2010, 30(15): 2157-2159. DOI:10.3969/j.issn.1005-9202.2010.15.032 |
| [9] |
马艳, 李智, 冉瑞龙. 蚕丝在生物医用材料领域的应用研究[J]. 材料导报, 2018, 32(1): 86-92. |
| [10] |
杨祖凤, 余卫华, 杨晓瑜, 等. 丝胶的特性及其应用[J]. 纺织科技进展, 2016(6): 12-14, 17. DOI:10.3969/j.issn.1673-0356.2016.06.004 |
| [11] |
刘美晓.丝胶对STZ致损伤INS-1细胞胰岛素胰岛素PI3K/Akt信号通路介导细胞凋亡的抑制作用[D].承德: 承德医学院, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10093-1017821062.htm
|
| [12] |
GAO Y F, ZHANG M N, WU T C, et al. Effects of D-pinitol on insulin resistance through the PI3K/Akt signaling pathway in type 2 diabetes mellitus Rats[J]. J Agric Food Chem, 2015, 63(26): 6019-6026. DOI:10.1021/acs.jafc.5b01238 |
| [13] |
RASHID M, KARIM S, ALI B, et al. PI3K signaling pathway targeting by using different molecular approaches to treat cancer[J]. J Chin Pharmaceut Sci, 2017, 26(9): 621-634. |
| [14] |
莫育霞, 廖化梅, 周燕. 妊娠期糖尿病与脂肪因子参与的胰岛素抵抗的相关性研究进展[J]. 现代医药卫生, 2017, 33(18): 2810-2812. DOI:10.3969/j.issn.1009-5519.2017.18.024 |
| [15] |
黎宇, 罗新新, 严奉东, 等. 葛根上调肝胰岛素抵抗HepG2细胞OB-R, IRS2, GLUT1和GLUT2蛋白调节糖代谢的研究[J]. 中国中药杂志, 2017, 42(10): 1939-1944. |
| [16] |
HU X, WANG S, XU J, et al. Triterpenoid saponins from Stauntonia chinensis ameliorate insulin resistance via the AMP-activated protein kinase and IR/IRS-1/PI3K/Akt pathways in insulin-resistant HepG2 cells[J]. Int J Mol Sci, 2014, 15(6): 10446-10458. DOI:10.3390/ijms150610446 |
| [17] |
WANG X, ZHAO L H. Calycosin ameliorates diabetes-induced cognitive impairments in rats by reducing oxidative stress via the PI3K/Akt/GSK-3β signaling pathway[J]. Biochem Biophys Res Commun, 2016, 473(2): 428-434. DOI:10.1016/j.bbrc.2016.03.024 |
| [18] |
ZHOU L, WANG L L, YANG B, et al. Protective effect of pretreatment with propofol against tumor necrosis factor-α-induced hepatic insulin resistance[J]. Exp Ther Med, 2015, 10(1): 289-294. DOI:10.3892/etm.2015.2496 |
| [19] |
BROZINICK J T Jr, ROBERTS B R, DOHM G L. Defective signaling through Akt-2 and-3 but not Akt-1 in insulin-resistant human skeletal muscle:potential role in insulin resistance[J]. Diabetes, 2003, 52(4): 935-941. DOI:10.2337/diabetes.52.4.935 |
| [20] |
钱俊文, 柴可夫. 加减抵当汤对胰岛素抵抗大鼠肝脏胰岛素受体基因表达的影响[J]. 浙江中医药大学学报, 2007, 31(3): 295-298. DOI:10.3969/j.issn.1005-5509.2007.03.020 |
 2020, Vol. 46
2020, Vol. 46


