扩展功能
文章信息
- 邓悦宁, 周达岸, 马贤德, 陈丹, 石丹, 姜亚男
- DENG Yuening, ZHOU Daan, MA Xiande, CHEN Dan, SHI Dan, JIANG Yanan
- 电针对T10脊髓横断后神经源性膀胱大鼠尿流动力学及Wnt/β-catenin信号通路的影响
- Effects of electro-acupuncture on urodynamics and Wnt/β-catenin signaling pathway in rats with neurogenic bladder after T10 spinal cord transection
- 吉林大学学报(医学版), 2020, 46(02): 221-227
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 221-227
- 10.13481/j.1671-587x.20200203
-
文章历史
- 收稿日期: 2019-05-06
2. 辽宁中医药大学教学实验中心, 辽宁 沈阳 110000
2. Teaching Experiment Center, Liaoning University of Traditional Chinese Medicine, Shenyang 110000, China
神经源性膀胱是完全性脊髓损伤患者最常见和最严重的并发症之一,其发病率呈逐年增长趋势。按照损伤平面的不同,脊髓损伤可分为骶髓损伤和骶上脊髓损伤(suprasacral cord injury, SSCI),其中SSCI患者占80%以上。完全性SSCI后出现神经源性膀胱的原因是骶髓排尿中枢失去了脑桥排尿中枢的正常抑制,导致膀胱逼尿肌出现无抑制性的反复收缩,也是诱发上尿路损害及肾脏衰竭等泌尿系统并发症的主要原因,严重者危及生命,最终成为完全性SSCI患者晚期死亡的首位原因[1-4]。针刺治疗SSCI由来已久,其临床治疗作用较好[5-6]。电针治疗是在传统针刺的基础上,进行配伍穴位间连接电针仪正负电极,以适宜强度刺激穴位达到治病作用的一种疗法[7-8]。电针对脊髓损伤后神经源性膀胱的疗效尤为显著[9-11]。
Wnt/β-catenin信号通路是哺乳动物神经干细胞发育的关键信号通路之一[12],该信号通路在神经损伤过程中发挥调控细胞增殖和损伤修复的作用[13]。基于上述研究,本研究采用T10脊髓横断(spinal cord transection, SCT)后神经源性膀胱模型大鼠为研究对象,以电针“大椎”和“次髎”穴为干预手段,通过检测各组大鼠尿流动力学和脊髓组织中Wnt-1和β-catenin mRNA及蛋白表达水平,探讨电针“大椎”和“次髎”穴对T10 SCT后神经源性膀胱的治疗作用及其机制,为中国传统医学治疗神经源性膀胱提供理论支持。
1 材料与方法 1.1 实验动物、主要试剂和仪器48只SPF级SD雌性大鼠,体质量180~220 g,由辽宁长生生物技术有限公司提供,动物许可证号:SCXK(辽)2016-0001,实验动物购入后,适应性饲养1周。抗Wnt-1(ab85060)、抗β-catenin(ab32572)和抗β-actin(ab8227)抗体(美国Abcam公司),二抗(北京中杉金桥生物技术有限公司),PCR试剂盒(日本TaKaRa公司),水合氯醛(国药集团化学试剂沈阳有限公司)。电泳仪(DYY-6C型,北京六一仪器设备厂),凝胶成像分析系统(4200SF型,中国天能公司),数码显微镜(DM2000型,德国徕卡公司),PCR仪(Bio-Rad型,美国伯乐公司),16通道生物机能实验系统(BL-420S型,成都泰盟科技有限公司),电针治疗仪(SDZ-Ⅲ型)和华佗牌针灸针(苏州医疗用品厂有限公司)。
1.2 实验分组和模型复制方法SPF级SD雌性大鼠48只,随机分为假手术组(12只)和模型组(36只)。采用手术方式建立T10 SCT模型。采用1%戊巴比妥钠(40mg·kg-1)腹腔注射麻醉,大鼠俯卧位固定于手术台上,背部脊柱胸椎下段备皮,碘伏消毒,根据解剖定位T10椎体棘突,以其为中心沿背侧正中线切开皮肤,切口长约2 cm,然后向下逐层分离皮下组织,沿椎板切开竖脊肌并向左右钝性分离,用拉钩左右拉开肌肉组织,暴露T9、T11胸椎的棘突和椎板。用手术刀切开T9-T10棘间韧带,咬骨钳自T9-T10椎板间隙紧贴椎板平行脊髓进钳,轻轻咬除椎板,直至咬除整个T10椎板及两侧的关节突。咬骨过程中保护脊髓硬脊膜、血管和神经根。以手术刀柄佩戴尖刀片,于暴露的脊髓上缘横向切断脊髓,反复切割3~5次,以确保完全离断。此时可见大鼠双下肢抽搐,尾巴甩动并松驰,提示脊髓完全横断。然后,用弯的眼科镊轻轻挑起脊髓断端,并从断端处用显微外科剪刀剪断并取出1~2mm长的脊髓组织,确保脊髓完全离断。取出后,脊髓发生内缩,形成1个空洞,用明胶海绵充分止血,并填充空洞,逐层缝合肌肉、皮下组织及皮肤。假手术组仅暴露T9~T11,并用咬骨钳去除T10棘突,然后逐层缝合。模型组采用脊髓损伤行为学(Basso Beattie Bresnahan, BBB)评分和尿流动力学对术后大鼠进行模型评价,造模成功的大鼠再次随机分为模型对照组、电针组和电针对照组。
1.3 模型评价术后大鼠完全苏醒后,对各组大鼠脊髓横断情况采用BBB评分法进行评价[14]。评分标准由0~21分组成,0分为无可见双后肢运动,分数逐渐递增,双后肢运动功能逐渐改善,21分为持续状态的掌面移动、协调步态、足趾抓地、躯干稳定、尾巴翘起,活动过程中身体与主动爪位置始终处于平行状态。由3人采用单盲法对评价结果分别进行记录并整理分析。大鼠T10 SCT后双后肢呈拖动前行状态,无任何运动,计为0分,表明大鼠脊髓横断模型复制成功。术后大鼠正常饲养,模型组大鼠每日手法排尿,记录尿量。连续2周后,大鼠排尿量稳定,第15天测定各组大鼠的尿流动力学指标,评估T10 SCT后神经源性膀胱大鼠的造模情况。
1.4 各组大鼠干预措施大鼠正常饲养至第15天,将T10 SCT后神经源性膀胱大鼠模型复制成功后再次随机分为模型对照组、电针组和电针对照组。
假手术组:再次分组后不做处理,正常饲养1周;模型对照组:再次分组后不做处理,正常饲养1周;电针组:以0.3mm×25.0mm毫针直刺,连接电针仪,正极连接“大椎”穴,负极连接“次髎”穴,电针仪参数设定为疏密波,10/50Hz(疏波10Hz/9s,密波50Hz/5s),留针20 min,强度以针刺处出现规律性收缩抽动为宜,每日1次,连续1周。参照《实验针灸学》大鼠穴位图谱,准确定位。“大椎”穴:背部正中第7颈椎和第1胸椎间,直刺5 mm。“次髎”穴:第2、3骶骨的棘突间隙正中偏上旁开5~10 mm(左右隔日交替进行),直刺5~12 mm;电针对照组:针刺点分别选取以“大椎”和“次髎”穴为中心旁开1 cm处(远脊柱侧)针刺,电针仪参数同上,留针20 min,每日1次,连续1周。
1.5 尿流动力学检测末次电针干预完成后1h,各组大鼠以1%戊巴比妥钠腹腔注射麻醉(40 mg·kg-1),麻醉后手法按压大鼠下腹部进行辅助排尿,排空膀胱后将大鼠仰卧位固定在手术台上,导管经三通管连接测压通道及微量灌注泵,排空管腔气体,导管润滑经尿道插入膀胱并固定,此时压力值为膀胱基础压力(cmH2O),随后以7.5 mL·h-1的速度进行温生理盐水灌注,观察随膀胱灌注量增加其膀胱压力的变化。尿道口有液体流出时,即膀胱漏尿点压力(cmH2O)和膀胱最大容量(mL)。漏尿后继续灌注至逼尿肌压力稳定,取压力峰值为膀胱最大压力(cmH2O),计算得出膀胱顺应性(mL·cm-1H2O)。膀胱顺应性=膀胱最大容量/(膀胱最大压力-膀胱基础压力)。
1.6 脊髓组织中Wnt-1和β-catenin mRNA表达水平检测末次电针干预后行尿流动力学,检测完成后,于各组大鼠中随机抽取6只,颈椎脱位处死大鼠,于SCT处,向下截取脊髓残端5 mm,置于1.5 mL冻存管中,冻存于-80℃冰箱中,用于Wnt-1和β-catenin mRNA表达水平检测。
采用RT-PCR法检测各组大鼠脊髓组织中Wnt-1和β-catenin mRNA表达水平。Trizol裂解法提取脊髓组织中总RNA,采用反转录试剂盒,将RNA逆转录为cDNA,然后再以Wnt-1和β-catenin扩增引物为模板,进行PCR扩增,扩增产物在琼脂糖凝胶中进行水平电泳,凝胶成像分析系统中采集电泳图像,并测定目的基因和内参基因扩增产物条带的积分光密度(integrated optical density, IOD)值,以Wnt-1和β-catenin条带与β-actin条带灰度值比值表示Wnt-1和β-catenin mRNA表达水平。引物序列见表 1。
| Primer | Sequence (5′-3′) | Production size(bp) |
| Wnt-1 | TGCTGTCCCTGTGGTATTGT ACAGCTTTCCTTGCCCTTTC |
170 |
| β-catenin | GACCACAAGCAGAGTGCTGA ACTCGGGTCTGTCAGGTGAG |
109 |
| β-actin | GCAGGAGTACGATGAGTCCG ACGCAGCTCAGTAACAGTCC |
217 |
末次电针干预后行尿流动力学,检测完成后,于各组大鼠中随机抽取6只,颈椎脱位处死大鼠,于SCT处,向上截取脊髓残端5 mm,浸泡于4%多聚甲醛溶液中,常温固定24 h以上,用于免疫荧光法检测Wnt-1和β-catenin蛋白表达。
常规制备石蜡切片,切片厚度为8 μm,采用免疫荧光法检测脊髓组织中Wnt-1和β-catenin蛋白表达水平。石蜡切片经二甲苯和梯度乙醇脱蜡至水,抗原修复后,5% BSA封闭1h后,滴加一抗工作液(1:300),4℃冰箱中孵育过夜,次日洗片3次后,滴加FITC标记的二抗工作液(1:500),37℃孵育1 h,洗片3次,滴加DAPI染核10 min,洗片3次,防荧光淬灭封片剂封片,荧光显微镜下观察Wnt-1和β-catenin蛋白阳性表达情况。随机选取5个视野,计数每个视野中的阳性表达细胞数,以其平均数作为Wnt-1和β-catenin蛋白表达水平。
1.8 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组大鼠BBB评分、电针干预后尿流动力学指标、大鼠脊髓组织中Wnt-1和β-catenin mRNA及蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,两组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠一般情况术前48只大鼠经过适应性饲养后,活动度正常,毛色洁白富有光泽。术后,假手术组大鼠活动度减少,饮水量减少,其余未见异常;模型组大鼠双下肢基本无活动,当天未出现死亡情况,次日死亡2只,每日手法排尿,至术后第14天,共计死亡9只,剩余27只。模型评价后将造模组随机分为模型对照组、电针组和电针对照组,每组9只。至实验结束时,模型对照组剩余6只,电针组剩余8只,电针对照组剩余7只。假手术组大鼠基本恢复正常,无行动和排尿障碍出现。电针组大鼠活动度和饮水量等明显多于模型对照组和电针对照组。
2.2 2组大鼠BBB评分与假手术组(21.000±0.000)比较,模型组大鼠BBB评分(0.417±0.692)明显降低(P < 0.01),证明大鼠SCT模型复制成功。
2.3 2组大鼠尿流动力学指标水平与假手术组比较,模型组大鼠膀胱基础压力、最大压力和漏尿点压力均明显升高(P < 0.01),大鼠膀胱最大容量和顺应性明显降低(P < 0.01),证明SCT后神经源性膀胱大鼠模型复制成功。见表 2。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | Bladder base pressure(cmH2O) | Bladder max pressure(cmH2O) | Bladder leakage point pressure(cmH2O) | Bladder max capacity(V/mL) | Bladder compliance (mL·cm-1H2O) | |||||||||||||||||||||||
| Sham operation | 12 | 19.800±1.914 | 38.025±2.718 | 37.325±2.897 | 5.100±1.421 | 0.292±0.062 | |||||||||||||||||||||||
| Model | 27 | 36.907±2.472* | 60.344±2.967* | 53.815±2.721* | 0.701±0.164* | 0.044±0.016* | |||||||||||||||||||||||
| * P < 0.01 compared with sham operation group. | |||||||||||||||||||||||||||||
与假手术组比较,模型对照组、电针对照组和电针组大鼠膀胱基础压力和最大压力升高(P < 0.05或P < 0.01),膀胱最大容量和顺应性明显降低(P < 0.01);模型对照组和电针对照组大鼠膀胱漏尿点压力升高(P < 0.01)。与模型对照组比较,电针组大鼠膀胱基础压力、最大压力和漏尿点压力明显降低(P < 0.01),膀胱最大容量和顺应性升高(P < 0.01)。与电针对照组比较,电针组大鼠膀胱基础压力、最大压力和漏尿点压力降低(P < 0.05或P < 0.01),膀胱最大容量和顺应性升高(P < 0.05或P < 0.01)。见表 3。
| (n=6, x±s) | |||||||||||||||||||||||||||||
| Group | Bladder base pressure(cmH2O) | Bladder max pressure(cmH2O) | Bladder leakage point pressure(cmH2O) | Bladder max capacity(V/mL) | Bladder compliance (mL·cm-1H2O) | ||||||||||||||||||||||||
| Sham operation | 19.833±3.084 | 37.967±2.819 | 36.633±6.534 | 4.800±1.367 | 0.316±0.153 | ||||||||||||||||||||||||
| Model control | 35.850±4.756** | 58.883±6.030** | 52.817±6.703** | 0.593±0.185** | 0.043±0.030** | ||||||||||||||||||||||||
| Electro-acupuncture control | 33.883±5.622** | 53.067±5.183** | 50.033±7.784** | 0.653±0.195** | 0.050±0.023** | ||||||||||||||||||||||||
| Electro-acupuncture | 26.400±3.166*△## | 44.267±5.655*△## | 40.333±7.557△# | 1.832±0.271**△## | 0.162±0.074**△# | ||||||||||||||||||||||||
| *P < 0.05, ** P < 0.01 compared with sham operation group; △ P < 0.01 compared with model control group; # P < 0.05, ## P < 0.01 compared with electro-acupuncture control group. | |||||||||||||||||||||||||||||
与假手术组比较,模型对照组、电针组和电针对照组大鼠脊髓组织中Wnt-1和β-catenin mRNA表达水平明显升高(P < 0.01)。与模型对照组比较,电针组大鼠脊髓组织中Wnt-1和β-catenin mRNA表达水平明显升高(P < 0.01);与电针对照组比较,电针组大鼠脊髓组织中Wnt-1和β-catenin mRNA表达水平明显升高(P < 0.01)。见图 1和表 4。
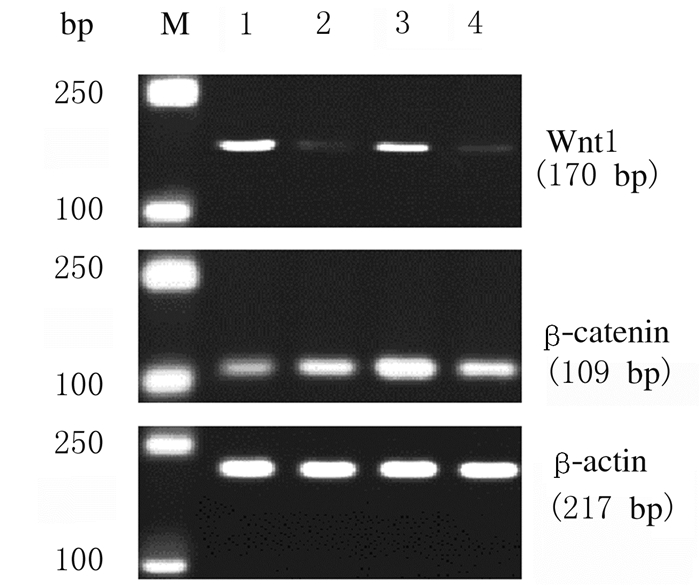
|
| M:250 bp marker; Lane 1:Sham operation group; Lane 2:Model control group; Lane 3:Electro-acupuncture group; Lane 4:Electro-acupuncture control group. 图 1 各组大鼠脊髓组织Wnt-1和β-catenin mRNA表达电泳图 Fig. 1 Electrophoregram of expressions of Wnt-1 and β-catenin mRNA in spinal cord tissue of rats in various groups |
|
|
| (n=6, x±s) | |||||||||||||||||||||||||||||
| Group | Wnt-1 mRNA | β-catenin mRNA | |||||||||||||||||||||||||||
| Sham operation | 0.210±0.033 | 0.222±0.034 | |||||||||||||||||||||||||||
| Model control | 0.323±0.037* | 0.346±0.069* | |||||||||||||||||||||||||||
| Electro-acupuncture control | 0.349±0.063* | 0.328±0.059* | |||||||||||||||||||||||||||
| Electro-acupuncture | 0.491±0.092*△# | 0.469±0.048*△# | |||||||||||||||||||||||||||
| *P < 0.01 compared with sham operation group; △ P < 0.01 compared with model control group; # P < 0.01 compared with electro-acupuncture control group. | |||||||||||||||||||||||||||||
与假手术组比较,模型对照组、电针对照组和电针组大鼠脊髓组织中Wnt-1和β-catenin蛋白表达水平明显升高(P < 0.01)。与模型对照组比较,电针组大鼠脊髓组织中Wnt-1和β-catenin蛋白表达水平明显升高(P < 0.01);与电针对照组比较,电针组大鼠脊髓组织中Wnt-1和β-catenin蛋白表达水平明显升高(P < 0.01)。见表 5、图 2(插页一)和图 3(插页一)。
| (n=6, x±s) | |||||||||||||||||||||||||||||
| Group | Wnt-1 protein | β-catenin protein | |||||||||||||||||||||||||||
| Sham operation | 14.667±3.327 | 15.667±3.141 | |||||||||||||||||||||||||||
| Model control | 24.333±3.077* | 24.667±2.944* | |||||||||||||||||||||||||||
| Electro-acupuncture control | 24.000±2.449* | 25.667±2.066* | |||||||||||||||||||||||||||
| Electro-acupuncture | 40.000±6.066*△# | 44.500±6.348*△# | |||||||||||||||||||||||||||
| *P < 0.01 compared with sham operation group; △ P < 0.01 compared with model control group; # P < 0.01 compared with electro-acupuncture control group. | |||||||||||||||||||||||||||||
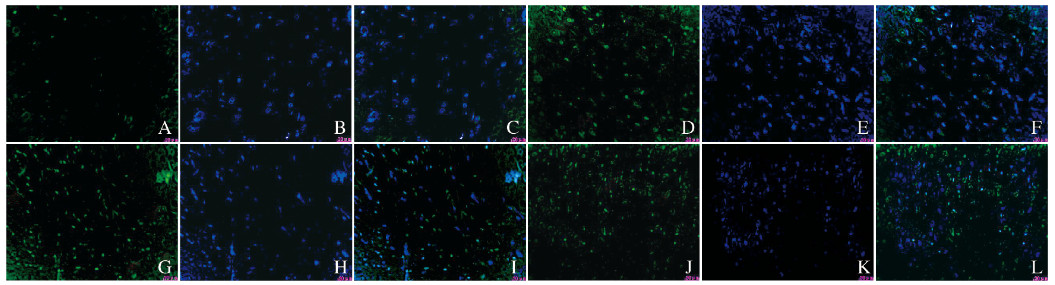
|
| A-C:Sham operation group; D-F:Model control group; G-I:Electro-acupuncture group; J-L:Electro-acupuncture control group; A, D, G, J:FITC staining; B, E, H, K:DAPI staining; C, F, I, L:Merge. 图 2 各组大鼠脊髓组织中Wnt-1蛋白表达情况(免疫荧光, ×400) Fig. 2 Expressions of Wnt-1 protein in spinal cord tissue of rats in various groups(Immunofluoresence, ×400) |
|
|
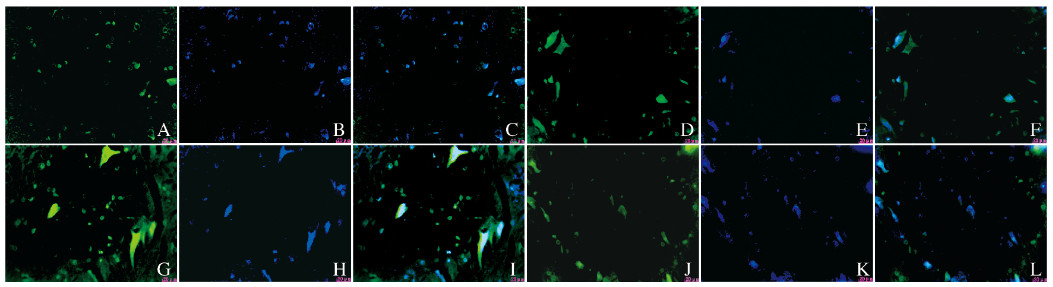
|
| A-C:Sham operation group; D-F:Model control group; G-I:Electro-acupuncture group; J-L:Electro-acupuncture control group; A, D, G, J:FITC staining; B, E, H, K:DAPI staining; C, F, I, L:Merge. 图 3 各组大鼠脊髓组织中β-catenin蛋白表达情况(免疫荧光, ×400) Fig. 3 Expressions of β-catenin protein in spinal cord tissue of rats in various groups (Immunofluoresence, ×400) |
|
|
电针治疗脊髓损伤后神经源性膀胱的疗效明确[15-16]。但以往治疗中取穴繁多,形成多条电流刺激作用在模型大鼠体内。本实验选取“大椎”和“次髎”两穴,从西医讲,完全性SSCI后神经源性膀胱是低级排尿中枢失去了高级排尿中枢的抑制,形成“高压、低容量、低顺应性”膀胱,逼尿肌反射亢进[17]。“大椎”穴位于脊髓上端,电流从该穴向下传导,作用在脊髓损伤处,促进神经功能恢复,改善低级排尿中枢的失控状态[18]。“次髎”穴位于第2骶后孔处,其内有骶神经通过,电针该穴可调节逼尿肌的协调运动,改善模型大鼠的排尿功能[19];从中医讲,脊髓损伤病在督脉,致肾阳亏虚,膀胱气化失司,出现“遗溺”等症状。电针“大椎”和“次髎”穴,可使经络通利,阳气温煦,恢复膀胱气化功能。由此确定主要治疗穴位点,并采用尿流动力学进行检测。
实验大鼠T10 SCT后,模型组大鼠BBB评分平均为0.417分,明显低于假手术组,无可见大鼠双后肢运动,证明SCT模型制备成功;在此基础上,模型组术后第15天经尿流动力学检测形成高容量、低顺应性神经源性膀胱(逼尿肌反射亢进)模型大鼠。电针干预后模型大鼠膀胱基础压力、最大压力和漏尿点压力均较模型对照组明显降低,膀胱最大容量和顺应性明显升高,结果证明电针干预SCT后神经源性膀胱模型大鼠,其尿流动力学检测指标明显改善,形成“低压储尿”膀胱,有效改善了T10 SCT后神经源性膀胱大鼠的排尿功能。为了探讨可能的作用机制,对各组大鼠脊髓组织中Wnt-1和β-catenin mRNA及蛋白的表达水平进行了检测。
Wnt信号转导通路在神经损伤过程中发挥着重要的调控细胞增殖和损伤修复的作用[20]。目前研究较多的是有β-catenin参与的经典Wnt信号通路[21-22]。Wnt-1是经典通路的配体,在神经发生的过程中起到非常重要的作用[23]。Wnt-1配体与细胞膜受体结合后,β-catenin能够在胞内短暂集聚并移至核内,具有促进受损组织细胞修复的功能[24]。本实验中,模型对照组大鼠脊髓组织中Wnt-1和β-catenin mRNA表达水平明显高于假手术组,表明SCT后Wnt-1/β-catenin信号通路被激活,此结果与其他研究者[25]的研究结果一致。电针组大鼠脊髓组织中Wnt-1和β-catenin mRNA表达水平明显高于模型对照组,表明电针“大椎”穴和“次髎”穴可强化Wnt-1/β-catenin信号通路的活化作用,进一步促进神经干细胞的增殖和分化,增强脊髓组织修复作用[26],恢复脑干排尿中枢对骶髓排尿中枢的控制作用,从而改善SCT后神经源性膀胱大鼠的排尿功能。
内脏运动神经纤维成分包括交感神经和副交感神经2种,两者作用相互拮抗。膀胱逼尿肌亢进是由于SCT后副交感神经刺激增加和(或)交感神经刺激减少所致。胸髓中间外侧核为交感神经低级中枢,本实验选取T10脊髓组织检测目标蛋白。分析尿流动力学结果显示交感神经为兴奋表现。免疫荧光检测结果显示:Wnt-1表达于细胞膜及细胞浆,β-catenin表达于细胞核,阳性表达细胞的形态可能是交感神经细胞,由此推测Wnt-1和β-catenin表达与交感神经的兴奋可能具有一定的相关性。本研究结果显示:假手术组偶见Wnt-1和β-catenin弱阳性表达细胞,模型对照组和电针对照组可见少量Wnt-1及β-catenin阳性表达细胞,电针组Wnt-1和β-catenin阳性表达细胞明显增多。提示SCT后,机体应激性上调Wnt-1和β-catenin的表达,以拮抗膀胱副交感神经兴奋而导致膀胱逼尿肌亢进;电针能够明显上调Wnt-1和β-catenin蛋白的表达水平,提示电针的作用机制与该作用密切相关。
综上所述,电针的作用机制可能与其上调Wnt-1和β-catenin蛋白在交感运动神经细胞的表达、增加交感神经的兴奋密切相关,进一步活化Wnt-1/β-catenin信号通路,促进神经干细胞的增殖和分化,发挥调控逼尿肌收缩功能,从而改善神经源性膀胱的临床症状。
| [1] |
ZAMLI A H, RATNALINGAM K, YUSMIDO Y A, et al. Diagnostic accuracy of single channel cystometry for neurogenic bladder diagnosis following spinal cord injury:a pilot study[J]. Spinal Cord Ser Cases, 2017, 3: 16044. |
| [2] |
WADA N, SHIMIZU T, SHUNT K, et al. Post-injury bladder management strategy influences lower urinary tract dysfunction in the mouse model of spinal cord injury[J]. Neurourol Urodynam, 2017, 36(5): 1301-1305. |
| [3] |
WAGENLEHNER F M E, PILATZ A. Preventing urinary tract infections in patients with neurogenic bladder[J]. Lancet Infect Dis, 2018, 18(9): 926-927. |
| [4] |
WEIN A J. The management of neurogenic lower urinary tract dysfunction after spinal cord injury[J]. J Urol, 2017, 198(3): 488. |
| [5] |
QIN J, ZHAO Y, SHI X, et al. Effects of acupuncture intervention at different stages on urinary function reconstruction of neurogenic bladder after spinal cord injury[J]. Zhongguo Zhen Jiu, 2015, 35(2): 132-136. |
| [6] |
ZHANG T, LIU H, LIU Z, et al. Acupuncture for neurogenic bladder due to spinal cord injury:a systematic review protocol[J]. BMJ Open, 2014, 4(9): e6249. |
| [7] |
HARRIS C J, LEMACK G E. Neurourologic dysfunction:evaluation, surveillance and therapy[J]. Curr Opin Urol, 2016, 26(4): 290-294. |
| [8] |
孙柯, 梁丽萍, 呼小雪, 王刚. 及早经皮穴位电针刺激对高龄老年髋部骨折术后认知的影响[J]. 中国医学物理学杂志, 2018, 35(9): 1075-1079. |
| [9] |
许明, 张泓, 张健, 等. 电针对骶上脊髓损伤后神经源性膀胱大鼠尿流动力学及脊髓组织中半胱氨酸天冬氨酸蛋白酶-3表达的影响[J]. 中国康复医学杂志, 2017, 32(12): 1338-1344. |
| [10] |
李波霖, 周宾宾, 张鸿升, 等. 电针治疗脊髓损伤后神经源性膀胱功能障碍动物实验研究进展[J]. 甘肃中医学院学报, 2015, 32(3): 63-65. |
| [11] |
李慧玲, 郭玉怀, 尹洪娜.近五年电针治疗脊髓损伤后神经源性膀胱的临床研究进展[C]. 2017世界针灸学术大会暨2017中国针灸学会年会.北京, 2017.
|
| [12] |
LI Z G, QIN L N, WANG X, et al. Electroacupuncture at Dazhui (GV14) and Mingmen (GV4) protects against spinal cord injury:the role of the Wnt/β-catenin signaling pathway[J]. Neural Regen Res, 2016, 11(12): 2004. |
| [13] |
WANG W, LI M C, WANG Y F, et al. GSK-3β inhibitor TWS119 attenuates rtPA-induced hemorrhagic transformation and activates the Wnt/β-catenin signaling pathway after acute ischemic stroke in rats[J]. Mol Neurobiol, 2016, 53(10): 7028-7036. |
| [14] |
BASSO D M, BEATTIE M S, BRESNAHAN J C. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1): 1-21. |
| [15] |
金敏.电针次髎穴对脊髓损伤后神经源性膀胱的疗效观察[D].昆明: 昆明医科大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10678-1016293698.htm
|
| [16] |
张艳, 李惠玲, 何涛, 等. 脊髓损伤后神经源性膀胱临床治疗进展[J]. 甘肃中医药大学学报, 2018, 35(5): 109-113. |
| [17] |
许明, 张泓, 刘继生, 等. 完全性骶上脊髓损伤后神经源性膀胱大鼠模型的建立及尿流动力学分析[J]. 中国康复理论与实践, 2016, 22(8): 869-875. |
| [18] |
齐英娜, 吴鑫杰, 王延雷, 等. 从督论治脊髓损伤的研究进展[J]. 时珍国医国药, 2018, 29(6): 1425-1427. |
| [19] |
黄瑞迎, 张笑, 李万瑶. 次髎穴的临床应用[J]. 蜜蜂杂志, 2017(2): 40-41. |
| [20] |
满夏楠, 陈健尔. Wnt信号通路在脊髓损伤修复中作用的实验研究进展[J]. 中国康复理论与实践, 2017, 23(6): 645-648. |
| [21] |
LU W, LIN C, LI Y. Rottlerin induces Wnt co-receptor LRP6 degradation and suppresses both Wnt/β-catenin and mTORC1 signaling in prostate and breast cancer cells[J]. Cell Signal, 2014, 26(6): 1303-1309. |
| [22] |
赵东康, 骆伟伟, 余水平. Wnt信号通路与肝纤维化发生发展的关系[J]. 临床肝胆病杂志, 2018, 34(11): 2415-2419. |
| [23] |
张彬渝, 余永莉. Wnt信号通路在神经发生中的作用[J]. 海南医学, 2017, 28(5): 791-794. |
| [24] |
BRIONA L K, POULAIN F E, MOSIMANN C, et al. Wnt/β-catenin signaling is required for radial glial neurogenesis following spinal cord injury[J]. Dev Biol, 2015, 403(1): 15-21. |
| [25] |
王学敏, 张慧, 安聪, 等. Wnt信号通路对中枢神经系统再生修复的作用及中医药研究近况[J]. 中医药临床杂志, 2018, 30(8): 1386-1390. |
| [26] |
申亚辉, 刘新禹, 康晓燕, 等. Wnt/β-catenin信号通路在中枢神经系统发育、再生及变性性疾病中作用的研究进展[J]. 山东医药, 2018, 58(26): 84-87. |
 2020, Vol. 46
2020, Vol. 46


