扩展功能
文章信息
- 郑全辉, 雷冰, 袁鸿儒, 马剑楠, 刘兆基, 张郡, 刘倚博, 张冰, 张爱红, 郑爱华, 张颖, 李会婷, 田枫
- ZHENG Quanhui, LEI Bing, YUAN Hongru, MA Jiannan, LIU Zhaoji, ZHANG Jun, LIU Yibo, ZHANG Bing, ZHANG Aihong, ZHENG Aihua, ZHANG Ying, LI Huiting, TIAN Feng
- 组蛋白去乙酰化酶3对恒定型自然杀伤性T细胞发育和功能的调控作用
- Regulatoy effects of HDAC3 on development and function of iNKT cells
- 吉林大学学报(医学版), 2020, 46(02): 205-213
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 205-213
- 10.13481/j.1671-587x.20200201
-
文章历史
- 收稿日期: 2019-06-20
2. 河北医科大学第三医院骨外科, 河北 石家庄 050051;
3. 河北省唐山市工人医院ICU, 河北 唐山 063000;
4. 北京大学医学部实验动物科学部, 北京 100191
2. Department of Immounology, Department of Orthopedics, Third Hospital, Hebei Medical University, Shijiazhuang 050051, China;
3. Tangshan Worker's Hospital, Hebei Province, Tangshan 063000, China;
4. Department of Laboratory Animal Science, Health Science Center, Peking University, Beijing 100191, China
恒定型自然杀伤性T细胞(invarient nature killer T cells, iNKT)产生于胸腺, 是一群既表达有限T细胞受体α链和β链,同时也表达NK细胞受体(NK1.1)的固有淋巴细胞亚群[1]。根据其细胞表面分子CD44和NK1.1的表达差异,iNKT在胸腺的发育和成熟可分为3个阶段:最初阶段非成熟iNKT细胞表现为CD44-NK1.1-;随iNKT细胞成熟程度的增加, CD44表达首先增加,表现为CD44+NK1.1-;成熟阶段iNKT细胞NK1.1表达明显增加,表现为CD44+NK1.1+[2]。由于iNKT细胞在活化后能够产生大量Th1和Th2型细胞因子,如干扰素γ(interferon-γ,IFN-γ)和白细胞介素4(interleukin-4, IL-4)等,因此在感染和肿瘤等多种疾病中发挥作用[3-5]。已有研究[6-9]发现:组蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)在传统T细胞、B细胞、巨噬细胞和树突状细胞的发育和功能调控中发挥促进或抑制作用,而HDAC3对iNKT细胞发育和功能的影响目前尚不完全清楚。本研究采用T细胞特异的hdac3基因敲除小鼠,探讨HDAC3对iNKT细胞发育和功能的影响。
1 材料与方法 1.1 实验动物、主要试剂和仪器C57BL/6背景的hdac3floxP转基因小鼠(Stock No:024119)和CD4启动子/增强子/沉默子-Cre转基因小鼠(Stock No:022071)购自美国Jackson实验室,并在华北理工大学SPF级小鼠房饲养、繁殖,动物合格证号:SCSK(京)2014-0004。hdac3floxP小鼠和CD4启动子/增强子/沉默子-Cre小鼠交配、繁殖子代后经细胞基因组PCR检测鉴定可获得T细胞特异的hdac3基因敲除小鼠(hdac3floxP+CD4Cre+,HDAC3KO),将hdac3基因正常小鼠作为野生型正常对照(hdac3floxP+CD4Cre-,WT)。实验选取4~8周龄及性别匹配的HDAC3KO和WT小鼠进行研究。实验操作按华北理工大学实验动物管理委员会规定进行。细胞DNA提取试剂盒购自天根生物科技(北京)有限公司,荧光素标记的抗小鼠TCRβ(H57-597)、NK1.1(PK136)、CD44(IM7), CD122(5H4)、CD69 (H1.2F3)、DX5(HMα2)、CD4(RM4-5)、CD8(53-6.7)、IL-4(11B11)、IFN-γ(XMG1.2)、生物素标记抗小鼠CD3(17A2)抗体及淋巴细胞固定/打孔试剂盒购自美国BD或eBioscience公司,抗生物素磁珠购自德国美天旎生物技术有限公司,半乳糖神经酰胺(α-Galcer)及荧光素标记的CD1d-α-Galcer四聚体购自日本麒麟公司,大鼠抗小鼠FcR单克隆抗体(2.4G2)取自2.4G2杂交瘤细胞培养上清,RPMI1640培养液、胎牛血清、HEPES、青-链霉素、谷氨酰胺、莫能菌素、红细胞裂解液及小鼠IFN-γ和IL-4 ELISA检测试剂盒购自北京达科为生物技术公司,引物由生工生物工程(上海)股份有限公司合成。低温冷冻离心机购自德国Beckan公司,FACSAriaⅡ流式细胞仪购自美国BD公司。
1.2 小鼠基因型鉴定采用FACSAriaⅡ流式细胞仪分别分选HDAC3KO和WT小鼠胸腺CD4+CD8+双阳性T细胞(DP)、CD4单阳性T细胞(CD4SP)、CD8单阳性T细胞(CD8SP)以及脾脏CD4+T细胞(CD4)和CD8+T细胞(CD8)。各取1×106个细胞,按试剂盒操作说明书提取DNA并进行PCR扩增。所用上游引物:5′-CCCAGGTTAGCTTTGAACTCT -3′, 下游引物:5′-CCACTGGCTTCTCCTAAGTTC-3′。HDAC3KO小鼠PCR扩增生成211 bp DNA片段,WT小鼠PCR扩增生成935 bp DNA片段。
1.3 流式细胞术分析HDAC3KO小鼠iNKT细胞数量和发育表型分别分离HDAC3KO和WT小鼠(每组3~5只)胸腺、脾、肝脏和淋巴结并制成单细胞悬液,采用含2%胎牛血清的PBS染色缓冲液洗涤2次,加入2.4G2封闭,4℃孵育30 min。然后直接加入10μL (1:10~1:100稀释)荧光素标记的单克隆抗体,4℃避光孵育30 min,用PBS染色缓冲液洗涤2次,采用FACSAriaⅡ流式细胞仪收集标本,采用FlowJo software或CELLQuest Pro(BD Biosciences)软件进行数据分析。实验至少重复3次。
1.4 骨髓混合嵌合体小鼠制备采用6~8周龄CD45.1+的B6.SJL小鼠作为受体,以剂量为900 Gy的γ射线照射杀死受体鼠骨髓细胞。在无菌条件下分别提取周龄和性别相同B6.SJL和CD45.2+的HDAC3KO小鼠(每组每种小鼠各取4~6只)骨髓细胞,裂解红细胞后采用生物素标记抗CD3抗体和抗生物素磁珠分选、剔除骨髓中存在的成熟CD3+T细胞。采用无菌PBS缓冲液洗涤并重悬剩余B6.SJL和HDAC3KO骨髓细胞,调整细胞浓度为1×107mL-1。按1:1比例混合后经尾静脉注射γ射线照射的B6.SJL小鼠(每只100μL)。细胞注射8周后采用流式细胞术检测不同骨髓来源iNKT细胞在受体B6.SJL小鼠胸腺的产生和发育情况。实验重复3次。
1.5 iNKT细胞活化和细胞内染色分析将α-Galcer用二甲基亚砜溶解,浓度为100mg·L-1,取2 μg α-Galcer溶于100 μL无菌PBS中,经尾静脉分别注入HDAC3KO和WT小鼠(每组每种小鼠各取3~5只)体内。4 h后分离小鼠脾细胞,红细胞裂解液处理去除红细胞后每种样本各取2×106个细胞重悬于RPMI 1640培养液(含10%胎牛血清、2 mmol·L-1谷氨酰胺和10 mmol·L-1HEPES),同时加入GolgiStop(1mg·L-1),于37℃、5%CO2条件下培养2 h。收集培养细胞首先经细胞表面染色,然后经冷PBS洗涤后用新鲜配置的固定/打孔液重悬细胞,加入2.4G2,4℃封闭10 min,直接加入抗小鼠IFN-γ和IL-4抗体进行细胞内染色,4℃避光孵育30 min,用固定/打孔液洗涤细胞2次,流式细胞仪分析iNKT细胞内IFN-γ和IL-4水平。实验至少重复3次。
1.6 酶联免疫吸附实验(ELISA)检测HDAC3KO小鼠血清细胞因子水平采用结合缓冲液(0.1 mol·L-1 Na2HPO4,pH 9.0)稀释抗小鼠IFN-γ和IL-4抗体至2 mg·L-1,按每孔100 μL加入至相应ELISA板,4℃包被过夜。移除包被液,加入封闭缓冲液(1% BSA),每孔200μL,室温孵育2 h,采用PBS/Tween20洗涤3次后加入1:50稀释α-Galcer处理的HDAC3KO和WT小鼠(每种小鼠各取3~5只)血清以及倍比稀释的标准血清,每孔100μL,室温孵育4 h。采用PBS/Tween20洗涤3次后加入底物显色,在450 nm处测量吸光度(A)值,并根据标准曲线计算血清中IFN-γ和IL-4水平(μg·L-1)。实验至少重复3次。
1.7 统计学分析采用SSPS19.0统计软件进行统计学分析。HDAC3KO和WT小鼠不同组织中iNKT细胞比例、数量、发育表型分子表达以及iNKT细胞和血清中IL-4和IFN-γ水平均符合正态分布,以x±s表示,两组间样本均数比较采用两独立样本t 检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 HDAC3敲除小鼠基因型鉴定对流式细胞术分选的HDAC3KO和WT小鼠胸腺和脾脏T细胞亚群进行基因型鉴定,来自WT小鼠的胸腺DP和CD4SP细胞产生935 bp的DNA片段,而来自HDAC3KO小鼠的胸腺DP、CD4SP、CD8SP细胞和脾脏CD4、CD8 T细胞均产生211 bp的DNA片段, 说明HDAC3KO小鼠基因型鉴定正确。见图 1。

|
| 图 1 PCR技术鉴定HDAC3KO和WT小鼠胸腺和脾脏T细胞亚群基因型 Fig. 1 Identification of genetypes of T cell subtypes of HDAC3KO and WT mice by PCR |
|
|
采用抗TCR-β抗体和荷载糖脂抗原α-Galcer的CD1d四聚体(CD1d-Tetramer)染色,流式细胞术分析各组织器官中iNKT细胞比例和数量。结果显示:与WT小鼠比较,HDAC3KO小鼠胸腺、脾脏、肝脏和淋巴结中iNKT细胞比例和数量均明显降低(P < 0.05)。见图 2、表 1和表 2。
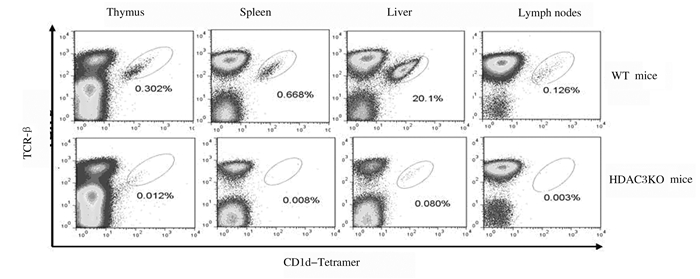
|
| 图 2 流式细胞术检测HDAC3KO和WT小鼠胸腺、脾脏、肝脏和淋巴结中iNKT细胞水平 Fig. 2 Levels of iNKT cells in thymus, spleen, liver and lymph nodes of HDAC3KO and WT micedetected by flow cytometry |
|
|
| (n=15, x±s, η /%) | |||||||||||||||||||||||||||||
| Group | Ratio of iNKT cells | ||||||||||||||||||||||||||||
| Thymus | Spleen | Liver | Lymph nodes | ||||||||||||||||||||||||||
| WT mice | 0.28±0.08 | 1.07±0.55 | 14.92±6.38 | 0.14±0.04 | |||||||||||||||||||||||||
| HDAC3KO mice | 0.02±0.01* | 0.01±0.01* | 0.08±0.04* | 0.01±0.01* | |||||||||||||||||||||||||
| *P < 0.05 compared with WT mice. | |||||||||||||||||||||||||||||
| (n=15, x±s) | |||||||||||||||||||||||||||||
| Group | Number of iNKT cells | ||||||||||||||||||||||||||||
| Thymus(×105) | Spleen(×105) | Liver(×104) | Lymph nodes(×104) | ||||||||||||||||||||||||||
| WT mice | 3.79±1.06 | 11.98±4.88 | 24.25±10.37 | 1.16±0.28 | |||||||||||||||||||||||||
| HDAC3KO mice | 0.21±0.06* | 0.15±0.07* | 0.22±0.10* | 0.06±0.04* | |||||||||||||||||||||||||
| *P < 0.05 compared with WT mice. | |||||||||||||||||||||||||||||
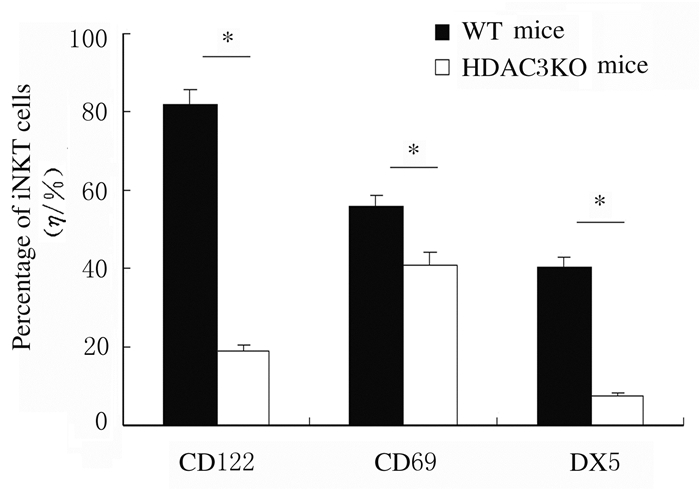
采用抗CD44、NK1.1、CD122、CD69和DX5抗体染色,流式细胞术检测iNKT细胞发育表型的结果显示:与WT小鼠比较,HDAC3KO小鼠处于非成熟阶段CD44-NK1.1-和CD44+NK1.1-iNKT细胞比例明显增加(P < 0.05),而成熟阶段CD44+NK1.1+细胞比例明显降低(P < 0.05)。见图 3和图 4。与WT小鼠比较,HDAC3KO小鼠iNKT细胞中CD122、CD69和DX5表达水平明显降低(P < 0.05)。见图 5和图 6。
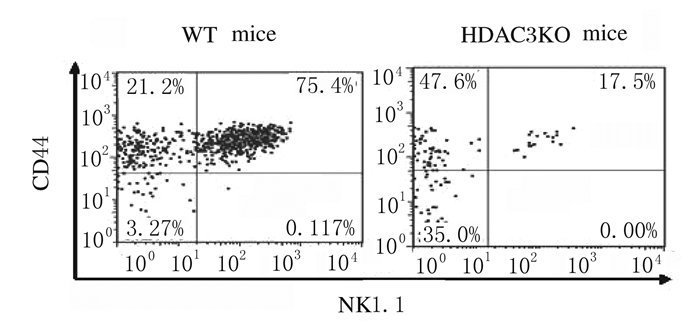
|
| 图 3 流式细胞术检测HDAC3KO和WT小鼠胸腺iNKT细胞中CD44和NK1.1的表达 Fig. 3 Expressions of CD44 and NK1.1 in thymus iNKT cells of HDAC3KO and WT mice detected by flow cytometry |
|
|
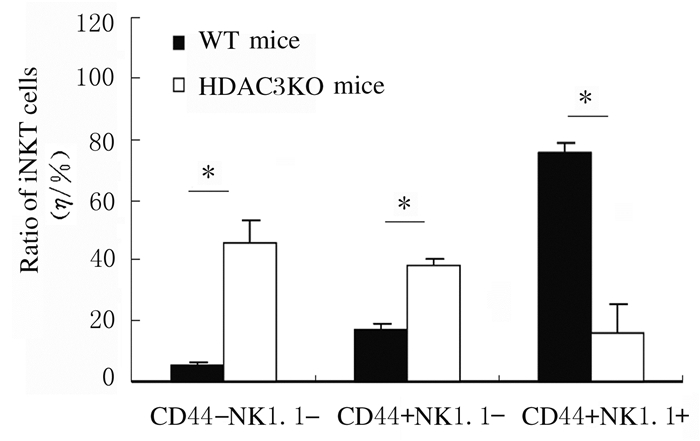
|
| *P < 0.05 compared with WT mice. 图 4 HDAC3KO和WT小鼠胸腺不同发育阶段iNKT细胞比例 Fig. 4 Ratios of iNKT cells in thymus in different development stages of WT and HDAC3KO mice |
|
|
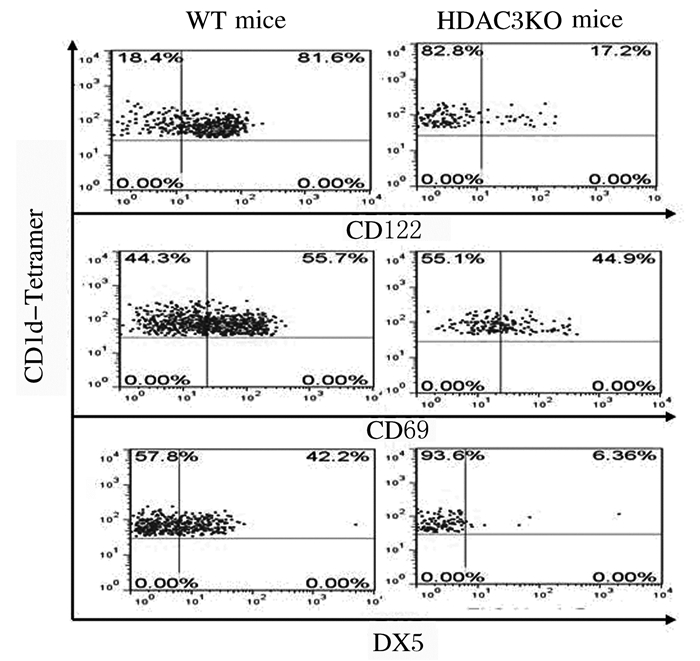
|
| 图 5 流式细胞术检测HDAC3KO和WT小鼠胸腺iNKT细胞中CD122、CD69和DX5表达 Fig. 5 Expressions of CD122, CD69 and DX5 in thymus iNKT cells of HDAC3KO and WT mice |
|
|
|
| *P < 0.05 compared with WT mice. 图 6 HDAC3KO小鼠胸腺iNKT细胞中CD122、CD69和DX5表达水平 Fig. 6 Expression levels of CD122, CD69 and DX5 in thymus iNKT cells of HDAC3KO mice |
|
|
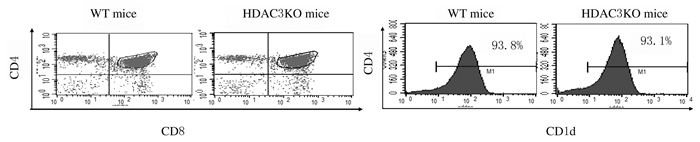
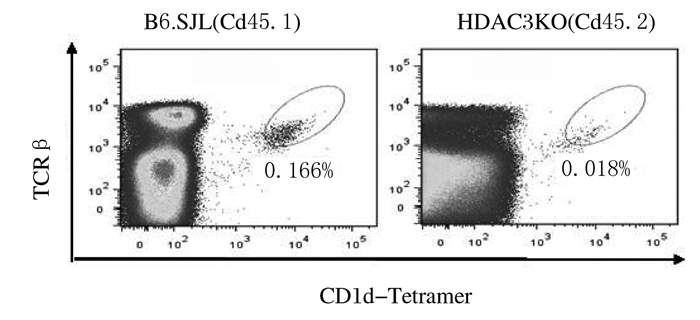
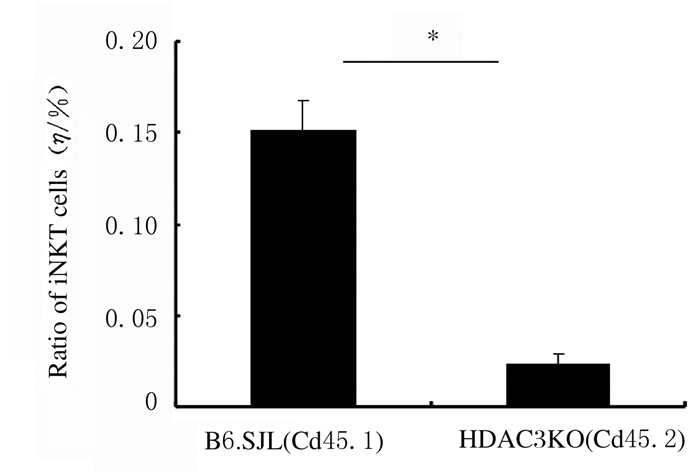
流式细胞术检测HDAC3KO小鼠DP细胞中CD1d表达结果显示:与WT小鼠比较,HDAC3KO小鼠DP细胞中CD1d表达无明显变化。见图 7。采用骨髓混合嵌合体方法检测受者小鼠胸腺iNKT细胞的产生和发育结果显示:与来源于正常小鼠的骨髓细胞比较,来源于HDAC3KO小鼠的骨髓细胞产生的iNKT细胞数量明显减少(P < 0.05)。发育表型检测结果显示:与来源于正常小鼠的骨髓细胞比较,来源于HDAC3KO小鼠骨髓的iNKT细胞主要表现为非成熟CD44-NK1.1-和CD44+NK1.1-表型,而成熟CD44+NK1.1+表型细胞比例明显降低(P < 0.05)。见图 8~11。
|
| 图 7 流式细胞术检测HDAC3KO和WT小鼠DP细胞中CD1d的表达 Fig. 7 Expressions of CD1d in DP cells of HDAC3KO and WT mice detected by flow cytomtetry |
|
|
|
| 图 8 流式细胞术检测来源于HDAC3KO和B6.SJL小鼠骨髓细胞的iNKT细胞的产生 Fig. 8 Production of iNKT cells from bone marrow cells of HDAC3KO and B6.SJL mice detected by flow cytometry |
|
|
|
| *P < 0.05 compared with B6.SJL mice. 图 9 来源于HDAC3KO和B6.SJL小鼠骨髓细胞的iNKT细胞比例 Fig. 9 Ratios of iNKT cells from bone marrow cells of HDAC3KO and B6.SJL mice |
|
|
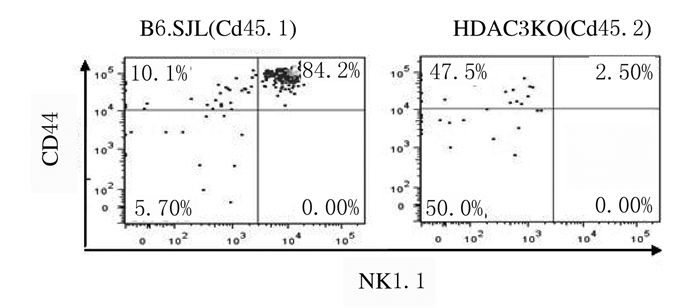
|
| 图 10 流式细胞术检测来源于HDAC3KO和B6.SJL小鼠骨髓细胞的iNKT细胞中CD44和NK1.1的表达 Fig. 10 Expressions of CD44 and NK1.1 in iNKT cells from bone marrow cells of HDAC3KO and B6.SJL mice detected by flow cytometry |
|
|
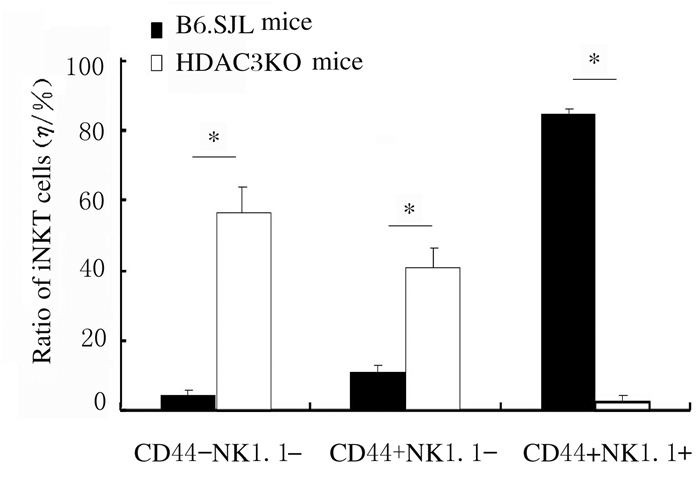
|
| *P < 0.05 compared with B6.SJL mice. 图 11 来源于HDAC3KO和B6.SJL小鼠骨髓细胞的不同表型iNKT细胞比例 Fig. 11 Ratios of iNKT cells with different phenotypes from bone marrow cells of HDAC3KO and B6.SJL mice |
|
|
细胞内染色结果显示:α-Galcer体内刺激4 h后,与WT小鼠比较,HDAC3KO小鼠iNKT细胞中IFN-γ和IL-4水平明显降低(P < 0.05)。见图 12和图 13。ELISA法检测显示:与WT小鼠比较,HDAC3KO小鼠血清中IFN-γ和IL-4水平明显降低(P < 0.05)。见图 14。
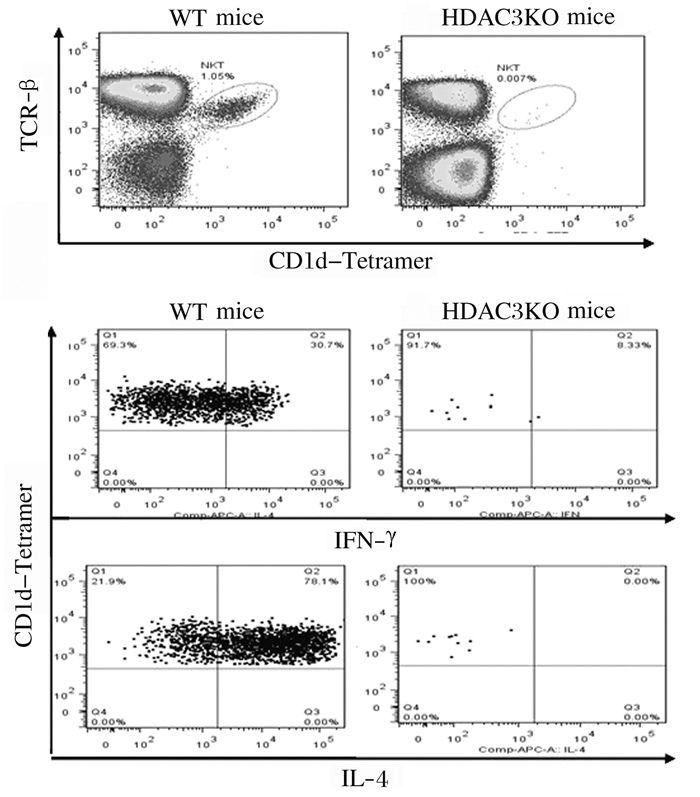
|
| 图 12 细胞内染色检测HDAC3KO和WT小鼠iNKT细胞中IFN-γ和IL-4表达 Fig. 12 Expressions of IFN-γ and IL-4 in iNKT cells of HDAC3KO and WT mice detected by intracellular staining |
|
|
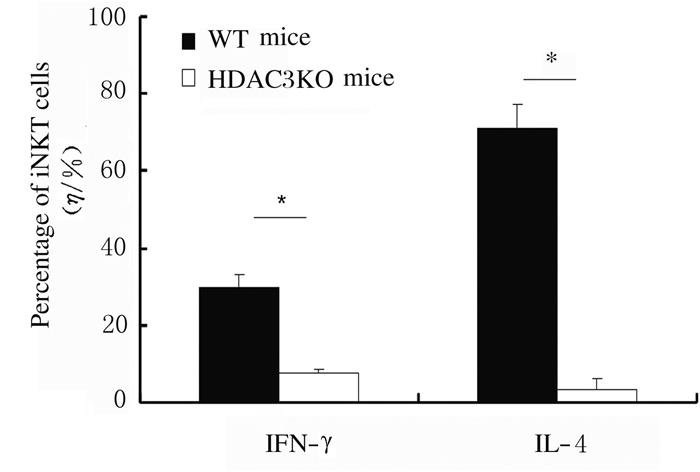
|
| *P < 0.05 compared with WT mice. 图 13 HDAC3KO和WT小鼠iNKT细胞中IFN-γ和IL-4表达水平 Fig. 13 Expression levels of IFN-γ and IL-4 in iNKT cells of HDAC3KO and WT mice |
|
|
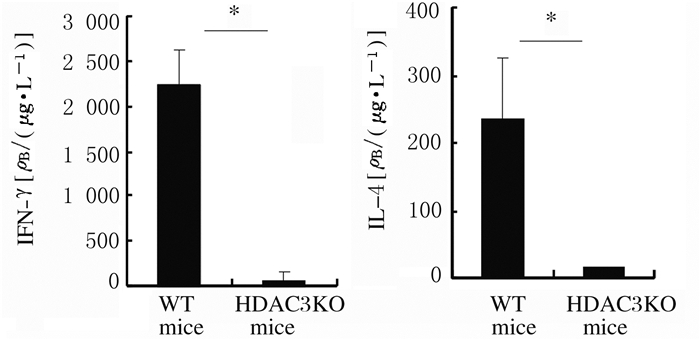
|
| *P < 0.05 compared with WT mice. 图 14 ELISA法检测HDAC3KO和WT小鼠血清中IFN-γ和IL-4表达水平 Fig. 14 Expression levels of IFN-γ and IL-4 in serum of HDAC3KO and WT mice detected by ELISA method |
|
|
本研究结果显示:HDAC3对于iNKT细胞的发育和细胞因子的产生发挥关键作用。HDAC3敲除导致中枢和外周免疫器官中iNKT细胞数量明显减少,iNKT细胞在胸腺的发育受阻,同时iNKT细胞因子水平也明显降低。
本文作者以往研究[10]显示:CD4Cre酶介导的HDAC3敲除不影响传统T细胞在胸腺的发育和成熟,但导致外周CD4+T细胞和CD8+T细胞出现活化诱导的细胞凋亡,表现为细胞核DNA复制加快但同时伴随着细胞凋亡的明显增加。另外,增殖能力旺盛的造血干细胞缺失HDAC3引起多能淋巴祖细胞凋亡增加,淋巴细胞生成明显减少[11]。鉴于HDAC3在T淋巴细胞活化增殖中的重要性,HDAC3已被作为靶点用于T细胞淋巴瘤的临床治疗[12]。另外,iNKT细胞由胸腺DP细胞识别邻近细胞CD1d提呈的糖脂类抗原后经阳性选择产生,在其发育和成熟过程中,iNKT细胞中CD44和CD69等T细胞活化分子表达水平明显升高,增殖活性也明显增强。本研究结果显示:HDAC3敲除主要导致CD44+NK1.1+成熟iNKT细胞比例明显降低,而非成熟CD44-NK1.1-和CD44+NK1.1-iNKT细胞比例升高,提示T细胞活化增殖越明显,其活性对HDAC3的依赖性越强。另外,THAPA等[13]采用PLZFCre酶介导的基因敲除方法,在iNKT细胞发生阳性选择后敲除HDAC3, 也观察到iNKT细胞数量在胸腺、脾脏和肝脏中明显减少。然而,CD4Cre酶介导的hdac3基因敲除导致iNKT细胞数量在胸腺和外周免疫器官中明显降低, 表明HDAC3对于iNKT细胞的阳性选择以及整个发育和成熟过程必不可少。
iNKT细胞在胸腺的产生和发育既依赖于胸腺微环境,也依赖于其细胞自身。胸腺DP细胞表面CD1d对糖脂类抗原的有效提呈在iNKT细胞阳性选择过程中发挥重要作用,CD1d敲除小鼠iNKT细胞几乎完全缺失[14]。然而,本研究结果显示:HDAC3敲除并不影响胸腺DP细胞表面CD1d的表达,提示HDAC3主要通过内源性途径调控iNKT细胞在胸腺的产生、发育和成熟,这也被骨髓混合嵌合体实验结果进一步证实。这一结果表明:以HDAC3为靶点的干预措施可直接对iNKT细胞发育和功能发挥调控作用,进而可以调节iNKT相关疾病的发生发展。
目前对HDAC3调控iNKT细胞产生、发育的信号通路仍不完全明确。CD122是IL-15受体β亚单位,本研究结果显示:CD122在HDAC3敲除小鼠iNKT细胞中表达水平明显降低,表明HDAC3敲除引起的iNKT细胞产生和发育缺陷与IL-15信号通路受阻有关[15]。ZHU等[16]报道IL-15信号途径缺陷导致iNKT细胞自噬功能下降,细胞生存能力明显降低。THAPA等[17]研究显示:与正常iNKT细胞比较,HDAC3缺失iNKT细胞自噬标记物Cyto-ID染色阳性率和LC3A/B表达降低,进一步证实HDAC3可通过细胞自噬途径调控iNKT的生存和发育。另外,HDAC3与NKAP和Runx1均可发生细胞内相互作用,而NKAP和Runx1缺失同样导致iNKT细胞生成明显减少,提示HDAC3也可通过NKAP和Runx1相关信号途径调控iNKT的产生和发育[18-19]。
在受到TCR信号刺激时,iNKT细胞能在短时间内产生大量Th1和Th2型细胞因子,进而发挥强大的免疫调节功能[20]。研究[21]显示:非成熟CD44-NK1.1-和CD44+NK1.1-iNKT细胞主要产生IL-4,而成熟CD44+NK 1.1+ iNKT细胞主要产生IFN-γ。本研究结果显示:HDAC3敲除导致iNKT细胞和机体IL-4和IFN-γ的产生均明显降低,表明HDAC3可总体影响iNKT细胞的功能。一方面,HDAC3缺失引起的iNKT及外周CD4+和CD8+T细胞数量的明显减少可导致α-Galcer活化iNKT细胞和机体细胞因子产生明显减少;另一方面,HDAC3也可能通过对IL-4和IFN-γ及其转录因子如GATA-3和T-bet的直接或间接表达调控作用影响以上细胞因子的产生[8]。
综上所述,HDAC3内源性地调控iNKT细胞的发育和成熟,HDAC3缺失导致iNKT细胞数量明显减少、细胞成熟障碍和细胞因子产生功能的明显降低。而对于HDAC3调控iNKT细胞产生、发育和功能发挥的信号通路目前仍不明确,需要在后续实验中进一步探讨。
| [1] |
BENDELAC A, SAVAGE P B, TEYTON L. The biology of NKT cells[J]. Annu Rev Immunol, 2007, 25(1): 297-336. |
| [2] |
BENLAGHA K, WEI D G, VEIGA J, et al. Characterization of the early stages of thymic NKT cell development[J]. J Exp Med, 2005, 202(4): 485-492. DOI:10.1084/jem.20050456 |
| [3] |
SCHMIDT S, TRAMSEN L, RAIS B, et al. Natural killer cells as a therapeutic tool for infectious diseases-current status and future perspectives[J]. Oncotarget, 2018, 9(29): 20891-20907. |
| [4] |
NAIR S, DHODAPKAR M V. Natural killer T cells in cancer immunotherapy[J]. Front Immunol, 2017, 8: 1178. |
| [5] |
VAN KAER L, WU L. Therapeutic potential of invariant natural killer T cells in autoimmunity[J]. Front Immunol, 2018, 9: 519. DOI:10.3389/fimmu.2018.00519 |
| [6] |
STENGEL K R, ZHAO Y, KLUS N J, et al. Histone deacetylase 3 is required for efficient T cell development[J]. Mol Cell Biol, 2015, 35(22): 3854-3865. DOI:10.1128/MCB.00706-15 |
| [7] |
STENGEL K R, BARNETT K R, WANG J, et al. Deacetylase activity of histone deacetylase 3 is required for productive VDJ recombination and B-cell development[J]. Proc Natl Acad Sci U S A, 2017, 114(32): 8608-8613. DOI:10.1073/pnas.1701610114 |
| [8] |
CHEN X, BAROZZI I, TERMANINI A, et al. Requirement for the histone deacetylase Hdac3 for the inflammatory gene expression program in macrophages[J]. Proc Natl Acad Sci U S A, 2012, 109(42): E2865-E2874. DOI:10.1073/pnas.1121131109 |
| [9] |
YASHIRO T, KUBO M, OGAWA H, et al. PU.1 suppresses Th2 cytokine expression via silencing of GATA3 transcription in dendritic cells[J]. PLoS One, 2015, 10(9): e0137699. DOI:10.1371/journal.pone.0137699 |
| [10] |
王姗, 田枫, 千晔, 等. 组蛋白去乙酰化酶3通过抑制AICD维持T细胞自稳[J]. 生物化学与生物物理进展, 2018, 45(1): 79-90. |
| [11] |
ELIZALDE C, FERNÁNDEZ-RUEDA J, SALCEDO J M, et al. Histone deacetylase 3 modulates the expansion of human hematopoietic stem cells[J]. Stem Cells Dev, 2012, 21(14): 2581-2591. DOI:10.1089/scd.2011.0698 |
| [12] |
WELLS C E, BHASKARA S, STENGEL K R, et al. Inhibition of histone deacetylase 3 causes replication stress in cutaneous T cell lymphoma[J]. PLoS One, 2013, 8(7): e68915. DOI:10.1371/journal.pone.0068915 |
| [13] |
THAPA P, ROMERO AROCHA S, CHUNG J Y, et al. Histone deacetylase 3 is required for iNKT cell development[J]. Sci Rep, 2017, 7(1): 5784. |
| [14] |
GAPIN L, MATSUDA J L, SURH C D, et al. NKT cells derive from double-positive thymocytes that are positively selected by CD1d[J]. Nat Immunol, 2001, 2(10): 971-978. DOI:10.1038/ni710 |
| [15] |
VILLANUEVA J E, MALLE E K, GARDAM S, et al. TRAF2 regulates peripheral CD8(+) T-cell and NKT-cell homeostasis by modulating sensitivity to IL-15[J]. Eur J Immunol, 2015, 45(6): 1820-1831. DOI:10.1002/eji.201445416 |
| [16] |
ZHU L L, XIE X P, ZHANG L Y, et al. TBK-binding protein 1 regulates IL-15-induced autophagy and NKT cell survival[J]. Nat Commun, 2018, 9(1): 2812. |
| [17] |
THAPA P, DAS J, MCWILLIAMS D, et al. The transcriptional repressor NKAP is required for the development of iNKT cells[J]. Nat Commun, 2013, 4: 1582. |
| [18] |
EGAWA T, EBERL G, TANIUCHI I, et al. Genetic evidence supporting selection of the Valpha14i NKT cell lineage from double-positive thymocyte precursors[J]. Immunity, 2005, 22(6): 705-716. DOI:10.1016/j.immuni.2005.03.011 |
| [19] |
DURST K L, LUTTERBACH B, KUMMALUE T, et al. The inv(16) fusion protein associates with corepressors via a smooth muscle myosin heavy-chain domain[J]. Mol Cell Biol, 2003, 23(2): 607-619. DOI:10.1128/MCB.23.2.607-619.2003 |
| [20] |
MATSUDA J L, NAIDENKO O V, GAPIN L, et al. Tracking the response of natural killer T cells to a glycolipid antigen using CD1d tetramers[J]. J Exp Med, 2000, 192(5): 741-754. DOI:10.1084/jem.192.5.741 |
| [21] |
BENLAGHA K, KYIN T, BEAVIS A, et al. A thymic precursor to the NK T cell lineage[J]. Science, 2002, 296(5567): 553-555. DOI:10.1126/science.1069017 |
 2020, Vol. 46
2020, Vol. 46


