扩展功能
文章信息
- 李红艳, 王雷, 刘敏, 林崇韬
- LI Hongyan, WANG Lei, LIU Min, LIN Chongtao
- 硝苯地平致糖尿病患者牙龈肥大1例报告及文献复习
- Nifedipine-induced gingival enlargement in diabetic patient: A case report and literature review
- 吉林大学学报(医学版), 2020, 46(02): 399-403
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 399-403
- 10.13481/j.1671-587x.20200232
-
文章历史
- 收稿日期: 2019-07-11
药物性牙龈肥大是指患者长期服用某些药物而引起的牙龈纤维性增生和体积增大。与药物性牙龈肥大有关的三类常用药物为抗癫痫药物(苯妥英钠)、免疫抑制剂(环孢素)和钙通道阻滞剂(硝苯地平)。硝苯地平属于二羟吡啶类的第1代钙通道阻滞剂,是目前广泛应用的治疗心血管疾病的药物,其导致的药物性牙龈肥大临床上较为常见,国外文献[1]报道其患病率为6.3%~83.0%。硝苯地平所致的牙龈肥大,增生组织覆盖大部分牙冠,影响患者的美观和咀嚼功能,更有严重者会导致牙齿的松动、移位,甚至脱落,给患者的生活带来烦恼,造成心理负担和精神压力。国内外关于硝苯地平引起牙龈肥大的病例报告较多,而有关硝苯地平引起糖尿病患者牙龈肥大的报道较少,二十年来只有2例相似报道[2-3],均为非洛地平引起糖尿病患者的牙龈增生,且对病因和治疗方法选择未详细介绍。伴有糖尿病的药物性牙龈肥大病因不清,目前治疗方法有非手术治疗和手术治疗[4]。以往的治疗以降糖和更换降压药物为首选[2-3]。2018年新的牙周病分类中将药物性牙龈肥大列入了菌斑为主要病因的牙龈疾病内[5],有学者[6]认为不更换降压药物的情况下进行以控制菌斑为导向的非手术治疗,效果可靠。伴有糖尿病的药物性牙龈肥大是否更换药物,是否需要手术治疗,以及手术时机的选择等还在困扰着临床医生。本文作者收集1例硝苯地平致糖尿病患者牙龈肥大的临床资料并进行分析,且对相关文献进行回顾,以期在治疗时机和治疗方法选择上为临床医生提供一定的参考。
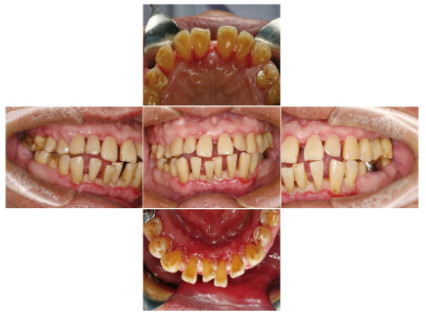
1 临床资料 1.1 一般资料患者,男性,67岁,因“牙龈肿大切除后2年复发”于2017年10月就诊吉林大学口腔医院。糖尿病史3年。除控制饮食外,未服用任何控制血糖药物。就诊日空腹血糖为10 mmol·L-1,糖化血红蛋白(glycosylated hemoglobin, HbA1c)水平为8.1%。高血压30年,持续服用降压药控制,4年前开始服用“硝苯地平”至今,服药后血压控制在130/90mmHg左右。患者服用硝苯地平半年后出现牙龈肿胀、出血,影响进食和美观,2015年于当地医院行牙龈切除术(具体不详),术后2年又出现牙龈肿胀、逐渐加重,再次影响进食,来诊。
1.2 专科检查患者口腔卫生情况差,简化口腔卫生指数(simplified oral hygiene index, OHI-S):2~3,牙龈暗红,龈缘厚钝,龈乳头呈球状增大,牙龈肿胀增生:上下前牙牙龈覆盖牙面的2/3以上,后牙区牙龈覆盖牙面的1/3~1/2,质地较韧。探诊深度(probing depth, PD):4~10mm,附着丧失(attachment loss, AL):1~3mm,出血指数(bleeding index, BI):3~5。11、12、13、21、22、23、31、32、33、41、42和43牙齿Ⅱ-Ⅲ度松动,且有移位,其余牙齿Ⅰ-Ⅱ度松动。27、28和47缺失,17银汞充填,36金属全冠修复。见图 1(插页六)和图 2。临床诊断为药物性牙龈肥大。
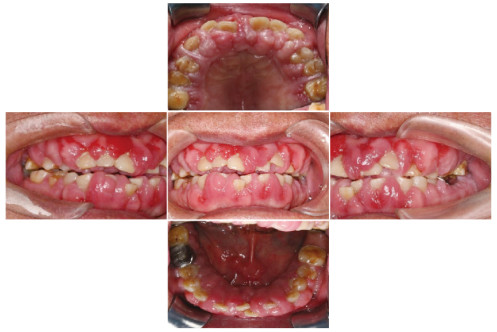
|
| 图 1 硝苯地平致牙龈肥大糖尿病患者治疗前口腔内照片 Fig. 1 Intraoral photography of nifedipine induced gingival hypertrophy patient with diabetes before treatment |
|
|
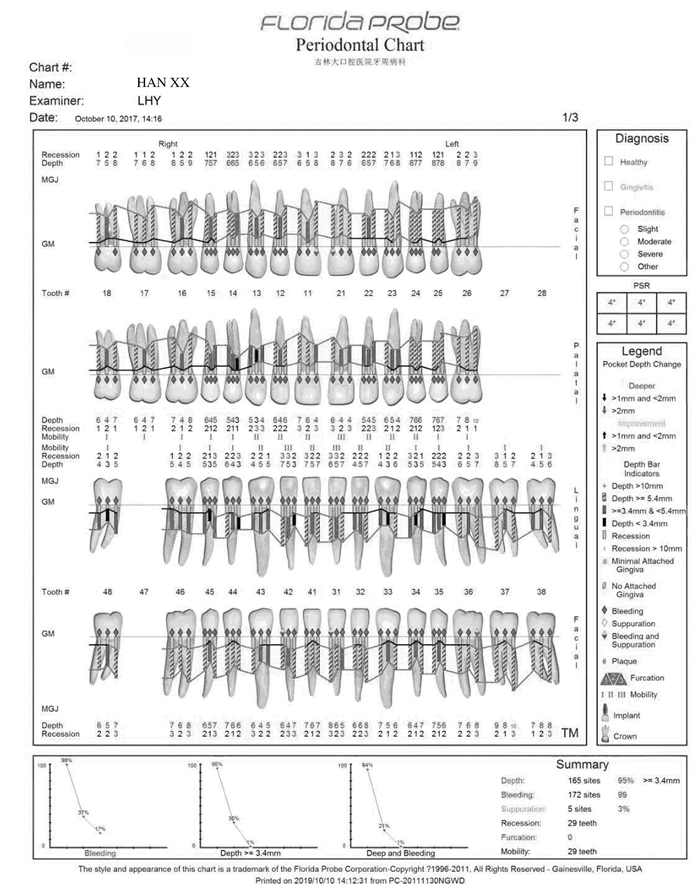
|
| 图 2 硝苯地平致牙龈肥大糖尿病患者治疗前牙周临床指标电子探诊结果 Fig. 2 Periodontal clinical electronic probing result in nifedipine-induced gingival hypertrophy patient with diabetes before treatment |
|
|
① 口腔卫生宣教,告知患者病情及治疗计划,患者知情同意;②与内科医生沟通,建议更换非钙通道阻滞剂类降压药,监控血压,控制血糖;③牙周基础治疗;④牙周手术治疗;⑤维护治疗。
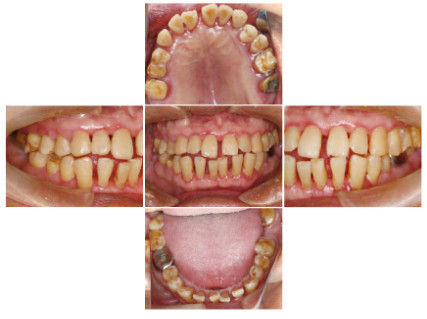
1.4 治疗过程2017年10月患者第1次就诊,首先控制血压、血糖至牙周治疗要求的水平(收缩压 < 140mmHg, 舒张压 < 100 mmHg;空腹血糖 < 7 mmol·L-1,HbA1c < 7.5%),为期1个月,内科会诊后不建议更换降压药。2017年12月完成第1次牙周基础治疗:龈上洁治术,龈下刮治术,根面平整术,牙周袋内置派丽奥缓释剂。基础治疗后6周复诊进行牙周疗效再评估,牙龈的色、形、质得到明显改善,肿胀程度明显减轻。口腔卫生控制不良,探诊出血位点>40%, 有部分牙位点仍有牙石暴露,再次行牙周基础治疗。强化口腔卫生指导,进入维护期。2018年7月,牙周基础治疗后6个月,患者口腔卫生状况良好,牙龈肿胀大部分减轻,见图 3(插页六)和图 4。针对增生的位点行牙龈切除术及牙龈成形术,术后口腔内照片见图 5(封三)。术后即进入维护期,每3个月复诊1次。进行长期有效的菌斑控制。术后1年口腔内照片和临床指标电子探诊结果见图 6(封三)和图 7。
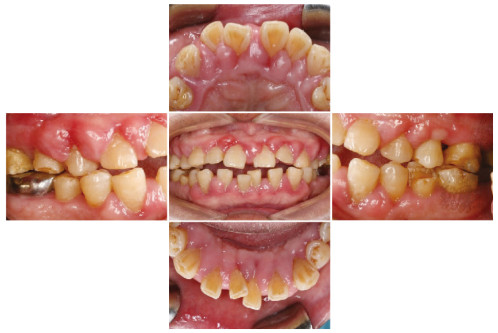
|
| 图 3 硝苯地平致牙龈肥大糖尿病患者牙周基础治疗后6个月口腔内照片 Fig. 3 Intraoral photography of nifedipine induced gingival hypertrophy patient with diabetes 6 months after periodontal treatment |
|
|
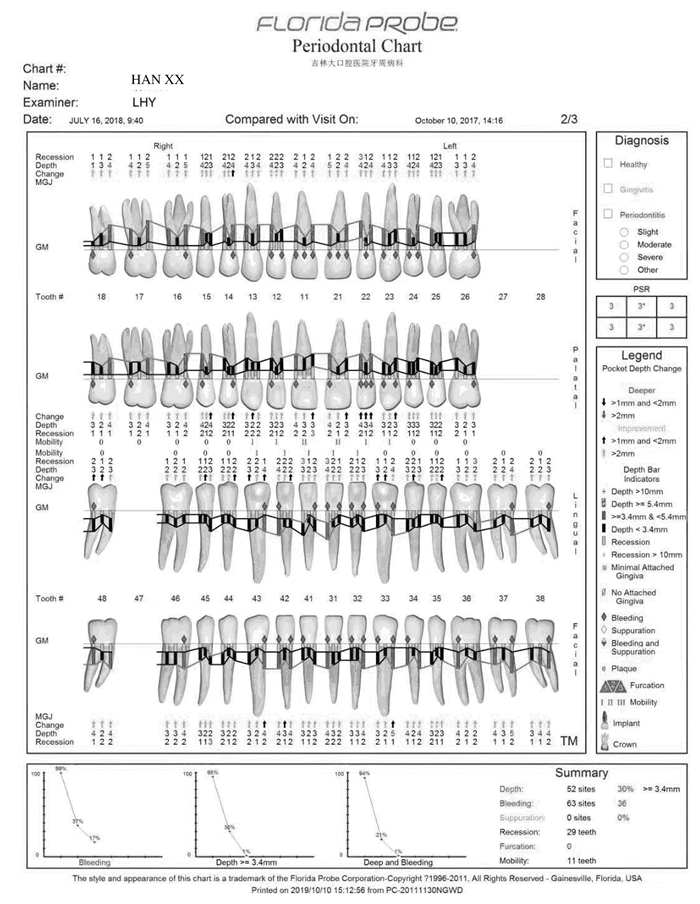
|
| 图 4 硝苯地平致牙龈肥大糖尿病患者基础治疗6个月后牙周临床指标电子探诊结果 Fig. 4 Periodontal clinical electronic probing result in nifedipine-induced gingival hypertrophy patient with diabetes 6 months after initial treatment |
|
|
|
| 图 5 硝苯地平致牙龈肥大糖尿病患者牙龈成形术后口腔内照片 Fig. 5 Intraoral photography of nifedipine-induced gingival hypertrophy patient with diabetes after gingivectomy |
|
|
|
| 图 6 硝苯地平致牙龈肥大糖尿病患者术后1年口腔内照片 Fig. 6 Intraoral photography of nifedipine induced gingival hypertrophy patient with diabetes 1 year after operation |
|
|

|
| 图 7 硝苯地平致牙龈肥大糖尿病患者术后1年牙周临床指标电子探诊结果 Fig. 7 Periodontal clinical electronic probing results in nifedipine- induced gingival hypertrophy patient with diabetes 1 year after operation |
|
|
随着社会老龄化进程的加速,患有高血压且需要长期服用降压药的老年患者不断增加。硝苯地平作为第1代钙离子拮抗剂,降压效果持久稳定,在临床上应用广泛, 但其在口腔的不良反应即药物性牙龈肥大也困扰着很多老年患者。研究[7]显示:约43.6%的高血压患者在服用硝苯地平后出现药物性牙龈肥大。63~67岁的男性较女性更容易患牙龈增生[1]。
硝苯地平引起的药物性牙龈肥大的病因机制尚不清楚,可能与年龄、性别和宿主等多因素有关联。其可能的机制:①硝苯地平能诱导角质细胞生长因子及其受体的变化。上皮角质细胞和间质成纤维细胞的活动可相互作用,调节基因表达,从而合成胶原增多,引起牙龈增生[8]。还有可能抑制成纤维细胞程序性死亡相关的转录因子—叉头框蛋白O1和半胱氨酸天冬酰胺特异蛋白酶-3(cysteinyl aspartate specific proteinase-3, caspase-3),从而上调抗凋亡蛋白Bcl-2表达和下调促凋亡蛋白Bax表达,牙龈成纤维细胞的程序性死亡明显下降,数量相对增多,合成胶原增多[9]。②硝苯地平可影响细胞内钙离子流动,降低整合素α2β1的结合水平,从而降低整合素介导的成纤维细胞吞噬胶原的功能[10],或者是抑制基质金属蛋白酶的活性而导致胶原蛋白的代谢受损[11],从而使胶原降解减少,导致牙龈增生。还有可能刺激血管紧张素Ⅱ表达,使肾素-血管紧张素系统中的中间化合物积聚,促进牙龈纤维化。③牙龈肥大的严重程度与口腔卫生不良密切相关, 菌斑在牙龈肥大中起重要作用[12]。SOUSA等[13]研究发现:药物性牙龈肥大与药理变量之间无关联,而与牙周的菌斑指数密切相关。服用硝苯地平后出现药物性牙龈肥大组,龈下菌斑中的牙龈卟啉单胞菌、中间普氏菌、齿垢密螺旋体和福赛拟杆菌检出量明显高于服用硝苯地平后未出现药物性牙龈肥大组。因此,菌斑微生物在诱导药物性牙龈肥大中起着重要作用[14]。菌斑诱导的牙龈炎症使龈沟液内大量细胞因子,如碱性成纤维细胞生长因子2(basic fibroblast growth factor-2,bFGF-2)、转化生子因子β1(transforming growth factor-β1,TGF-β1)、白细胞介素1(interleukin-1,IL-1)、白细胞介素6(interleukin-6, IL-6)、白细胞介素1 β(interleukin-1β,IL-1β)、血小板衍生生长因子β(platelet derived growth factor-β,PDGF-β)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和表皮生长因子(epidermal growth factor, EGF)聚集,改变牙龈局部微环境,增强牙龈对药物的敏感性,促进药物性牙龈肥大的发生,牙龈增生肥大后改变了原有的生理外形,加重菌斑的堆积,加重疾病的进展[15]。同时这些因子在牙龈组织高表达,促进成纤维细胞迁移、血管形成、胶原合成和细胞外基质改建[16]。
除了药物,牙龈肥大也与其他因素有关,包括糖尿病。VAN DIS等[17]报道了4例糖尿病患者牙龈肥大的病例,SUN等[2]和FAY等[3]分别报道了1例服用非洛地平的患有2型糖尿病患者牙龈肥大的病例。因此,糖尿病可被视为牙龈肥大发展的促成因素之一,特别是钙离子拮抗剂诱导的牙龈肥大。本文作者推测糖尿病导致牙龈肥大的发展可能是因为高血糖增加了局部炎症反应, 牙周炎症被认为是药物引起的牙龈增生的危险因素[18]。
药物性牙龈肥大虽然病因复杂,但菌斑微生物在疾病的发生发展中起到了至关重要的作用, 因此治疗该病,菌斑控制非常重要。目前药物性牙龈肥大治疗方法包括非手术治疗和手术治疗, 非手术治疗包括牙周基础治疗及菌斑控制[19]、抗菌药物治疗和降压药物替代治疗[20]等,有国外学者[21]报道控制牙周感染,采用非手术治疗药物性牙龈肥大可获得良好的效果。对于牙周基础治疗后仍然存在的牙龈组织的实质性增生,尤其是不能更换其他降压药物的患者,配合牙龈切除术和牙龈成形术,恢复牙周组织的生理外形,以利于菌斑控制[22], 从而减少或者阻止硝苯地平所致的药物性牙龈肥大的复发。
本例患者无法更换降压药,因此首先控制患者的血压和血糖达到临床操作要求的水平, 然后采用非手术治疗和手术治疗相结合的方法,先进行龈上洁治,龈下刮治,根面平整,抗菌药物治疗,消除牙龈炎症,控制牙周感染,并教会患者自我控制菌斑的方法;牙周基础治疗后6周进行牙周再评估,牙龈炎症得到明显控制,肿胀程度明显减轻, 但可见部分牙位龈下牙石暴露,再次行牙周基础治疗。再次牙周基础治疗后6个月牙周临床指标明显改善,仍有部分牙位牙龈肿胀增生, 针对这些区域分次行牙龈成形术,切除增生牙龈组织,恢复牙龈外形。牙周手术后进入牙周维护治疗,每3个月复诊1次,强化患者自行控制菌斑的方法,如刷牙、使用牙线和牙间隙刷,严格控制菌斑[23],减少复发。目前患者无复发,牙周临床指标基本稳定。
本病例首先控制全身系统疾病,以菌斑控制为导向,采用牙周基础治疗和手术治疗相结合的方法,治疗效果较为满意。但硝苯地平引起的药物性牙龈肥大在临床上容易复发,该病例观察时间较短,还需长期随访,定期维护,严格进行菌斑控制,控制血糖,以保证持久稳定的治疗效果。
| [1] |
LIVADA R, SHILOAH J. Calcium channel blocker-induced gingival enlargement[J]. J Hum Hypertens, 2014, 28(1): 10-14. DOI:10.1038/jhh.2013.47 |
| [2] |
SUN L, WANG C X, XI S G, et al. Felodipine associated gingival overgrowth in a type 2 diabetic patient:A case report and literature review[J]. Exp Ther Med, 2019, 17(5): 3399-3402. |
| [3] |
FAY A A, SATHEESH K, GAPSKI R. Felodipine influenced gingival enlargement in an uncontrolled type 2 diabetic patient[J]. J Periodontol, 2005, 76(7): 1217-1222. DOI:10.1902/jop.2005.76.7.1217 |
| [4] |
KULKARNI A V, KINI R, RAO P K, et al. Drug induced gingival enlargement:dentist's dilemma[J]. Cukurova Med J, 2018, 43(3): 722-725. DOI:10.17826/cumj.397485 |
| [5] |
CATON J G, ARMITAGE G, BERGLUNDH T, et al. A new classification scheme for periodontal and peri-implant disease and conditions-Introduction and key changes from the 1999 classification[J]. J Clin Periodontol, 2018, 45(20): s1-s8. |
| [6] |
KATO T, TAKIUCHIH, YAMAGUCHI M, et al. Ca-channel blocker-induced gingival overgrowth that improved with non-surgical therapy during visiting care:a case report[J]. Gerodontology, 2015, 32(4): 318-320. DOI:10.1111/ger.12203 |
| [7] |
QUENEL L, KERIBIN P, GIRAN G, et al. Amlodipine-induced gingival enlargement:A case report[J]. J Stomatol Oral Maxillofac Surg, 2019, 5(2): 1-4. |
| [8] |
DI C P, SUN Y, ZhAO L, et al. Effect of nifedipine on the expression of keratinocyte growth factor and its receptor in cocultured/monocultured fibroblasts and keratinocytes[J]. J Periodont Res, 2013, 48(6): 740-747. |
| [9] |
VIDAL F, DE SOUZAR C, FERREIRA D C, et al. Influence of 3 calcium channel blockers on gingival overgrowth in a population of severe refractory hypertensive patients[J]. J Periodont Res, 2018, 53(5): 721-726. DOI:10.1111/jre.12556 |
| [10] |
HEASMAN P, HUGHES F J. Drugs, medications and periodontal disease[J]. Br Dent J, 2014, 217(8): 411-419. DOI:10.1038/sj.bdj.2014.905 |
| [11] |
KANNO C M, OLIVEIRA J A, GARCIA J F, et al. Effects of cyclosporin, phenytoin, and nifedipine on the synthesis and degradation of gingival collagen in tufted capuchin monkeys (Cebus apella):Histochemical and MMP-1 and -2 and collagenⅠgene expression analyses[J]. J Periodontol, 2008, 79(1): 114-122. DOI:10.1902/jop.2008.070267 |
| [12] |
HATAHIRA H, ABE J, HANE Y, et al. Drug-induced gingival hyperplasia:a retrospective study using spontaneous reporting system databases[J]. J Pharm Health Care Sci, 2017, 3: 19. |
| [13] |
SOUSA C P, NAVARRO C M, SPOSTO M R. Clinical assessment of nifedipine-induced gingival overgrowth in a group of brazilian patients[J]. ISRN Dent, 2011, 2011: 102047. |
| [14] |
刘海杰, 潘亚萍. 牙周致病微生物与药物性牙龈肥大的关系[J]. 口腔医学研究, 2015, 31(4): 370-372. |
| [15] |
PAVLIC V, ZUBOVIC N, LLIC S, et al. Untypical amlodipine-induced gingival hyperplasia[J]. Case Rep Dent, 2015, 2015: 756976. |
| [16] |
RAMIÍREZ-RÁMIZ A, BRUNET-LLOBET L, LAHOR-SOLER E, et al. On the cellular and molecular mechanisms of drug-induced gingival overgrowth[J]. Open Dent J, 2017, 11: 420-435. DOI:10.2174/1874210601711010420 |
| [17] |
VAN DIS M L, ALLEN C M, NEVILLE B W. Erythematous gingival enlargement in diabetic patients:A report of 4 cases[J]. JOral Maxillofac Surg, 1988, 46(9): 794798. |
| [18] |
MATSUDA S, OKANOBU A, HATANO S, et al. Relationship between periodontal inflammation and calcium channel blockers induced gingival overgrowth-a cross-sectional study in a Japanese population[J]. Clin Oral Investig, 2019, 23(11): 4099-4105. DOI:10.1007/s00784-019-02846-8 |
| [19] |
DE CARVALHO FARIAS B, CABRAL P A, GUSMAO E S, et al. Non-surgical treatment of gingival overgrowth induced by nifedipine:a case report on an elderly patient[J]. Gerodontology, 2010, 27(1): 76-80. DOI:10.1111/j.1741-2358.2009.00273.x |
| [20] |
SAM G, SEBASTIAN S C. Nonsurgical management of nifedipine induced gingival overgrowth[J]. Case Rep Dent, 2014, 2014: 741402. |
| [21] |
PUNDIR A J, PUNDIR S, YELTIWAR R K, et al. Treatment of drug-induced gingival overgrowth by full-mouth disinfection:A non-surgical approach[J]. J Indian Soc Periodontol, 2014, 18(3): 311-315. DOI:10.4103/0972-124X.134567 |
| [22] |
MAVROGIANNIS M, ELLIS J S, SEYMOUR R A, et al. The efficacy of three different surgical techniques in the management of drug-induced gingival overgrowth[J]. J Clin Periodontol, 2006, 33(9): 677-682. DOI:10.1111/j.1600-051X.2006.00968.x |
| [23] |
CARTY O, WALSH E, ABDELSALEM A, et al. Case report:drug-induced gingival overgrowth associated with the use of a calcium channel blocker (amlodipine)[J]. J Ir Dent Assoc, 2015, 61(5): 248-251. |
 2020, Vol. 46
2020, Vol. 46


