扩展功能
文章信息
- 张利芳, 蔡琳, 王云华, 张克实, 乌日娜
- ZHANG Lifang, CAI Lin, WANG Yunhua, ZHANG Keshi, WU Rina
- 硒蛋白P基因多态性与乳头状甲状腺癌发病风险的关联性分析
- Analysis on association between selenoprotein P polymorphism and risk of papillary thyriod carcinoma
- 吉林大学学报(医学版), 2020, 46(02): 383-388
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 383-388
- 10.13481/j.1671-587x.20200229
-
文章历史
- 收稿日期: 2019-05-03
2. 内蒙古自治区包头市肿瘤医院检验科, 内蒙古 包头 014030;
3. 包头医学院第二附属医院普外科, 内蒙古 包头 014030;
4. 包头医学院第一附属医院超声科, 内蒙古 包头 014010
2. Department of Clinical Laboratory, Baotou Tumor Hospital, Inner Mongolia Autonomous Region, Baotou 014030, China;
3. Department of General Surgery, Second Affiliated Hospital, Baotou Medical College, Baotou 014030, China;
4. Department of Medical Ultrasonic, First Affiliated Hospital, Baotou Medical College, Baotou 014010, China
硒是维持人类健康的一种必需微量元素,参与体内多种代谢活动。缺硒或硒中毒与多种疾病的发生有关,如心血管疾病、糖尿病、肿瘤、免疫和甲状腺功能低下等[1-4]。硒与甲状腺之间存在着更为密切的关系,硒参与甲状腺激素的合成、分泌与代谢,其在甲状腺中的含量最高,硒含量异常与多种甲状腺疾病有关,如甲状腺肿、免疫性甲状腺病(桥本氏甲状腺炎和Graves病)和甲状腺癌等[5-8]。
硒蛋白P(selenoprotein P,Sepp1)是硒蛋白家族中非常重要的成员之一,是血硒的主要储运蛋白,对于维持血硒含量稳定方面具有重要作用。同时Sepp1还具有抗氧化酶的活性,与其他抗氧化酶一起构成机体防御屏障,在保护机体免受氧化损伤、维持结构蛋白和基因组DNA的稳定方面起重要作用[9]。国内外研究[10-13]表明:Sepp1与心血管疾病、糖尿病、老年痴呆和恶性肿瘤等发病相关。研究者[9, 14-15]分别对不同位点Sepp1基因多态性与结直肠癌、乳腺癌和前列腺癌等进行了关联研究,结果不尽一致。基于Sepp1重要生理功能及其在恶性肿瘤中异常基因表达模式,本课题组选择内蒙古地区汉族人群乳头状甲状腺癌(papillary thyriod carcinoma,PTC)患者为研究对象,采用一种快速简易的点突变检测技术——等位基因特异性聚合酶链式反应(allele-specific polymerase chain reaction,AS-PCR)技术检测PTC患者Sepp1基因rs7579位点多态性,并进行分层分析和结合非遗传因素联合分析综合探讨Sepp1基因遗传易感性与PTC患病风险的关联性,研究内容与方法均与以往报道不同,旨在为临床甲状腺癌的防治提供可靠的实验室依据。
1 资料与方法 1.1 研究对象收集2017年12月—2018年12月在内蒙古自治区包头市肿瘤医院、包头医学院第一附属医院和包头医学院第二附属医院经临床组织病理学确诊的新发汉族PTC患者138例(病例组),其中女性104例,男性34例,平均年龄(49.39±8.47)岁。收集同期社区健康者140人(对照组),其中女性105人,男性35人,平均年龄(47.91±6.60)岁,经问卷调查排除相关肿瘤史,同时记录2组研究对象吸烟、饮酒、碘盐摄入、放射线接触和精神状态等情况(吸烟界定标准:每天1支以上,时间超过6个月;饮酒界定标准:平均每周1次,时间超过1年;碘盐摄入标准:日常食入含碘盐,时间不少于5年;放射线接触史:近5~10年接受过放射线暴露,如做CT等影像检查及职业接触等;精神状态好标准:主观感觉体力好,睡眠质量好,情绪稳定,反之为精神状态差,时间超过3年;工作压力小标准:主观感觉工作轻松、愉快,反之为压力大,时间超过3年)。经样本总体检验病例组和对照组研究对象年龄和性别匹配(年龄:t=1.432,P=0.153;性别:χ2=0.005,P=0.944),具有可比性。
1.2 基因组DNA提取与引物合成采集研究对象空腹全血2mL,EDTA抗凝,提取血液基因组DNA。通过PubMed-SNP数据库查询Sepp1基因rs7579位点两侧基因序列,应用Premier 5.0软件设计引物。见表 1。
| dbSNP | PCR primer(5′-3′) | Length(bp) |
| G-Type | F1:TGACCTTCAAACTAAATATTTAAAATCGG R2:CTCCATCATAAAAAATATGGTTTGAGTC |
212 |
| A-Type | F2:GAGGAGAACATAACTGAATCTTGTCAGT R1:TGTGTCTAGACTAAATTGGGGAGTATTTT |
183 |
| rs7579 | F2:GAGGAGAACATAACTGAATCTTGTCAGT R2:CTCCATCATAAAAAATATGGTTTGAGTC |
338 |
特异性内引物F1和R1分别在3′端倒数第3位引入1个人为的错配碱基(下划线部分)以便于增加分型的特异性。F1和R2组合检测G等位基因,其PCR产物片段大小为212 bp。F2和R1组合检测A等位基因,其PCR产物片段大小为183 bp。外引物F2和R2组合扩增出的PCR产物片段大小为338 bp,作为阳性对照。引物由生工生物工程(上海)股份有限公司合成。
1.3 AS-PCR法进行扩增反应体系为25 μL,包括DNA模板6 μL(约100 ng),F2和R2 (10 μmol·L-1)各0.4 μL,F1和R1(10μmol·L-1)各0.8 μL,2×Taq PCR Master Mix 12.5 μL,去离子水4.1 μL。PCR反应条件:95℃预变性5 min;94℃变性30 s,59℃退火30 s,72℃延伸30 s,共循环35次;最后72℃延伸5 min。PCR产物于3%琼脂糖凝胶电泳进行鉴定。随机选取50个PCR产物送生工生物工程(上海)股份有限公司进行测序验证,所用引物为表 1中的F2和R2,PCR反应体系为50 μL,包括DNA模板12 μL(约100 ng),F2和R2(10μmol·L-1)各2 μL,2×Taq PCR Master Mix 25 μL,去离子水9 μL。反应条件同AS-PCR法。
1.4 统计学分析采用SPSS 20.0统计软件进行统计学分析。群体样本进行Hardy-Weinberg平衡定律检验;2组研究对象基因型和等位基因频数分布比较采用χ2检验,采用非条件Logistic回归分析计算风险比(OR)及其95%可信区间(CI)描述相对风险度,双侧检验以P<0.05为差异有统计学意义。采用非条件多因素Logistic回归分析基因型、吸烟和饮酒等与PTC发病的关系,以P<0.1为差异有统计学意义。
2 结果 2.1 Sepp1基因rs7579位点基因分型AS-PCR法检测后可见3种基因型:产生338、212和183 bp3个条带的为GA基因型,产生338和183 bp 2个条带的为AA基因型,产生338和212 bp 2个条带的为GG基因型。见图 1。
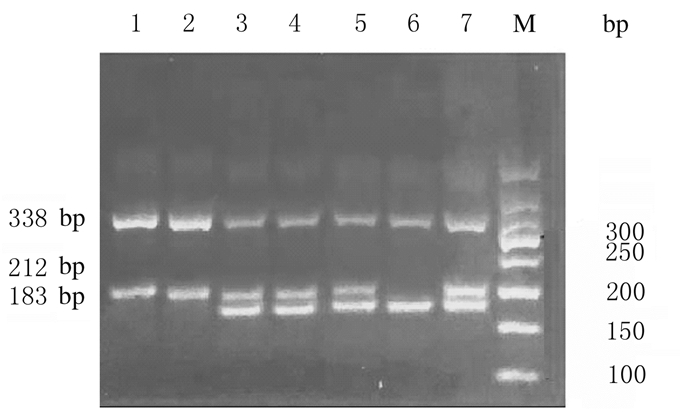
|
| Lane 1, 2:GG genotype; Lane 3, 4, 5, 7:GA genotype; Lane 6:AA; M:50 bp DNA marker. 图 1 Sepp1基因rs7579位点基因分型电泳图 Fig. 1 Electrophoregram of genetypes at rs7579 site of Sepp1 gene |
|
|
Sepp1基因rs7579位点3种基因型测序结果与AS-PCR法检测结果一致。见图 2。
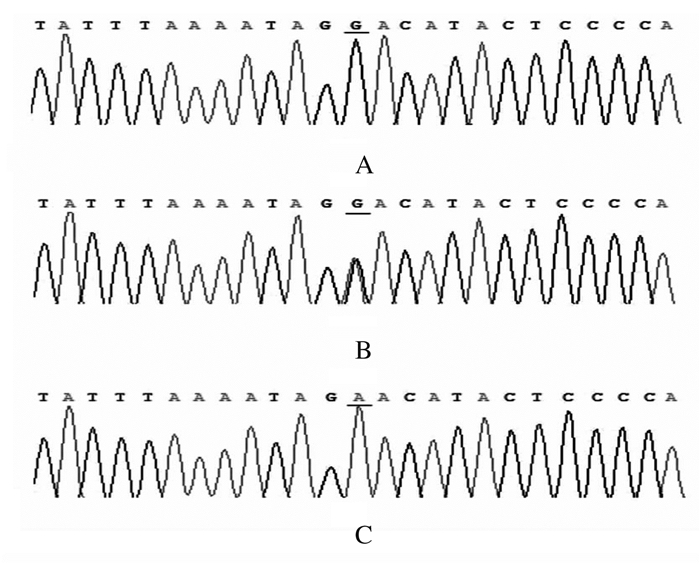
|
| A:GG genotype; B:GA genotype; C:AA genotype. 图 2 Sepp1基因rs7579位点PCR产物测序结果 Fig. 2 Sequencing results of PCR products of rs7579 site of Sepp1 gene |
|
|
为检验研究对象Sepp1基因rs7579位点多态性分布是否符合Hardy-Weinberg平衡定律,对研究对象的基因型频数分布进行遗传平衡检验,结果显示:所观察的样本具有群体代表性(χ2=0.642,P=0.773)。病例组与对照组GG、GA和AA 3种基因型频数分布比较差异无统计学意义(χ2=0.622,P= 0.733);等位基因G和A频数分布比较差异亦无统计学意义(χ2=0.673,P=0.412)。见表 2。
| [η/%(n)] | |||||||||||||||||||||||||||||
| Group | n | Genotypic frequency | χ2 | P | Allelic frequency | χ2 | P | ||||||||||||||||||||||
| GG | GA | AA | G | A | |||||||||||||||||||||||||
| Case Control |
138 140 |
53.62(74) 49.29 (69) |
36.96(51) 39.29(55) |
9.42(13) 11.42 (16) |
0.622 | 0.733 | 72.10(199) 68.93(193) |
27.90(77) 31.07(87) |
0.673 | 0.412 | |||||||||||||||||||
在年龄分层中,≥50岁病例组和对照组研究对象GG、GA和AA基因型频数分布比较差异有统计学意义(χ2=7.717,P= 0.028),PTC患者AA基因型频数分布明显低于对照者(P<0.05),说明携带A等位基因的AA和(或)GA基因型研究对象患PTC的风险低于GG基因型者(OR=0.481,95%CI:0.267~0.866);而病例组中 < 50岁组、男性组、女性组、无淋巴转移组、淋巴转移组、肿瘤直径≥2 cm组、肿瘤直径 < 2 cm组PTC患者GG、GA和AA基因型频数分布与对照组比较差异均无统计学意义(χ2=1.887,P=0.389;χ2=0.451,P=0.797;χ2=0.165,P=0.921;χ2=1.369,P=0.504;χ2=3.845,P=0.146;χ2=0.713,P=0.700;χ2=0.396,P=0.821)。提示Sepp1基因rs7579位点单核苷酸多态性(single nucleotide polymorphisms,SNPs)对PTC患病风险的影响与年龄有关联,但与性别、淋巴结转移和肿瘤大小无关联。见表 3。
| [η/%(n)] | |||||||||||||||||||||||||||||
| Item | Case group | Control group | |||||||||||||||||||||||||||
| n | GG | GA | AA | n | GG | GA | AA | ||||||||||||||||||||||
| Age(year) | |||||||||||||||||||||||||||||
| ≥50 | 65 | 69.23(45) | 24.62(16) | 6.15(4) | 63 | 47.62(31) | 39.68(25) | 11.11(7) | |||||||||||||||||||||
| <50 | 73 | 39.73(29) | 47.95(35) | 12.32(9) | 77 | 49.35(38) | 38.96(30) | 11.68(9) | |||||||||||||||||||||
| Gender | |||||||||||||||||||||||||||||
| Female | 104 | 53.84(56) | 37.50(39) | 8.66(9) | 105 | 49.52(52) | 39.05(42) | 8.58(11) | |||||||||||||||||||||
| Male | 34 | 52.94(18) | 35.29(12) | 11.76(4) | 35 | 48.57(17) | 37.14(13) | 14.28(5) | |||||||||||||||||||||
| Lymph node metastasis | |||||||||||||||||||||||||||||
| No | 131 | 54.20(71) | 36.64(48) | 9.16(12) | 140 | 49.29(69) | 39.29(55) | 11.42(16) | |||||||||||||||||||||
| Yes | 7 | 42.86(3) | 42.86(3) | 14.28(1) | 140 | 49.29(69) | 39.29(55) | 11.42(16) | |||||||||||||||||||||
| Tumor nodule size | |||||||||||||||||||||||||||||
| ≥2 cm | 15 | 60.00(9) | 33.33(5) | 6.67(1) | 140 | 49.29(69) | 39.29(55) | 11.42(16) | |||||||||||||||||||||
| <2 cm | 123 | 52.85(65) | 37.40(46) | 9.75(12) | 140 | 49.29(69) | 39.29(55) | 11.42(16) | |||||||||||||||||||||
以发生PTC为应变量(患者=1,正常=0),以Sepp1基因型(GG或GA基因型=1,AA型=0)、吸烟(是=1,否=0)、饮酒(是=1,否=0)、体质量指数(body mass index,BMI)(< 18.5kg·m-2=0,18.5~23.9kg·m-2=1,≥24.0kg·m-2=2)、碘盐摄入(是=1,否=0)、放射接触史(有=1,无=0)、精神状态(差=1,好=0)、工作压力(大=1,小=0)等影响因素为自变量,进行多因素非条件Logistic回归分析,结果显示:高BMI、碘盐摄入和工作压力大是PTC发病的危险因素(OR=1.149,95%CI:1.004~1.264;OR=5.112,95%CI:1.597~16.367;OR=2.848,95%CI:1.549~5.235,均P<0.1),精神状态好是PTC保护性因素(OR=0.347,95%CI:0.203~ 0.895;P<0.1)。见表 4。
| Factor | B | S.E, | Wals | Sig. | Exp (B) | Exp(B):95%CI |
| Genotypic frequency of Sepp1 | 0.374 | 0.200 | 3.502 | 0.081 | 1.623 | 0.974-2.163 |
| Smoking | -0.932 | 0.501 | 3.461 | 0.063 | 0.538 | 0.148-1.051 |
| Alcohol drinking | 0.035 | 0.483 | 0.005 | 0.942 | 1.036 | 0.402-2.670 |
| BMI | 0.139 | 0.049 | 8.076 | 0.004 | 1.149 | 1.044-1.264 |
| Iodized salt intake | 1.632 | 0.594 | 7.553 | 0.006 | 5.112 | 1.597-16.367 |
| Radiation exposure history | -0.624 | 0.876 | 0.508 | 0.476 | 0.536 | 0.096-2.980 |
| Mental state | -0.853 | 0.379 | 5.079 | 0.024 | 0.347 | 0.203-0.895 |
| Working pressure | 1.047 | 0.311 | 11.345 | 0.001 | 2.848 | 1.549-5.235 |
硒在人体中主要以硒代半胱氨酸的形式存在于各种硒蛋白中,硒蛋白具有广泛的生理作用,如参与免疫反应、甲状腺激素的代谢、保护细胞免受氧化损伤和男性精子生成等[9, 16]。Sepp1是硒蛋白家族中非常重要的成员之一,是血硒的储运蛋白,包含几乎50%的总血浆硒[17]。Sepp1基因定位于人染色体5q31,包含7个外显子,全长16 000 bp,由2个结构域构成,即大片段N末端和小片段C末端。Sepp1由肝脏合成分泌入血,进入外周组织后C端片段分泌硒被组织细胞摄取,以维持细胞正常生理功能,N末端与细胞膜有较强的亲和力,释放了硒的Sepp1结合至细胞膜上可发挥抗氧化作用。Sepp1在维持血硒含量稳定和保护机体免受氧化损伤方面具有重要作用[18-19]。
人类Sepp1基因SNPs位点现已发现1万多个,且这些多态性位点与Sepp1的存在形式、功能的发挥及与疾病的患病风险有密切关联,其中有关rs3877899和rs7579位点的研究最多。Sepp1基因SNPs与肿瘤遗传易感性关系的研究较多,但结果缺乏一致性。MÉPLAN等[14]以丹麦975例乳腺癌患者与相同时间健康对照者作为研究对象进行Sepp1基因多态性与乳腺癌遗传易感性关联性分析,结果显示rs3877899多态性位点与导管性乳腺癌有关。STEINBRECHER等[15]发现:在欧洲人群中Sepp1基因rs7579位点多态性与前列腺癌患病不具有相关性;张龙等[9]研究湖南省人群结直肠癌患者Sepp1基因rs7579位点基因多态性发现:A等位基因在55岁以上肿瘤组与对照组人群中存在差异。
本研究结果显示:BMI、摄入碘盐、精神状态和工作压力是PTC发病危险因素,提示肥胖、摄入含碘的盐,精神压力大和睡眠不足等增加PTC患病风险,在生活中应该注意相关方面的调节。本研究进一步检测Sepp1基因rs7579位点多态性结果显示:病例组和对照组研究对象GG、GA、AA基因型和G、A等位基因频数分布比较差异虽无统计学意义,但根据临床特征进行分层分析发现:年龄≥50岁组PTC患者GG、GA、AA基因型频数分布与健康对照者比较差异有统计学意义,PTC患者AA基因型频数分布明显低于对照者,说明携带A等位基因的AA和(或)GA基因型个体患PTC的风险低于GG基因型者(OR=0.481,95%CI:0.267~0.866),说明A等位基因可能是≥50岁组人群降低PTC发病的保护性因素之一。这与张龙等[9]研究结果接近。rs7579位点位于Sepp1 3′UTR,该位点的基因变异可以影响Sepp1合成过程中硒代半胱氨酸的插入,影响Sepp1的合成及其在血中的存在形式,进而影响其功能的发挥。健康人血浆中主要存在2种Sepp1,即相对分子质量为51 000和61 000的Sepp1[17],后者运输硒的能力强。MÉPLAN等[20]研究Sepp1基因rs7579多态性位点发现:AA基因型人群中相对分子质量为61 000的Sepp1水平高于GG基因型人群,随年龄不断增长,细胞代谢活性降低,机体运输硒的能力也随着降低。本研究中年龄≥50岁组对照人群rs7579位点AA基因型频数高于PTC人群,即含大相对分子质量的Sepp1较多,可能一定程度上保证了机体对硒的需求,进而降低了PTC的患病风险。本研究结果与以往研究结果不尽一致,分层分析和多因素回归分析提示了PTC发病的复杂性,这可能与选择的人群、地区和样本有关,还需进一步验证。
综上所述,Sepp1基因rs7579位点基因突变与环境因素(BMI、摄入碘盐、精神状态和工作压力)可能共同或交互作用影响PTC患病,可采取高危策略加强PTC群体预防,除筛查具有易感基因型的个体,更要加强健康生活方式教育,减少人群吸烟和碘盐摄入等暴露,以降低PTC发病风险。
| [1] |
张亚萍, 王文英, 刘增加, 等. 硒与内分泌疾病关系的研究进展[J]. 西北国防医学杂志, 2019, 40(8): 524-528. |
| [2] |
朱洁, 高伟娜, 刘冲, 等. 妊娠期糖尿病孕妇妇产后糖代谢异常的危险因素和孕中期血清硒蛋白P的预测价值[J]. 郑州大学学报(医学版), 2019, 54(5): 750-753. |
| [3] |
AVERY J C, HOFFMANN P R. Selenium, selenoproteins and immunity[J]. Nutrients, 2018, 10(9): E1203. DOI:10.3390/nu10091203 |
| [4] |
XIAO L, YUAN J, YAO Q, et al. A case-control study of selenoprotein genes polymorphisms and autoimmune thyroid diseases in a Chinese population[J]. BMC Med Genet, 2017, 18(1): 54-59. DOI:10.1186/s12881-017-0415-6 |
| [5] |
李江平, 晋建华. 微量元素硒与甲状腺疾病关系的研究进展[J]. 中西医结合心血管杂志, 2016, 4(26): 5-7. |
| [6] |
连小兰, 白耀. 硒与甲状腺[J]. 药品评价, 2013, 10(19): 8-11. DOI:10.3969/j.issn.1672-2809.2013.19.002 |
| [7] |
吴兆宇, 赵金鹏, 纪艳超. 微量元素碘、硒与氟与甲状腺疾病相关性的研究进展[J]. 中国医药导报, 2014, 11(10): 153-155. |
| [8] |
白超, 魏巍, 张丽, 等. 乌鲁木齐地区人碘和硒营养状态与甲状腺癌相关性研究[J]. 新疆医科大学学报, 2016, 39(9): 1183-1186. DOI:10.3969/j.issn.1009-5551.2016.09.027 |
| [9] |
张龙, 朱燕, 王晓春, 等. 硒蛋白P基因多态性与结直肠癌遗传易感性的关联性分析[J]. 吉林大学学报(医学版), 2015, 41(5): 980-985. |
| [10] |
樊华英, 施毕旻, 李慧娟, 等. 血清硒蛋白P与老年2型糖尿病合并非酒精性脂肪性肝病的相关性研究[J]. 中国糖尿病杂志, 2019, 27(4): 250-253. |
| [11] |
TAKATA Y, XIANG YONG Y B, BURK R F, et al. Plasma selenoprotein P concentration and lung cancer risk:Results from a case-control study nested within the Shanghai Men's Health Study[J]. Carcinogenesis, 2018, 39(11): 1352-1358. DOI:10.1093/carcin/bgy103 |
| [12] |
JUJIC A, MELANDER O, BERGMANN A, et al. Selenoprotein P deficiency and risk of mortality and rehospitalization in acute heart failure[J]. J Am Coll Cardiol, 2019, 74(7): 1009-1011. DOI:10.1016/j.jacc.2019.06.023 |
| [13] |
NIKOLAY D, EVGENII J, GEIR B, et al. Selenium, selenoprotein P, and Alzheimer's disease:is there a link?[J]. Free Radic BioL Med, 2018, 127(1): 124-133. |
| [14] |
MÉPLAN C, DRAGSTED L O, RAVN HAREN G, et al. Association between polymorphisms in glutathione peroxidase and selenoprotein P genes, glutathione peroxidase activity, HRT use and breast cancer risk[J]. PLoS One, 2013, 8(9): e73316. DOI:10.1371/journal.pone.0073316 |
| [15] |
STEINBRECHER A, MEPLAN C, HESKETH J, et al. Effects of selenium status and polymorphisms in selenoprotein genes on prostate cancer risk in a prospective study of European men[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(11): 2958-2968. DOI:10.1158/1055-9965.EPI-10-0364 |
| [16] |
赵东海, 马嫣妍, 杨柠, 等. 硒及硒蛋白与精子发生[J]. 吉林医药学院学报, 2016, 37(5): 365-369. |
| [17] |
卢文丽, 方肇勤. SEPP1基因与肿瘤的发展[J]. 中国中医基础医学杂志, 2017, 23(12): 1790-1794. |
| [18] |
KUROKAWA S, ERIKSSON S, ROSE K L, et al. Sepp1(UF) forms are N-terminal selenoprotein P truncations that have peroxidase activity when coupled with thioredoxin reductase-1[J]. Free Radic BioL Med, 2014, 69: 67-76. DOI:10.1016/j.freeradbiomed.2014.01.010 |
| [19] |
SHETTY S P, SHAH R, COPELAND P R. Regulation of selenocysteine incorporation into the selenium transportprotein, selenoprotein P[J]. J Biol Chem, 2014, 289(36): 25317-25326. DOI:10.1074/jbc.M114.590430 |
| [20] |
MÉPLAN C, NICOL F, BURTLE B T, et al. Relative abundance of selenoprotein P isoforms in human plasma depends on genotype, Se intake, and cancer status[J]. Antioxid Redox Signal, 2009, 11(11): 2631-2640. DOI:10.1089/ars.2009.2533 |
 2020, Vol. 46
2020, Vol. 46


