扩展功能
文章信息
- 宋红云, 潘莹, 安福润, 张家奎, 杨冬冬, 翟志敏
- SONG Hongyun, PAN Ying, AN Furun, ZHANG Jiakui, YANG Dongdong, ZHAI Zhimin
- 伴有复杂核型的急性白血病患者的临床特征及其对预后的影响
- Clinical characteristics of acute leukemia patients with complex karyotypes and their effects on prognosis
- 吉林大学学报(医学版), 2020, 46(02): 377-382
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 377-382
- 10.13481/j.1671-587x.20200228
-
文章历史
- 收稿日期: 2019-04-21
近年来随着细胞遗传学技术的发展,染色体核型检测对急性白血病(acute leukemia,AL)的诊断、分型、治疗和预后的价值越来越受到重视[1]。目前国内外许多指南及专家共识均已将染色体核型结果加入到AL患者的危险度分层及预后判断的指标中。其中复杂核型是指存在3种或3种以上附加异常核型染色体[1]。美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)2017年(指南)、中国急性髓系白血病(acute myeloid leukemia,AML)和急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)指南均将复杂核型纳入预后不良组[2-5]。然而,由于复杂核型的构成比较低,目前对该类患者的相关研究较少,且病例数不多。因此,进一步扩大样本量,研究复杂核型患者的临床特征与染色体核型正常的患者之间的差异,以及进一步探讨两组间预后差异,对进一步了解复杂核型异常对AL患者预后的影响具有一定价值。目前有关复杂核型构成比研究[6-7]的结果不一致。国外研究[7-9]显示:复杂核型对患者治疗疗效及预后均有负面作用,而国内相关报道少见。本研究分析本院近10年诊断的复杂核型AL患者的临床资料,并与同期非复杂核型AL患者进行比较,探讨分析复杂核型AL患者的临床特征及其对预后的影响。
1 资料与方法 1.1 一般资料选取2008年10月—2018年6月于安徽医科大学第二附属医院血液科诊断、并常规行染色体检查的281例AL患者作为筛查对象,其中复杂核型和非复杂核型AL患者分别为33和248例,33例复杂核型AL患者作为复杂核型组,从248例非复杂核型AL患者中随机抽取43例患者作为非复杂核型组[10],随访1年以上。2组患者年龄和性别等指标比较差异无统计学意义(P>0.05)。以上病例诊断依据初诊患者的临床表现、血象、骨髓细胞形态和化学染色及免疫分型等检测结果并参照《血液病诊断及疗效标准》第3版[11]而确定。排除标准:①诊断急性早幼粒细胞白血病;②骨髓染色体培养失败;③伴有严重心、肺、肝和肾等疾病。
1.2 检测方法抽取骨髓3 mL,肝素抗凝送检染色体,采用骨髓细胞24小时短期培养法,按常规制备染色体,染色体检查采用G显带,核型的命名参照《人类细胞遗传学国际命名体制(ISCN)2005》[12]标准。每例分析15~20个中期分裂细胞。
1.3 治疗方法和疗效判断诱导化疗AML患者采用标准的DA、IA(柔红霉素、伊达比星和阿糖胞苷)3+7标准方案治疗,ALL患者采用标准的DVCP±L方案(柔红霉素、长春地辛、环磷酰胺、强的松和左旋门冬酰氨酶),伴Ph染色体阳性加酪氨酸酶抑制剂类药物治疗,混合AL患者采用DVCLP。疗效标准参照张之南《血液病诊断及疗效标准》第3版[11]。无复发生存时间(recurrence-free survival,RFS)的定义为疾病缓解到复发或死亡的时间。总生存时间(overall survival,OS)的定义为确诊至死亡或结束随访的时间。
1.4 统计学分析采用SPSS 17.0统计软件进行统计学分析。2组患者临床特征及疗效比较采用χ2检验和Fisher精确概率法,生存分析采用Kaplan-Meier方法。以P<0.05为差异有统计学意义。
2 结果 2.1 2组患者临床特征本研究中,复杂核型AL在AL(除外急性早幼粒细胞白血病)患者中的构成比为11.7%(33/281,AML 11.2%,ALL 12.8%),33例复杂核型AL患者,其中AML 21例(M0 1例、M2 11例、M4 2例、M5 2例,不能具体分型5例),ALL 10例(B-ALL 9例、T-ALL 1例),混合细胞性AL 2例。初诊时外周血白细胞计数:≥100×109L-1的AML患者有1例,占4.8%(1/21);≥30×109L-1的B-ALL患者有4例,占44.4%(4/9);≥100×109L-1的T-ALL患者有1例,占100%(1/1)。贫血患者20例,占60.6%(20/33);重度贫血者10例,占30.3%(10/33)。血小板减少24例,血小板计数小于10×109L-1者5例,占15.2%(5/33)。复杂核型组与非复杂核型组患者在性别、年龄、治疗前血细胞、骨髓及外周血原始细胞、骨髓CD34阳性率及是否存在髓外浸润等指标比较差异均无统计学意义(P>0.05)。见表 1。
| [n(η/%)] | |||||||||||||||||||||||||||||
| Clinical characteristic | Complex karyotype (n=33) |
Non-complex karyotype (n=43) |
χ2 | P | |||||||||||||||||||||||||
| Age(year) | |||||||||||||||||||||||||||||
| <60 ≥60 |
19(57.6) 14(42.4) |
33(76.7) 10(23.3) |
3.175 | 0.075 | |||||||||||||||||||||||||
| Gender | |||||||||||||||||||||||||||||
| Male Female |
21(63.6) 12(36.4) |
23(53.5) 20(46.5) |
0.789 | 0.374 | |||||||||||||||||||||||||
| Neutrophil(×109L-1) | |||||||||||||||||||||||||||||
| <2.5 ≥2.5 |
23(69.7) 10(30.3) |
32(74.4) 11(25.6) |
0.208 | 0.648 | |||||||||||||||||||||||||
| Hemoglobin(g·L-1) | |||||||||||||||||||||||||||||
| <60 ≥60 |
11(33.3) 22(66.7) |
10(23.3) 33(76.7) |
0.948 | 0.330 | |||||||||||||||||||||||||
| Platelets(×109L-1) | |||||||||||||||||||||||||||||
| <10 ≥10 |
5(15.2) 28(84.8) |
4(9.3) 39(90.7) |
0.612 | 0.490 | |||||||||||||||||||||||||
| Bone marrow primordial cells | |||||||||||||||||||||||||||||
| <60% ≥60% |
15(45.5) 18(54.5) |
22(51.2) 21(48.8) |
0.482 | 0.488 | |||||||||||||||||||||||||
| Extramedullary infiltration | |||||||||||||||||||||||||||||
| Yes No |
3(9.1) 30(90.9) |
2(4.7) 41(95.3) |
0.599 | 0.647 | |||||||||||||||||||||||||
去除1例复杂核型和3例非复杂核型AML患者诱导化疗过程中拒绝继续治疗出院失访者,可评估临床疗效的复杂核型组和非复杂核型组患者分别为32和40例。复杂核型患者19例获完全缓解(complete remission,CR)患者3例于半年内出现复发,6例于1年内出现骨髓复发,1例于CR 4个月后发生中枢浸润髓外复发;非复杂核型AL患者34例获CR患者中6例于半年内出现骨髓复发;11例于1年内出现骨髓复发,1例于CR 2个月后出现胸腔侵犯髓外复发,1例于CR 6个月后出现中枢浸润髓外复发。进一步分析影响复杂核型AL患者CR率的因素,复杂核型AL患者中染色体复杂程度高(复杂核型数目>5)患者CR率为41.2%(7/17),染色体复杂程度低(3≤复杂核型数目≤5)患者CR率为80.0%(12/15),二者比较差异有统计学意义(χ2=4.979,P=0.036)。经1个疗程诱导治疗后2组患者缓解情况见表 2。
| [n(η/%)] | |||||||||||||||||||||||||||||
| Group | n | CR | Non-CR | χ2 | P | ||||||||||||||||||||||||
| AL patient | |||||||||||||||||||||||||||||
| Complex karyotype Non-complex karyotype |
32 40 |
19(59.4) 34(85.0) |
13(40.6) 6(15.0) |
6.010 | 0.014 | ||||||||||||||||||||||||
| AML patient | |||||||||||||||||||||||||||||
| Complex karyotype Non-complex karyotype |
21 29 |
10(47.6) 23(79.3) |
11(52.4) 6(20.7) |
0.451 | 0.020 | ||||||||||||||||||||||||
| ALL patient | |||||||||||||||||||||||||||||
| Complex karyotype Non-complex karyotype |
9 11 |
7(77.8) 11(100.0) |
2(22.2) 0(0.00) |
0.189 | |||||||||||||||||||||||||
截止2018年12月1日,可评估疗效的复杂核型组32例患者中有2例失访,1例行骨髓移植,中位随访时间227 d(11~720 d)。非复杂核型组40例患者中有3例失访,中位随访时间733 d(51~1 547 d)。应用Kaplan-Meier法进行生存分析,复杂核型组和非复杂核型组患者中位RFS分别为162和462 d,2组比较差异有统计学意义(χ2=10.011,P=0.002)。见图 1(插页六)。
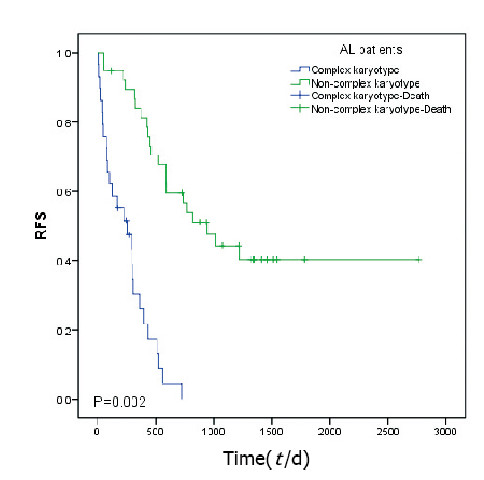
|
| 图 1 复杂核型组和非复杂核型组AL患者的RFS曲线 Fig. 1 RFS curves of AL patients in complex karyotype group and non-complex karyotype group |
|
|
复杂核型组和非复杂核型组患者中位OS分别为256和939 d,1年OS分别为25%和82%,2年OS分别为0.1%和57.0%,3年OS分别为小于0.1%和42.0%,2组比较差异均有统计学意义(P<0.01)。见图 2(插页六)。

|
| 图 2 复杂核型组和非复杂核型组AL患者的生存曲线 Fig. 2 Survival curves of AL patients in complex karyotype group and non-complex karyotype group |
|
|
AML患者中,复杂核型组和非复杂核型组患者中位OS分别为125和822d,2组比较差异有统计学意义(χ2=26.551,P<0.01)。见图 3(插页六)。
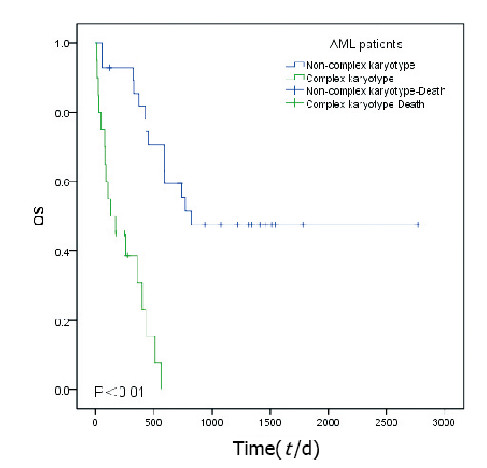
|
| 图 3 复杂核型组和非复杂核型组AML患者的生存曲线 Fig. 3 Survival curves of AML patients in complex karyotype group and non-complex karyotype group |
|
|
ALL患者中,复杂核型组和非复杂核型组患者中位OS分别为293和939 d,2组比较差异有统计学意义(χ2=7.095,P=0.008)。见图 4(插页六)。

|
| 图 4 复杂核型组和非复杂核型组ALL患者的生存曲线 Fig. 4 Survival curves of ALL patients in complex karyotype group and non-complex karyotype group |
|
|
复杂核型AL患者中,染色体复杂程度低(3≤复杂核型数≤5)(12例)患者中位OS为153d,染色体复杂程度高(复杂核型数>5)(17例)患者中位OS为71d,2组比较差异无统计学意义(χ2=3.578,P=0.059)。见图 5(插页六)。

|
| 图 5 不同染色体复杂程度复杂核型AL患者的生存曲线 Fig. 5 Survival curves of complex karyotype AL patients with different chromosome complexity degrees |
|
|
白血病是源于造血干细胞具有高度异质性的恶性克隆性疾病,个体间化疗疗效差异较大[5]。近年来随着细胞培养和分带技术的进一步发展,核型分析对AL的诊断、鉴别、疗效和预后有着重要的价值,染色体会随着疾病的变化而改变,而这种改变为选择化疗方案和预后评价提供了参考[1]。
研究[13-14]报道:AML患者中复杂核型的构成比为25%~30%。本研究中复杂核型在AL(除外急性早幼粒细胞白血病)患者中的构成比为11.7%(33/281,AML 11.2%,ALL 12.8%),与上述研究结果存在明显差异,考虑本研究样本有限,且存在东西方人种差异,可加大样本量进一步研究证实。本研究结果显示:复杂核型AL患者与同期非复杂核型AL患者在年龄、性别、是否并发重度贫血、粒细胞计数及血小板计数是否正常、骨髓及是否存在髓外浸润等方面, 差异无统计学意义。复杂核型AL患者经过1个疗程的诱导治疗后CR率明显低于同期非复杂核型AL患者。进一步分组发现,2组中仅AML患者差异有统计学意义。此结果与相关文献[7, 15-17]报道结果一致。KURODA等[10]对Ph染色体阳性AL患者进行资料分析发现:68%的患者并发有染色体异常,其中最容易复发的为双Ph染色体者。国外研究[18]显示:t(9;22)易位是ALL患者最常见的染色体异常,其中成人发生率最高。而本研究中,10例复杂核型ALL患者中伴有Ph染色体阳性有4例,诱导缓解后均在1年内出现复发,与以上研究结果相符。SEOL等[8]研究表明:Ph染色体阳性并伴有复杂核型异常的ALL患者预后明显差于单纯Ph染色体阳性患者,本研究因样本量较少,故未进一步探讨。
本研究中复杂核型组和非复杂核型组患者中位RFS分别为162和462d,2组比较差异有统计学意义,与既往一些研究[7, 19-20]结果相符。2组患者中位OS分别为256和769d,1年OS分别为25%和80%,2年OS分别为0.1%和52.0%,2组比较差异有统计学意义,该结果与美国KHORAL等[20]对获得CR的1213例AML的细胞遗传学进行分析的结果一致。在本研究影响预后相关因素中,年龄和粒细胞数对复杂核型AL患者CR率和OS的影响无统计学意义,复杂核型AL患者染色体的复杂程度对CR率有影响,对OS无影响,此结果与既往一些研究[6-7, 21]的结果不一致,即年龄越大、白细胞数越高,预后越差;核型复杂程度与AL预后有明显相关性;考虑可能由本研究样本量较少引起。
综上所述,复杂核型AL患者较非复杂核型AL患者CR率低、RFS及OS短,且染色体复杂程度越高,复杂核型AL患者CR率越低。染色体核型分析有助于临床个体化治疗,以提高白血病患者CR率并延长OS。
| [1] |
刘艳春, 李伟, 王欢, 等. 染色体核型动态监测对急性白血病患者化疗疗效评估的作用[J]. 中国实验血液学杂志, 2015, 23(3): 658-662. |
| [2] |
BROWN P A, SHAH B, FATHI A, et al. NCCN guidelines insights:Acute lymphoblastic leukemia, version1.2017[J]. J Natl Compr Canc Netw, 2017, 15(9): 1091-1102. DOI:10.6004/jnccn.2017.0147 |
| [3] |
O'DONNELL M R, TALLMAN M S, ABBOUD C N, et al. NCCN clinical practice guidelines in oncology:Acute myeloid leukemia, version3.2017[J]. J Natl Compr Canc Netw, 2017, 15(7): 926-957. DOI:10.6004/jnccn.2017.0116 |
| [4] |
中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J]. 中华血液学杂志, 2017, 38(3): 177-182. |
| [5] |
中国抗癌协会血液肿瘤专业委员会, 中华医学会血液学分会白血病淋巴瘤学组. 中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)[J]. 中华血液学杂志, 2016, 37(10): 837-845. DOI:10.3760/cma.j.issn.0253-2727.2016.10.002 |
| [6] |
NISHIWAKI S, MIYAMURA K, OHASHI K, et al. Impact of a donor source on adult Philadelphia chromosome-negative acute lymphoblastic leukemia:a retrospective analysis from the Adult Acute Lymphoblastic Leukemia Working Group of the Japan Society for Hematopoietic Cell Transplantation[J]. Ann Oncol, 2013, 24(6): 1594-1602. DOI:10.1093/annonc/mds655 |
| [7] |
STRICKLAND S A, SUN ZX, KETTERLING R P, et al. Independent prognostic significance of monosomy 17 and impact of karyotype complexity in monosomal karyotype/complex karyotype acute myeloid leukemia:results from four ECOG-ACRIN prospective therapeutic trials[J]. Leuk Res, 2017, 59: 55-64. DOI:10.1016/j.leukres.2017.05.010 |
| [8] |
SEOL C A, CHO Y U, JANG S, et al. Prognostic significance of recurrent additional chromosomal abnormalities in adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia[J]. Cancer Genet, 2017, 216/217: 29-36. DOI:10.1016/j.cancergen.2017.06.001 |
| [9] |
BYRD J C, MRÓZEK K, DODGE R K, et al. Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse, and overall survival in adult patients with de novo acute myeloid leukemia:results from Cancer and Leukemia Group B (CALGB 8461)[J]. Blood, 2002, 100(13): 4325-4336. DOI:10.1182/blood-2002-03-0772 |
| [10] |
KURODA I, INUKAI T, ZHANG X, et al. BCR-ABL regulates death receptor expression for TNF-related apoptosis-inducing ligand (TRAIL) in Philadelphia chromosome-positive leukemia[J]. Oncogene, 2013, 32(13): 1670-1681. DOI:10.1038/onc.2012.186 |
| [11] |
张之南, 沈悌. 血液病诊断及疗效标准[J]. 3版.北京:科学出版, 2007, 103-121. |
| [12] |
SCHWINGER E, LISA G, SHAFFER. Niels Tommerup:ISCN 2005:An international system for human cytogenetic nomenclature[J]. Ann Anat, 2006, 188(4): 328. |
| [13] |
HAFERLACH C, ALPERMANN T, SCHNITTGER S, et al. Prognostic value of monosomal karyotype in comparison to complex aberrant karyotype in acute myeloid leukemia:a study on 824 cases with aberrant karyotype[J]. Blood, 2012, 119(9): 2122-2125. DOI:10.1182/blood-2011-10-385781 |
| [14] |
KAYSER S, ZUCKNICK M, DÖHNER K, et al. Monosomal karyotype in adult acute myeloid leukemia:prognostic impact and outcome after different treatment strategies[J]. Blood, 2012, 119(2): 551-558. DOI:10.1182/blood-2011-07-367508 |
| [15] |
STÖLZEL F, MOHR B, KRAMER M, et al. Karyotype complexity and prognosis in acute myeloid leukemia[J]. Blood Cancer J, 2016, 6: e386. DOI:10.1038/bcj.2015.114 |
| [16] |
DANESHBOD Y, KOHAN L, TAGHADOSI V, et al. Prognostic significance of complex karyotypes in acute myeloid leukemia[J]. Curr Treat Options Oncol, 2019, 20(2): 15. DOI:10.1007/s11864-019-0612-y |
| [17] |
SHI L H, MA P, LIU J S, et al. Current views of chromosomal abnormalities in pediatric acute myeloid leukemia (AML)[J]. Eur Rev Med Pharmacol Sci, 2017, 21(4 Suppl): 25-30. |
| [18] |
KAWAJIRI C, TANAKA H, HASHIMOTO S, et al. Successful treatment of Philadelphia chromosome-positive mixed phenotype acute leukemia by appropriate alternation of second-generation tyrosine kinase inhibitors according to BCR-ABL1 mutation status[J]. Int J Hematol, 2014, 99(4): 513-518. DOI:10.1007/s12185-014-1531-0 |
| [19] |
丁懿, 李萍, 张文君, 等. 同济96方案序贯治疗Ph染色体阴性成人急性淋巴细胞白血病疗效分析[J]. 中华血液学杂志, 2015, 36(4): 272-276. |
| [20] |
KHORAL P, ATENAFU E G, CRADDOCK K J, et al. Prognostic effect of complex karyotype, monosomal karyotype, and chromosome 17 abnormalities in B-cell acute lymphoblastic leukemia[J]. Clin Lymphoma Myeloma Leuk, 2017, 17(4): 215-219. DOI:10.1016/j.clml.2017.02.009 |
| [21] |
MRÓZEK K, MARCUCCI G, NICOLET D, et al. Prognostic significance of the European LeukemiaNet standardized system for reporting cytogenetic and molecular alterations in adults with acute myeloid leukemia[J]. J Clin Oncol, 2012, 30(36): 4515-4523. DOI:10.1200/JCO.2012.43.4738 |
 2020, Vol. 46
2020, Vol. 46


