扩展功能
文章信息
- 黄蕾, 刘宇妍, 于文雯, 周雪纯, 张骁, 申玉芹, 郑义, 孙新华
- HUANG Lei, LIU Yuyan, YU Wenwen, ZHOU Xuechun, ZHANG Xiao, SHEN Yuqin, ZHENG Yi, SUN Xinhua
- CpG ODN BW006对实验性牙移动模型大鼠牙周组织中Runx2和Osterix表达的影响及其意义
- Effect of CpG ODN BW006 on expressions of Runx2 and Osterix in periodontal tissue of experimental tooth movement model rats and its significance
- 吉林大学学报(医学版), 2020, 46(02): 340-345
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 340-345
- 10.13481/j.1671-587x.20200222
-
文章历史
- 收稿日期: 2019-12-09
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021;
3. 吉林大学口腔医院修复科, 吉林 长春 130021;
4. 吉林大学口腔医院牙周病科, 吉林 长春 130021
2. Jilin Provincial Key Laboratory of Tooth Development and Jaw Remodeling and Regeration, Changchun 130021, China;
3. Department of Prosthodontics, Stomatology Hospital, Jilin University, Changchun 130021, China;
4. Department of Periodontology, Stomatology Hospital, Jilin University, Changchun 130021, China
口腔正畸是通过对牙齿施加一定大小的力,引起牙齿移动,解除各种错颌畸形,改善颌面部功能和美观的治疗方法。临床上正畸患者可能存在体内激素水平变化或局部牙周组织炎症,当这些患者的牙齿受到正畸力的作用时,易导致牙周组织改建失衡,出现支抗丧失、牙齿移动过快伴随牙齿松动度过大等现象。目前研究[1]已明确正畸治疗中牙周组织的改建是骨形成和骨吸收两者偶联的动态平衡过程,可影响该平衡的因素(物理因素[2]、生物因素[3]和药物因素[4]等)均可能改变牙齿移动的效率,因此寻找一种安全、稳定且高效的方法来调控牙周组织改建是口腔正畸学领域的研究热点。免疫刺激性脱氧寡核苷酸(CpG ODN)是一种人工合成的短脱氧核糖核酸单链分子。早期研究[5]表明:CpG ODN可通过经典作用方式调控成骨-破骨平衡。研究[6-7]显示:特定序列的CpG ODN可促进大鼠骨髓间充质干细胞和人牙周膜细胞增殖,且可上调经成骨诱导的骨髓间充质干细胞中Runt-相关转录因子2(Runt-related transcription factor 2,Runx2)、Osterix和Ⅰ型胶原(collagen Ⅰ, Col Ⅰ)等成骨相关因子的表达,FENG等[8]通过体外研究筛选出CpG ODN BW006具有促进大鼠成骨细胞增殖的作用,但其在体内环境中对牙周组织有何影响未见相关报道。HAN等[9]通过建立大鼠实验性牙移动模型证实机械刺激可通过上调Runx2和Osterix的表达调控牙周组织改建。基于以上研究,本研究在大鼠实验性牙移动模型中观察CpG ODN BW006对牙移动距离、牙周组织中Runx2和Osterix表达的影响,初步探究其对正畸牙移动过程中成骨-破骨平衡的调控作用,为未来深入研究CpG ODN如何调控牙周组织改建奠定基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器7周龄Wistar雄性大鼠36只(吉林大学实验动物中心提供),动物合格证号:SCXK(辽)2015-0001,体质量(180±10)g。CpG ODN BW006 (5′-TCGACGTTCGTCGTTCGTCGTTC-3′)由吉林大学基础医学院分子生物学实验室设计,大连TaKaRa公司合成;磷酸盐缓冲液(PBS)和苏木精-伊红(HE)染色剂(吉林大学口腔医学院免疫组织化学实验室配制);柠檬酸钠抗原修复液(武汉博士德生物公司);Runx2抗体和Osterix抗体(北京博奥森生物技术有限公司);即用型免疫组织化学超敏UltraSensitiveTM SP试剂盒和DAB显色试剂盒(福州迈新生物技术开发有限公司)。RM2245石蜡切片机(徕卡公司,德国),IX71倒置荧光显微镜(Olympus公司,日本)。
1.2 实验动物分组36只Wistar大鼠每笼6只分笼饲养,自由饮水摄食,每12 h昼夜交替,适应性饲养7 d,每只大鼠左侧上颌为实验组(局部注射CpG ODN BW006),右侧上颌为对照组(局部注射PBS)。
1.3 实验性大鼠牙移动模型的建立大鼠经10%水合氯醛(3 mL·kg-1)腹腔注射麻醉,仰卧位固定于操作台,使用高速涡轮机装配细颗粒金刚砂车针在大鼠上颌切牙唇面和轴角近龈缘处及双侧上颌第一磨牙近中轴角近龈缘处做固位沟,深度约0.25 mm,使用0.25 mm的正畸不锈钢结扎丝将镍钛螺旋拉簧与大鼠上颌第一磨牙和切牙结扎,弹簧测力计调整拉簧力量为0.49 N,以切牙作为支抗牙近中移动双侧第一磨牙(图 1,见插页四),每24 h检查加力装置,如发生脱落重新结扎。
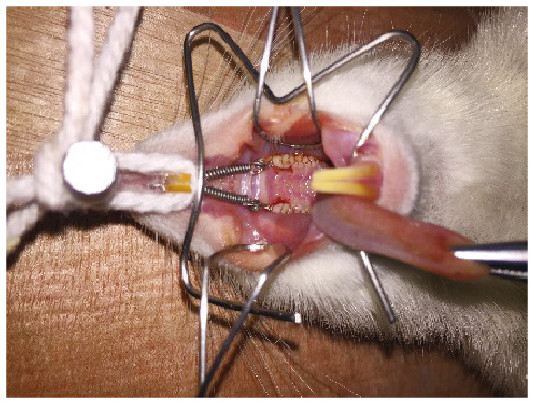
|
| 图 1 大鼠实验性牙移动模型 Fig. 1 Experimental tooth movement model of rat |
|
|
大鼠实验性牙移动模型建立后,于大鼠左侧上颌第一磨牙近中颊侧牙龈黏膜处局部注射CpG ODN BW006 40 μL,浓度为25 mg·L-1,并于右侧同名牙相同部位注射等量PBS溶液,每3 d注射1次,直至实验结束。
1.5 实验标本的制备分别于加力3、7和14 d时随机选取12只大鼠心脏灌流处死,分离含双侧上颌磨牙和牙槽骨的组织块,置于新配置的4%中性多聚甲醛固定液中常规固定24 h,使用10%乙二胺四乙酸(EDTA)室温下脱钙12周,常规梯度脱水,石蜡包埋,沿第一磨牙近远中方向制备厚度为3~5 μm的连续石蜡切片。分别进行HE染色和免疫组织化学染色。
1.6 HE染色观察大鼠牙周组织形态表现显微镜下选取牙周韧带完整的切片,常规经二甲苯脱蜡,梯度乙醇水化,苏木精染色,盐酸酒精分化,伊红复染,脱水、透明,中性树胶封片,光镜下观察牙周组织形态表现,使用显微摄像系统(CMS800)进行图像采集,使用Image-Pro Plus6.0图像分析软件测量加力7和14 d时大鼠第一磨牙远中最凸点与第二磨牙近中最凸点间距离作为牙齿移动距离,单位为mm。
1.7 免疫组织化学染色检测大鼠牙周组织中Runx2和Osterix阳性表达水平使用Runx2抗体、Osterix抗体、免疫组织化学SP试剂盒和DAB显色试剂盒进行免疫组织化学染色,以PBS缓冲液代替一抗作为阴性对照,细胞或组织呈特异性棕黄色染色者为阳性表达信号。染色结果采用显微摄像系统进行图像采集,每张切片分别选取阳性表达区域在400倍镜下采集图像,使用Image-Pro Plus6.0图像分析软件半定量分析Runx2和Osterix阳性表达区域的平均光密度(average optical density,AOD)值,由同一实验者重复测量2次后取平均值,即为Runx2和Osterix阳性表达水平。
1.8 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组大鼠牙齿移动距离及Runx2、Osterix阳性表达水平符合正态分布,以x±s表示,实验组与对照组组间比较采用两独立样本t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 2组大鼠牙周组织形态表现压力侧:加力3 d时对照组牙周膜间隙变窄,可见部分牙周韧带呈玻璃样变,大量破骨细胞分布于根尖区,尚未见明显骨吸收;实验组牙周膜未见明显变化。加力7 d时对照组可见蚕蚀状骨吸收陷窝,牙槽骨明显吸收;实验组可见破骨细胞活动,出现骨吸收。加力14 d时对照组和实验组牙周膜纤维基本恢复正常排列,骨吸收活动减弱。张力侧:加力3 d时对照组牙周膜间隙增宽,可见牙周膜纤维排列紊乱;实验组牙周膜间隙未见明显改变,可见少量成骨细胞。加力7 d时对照组牙周膜间隙进一步增宽,同时可见成骨细胞;实验组大量成骨细胞沿牙槽骨牙周膜交界处分布。见图 2(插页五)。加力14 d时对照组牙槽骨丰满度和高度均低于实验组。
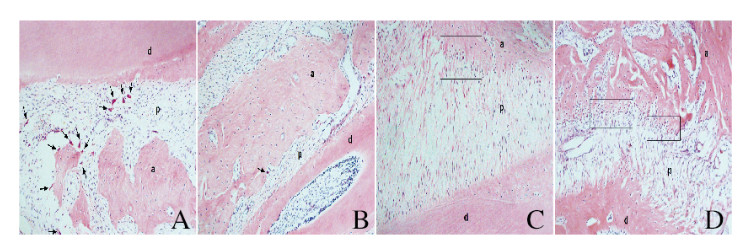
|
| A, C: Control group; B, D: Experimental group; A, B: Pressure side; C, D: Tension side. a: Alveolar bone; d: Dentin; p: Periodontal ligament. The arrows showed the osteoclasts and the boxes showed the osteoblasts. 图 2 加力7d时2组大鼠牙周组织形态表现(HE, ×200) Fig. 2 Morphology of periodontal tissue of rats in two groups at 7 d of stress (HE, ×200) |
|
|
对照组和实验组大鼠牙齿移动距离随时间延长不断增加;与对照组比较,加力7和14 d时实验组大鼠牙齿移动距离明显减少(P < 0.01)。见表 1和图 3(插页五)。
| (n=6, x±s, l/mm) | |||||||||||||||||||||||||||||
| Group | Distance of tooth movement | ||||||||||||||||||||||||||||
| (t/d) 7 | 14 | ||||||||||||||||||||||||||||
| Control | 0.585±0.012 | 0.975±0.084 | |||||||||||||||||||||||||||
| Experimental | 0.347±0.007* | 0.443±0.016* | |||||||||||||||||||||||||||
| * P < 0.01 compared with control group. | |||||||||||||||||||||||||||||
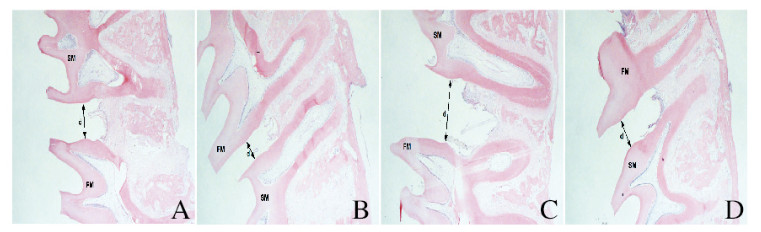
|
| A, C: Control group; B, D: Experimental group; A, B:7d; C, D: 14 d. FM: First molar; SM: Second molar; d: Tooth movement distance. 图 3 不同时间2组大鼠牙齿移动距离(HE, ×40) Fig. 3 Tooth movement distances of rats at different time in two groups(HE, ×40) |
|
|
Runx2主要表达于大鼠牙周膜成纤维细胞、成牙骨质细胞和成骨细胞中,特异性棕黄色染色为阳性表达信号,阴性对照为蓝色。加力3 d时实验组Runx2阳性表达水平高于对照组(P < 0.05);随着加力时间的延长,实验组Runx2阳性表达水平升高,7 d时达到峰值,明显高于对照组(P < 0.01);14 d时实验组Runx2阳性表达水平有所下降,但仍明显高于对照组(P < 0.05)。对照组牙周组织中Runx2阳性表达水平一直较低,3 d时表达水平最高,随后逐渐下降。见表 2和图 4(插页五)。
| (n=9, x±s) | |||||||||||||||||||||||||||||
| Group | Expression level of Runx2 | ||||||||||||||||||||||||||||
| (t/d) 3 | 7 | 14 | |||||||||||||||||||||||||||
| Control | 0.332±0.023 | 0.300±0.230 | 0.295±0.027 | ||||||||||||||||||||||||||
| Experimental | 0.359±0.026* | 0.404±0.039** | 0.326±0.019* | ||||||||||||||||||||||||||
| * P < 0.05,** P < 0.01 compared with control group. | |||||||||||||||||||||||||||||
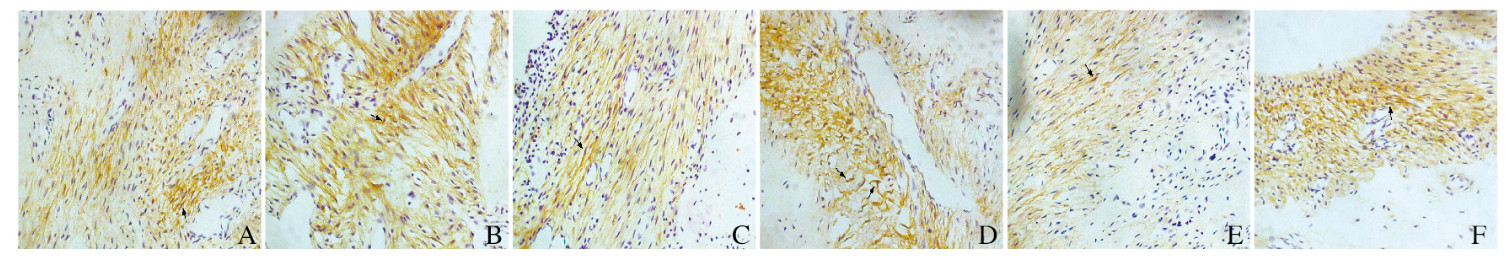
|
| A, C, E: Control group; B, D, F: Experimental group; A, B: 3 d; C, D: 7 d; E, F: 14 d. The arrows showed the positive expression of Runx2. 图 4 2组大鼠牙周组织中Runx2的表达情况(免疫组织化学, ×400) Fig. 4 Expressions of Runx2 in periodontal tissue of rats in two groups (Immunohistochemistry, ×400) |
|
|
Osterix主要表达于牙龈成纤维细胞、牙周膜成纤维细胞、成骨细胞及骨细胞中,特异性棕黄色染色为阳性表达信号,阴性对照为蓝色。加力3 d时实验组Osterix阳性表达水平明显高于对照组(P < 0.01);随着加力时间的延长,实验组和对照组Osterix阳性表达水平均呈现先升高后降低的趋势,7 d时达到峰值,14 d时有所下降,但实验组Osterix阳性表达水平明显高于对照组(P < 0.01)。见表 3和图 5(插页五)。
| (n=9, x±s) | |||||||||||||||||||||||||||||
| Group | Expression level of Osterix | ||||||||||||||||||||||||||||
| (t/d) 3 | 7 | 14 | |||||||||||||||||||||||||||
| Control | 0.262±0.022 | 0.299±0.017 | 0.272±0.017 | ||||||||||||||||||||||||||
| Experimental | 0.339±0.014* | 0.349±0.019* | 0.321±0.014* | ||||||||||||||||||||||||||
| * P < 0.01 compared with control group. | |||||||||||||||||||||||||||||
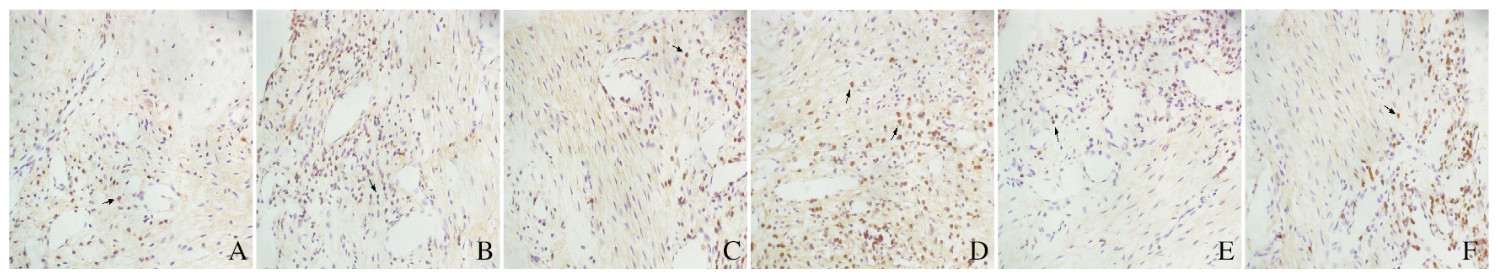
|
| A, C, E: Control group; B, D, F: Experimental group; A, B: 3 d; C, D: 7 d; E, F: 14 d. The arrow showed the positive expression of Osterix 图 5 2组大鼠牙周组织中Osterix的表达情况(免疫组织化学, ×400) Fig. 5 Expressions of Osterix in periodontal tissue of rats in two groups (Immunohistochemistry, ×400) |
|
|
CpG ODN是长度为20~30个碱基、含有数个CpG基序的脱氧寡核苷酸,CpG基序是以非甲基化CpG为核心,5′端有2个嘌呤、3′端有2个嘧啶的六核苷酸序列,如AACGTT等,CpG基序使ODN具有较强的免疫刺激活性[10]。目前,CpG ODN对成骨细胞增殖分化的作用已经得到验证,FENG等[8]的研究表明:特定序列的CpG ODN影响成骨细胞相关功能基因的转录表达,通过上调MG63细胞中Runx2和Osterix的表达促进成骨细胞增殖活化。CpG ODN BW006是我国自行设计合成的一种线性全硫代修饰B型CpG ODN,对B细胞有很强的免疫刺激活性,由于其本身无免疫原性[11],不会诱发自身免疫反应,且多项体内研究[12-13]表明其安全性高,局部刺激性小,可通过多种途径给药,近年来被广泛应用于抗肿瘤、抗过敏、抗感染[14]及疫苗佐剂[11]的研究与开发。
正畸牙齿的移动是复杂而精细的生物机械过程,该过程主要依赖于牙周组织对持续性机械力的生物反应[15],正畸力诱导神经递质、生长因子和细胞因子生成并通过生物力学信号转导通路传递至破骨细胞和成骨细胞,导致骨吸收和骨形成[16-17]。骨形成的分子机制主要涉及3个阶段:增殖、细胞外基质的成熟和矿化。早期骨改建相关研究[8]显示:CpG ODN BW006可促进大鼠成骨细胞增殖。本实验通过建立大鼠实验性牙移动模型,采用局部注射CpG ODN BW006的方法,初步探究其在体内环境下对正畸过程中牙周组织改建的调控作用。本研究结果显示:与对照组比较,实验组大鼠牙齿移动距离明显减小, 牙槽骨高度及丰满度明显增加,说明CpG ODN BW006抑制了实验组大鼠的牙槽骨吸收,导致正畸力作用下大鼠第一磨牙的近中移动减慢。为探讨其可能的机制,本研究进一步检测了大鼠牙周组织中Runx2和Osterix蛋白的表达。
Runx2是首个被发现的成骨细胞特异性转录因子,通过与启动子区域的成骨细胞特异顺式作用元件2(osteoblast-specifics-acting element2,OSE2)结合激活一系列标志基因,如骨钙素(osteocalcin,OCN)、碱性磷酸酶(alkaline phosphatase,ALP)、骨唾液蛋白(bone sialoprotein,BSP)和骨桥蛋白(osteopontin,OPN)等[18-19],启动骨髓间充质干细胞向成骨细胞分化[20]。早期研究[21]表明:牙周膜中的Runx2是力学信号的靶基因。本研究通过免疫组织化学染色方法检测了实验性牙移动模型大鼠牙周组织中Runx2的表达,结果显示:在正畸力作用下,大鼠牙周组织中Runx2主要表达于牙周膜成纤维细胞、成牙骨质细胞和成骨细胞,加力3 d时局部注射PBS的对照组大鼠牙周组织中Runx2表达水平最高,随后其表达水平下降,这与QIN等[22]的研究结果一致;局部注射CpG ODN BW006的实验组大鼠牙周组织中Runx2表达水平则在加力7 d时达到峰值,考虑到有研究表明Runx2在前成骨细胞中表达上调,在未成熟成骨细胞中表达达到最高水平,在成熟的成骨细胞中表达下调,本文作者推测CpG ODN BW006可能使更多的牙周膜干细胞向前成骨细胞分化且促进了前成骨细胞的增殖,一定程度上增加了加力7 d时大鼠牙周组织中未成熟成骨细胞的数量;在14 d实验期内,实验组大鼠牙周组织中Runx2表达水平虽先升高后降低,但始终明显高于对照组,说明CpG ODN BW006可增强大鼠牙移动过程中牙周组织中Runx2的表达水平。
Osterix是2002年由NAKASHIMA等[23]发现的一种锌指转录因子,研究[24-25]表明:Osterix是成骨细胞生成、分化和骨组织发育重要的调控因子,通过激活一系列基因在前成骨细胞分化为成熟成骨细胞和骨细胞的过程中起重要作用。本研究结果显示:机械刺激使大鼠牙周组织中Osterix的表达水平先升高后降低,加力7 d时达到最高值,该结果与HAN等[9]的动物实验研究结果相符。本研究中与对照组比较,实验组大鼠牙周组织中Osterix阳性表达水平明显升高,进一步说明局部注射CpG ODN BW006也可上调牙移动过程中大鼠牙周组织中Osterix的表达。牙槽骨中成骨细胞的分化成熟是一个多步骤的复杂过程,牙周膜干细胞形成前成骨细胞的关键因子是Runx2,而Osterix是前成骨细胞分化为成熟成骨细胞的关键因子,且Osterix是Runx2的下游信号分子,受Runx2的调控[18],在本研究中大鼠牙周组织中Runx2和Osterix阳性表达水平的变化证明其符合生物调控的规律。
CpG ODN BW006的安全性是体内用药所必须考虑的。本研究中大鼠局部注射部位未观察到明显的黏膜变化,如水肿、发红或糜烂等,结合已有关于CpG ODN BW006安全性的研究[13],提示大鼠注射该剂量CpG ODN BW006处于安全范围之内,但关于其局部注射的生物安全性尚待进一步验证。
本研究通过建立大鼠实验性牙移动模型,证实了CpG ODN BW006可减少正畸力作用下大鼠牙齿的移动距离,初步阐明其可能途径是通过上调牙周组织中Runx2和Osterix的表达水平来调控牙周组织改建,但具体作用机制尚有待今后深入研究。本研究为深入探讨CpG ODN调控牙周组织改建奠定了体内实验基础,局部注射CpG ODN BW006有望成为调控牙周组织改建的新途径。
| [1] |
BALOUL S S. Osteoclastogenesis and Osteogenesis during tooth movement[J]. Frontiers Oral Biol, 2016, 18: 75-79. |
| [2] |
EKIZER A, UYSAL T, GVRAY E, et al. Effect of LED-mediated-photobiomodulation therapy on orthodontic tooth movement and root resorption in rats[J]. Lasers Med Sci, 2015, 30(2): 779-785. DOI:10.1007/s10103-013-1405-3 |
| [3] |
SINGH A, GILL G, KAUR H, et al. Role of osteopontin in bone remodeling and orthodontic tooth movement:a review[J]. Prog Orthod, 2018, 19(1): 18. DOI:10.1186/s40510-018-0216-2 |
| [4] |
VENKATARAMANA V, CHIDAMBARAM S, REDDY B V, et al. Impact of bisphosphonate on orthodontic tooth movement and osteoclastic count:An animal study[J]. Intern Oral Health, 2014, 6(2): 1-8. |
| [5] |
KRISHER T, BAR-SHAVIT Z. Regulation of osteoclastogenesis by integrated signals from Toll-like receptors[J]. J Cell Biochem, 2014, 115(12): 2146-2154. DOI:10.1002/jcb.24891 |
| [6] |
SHEN Y, FENG Z, LIN C, et al. An oligodeoxynucleotide that induces differentiation of bone marrow mesenchymal stem cells to osteoblasts in vitro and reduces alveolar bone loss in rats with periodontitis[J]. Int J Mol Sci, 2012, 13(3): 2877-2892. DOI:10.3390/ijms13032877 |
| [7] |
秦雁雁, 申玉芹, 任春霞, 等. 不同序列CpG ODN对牙周膜细胞的促增殖作用[J]. 吉林大学学报(医学版), 2012, 38(5): 876-879. |
| [8] |
FENG Z Y, SHEN Y Q, WANG L Y, et al. An oligodeoxynucleotide with promising modulation activity for the proliferation and activation of osteoblast[J]. Int J Mol Sci, 2011, 12(4): 2543-2555. DOI:10.3390/ijms12042543 |
| [9] |
HAN J Y, HE H. Expression and function of osteogenic genes runt-related transcription factor 2 and osterix in orthodontic tooth movement in rats[J]. Int J Clin Exp Pathol, 2015, 8(9): 11895-11900. |
| [10] |
SHIROTA H, KLINMAN D M. Recent progress concerning CpG DNA and its use as a vaccine adjuvant[J]. Expert Rev Vaccines, 2014, 13(2): 299-312. DOI:10.1586/14760584.2014.863715 |
| [11] |
LI Z, DING W, GUO Q, et al. Analysis of the dose-sparing effect of adjuvanted Sabin-inactivated poliovirus vaccine (sIPV)[J]. Hum Vaccines Immunother, 2018, 14(8): 1987-1994. DOI:10.1080/21645515.2018.1454571 |
| [12] |
刘丽, 姜华, 潘东升, 等. CpG 684-乙肝疫苗食蟹猴重复免疫安全性评价[J]. 中国药理学与毒理学杂志, 2018, 32(7): 557-564. DOI:10.3867/j.issn.1000-3002.2018.07.007 |
| [13] |
刘丽, 王超, 林志, 等. 大鼠重复肌肉注射CpG 684-乙肝疫苗安全性评价[J]. 中国新药杂志, 2016, 25(19): 2189-2198. |
| [14] |
HANAGATA N. CpG oligodeoxynucleotide nanomedicines for the prophylaxis or treatment of cancers, infectious diseases, and allergies[J]. Int J Nanomed, 2017, 12: 515-531. DOI:10.2147/IJN.S114477 |
| [15] |
LI Y, JACOX L A, LITTLE S H, et al. Orthodontic tooth movement:The biology and clinical implications[J]. Kaohsiung J Med Sci, 2018, 34(4): 207-214. DOI:10.1016/j.kjms.2018.01.007 |
| [16] |
KITAURA H, KIMURA K, ISHIDA M, et al. Effect of cytokines on osteoclast formation and bone resorption during mechanical force loading of the periodontal membrane[J]. Sci World, 2014, 2014: 617032. |
| [17] |
ISOLA G, MATARESE G, CORDASCO G, et al. Mechanobiology of the tooth movement during the orthodontic treatment:a literature review[J]. Minerva Stomatol, 2016, 65(5): 299-327. |
| [18] |
VIMALRAJ S, ARUMGAM B, MIRANDA P J, et al. Runx2:Structure, function, and phosphorylation in osteoblast differentiation[J]. Int J Biol Macromol, 2015, 78: 202-208. DOI:10.1016/j.ijbiomac.2015.04.008 |
| [19] |
沈晨曦, 李米, 李金源, 等. 全反式维A酸与骨形态发生蛋白联合应用对不同鼠源细胞骨钙素及成骨相关基因表达的影响[J]. 解放军医学杂志, 2019, 44(4): 287-296. |
| [20] |
BAEK J E, CHOI J Y, KIM J E. Skeletal analysis and differential gene expression in Runx2/Osterix double heterozygous embryos[J]. Biochem Biophys Res Commun, 2014, 451(3): 442-448. DOI:10.1016/j.bbrc.2014.08.010 |
| [21] |
ZIROS P G, GIL A P R, GEORGAKOPOULOS T, et al. The bone-specific transcriptional regulator Cbfa1 is a target of mechanical signals in osteoblastic cells[J]. J Biol Chem, 2002, 277(26): 23934-23941. DOI:10.1074/jbc.M109881200 |
| [22] |
QIN X, JIANG Q, MIYAZAKI T, et al. Runx2 regulates cranial suture closure by inducing hedgehog, Fgf, Wnt and Pthlh signaling pathway gene expressions in suture mesenchymal cells[J]. Hum Mol Genet, 2018, 28(6): 896-911. |
| [23] |
NAKASHIMA K, ZHOU X, KUNKEL G, et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation[J]. Cell, 2002, 108(1): 17-29. DOI:10.1016/S0092-8674(01)00622-5 |
| [24] |
FARSHDOUSTI HAGH M, NORUZINIA M, MORTAZAVI Y, et al. Different methylation patterns of RUNX2, OSX, DLX5 and BSP in osteoblastic differentiation of mesenchymal stem cells[J]. Cell J, 2015, 17(1): 71-82. |
| [25] |
FELBER K, ELKS P M, LECCA M, et al. Expression of osterix is regulated by FGF and Wnt/β-catenin signalling during osteoblast differentiation[J]. PLoS One, 2015, 10(12): e0144982. DOI:10.1371/journal.pone.0144982 |
 2020, Vol. 46
2020, Vol. 46


