扩展功能
文章信息
- 吴雪艳, 赵依纳, 王小杰, 麻雯熠, 王新杰, 李欣
- WU Xueyan, ZHAO Yina, WANG Xiaojie, MA Wenyi, WANG Xinjie, LI xin
- 半乳糖凝集素3表达抑制对人胃癌MGC-803细胞中Bcl-2和Bax表达的影响及其促凋亡作用
- Effect of galectin-3 expression suppression on expressions of Bcl-2 and Bax in gastric cancer MGC-803 cells and its promotion on apoptosis
- 吉林大学学报(医学版), 2020, 46(02): 335-339
- Journal of Jilin University (Medicine Edition), 2020, 46(02): 335-339
- 10.13481/j.1671-587x.20200221
-
文章历史
- 收稿日期: 2019-05-27
2. 河北生殖妇产医院生殖医学科, 河北 石家庄 050000;
3. 承德医学院基础医学研究所, 河北 承德 067000;
4. 承德医学院组织与胚胎学教研室, 河北 承德 067000;
5. 河北省承德市中心医院肿瘤内科, 河北 承德 067000
2. Department of Reproductive Medicine, Hebei Maternity Hospital, Shijiazhuang 050000, China;
3. Institute of Basic Medicine, Chengde Medical College, Chengde 067000, China;
4. Department of Histology and Embryology, Chengde Medical College, Chengde 067000, China;
5. Department of Oncology, Chengde Central Hospital, Hebei Province, Chengde 067000, China
胃癌是我国最常见的恶性肿瘤之一,其发生率和致死率在肿瘤中位于第3位,严重危害人类健康。半乳糖凝集素3(galectin-3)是半乳糖凝集素家族成员,其结构独特,具有富含脯氨酸、甘氨酸的氨基端和带有糖基识别结构域(carbohydrate recognition domain, CRD)的球形羧基端[1],主要定位于细胞质,在正常细胞和肿瘤细胞中广泛表达,参与调节细胞的生长、凋亡与黏附、肿瘤细胞的转移与侵袭和血管形成等多种功能[2]。galectin-3在乳腺癌[3]、结直肠癌[4]、肺癌[5]、甲状腺癌[6]、口腔鳞状细胞癌[7]和胃癌[8]等多种恶性肿瘤组织中高表达,并与肿瘤的恶性程度及转移浸润有关。近年来研究[9]显示:galectin-3的表达异常与胃癌的发生、发展、侵袭和转移等密切相关。本课题组前期研究[10]显示:galectin-3在胃癌细胞系MGC-803细胞中的表达明显上调,敲低galectin-3可抑制细胞的增殖。本研究为前期工作的延续,通过下调galectin-3的表达水平,观察MGC-803细胞的凋亡情况以及凋亡相关蛋白Bcl-2和Bax的表达变化,从而为胃癌的发生机制研究提供实验依据,为其靶向治疗提供潜在靶点。
1 材料与方法 1.1 细胞、主要试剂和仪器人胃癌MGC-803细胞株购于上海中科院细胞库。靶向galectin-3的siRNA、Lipofectamine2000(Lipo2000)转染试剂、鼠抗人和兔抗人第二抗体购自美国Invintrogen公司,Bcl-2和Bax兔抗人单克隆抗体购自美国Epitomics公司,galectin-3单克隆抗体购自美国Sigma公司,DMEM培养基购自美国Gibco公司,AnnexinⅤ-FITC/PI凋亡检测试剂盒购自联科生物公司。流式细胞仪为美国BD公司产品,HER Aceu 150型CO2培养箱为德国贺利公司产品。
1.2 细胞培养MGC-803细胞培养于含10%胎牛血清(FBS)的DMEM中,在5% CO2、37℃的培养箱中放置,根据生长情况传代。
1.3 siRNA转染MGC-803细胞MGC-803细胞培养于60 mm培养板中,将细胞分为转染靶向galectin-3 siRNA的siRNA干扰组、转染非特异性siRNA的阴性对照组和只加转染试剂的空白对照组。转染前1 d按每孔2×105个细胞接种于6孔培养板中,使细胞在24 h内达到50%~70%的密度;在无血清DMEM中加入20 pmol·L-1 siRNA Oligo后轻柔混匀,使终体积为250 μL;将5 μL Lipo2000转染试剂稀释于250 μL无血清DMEM培养基中,静置5 min;将Lipo2000转染试剂和siRNA Oligo混合,室温孵育20 min;将混悬液加入6孔培养板中。转染后6 h更换含10%胎牛血清的培养基。转染后48 h收集各组细胞。
1.4 Western blotting法检测转染后MGC-803细胞中galectin-3、Bcl-2和Bax蛋白表达水平收集各组MGC-803细胞,加入80 μL细胞裂解液反复冻融充分裂解,提细胞总蛋白后用BCA法检测蛋白浓度;将蛋白质变性后上样,行12% SDS-PAGE凝胶电泳,每泳道30 μg。电转至PVDF膜;5%脱脂奶粉/TBST溶液封闭2 h,一抗孵育4℃过夜(稀释比例:galectin-3为1:5000,Bcl-2和Bax分别为1:1000,β-actin为1:1000);TBST洗膜;加入羊抗鼠二抗1:5000稀释,常温孵育2 h;使用ECL法获得结果。用Quantity One 4.62软件分析条带。计算目的条带与β-actin条带的灰度值比值,作为galectin-3、Bcl-2和Bax蛋白相对表达水平,比值越大表示蛋白表达水平越高。
1.5 流式细胞术检测细胞凋亡率各组细胞转染后48 h,用预冷的无菌PBS缓冲液冲洗3次,采用0.25%胰蛋白酶消化贴壁细胞行成单细胞悬液;300 g离心5 min,PBS缓冲液冲洗2次;采用500 μL复性缓冲液重悬细胞,计数5×105个细胞,加入5 μL Annexin Ⅴ-FITC和10 μL PI染液,轻柔混匀,室温避光孵育5 min;采用流式细胞仪检测细胞凋亡率。
1.6 PI染色法检测细胞凋亡情况MGC-803细胞转染72 h后,收集细胞,制作成浓度为1×106 mL-1细胞悬液;取95 μL细胞悬液,加入5 μL PI溶液染色,混匀,室温避光下孵育5 min;在荧光显微镜下观察,200倍镜下选取6个不同视野进行阳性细胞计数,统计分析并拍照。
1.7 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组MGC-803细胞中galectin-3、Bax和Bcl-2蛋白表达水平,细胞凋亡率及凋亡细胞数均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组MGC-803细胞中galectin-3蛋白表达水平与空白对照组和阴性对照组(4.247%±0.112%和4.166%± 0.090%)比较,siRNA干扰组MGC-803细胞中galectin-3蛋白表达水平(0.969%± 0.061%)明显下降(P < 0.05);与空白对照组比较,阴性对照组MGC-803细胞中galectin-3蛋白表达水平差异无统计学意义(P>0.05)。见图 1。
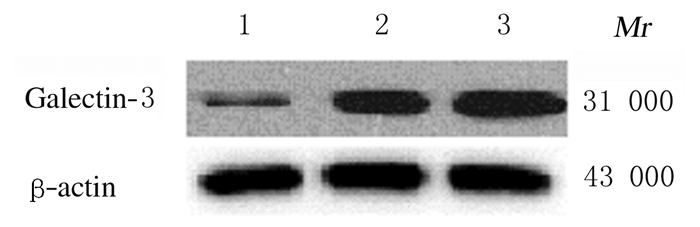
|
| Lane 1: siRNA interference group; Lane 2: Negative control group; Lane 3: Blank control group. 图 1 Western blotting法检测各组MGC-803细胞中galectin-3蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of galectin-3 protein in MGC-803cells in various groups detected by Western blotting method |
|
|
流式细胞术检测结果显示:siRNA干扰组MGC-803细胞凋亡率为(46.746±1.113)%,明显高于阴性对照组(16.556%±0.656%)和空白对照组(15.398%±0.911%)(P < 0.05),而阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。见图 2。
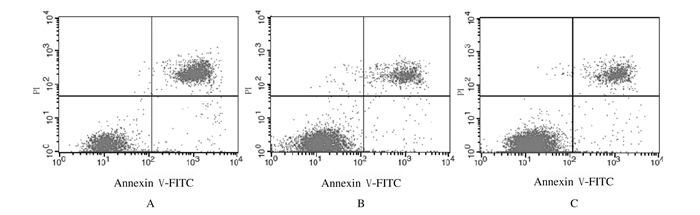
|
| A: siRNA interference group; B: Negative control group; C: Blank control group. 图 2 流式细胞术检测各组MGC-803细胞凋亡率 Fig. 2 Apoptotic rates of MGC-803 cells in various groups detected by flow cytometry |
|
|
siRNA干扰组凋亡细胞明显增加,凋亡细胞出现细胞核固缩、染色质浓集、新月形和凋亡小体等细胞凋亡特征,阴性对照组仅有少量散在的凋亡细胞(图 3,见插页四)。与阴性对照组(8+1)和空白对照组(7±2)比较,siRNA干扰组凋亡细胞数明显增加(24±3)(P < 0.05),阴性对照组与空白对照组凋亡细胞数比较差异无统计学意义(P>0.05)。
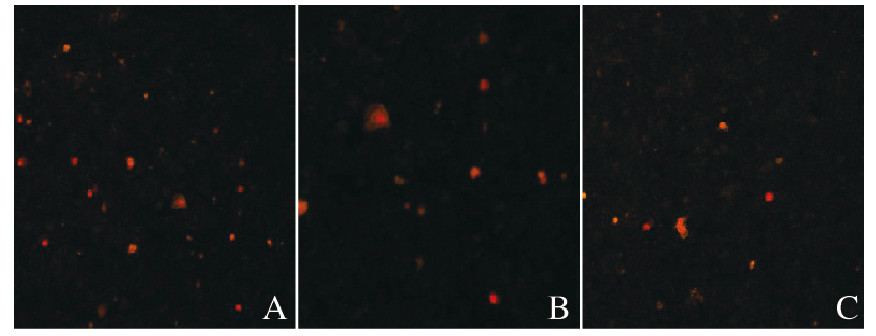
|
| A: siRNA interference group; B: Negative control group; C: Blank control group. 图 3 PI染色法检测各组MGC-803细胞凋亡情况(×200) Fig. 3 Apoptosis of MGC-803 cells in various groups detected by PI staining (×200) |
|
|
与阴性对照组和空白对照组(0.382%±0.028%和0.428%±0.066%)比较,siRNA干扰组抗凋亡蛋白Bcl-2蛋白表达水平(0.149%±0.019%)明显降低(P < 0.05);各组促凋亡蛋白Bax蛋白表达水平无明显变化(1.495%±0.046%、1.476%±0.047%和1.519%±0.085%)(P>0.05)。见图 4。

|
| Lane 1: siRNA interference group; Lane 2: Negative control group; Lane 3: Blank control group. 图 4 Western blotting法检测各组MGC-803细胞中Bcl-2和Bax蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of Bcl-2 and Bax proteins in MGC-803 cells in various groups detected by Western blotting method |
|
|
目前胃癌主要的治疗手段是根治性切除术,但术后复发、转移率高是提高患者生存率的主要障碍[11]。近年来肿瘤的靶向治疗为胃癌治疗提供了新的思路,因此,寻找对胃癌侵袭和转移有影响的特定靶点对提高患者生存率至关重要。研究[12]表明:在凋亡诱导剂作用下,galectin-3能转位至核周膜,于线粒体内富集,可防止线粒体受破坏和抑制细胞色素C的释放,对多种肿瘤细胞具有抗凋亡的作用。本研究在胃癌细胞中敲低galectin-3后,发现细胞凋亡率明显升高,凋亡相关蛋白Bcl-2表达水平明显降低。
本课题组前期研究[10]已成功地将靶向galectin-3的siRNA转染入人胃癌MGC-803细胞,转染后48 h达到70%以上的抑制率,且发现:galectin-3低表达可抑制MGC-803细胞的增殖。本研究继续将靶向galectin-3的siRNA转染入人胃癌MGC-803细胞,观察敲低galectin-3表达对MGC-803细胞凋亡及相关蛋白Bcl-2和Bax表达的影响,流式细胞术和PI染色法检测结果均显示:抑制galectin-3表达后细胞凋亡明显增加,提示在胃癌发生过程中galectin-3抑制了细胞凋亡,由此推测,galectin-3具有成为胃癌靶向治疗新基因靶点的可能。为探讨其发生机制,本研究检测了凋亡相关蛋白Bcl-2和Bax的表达情况。
细胞凋亡是一种受内在基因调控的细胞主动程序化的死亡过程,是机体维持稳定的重要调节机制[13]。细胞凋亡不足会引发癌症[14],Bcl-2和Bax分别是抗细胞凋亡和促进细胞凋亡的基因。Bcl-2可以通过介导细胞膜的通透性来抑制细胞色素C等促凋亡蛋白的释放,阻止细胞凋亡的级联反应,其表达下调可使肿瘤细胞的凋亡率明显上调[15]。Bax的功能则刚好相反,当受到凋亡信号的刺激后,Bax可诱导降低线粒体膜的电位,促进细胞色素C的释放,启动细胞凋亡级联反应[16]。当细胞受到促凋亡因素刺激时,Bcl-2与Bax可相互作用,两者的比率是启动细胞凋亡的开关[17]。当Bcl-2/Bax比值上调时,形成Bcl-2同源二聚体,细胞凋亡出现抑制;反之,Bcl-2/Bax比值下调,则容易形成Bax同源二聚体,诱发细胞凋亡[18]。
本研究结果显示:抑制galectin-3表达之后,siRNA干扰组细胞凋亡率较2个对照组明显升高,siRNA干扰组细胞中Bcl-2蛋白表达水平明显降低,而Bax蛋白表达水平未见明显变化,由此推测,galectin-3的低表达对Bcl-2蛋白产生了较大影响。Bax蛋白虽然未见明显变化,但Bcl-2/Bax比值亦下调,提示siRNA干扰组MGC-803细胞凋亡可能是galectin-3低表达所引发的Bcl-2下调所致,galectin-3和Bcl-2有很多相似之处,均可以促进细胞增殖,抑制细胞凋亡,且两者在结构上还有着高度同源性序列,2种蛋白在C-羟基端有1个NWGR基序,包括了4个氨基酸(Asu-Trp-Gly-Arg)[19],是凋亡抑制活性的关键结构,这个基序在Bcl-2中高度保守,对于抑制细胞程序性死亡的功能起着关键的作用。既然galectin-3与Bcl-2存在诸多相似性,那么二者之间的调控关系是否是互作蛋白等均有待于进一步探讨。本课题组将对galectin-3、Bcl-2及各个凋亡途径中的关键蛋白进行系统的研究,从而明确galectin-3参与的肿瘤调控通路及其作用途径。
| [1] |
MIRANDOLA L, NGUYEN D D, RAHMAN R L, et al. Anti-galectin-3 therapy:a new chance for multiple myeloma and ovarian cancer?[J]. Int Rev Immunol, 2014, 33(5): 417-427. DOI:10.3109/08830185.2014.911855 |
| [2] |
ZHANG D, CHEN Z G, LIU S H, et al. Galectin-3 gene silencing inhibits migration and invasion of human tongue cancer cells in vitro via downregulating β-catenin[J]. Acta Pharmacol Sin, 2013, 34(1): 176-184. |
| [3] |
颜文贞, 戴璟, 田猛, 等. 乳腺癌淋巴转移与Galectin-3、CA19-9表达的相关性研究[J]. 中国实验诊断学, 2017, 21(9): 1489-1491. DOI:10.3969/j.issn.1007-4287.2017.09.001 |
| [4] |
李宏伟, 李艳红, 黄勇, 等. galectin-3和CD105蛋白在结直肠癌中的表达及意义[J]. 中国普外基础与临床杂志, 2011, 18(8): 871-875. |
| [5] |
向丹, 罗琴. Galectin-3基因调控Wnt/β-catenin信号通路对肺癌细胞凋亡的影响[J]. 中国老年学杂志, 2018, 38(2): 289-291. DOI:10.3969/j.issn.1005-9202.2018.02.013 |
| [6] |
张开玲, 张文伟, 臧传善, 等. Ck19、Galectin-3及HBME-1在甲状腺乳头状癌中的表达及临床意义[J]. 肿瘤学杂志, 2017, 23(4): 262-267. DOI:10.3760/cma.j.issn.1673-422X.2017.04.005 |
| [7] |
方政, 邱峰, 赵军方, 等. 半乳糖凝集素-3基因在口腔鳞状细胞癌增殖、侵袭、凋亡中的作用及机制研究[J]. 华西口腔医学杂志, 2018, 36(4): 404-409. |
| [8] |
MIYAZAKI J, HOKARI R, KATO S, et al. Increased expression of Galectin-3 in primary gastric cancer and the metastatic lymph nodes[J]. Oncol Rep, 2002, 9(6): 1307-1312. |
| [9] |
李小林, 余倩, 张学彦. Galectin-3在胃癌中的研究进展[J]. 胃肠病学和肝病学杂志, 2015, 24(2): 220-222. |
| [10] |
吴雪艳, 赵依纳, 王小杰, 等. 半乳糖凝集素3低表达对人胃癌MGC-803细胞增殖的影响[J]. 解剖学报, 2018, 49(6): 724-729. |
| [11] |
刘雨, 杜奕奇, 李兆申. 中国胃癌一级预防策略的思考[J]. 中国实用内科杂志, 2019, 39(6): 511-514. |
| [12] |
WONGKHAM S, JUNKING M, WONGKHAM C, et al. Suppression of galectin-3 expression enhances apoptosis and chemosensitivity in liver fluke-associated cholangiocarcinoma[J]. Cancer Sci, 2009, 100(11): 2077-2084. DOI:10.1111/j.1349-7006.2009.01304.x |
| [13] |
MEIER P, FINCH A J, EVAN G I. Apoptosis in development[J]. Nature, 2000, 407(6805): 796-801. DOI:10.1038/35037734 |
| [14] |
尹智勇, 杨俊元, 祁宏. Bcl-2蛋白质家族调控细胞凋亡机制的研究进展[J]. 信阳师范学院学报(自然科学版), 2017, 30(2): 340-344. DOI:10.3969/j.issn.1003-0972.2017.02.034 |
| [15] |
杨连君. bcl-2, bax与肿瘤细胞凋亡[J]. 中国肿瘤生物治疗杂志, 2003, 10(3): 232-234. DOI:10.3872/j.issn.1007-385X.2003.03.021 |
| [16] |
GHONEUM M, MATSUURA M, BRAGA M, et al. S.cerevisiae induces apoptosis in human metastatic breast cancer cells by altering intracellular Ca2+ and the ratio of Bax and Bcl-2[J]. Int J Oncol, 2008, 33(3): 533-539. |
| [17] |
王卫东, 陈正堂. Bcl-2/Bax比率与细胞"命运"[J]. 中国肿瘤生物治疗杂志, 2007, 14(4): 393-396. DOI:10.3872/j.issn.1007-385X.2007.04.020 |
| [18] |
KORBAKIS D, SCORILAS A. Quantitative expression analysis of the apoptosis-related genes BCL2, BAX and BCL2L12 in gastric adenocarcinoma cells following treatment with the anticancer drugs cisplatin etoposide and taxol[J]. Tumour Biol, 2012, 33(3): 865-875. DOI:10.1007/s13277-011-0313-z |
| [19] |
YANG R Y, HSU D K, LIU F T. Expression of galectin-3 modulates T-cell growth and apoptosis[J]. Proc Natl Acad Sci U S A, 1996, 93(13): 6737-6742. DOI:10.1073/pnas.93.13.6737 |
 2020, Vol. 46
2020, Vol. 46


