扩展功能
文章信息
- 吕亚楠, 范伟, 胡正
- LYU Yanan, FAN Wei, HU Zheng
- 基于piggyBac转座子系统构建长期表达人细胞因子的免疫缺陷小鼠模型
- Construction of immunodeficient mouse models with long-term expression of human cytokines based on piggyBac transposon system
- 吉林大学学报(医学版), 2020, 46(01): 176-181
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 176-181
- 10.13481/j.1671-587x.20200131
-
文章历史
- 收稿日期: 2019-05-05
小鼠作为模式动物常被用于研究哺乳动物尤其是人类的体内免疫系统应答。然而物种之间的免疫系统存在差异[1],致使从小鼠模型中得到的结论不能完全转化给人类。因此,使用移植有人造血干细胞和(或)祖细胞的人源化小鼠成为一种研究人体免疫功能的更优模型[2]。然而,在目前已有的人源化小鼠模型中,人单核细胞、巨噬细胞和自然杀伤细胞(natural killer cell,NK)细胞的发育和功能存在很大程度上的缺陷[3-4]。细胞因子在造血细胞的发育、分化及功能的行使过程中发挥着关键作用,例如,红细胞的发育需要白细胞介素3(interleukin-3, IL-3)和红细胞生成素(erythropoietin, EPO)[5],树突状细胞(dendritic cells, DC)的发育需要粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)和白细胞介素4(interleukin-4, IL-4)[6],NK细胞的发育需要白细胞介素15(interleukin-15, IL-15)[7]。目前认为人源化小鼠中人类固有免疫细胞的发育缺陷很可能是由于小鼠细胞因子与相对应的人类细胞因子受体的反应性有限,已报道小鼠的IL-15、GM-CSF、IL-6、巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)和IL-3均未在人细胞上起作用[8]。目前已报道的解决该问题的策略主要是使用编码人细胞因子的转基因小鼠,该方法会引起全身性的细胞因子高浓度导致造血干细胞的动员和衰竭[9];或施用外源性人类细胞因子,该方法费时费力[7];或是通过高压注射递送编码人类细胞因子的DNA载体,其缺点在于人类细胞因子的持续表达只能维持2~3周[10]。
piggyBac(PB)转座子系统是在一种粉蝶中被发现的。PB转座子需要相应的转座酶和酶的识别序列同时存在,其插入位点几乎都在TTAA位点,而且可以携带多个基因使其在插入位点表达,转座过程不留痕迹。2005年首次证实PB转座子可以有效作用于小鼠基因转移[11]。目前,PB已被用于人类细胞的基因组修饰[12],包括哺乳动物转基因、诱变、临床相关细胞类型的离体修饰以及体内哺乳动物的基因转移[13]。本研究首次将PB转座子系统用于优化人源化小鼠模型,将人IL-6、IL-3、IL-15、干细胞生长因子(stem cell growth factor, SCF)和GM-CSF基因连接后整合到PB转座子质粒中,并将其与表达转座酶的质粒共同高压注入NOD.Cg-Prkdcscid IL2rgtm1Wjl/SzJ(NCG)小鼠,使其在肝脏发生整合并实现长期表达。本实验通过构建含有人IL-6、IL-3、IL-15、SCF和GM-CSF 5种细胞因子的表达质粒,利用PB转座子体系将目的基因整合到宿主小鼠细胞基因组中实现长期表达,以此优化免疫系统人源化小鼠模型,与目前已报道的方法比较,该方法灵活和简单并且长效。
1 材料与方法 1.1 实验动物、主要试剂和仪器NCG小鼠购自南京大学-南京生物医药研究院,动物许可证号:SCXK(苏)2015-0001。人IL-6、IL-3、IL-15、SCF和GM-CSFELISA试剂盒购自美国R&D公司。流式细胞仪(FACS Fortessa)购自美国BD公司,HIMFD多功能酶标仪购自美国BioTek公司。
1.2 含有人IL-6、IL-3、IL-15、SCF和GM-CSF基因的PB转座子质粒的构建化学合成人IL-6、IL-3、IL-15、SCF和GM-CSF基因序列,每2个细胞因子之间用不同的蛋白接头序列(Linker)连接,分别为T2A、F2A、P2A和E2A,最后一个基因末尾加入终止子,目的基因通过酶切位点5′NheⅠ和3′BamHⅠ克隆至载体PB转座子,获得目的质粒(PB-5F)。同时构建绿色荧光蛋白(GFP)基因作为目的基因的PB转座子质粒(PB-GFP),用于体外验证PB转座子体系的长效性表达情况。上述基因的合成及质粒的构建由苏州金唯智生物科技有限公司完成。经库美生物科技有限公司测序验证插入序列准确无误。
1.3 PB-GFP转染293T细胞293T细胞分为阴性对照组(未转染质粒)、阳性对照组(转染pLVTHM质粒)、瞬时转染组(转染PB-GFP质粒)和稳定转染组[共同转染PB-GFP和转座酶质粒(super-PB)]。4组细胞转染后第3天进行传代,利用流式细胞术检测各组细胞中GFP表达水平,每3d1次,共10次,每组3个复孔。
1.4 转染后293T细胞中GFP阳性(GFP+)细胞百分率弃掉培养基,用无菌PBS洗2次,弃去液体。每孔加入1 mL0.25%胰蛋白酶,37℃、5%CO2培养箱中消化5 min。DMEM完全培养基终止消化后收集到15 mL离心管中,600 g、4℃离心5 min。PBS重悬沉淀。取5×105个细胞加入到流式细胞仪上样管中,加入3 mL FACS液体,600 g、4℃离心5 min。弃净上清,加入100 μL FACS液体,在样品中加入适量的PI进行流式细胞术检测及分析,计算GFP+细胞百分率。
1.5 NCG小鼠尾静脉高压注射质粒实验NCG小鼠分为瞬时转染组和稳定转染组, 每组4只。瞬时转染组为小鼠尾静脉高压注射PB-5F质粒(50μg/只),稳定转染组为尾静脉高压注射PB-5F质粒(50μg/只)和super-PB质粒(20μg/只)。5s内注射小鼠体质量10%的液体量。
1.6 ELISA法检测NCG小鼠血清中IL-6、IL-3、IL-15、SCF和GM-CSF水平各组小鼠尾静脉高压注射后1、3、5和9 d,及随后每周1次尾静脉取血,离心分离血清,-80℃保存。ELISA法检测NCG小鼠血清中IL-6、IL-3、IL-15、SCF和GM-CSF水平。实验步骤:将试剂盒提前30min置于室温,准备标准品和样品;标准品等比稀释;血清样品在37℃水浴中溶化后,所有组的样品按同一比例稀释;上样,每孔加入50 μL准备好的标准品和样品,封口后室温孵育3h;弃净液体,用Wash buffer(1×)洗4次,300 μL/孔,每次1min;弃净液体,每孔加入200 μL结合液,封口后室温孵育1h;弃净液体,用Wash buffer(1×)洗4次,每孔300 μL,每次1min;弃净液体,每孔加入200 μL底物,封口后避光室温孵育30min,颜色变蓝;每孔加入50μL终止液,混匀,颜色由蓝变黄,终止显色,在450nm波长下测定吸光度(A)值。根据标准品的浓度和A值绘制标准曲线,在根据标准曲线计算小鼠血清中IL-6、IL-3、IL-15、SCF和GM-CSF水平。
1.7 统计学分析采用GraphPad Prism7.0作图分析软件进行统计学分析。各组细胞中的GFP+细胞百分率和各组小鼠血清中不同细胞因子水平均以x ±s表示,符合正态分布的数据多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,两组间样本均数比较采用两独立样本t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 PB-5F质粒构建将连接后的人IL-6、IL-3、IL-15、SCF和GM-CSF基因序列片段克隆至PB转座子载体上,阳性克隆经NheI和BamHI双酶切鉴定,可切出2 955bp的目的片段和6 846bp的载体片段。见图 1。
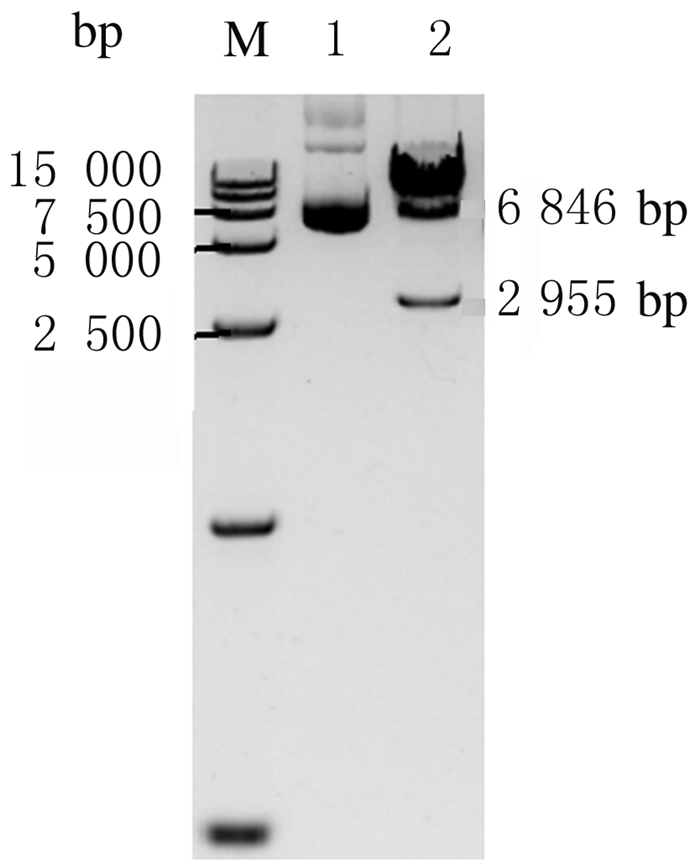
|
| M: DL 15000 DNA marker; Lane 1:PB-5F;Lane 2:PB-5F digested with restriction enzyme. 图 1 PB-5F酶切鉴定电泳图 Fig. 1 Electrophoregram of identification of PB-5F with enzyme digestion |
|
|
PB-GFP转染293T细胞3d后,阳性对照组、瞬时转染组和稳定转染组293T细胞中GFP+细胞百分率(33.70%±0.10%、32.57%±0.19%和32.83%±0.58%)比较差异均无统计学意义(P>0.05);转染30 d后,稳定转染组293T细胞中GFP+细胞百分率(4.61%±0.42%)明显高于阳性对照组(0.58%±0.05%)和瞬时转染组(0.86%±0.10%)(P < 0.01)。见图 2。
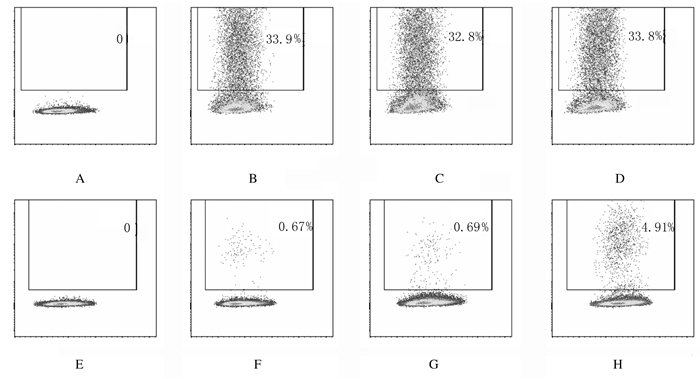
|
| A-D:3d; E-H:30d; A, E:Negative control group; B, F:Positive control group; C, G:Transient transfection group; D, H:Stable transfection group. 图 2 转染后不同时间点各组293T细胞中GFP+细胞百分率 Fig. 2 Percentages of GFP+ cells in 293T cells in various groups at different time points after transfection after transfection |
|
|
质粒高压注射第5天,稳定转染组和瞬时转染组小鼠血清中IL-6、IL-3、IL-15和GM-CSF水平比较差异无统计学意义(P>0.05),在小鼠血清中未检测到SCF。见表 1。质粒高压注射第30天,稳定转染组小鼠血清中IL-6、IL-15和GM-CSF水平分别为(1 906.89±564.26)、(239.92±44.65)和(840.67±267.12)ng·L-1,均高于瞬时转染组[(509.22±34.72)、(125.15±15.77)和(162.69±37.34)ng·L-1](P=0.048,P=0.051,P=0.045),而2组小鼠在第9天时血清中均未检测出IL-3。质粒高压注射第60天,稳定转染组小鼠血清中仍能检测出IL-6、IL-15和GM-CSF[495.02±233.34)、(90.26±25.20)和(162.34±115.87)ng·L-1]。
| [n=4, x ±s, ρB/(ng·L-1)] | |||||||||||||||||||||||||||||
| Group | IL-6 | IL-3 | IL-15 | GM-CSF | |||||||||||||||||||||||||
| Stable transfection | 7 648.30±999.31 | 57.36±42.48 | 474.78±83.10 | 3 687.37±820.86 | |||||||||||||||||||||||||
| Transient transfection | 7 748.52±1 511.32 | 131.83±80.63 | 549.52±123.85 | 4 258.96±1 009.05 | |||||||||||||||||||||||||
为了解决将动物模型中的研究发现转化为临床应用的局限性,研究人员设计并开发了“人源化小鼠”模型,以在细胞和分子水平上模拟人类。近年来研发的具有人类免疫系统的人源化小鼠模型用于理解疾病的发病机制以及评估药物对于人类疾病的治疗,研究的疾病主要包括癌症、传染病、自身免疫疾病和移植物抗宿主病等[14]。
尽管免疫系统人源化小鼠发展多年且在多领域中有着重要贡献,但该模型在许多方面存在缺陷,主要包括:在重建的免疫系统中缺乏人红细胞和中性粒细胞的重建[15];人髓系细胞和NK细胞发育受损以及功能缺陷;B细胞发育不成熟,抗原特异性IgG产生过少等[16]。所有血细胞均由造血干细胞分化而来,细胞因子在分化过程中发挥着关键作用,但由于人与小鼠之间的进化分歧,很多细胞因子是物种特异性的,小鼠细胞因子无法作用于人的细胞而发挥功能[8]。为了克服细胞因子的障碍,目前可采用外源补充细胞因子重组蛋白、高压注射表达细胞因子的DNA质粒、感染诱导细胞因子表达的慢病毒和敲入相关基因等方法,改善小鼠的体内环境使其更适合人免疫系统的发育。
本课题组开发了一种简单、灵活且长效的技术,该技术不需要复杂的程序,易于应用到任何实验室。采用该方法处理,人IL-6、IL-15和GM-CSF表达可存在2个月以上。与敲入细胞因子的小鼠不同,高压注射转座子体系的方法能够准确控制细胞因子的诱导时间,从而准确调控细胞的分化发育,并且可根据不同目的而灵活选择细胞因子的种类。
目前敲入人IL-6基因的人源化小鼠模型表现出适应性免疫功能明显改善、T细胞和B细胞更好地植入及分化[17]。IL-6可以诱导CD4-CD8-胸腺细胞分化为CD4+CD8+和CD4+CD8-细胞,成熟表型的B细胞随着重建时间的延长而增加,24周后超过60%。与其他模型比较,表达人IL-6基因的人源化小鼠模型总IgG和抗原特异性IgG产生明显增加,这种增加与IgG1记忆B细胞和浆母细胞的分化增强有关。因此,表达人IL-6基因的人源化小鼠模型改善了适应性免疫细胞的发育和功能。
IL-15可以诱导重建的NK细胞表现出正常的表型和功能。诱导人NK细胞表达NK受体的3个主要家族包括NK细胞活化性受体(NKG2D)、NK细胞抑制性受体(NKG2A和KIR)及天然细胞毒性受体(NKp46)[10]。细胞因子诱导的NK细胞能够在体外和体内裂解组织相容性复合体Ⅰ类分子(MHC Ⅰ)缺陷的靶细胞[18], 并在聚肌胞苷酸(polyⅠ:C)刺激时分泌干扰素γ(interferon-γ, IFN-γ)。此外,细胞因子诱导的NK细胞能够针对腺病毒感染产生强烈反应,如IL-15和酪氨酸激酶3(Flt-3)/胎肝激酶2(Flk-2)配体处理的人源化小鼠发生广泛的肝坏死和高水平的丙氨酸氨基转移酶(ALT)[19]。上述研究[10, 18-19]表明:人IL-15诱导的NK细胞在表面表型和功能方面均正常。
人源化小鼠中GM-CSF和IL-4的表达可以刺激B细胞的成熟、CD5+B细胞的产生和CD209+DC的分化,这些细胞因子处理的小鼠可以在免疫后产生明显的抗原特异性IgG抗体应答[20]。IL-3和GM-CSF的表达诱导功能性人肺泡巨噬细胞的发育[21]。
引起人类疾病的某些病原体具有种属特异性[10]。例如,登革热病毒感染人DC和单核细胞/巨噬细胞,恶性疟原虫感染人红细胞,Epstein Barr病毒感染人B细胞,人类免疫缺陷病毒-1感染人巨噬细胞和T细胞。目前人源化小鼠对于上述感染的研究受到病原体靶细胞的缺失或者其存在的数量远低于人体组织的阻碍。本研究结果表明:通过高压注射递送表达细胞因子基因的转座子系统,可以增强人源化小鼠中特定人血细胞谱系重建的能力,有助于使人源化小鼠成为针对病原体感染后的免疫应答研究的更好模型。
| [1] |
RONGYVAUX A, TAKIZAWA H, STROWIG T, et al. Human hemato-lymphoid system mice:current use and future potential for medicine[J]. Annu Rev Immunol, 2013, 31: 635-674. DOI:10.1146/annurev-immunol-032712-095921 |
| [2] |
SHULTZ L D, BREHM M A, GARCIA-MARTIZNE Z J V, et al. Humanized mice for immune system investigation:progress, promise and challenges[J]. Nat Rev Immunol, 2012, 12(11): 786-798. DOI:10.1038/nri3311 |
| [3] |
TANAKA S, SAITO Y, KUNISAWA J, et al. Development of mature and functional human myeloid subsets in HSC engrafted NOD/SCID/IL2rγKO mice[J]. J Immunol, 2012, 188(12): 6145-6155. DOI:10.4049/jimmunol.1103660 |
| [4] |
HUNTINGTON N D, LEGRAND N, ALVES N L, et al. IL-15 trans-presentation promotes human NK cell development and differentiation in vivo[J]. J Exp Med, 2009, 206(1): 25-34. DOI:10.1084/jem.20082013 |
| [5] |
GIARRATANA M C, KOBARI L, LAPILLONNE H, et al. Ex vivo generation of fully mature human red blood cells from hematopoietic stem cells[J]. Nat Biotechnol, 2005, 23(1): 69-74. |
| [6] |
ROSENZWAJG B M, CANQUE B, GLUCKMAN J C. Human dendritic cell differentiation pathway from CD34+ hematopoietic precursor cells[J]. Blood, 1996, 87(2): 535-544. DOI:10.1182/blood.V87.2.535.bloodjournal872535 |
| [7] |
EISENMAN J, AHDIEH M, BEERS C, et al. Interleukin-15 interactions with interleukin-15 receptor complexes:characterization and species specificity[J]. Cytokine, 2002, 20(3): 121-129. DOI:10.1006/cyto.2002.1989 |
| [8] |
MANZ M G. Human-hemato-lymphoid-system mice:opportunities and challenges[J]. Immunity, 2007, 26(5): 537-541. DOI:10.1016/j.immuni.2007.05.001 |
| [9] |
NICOLINI F E, CASHMAN J D, HOGGE D E, et al. NOD/SCID mice engineered to express human IL-3, GM-CSF and Steel factor constitutively mobilize engrafted human progenitors and compromise human stem cell regeneration[J]. Leukemia, 2004, 18(2): 341-347. DOI:10.1038/sj.leu.2403222 |
| [10] |
CHEN Q F, KHOURY M, CHEN J Z. Expression of human cytokines dramatically improves reconstitution of specific human-blood lineage cells in humanized mice[J]. Proc Natl Acad Sci U S A, 2009, 106(51): 21783-21788. DOI:10.1073/pnas.0912274106 |
| [11] |
DING S, WU X H, LI G, et al. Efficient transposition of the piggyBac (PB) transposon in mammaliancells and mice[J]. Cell, 2005, 122(3): 473-483. DOI:10.1016/j.cell.2005.07.013 |
| [12] |
WILSON M H, COATES C J, GEORGE JR A L. PiggyBac transposon-mediated gene transfer in human cells[J]. Mol Ther, 2007, 15(1): 139-145. DOI:10.1038/sj.mt.6300028 |
| [13] |
TAGAYA H, SEMBA K, ISHIKAWA K. Genetic manipulation of the mammary gland and potential applications[J]. Oncotarget, 2019, 10(42): 4253-4254. |
| [14] |
YONG M K S, HER Z, CHEN Q F, et al. Humanized mice as unique tools for human-specific studies[J]. Arch Immunol Ther Exp(Warsz), 2018, 66(4): 245-266. DOI:10.1007/s00005-018-0506-x |
| [15] |
HU Z, VEN ROOIJEN N, YANG Y G. Macrophages prevent human red blood cell reconstitution in immunodeficient mice[J]. Blood, 2011, 118(22): 5938-5946. DOI:10.1182/blood-2010-11-321414 |
| [16] |
JANGALWE S, SHULTZ L D, MATHEW A, et al. Improved B cell development in humanized NOD-scid IL2Rgnull mice transgenically expressing human stem cell factor, granulocyte-macrophage colony-stimulating factor and interleukin-3[J]. Immun Inflamm Dis, 2016, 4(4): 427-440. DOI:10.1002/iid3.124 |
| [17] |
YU H, BORSOTTI C, SCHICKEL J N, et al. A novel humanized mouse model with significant improvement of class-switched, antigen-specific antibody production[J]. Blood, 2017, 129(8): 959-969. DOI:10.1182/blood-2016-04-709584 |
| [18] |
HERNDLER-BRANDSTETTER D, SHAN L, YAO Y, et al. Humanized mouse model supports development, function, and tissue residency of human natural killer cells[J]. Proc Natl Acad Sci U S A, 2017, 114(45): E9626-E9634. DOI:10.1073/pnas.1705301114 |
| [19] |
ROSENBERGER C M, CLARK A E, TREUTING P M, et al. ATF3 regulates MCMV infection in mice by modulating IFN-γ expression in natural killer cells[J]. Proc Natl Acad Sci U S A, 2008, 105(7): 2544-2549. DOI:10.1073/pnas.0712182105 |
| [20] |
CHEN Q F, HE F, KWANG J, et al. GM-CSF and IL-4 stimulate antibody responses in humanized mice by promoting T, B and dendritic cell maturation[J]. J Immunol, 2012, 189(11): 5223-5229. DOI:10.4049/jimmunol.1201789 |
| [21] |
WILLINGER T, RONGVAUX A, TAKIZAWA H, et al. Human IL-3/GM-CSF knock-in mice support human alveolar macrophage development and human immune responses in the lung[J]. Proc Natl Acad Sci U S A, 2011, 108(6): 2390-2395. DOI:10.1073/pnas.1019682108 |
 2020, Vol. 46
2020, Vol. 46


