扩展功能
文章信息
- 陈林, 赵良智, 蔡艳俊, 齐月, 李婉玉
- CHEN Lin, ZHAO Liangzhi, CAI Yanjun, QI Yue, LI Wanyu
- 先天性肝纤维化致肝功能衰竭行肝移植术1例报告及文献复习
- Liver transplantation for congenital hepatic fibrosis-induced liver function failure: A case report and literature review
- 吉林大学学报(医学版), 2020, 46(01): 159-163
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 159-163
- 10.13481/j.1671-587x.20200128
-
文章历史
- 收稿日期: 2019-05-01
2. 吉林大学第一医院培训部, 吉林 长春 130021
2. Department of Training, First Hospital, Jilin University, Changchun 130021, China
先天性肝纤维化(congential hepatic fibrosis, CHF)是一种少见的常染色体隐性遗传病,多见于儿童。CHF的病理改变为肝内各汇管区纤维组织明显增生,其间密布粗细不一的胆管丛,呈管状或囊状扩张,宽厚的纤维素连接着胆管,把肝组织分割成无数不整齐的小岛,肝小叶结构尚正常,有完整的中央静脉。CHF患者主要临床表现为肝纤维化和门静脉高压症,而肝功能正常或轻度异常[1], 常并发多囊肾和(或)肝内外胆管发育异常。由于CHF临床表现无特异性,易误诊或漏诊,因此肝穿刺活检是唯一的诊断标准。本例患者除具备CHF典型的门静脉高压外,凝血功能差,并发肝功能衰竭,因CHF所致肝功能衰竭病例少见,故在诊治过程中曾忽略本病,患者肝移植前并未明确诊断。目前国内外CHF的治疗多以内科治疗为主,行外科肝移植术的患者较少。现将1例CHF致肝功能衰竭行肝移植术患者的诊断和治疗过程报道如下,以提高对该病的认识。
1 临床资料 1.1 一般资料患者,男性,39岁。因乙型肝炎病原学阳性30余年,肝硬化5年,食管胃底曲张静脉套扎术后2月余入院。患者30余年前查体时发现乙型肝炎病原学阳性,肝功能及病毒定量结果不详,未定期检查及系统治疗。5年前因强直性脊柱炎就诊于当地医院首次确诊为肝硬化,无腹腔积液,乙型肝炎病原学阴性,诊断为肝硬化代偿期,此后仍未进行系统治疗。2个月前患者出现呕血,约3 000 mL,并有黑便,于吉林市中心医院行内镜下胃底食管曲张静脉套扎手术后出院。患者病程中尿黄,睡眠欠佳,近半年体质量减轻约22 kg。
1.2 既往史强直性脊柱炎5年,未行系统治疗;无特殊药物服用史,无长期大量饮酒史。其母患有乙型肝炎。
1.3 入院查体患者生命体征平稳,体态肥胖,体质量指数(BMI)38 kg·m-2,皮肤及巩膜轻度黄染,贫血貌,可见肝掌,未见蜘蛛痣。双肺呼吸音粗,未闻及干湿性口罗音。腹膨隆,腹部无明显压痛、肌紧张及反跳痛,肝脾肋下未触及,Murphy征阴性,肝区叩击痛阴性,移动性浊音阳性,双下肢无明显水肿。
1.4 辅助检查乙型肝炎表面抗体及核心抗体阳性,乙型肝炎病毒定量 < 50 IU·mL-1。抗核抗体(ANA)和抗线粒体M2抗体阴性,铜蓝蛋白0.19 g·L-1,血清铜和24 h尿铜正常。血常规:白细胞1.44×109 L-1,红细胞3.31×1012L-1,血红蛋白77g·L-1,血小板77×109 L-1;凝血常规:凝血酶原时间22.1s,国际标准化比值1.88,凝血酶原活动度40%,纤维蛋白原1.08 g·L-1;肝功能:胆碱脂酶1501U·L-1,白蛋白30.2 g·L-1,总胆红素34.8 μmol·L-1;肾功能:肌酐51.1 μmol·L-1;尿液常规检查:尿胆红素1+,尿潜血3+,尿蛋白3+,尿红细胞4747.0/HPF,尿白细胞207.9/HPF,管型78/LPF。尿培养阴性。溶血检查及阵发性睡眠性血红蛋白尿症(PNH)流式监测未见异常;抗中性粒细胞抗体阴性。血尿定位:考虑为肾小球性血尿并发急慢性泌尿系统感染。24 h尿蛋白5.19 g·24 h-1,24 h尿微量白蛋白3563.60 mg·24 h-1;尿微量蛋白5项:IgG 600.98 mg·24h-1,LAM轻链130.16 mg·24 h-1,KAP轻链178.48 mg·24 h-1。肝胆脾胰多排CT平扫加三期增强扫描显示:肝硬化,脾大,少量腹水,门静脉高压伴侧支循环开放并与左肾静脉相通(图 1)。肾脏多排CT平扫加三期增强扫描显示:右肾上部见类圆形略低密度影,大小为3.0 cm×2.2 cm,CT值约为30 HU,边界尚清,增强扫描呈低强化;右肾内另见类圆形低密度影,直径约1.0 cm,界清,未见强化(图 2)。脏器声学造影:右肾上部背侧低-无回声结节,造影考虑复杂囊肿可能性大。PET/CT报告:①肝硬化,肝脏代谢密度不均匀增高,肝实质内未见局限异常高代谢灶;②右肾上部团块,代谢不高,考虑肾囊肿。
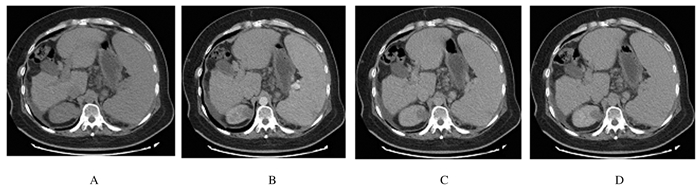
|
| A: Non-contrast phase; B: Arterial phase; C: Portal venous phase; D: Equilibrium phase. 图 1 CHF患者肝胆脾胰多排CT平扫加三期增强扫描图像 Fig. 1 Images of multi-slice CT scan and triple-phase contrast-enhanced scan of hepatobiliary, spleen and pancreas of CHF patient |
|
|
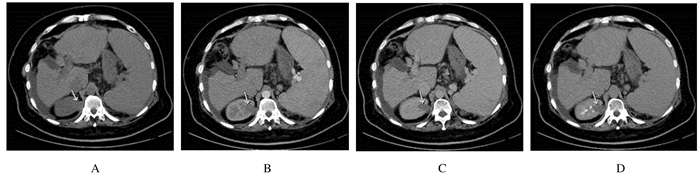
|
| The arrow showed a slightly low-density shadow on the upper part of the right kidney. A: Non-contrast phase; B: Arterial phase; C: Portal venous phase; D: Equilibrium phase. 图 2 CHF患者肾脏多排CT平扫加三期增强扫描图像 Fig. 2 Images of multi-slice CT scan and triple-phase contrast-enhanced scan of kidney of CHF patient |
|
|
患者入院后诊断为肝硬化失代偿期和右肾囊肿。患者肝硬化原因不详,考虑如下:①乙型肝炎病毒感染。患者有乙型肝炎家族史,30余年前明确诊断为乙型肝炎,此次入院检查示乙型肝炎表面抗体(+)、乙肝核心抗体(+),肝硬化可能为乙型肝炎所致,但病情进展过程中机体自行清除病毒。②非酒精性脂肪肝。患者肥胖,BMI高,不除外非酒精性脂肪肝所致。③肝豆状核变性。患者无家族史,铜蓝蛋白略低,血清铜、24h尿铜正常,角膜色素环(K-F环)阴性,不支持本病。④药物及酒精。患者无特殊药物服用史及长期大量饮酒史,故除外本病。患者肝硬化原因不详,入院时即存在肝功能衰竭,凝血功能极差,肝穿刺风险大,故不适合病理学诊断。出现一过性肉眼血尿,入院后给予改善肝功能、改善凝血和对症支持治疗后,患者病情一直无好转,凝血功能无改善,肝功能衰竭未得到纠正。患者预后差,向其交代肝移植,于入院后第43天行同种异体原位肝移植术。术后肝脏病理检查结果:汇管区周围弥漫性肝纤维化,肝细胞岛不规则,纤维间隔内见胆管增生,局部成错构瘤样改变,考虑为CHF所致。免疫组织化学:HbcAg(-),HbsAg(-),CK7(胆管+)。特殊染色:Masson(+),网染(+)。见图 3(封三)。病理诊断:CHF。患者移植术后1个月复查肝功能、肾功能、血常规和凝血常规均正常。目前患者术后1年,恢复较好。
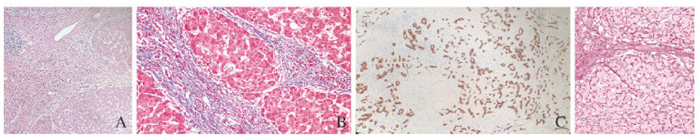
|
| A: HE staining (×100 );B: CK7 staining (×100);C: Masson (+);D:Feticular fiber (+). 图 3 CHF患者肝组织病理形态表现 Fig. 3 Pathomorphology of liver tissue of CHF patient |
|
|
1961年KERR等[2]首次报道了CHF病例。CHF为一种罕见的遗传性先天性畸形,以门管区结缔组织增生和小胆管增生为特征,病程后期会导致门静脉高压症,50%患者因消化道出血死亡。CHF现病因未明,常累积多器官系统,常因伴随其他疾病而临床表现多样化,导致临床确诊困难。CHF发病率极低,有文献报道大约为1/40 000~1/20 000[3]。CHF根据临床表现分为门静脉高压型、胆管炎型、混合型和隐匿型[4]。吴欣等[5]观察了75例CHF患者,其中51%为门静脉高压型,5%为胆管炎型,40%为门静脉高压和胆管炎混合型,其余3%为隐匿型。在我国,CHF以门静脉高压型为主, 与国外报道类型一致,表现为上消化道出血、腹水、脾肿大和食管胃底静脉曲张等相关并发症,胆管炎型临床少见[3]。
国外有文献[6]报道:64%的CHF患者并发常染色体隐性遗传的多囊肝肾疾病(ARPKD),25.6%的患者并发Caroli病,仅有9.5%的CHF患者为单发的CHF。目前研究[7-8]认为:CHF、ARPKD和先天性肝内胆管囊状扩张症(Caroli病)均与PKHD1基因突变有关,该基因突变可致胆管细胞的纤维环蛋白(FPC)功能缺陷,导致胆管板发育畸形。一项包括51例成人和60例儿童CHF患者的研究[9]报道:儿童期确诊CHF者肝脾肿大更明显,肾囊肿和肝囊肿相对少见,而成年期确诊肝肾囊肿更多见。存在肾脏受累者常死于肾功能不全,JANOWSKI等[1]报道婴幼儿更容易发生肾脏损害。年纪较大的CHF患者常见的肝外表现为多囊肾[3, 10]。
多数CHF患者肝功能较好,影像学检查多显示门静脉高压、胆管异常和肾脏病变等,临床上极易被漏诊或误诊为肝硬化。肝穿刺活检为诊断CHF的金标准,但很多患者因门静脉高压反复消化道出血入院,肝穿刺活检风险高或已失去活检的机会,故造成诊断困难。CHF特征性的病理特点为:①肝小叶完整的情况下汇管区极度纤维化;②纤维间隔内可见胆管板发育畸形;③肝细胞板排列大致正常[11]。
针对CHF患者尚无特殊治疗可以停止或逆转肝纤维化的进程,临床上治疗主要针对并发症。对于门静脉高压引起的消化道出血,可采用药物及内镜下套扎或注射硬化剂止血治疗[12];对于反复胆管炎发作的患者可采用内镜下逆行胰胆管造影术行胆汁引流。目前能够治愈CHF的唯一方法是肝移植。对于保守治疗无效的难治性门静脉高压症或复发性胆管炎患者,肝移植效果非常好[7]。尽管肝移植是一种治疗选择,但肝移植对与该病相关的多囊肾长期肾功能影响尚不清楚。CHF患者因门静脉高压和腹水导致肾脏血流改变导致肾功能不全与其他慢性肝衰竭比更常见。此外CHF患者对肝移植术后具有肾脏毒性的免疫抑制剂更敏感,可能会加速肾功能不全的发展[13-14],若同时存在肝肾损伤,可行肝肾联合移植,预后良好[15-17]。
本例患者在外院未明确诊断,被误诊为“乙型肝炎后肝硬化”。该患有乙型肝炎家族史,自述多年前乙型肝炎病原学阳性,5年前诊断肝硬化时HBsAg及HBVDNA阴性,当时医生推测肝硬化可能为乙型肝炎所致,但病情进展过程中机体自行清除病毒。患者在本院行乙型肝炎病原学检测,乙型肝炎表面抗体和核心抗体阳性,乙型肝炎病毒定量 < 50IU·mL-1,考虑既往感染过乙型肝炎已经清除并且产生保护性抗体。该患误诊的原因可能是临床医生认识不足,未意识到病例的特殊性,亦可能是外院的检验结果存在误差从而导致误诊。该患最终通过肝穿刺活检确诊,并行肝移植术,术后恢复较好。
经验和教训:本例患者的特点为青年男性,病程长,以门静脉高压为突出表现,肝功能轻度改变并存在右肾复杂囊肿。因此对于临床医生,要提高自己的分析和辨别能力,提高临床思维能力,加强对CHF的认知,对于不明原因的门静脉高压,尤其是肝功能改变不明显,存在多囊肾或肾囊肿的病例,要考虑CHF的可能,并应在病情允许阶段尽早完善肝穿刺活检确诊。对于降门脉压力包括内科保守治疗、经颈静脉门体分流(TIPS)及脾切联合断流术控制不佳的CHF患者,应尽早行肝移植术,预后较好。
| [1] |
JANOWSKI K, GOLISZEK M, CIELECKA-KUSZYK J, et al. Congenital hepatic fibrosis in a 9-year-old female patient-a case report[J]. Clin Exp Hepatol, 2017, 3(3): 176-179. |
| [2] |
KERR D N, HARRISON C V, SHERLOCK S, et al. Congenital hepatic fibrosis[J]. Q J Med, 1961, 30: 91-117. |
| [3] |
杨灿洪, 刘志华. 先天性肝纤维化合并多囊肾1例[J]. 中华肝脏病杂志, 2015, 23(6): 467-468. DOI:10.3760/cma.j.issn.1007-3418.2015.06.015 |
| [4] |
任美欣, 韩莹, 刘晖, 等. 先天性肝纤维化10例临床分析[J]. 北京医学, 2018, 40(4): 364-365, 368. |
| [5] |
吴欣, 周超, 罗生强. 先天性肝纤维化不同分型的临床特征75例分析[J]. 肝脏, 2014, 19(7): 479-482. |
| [6] |
SRINATH A, SHNEIDER B L. Congenital hepatic fibrosis and autosomal recessive polycystic kidney disease[J]. J Pediatr Gastroenterol Nutr, 2012, 54(5): 580-587. DOI:10.1097/MPG.0b013e31824711b7 |
| [7] |
ROCK N, MCLIN V. Liver involvement in children with ciliopathies[J]. Clin Res Hepatol Gastroenterol, 2014, 38(4): 407-414. DOI:10.1016/j.clinre.2014.04.001 |
| [8] |
LOCATELLI L, CADAMURO M, SPIRLÌ C, et al. Macrophage recruitment by fibrocystin-defective biliary epithelial cells promotes portal fibrosis in congenital hepatic fibrosis[J]. Hepatology, 2016, 63(3): 965-982. DOI:10.1002/hep.28382 |
| [9] |
吴欣, 杜霄壤, 丁金芳, 等. 儿童先天性肝纤维化的临床特点[J]. 临床儿科杂志, 2016, 34(6): 444-448. DOI:10.3969/j.issn.1000-3606.2016.06.011 |
| [10] |
GUNAY-AYGUN M, FONT-MONTGOMERY E, LUKOSE L, et al. Characteristics of congenital hepatic fibrosis in a large cohort of patients with autosomal recessive polycystic kidney disease[J]. Gastroenterology, 2013, 144(1): 112-121. DOI:10.1053/j.gastro.2012.09.056 |
| [11] |
冯茂森, 马文斌, 汤善宏, 等. 先天性肝纤维化的发病机制及诊治现状[J]. 临床肝胆病杂志, 2017, 33(3): 553-557. DOI:10.3969/j.issn.1001-5256.2017.03.035 |
| [12] |
ROSSI G, DE CHIO T, NASTASIO S, et al. Spontaneous extra-hepatic portosystemic shunt in congenital hepatic fibrosis[J]. J Pediatr Gastroenterol Nutr, 2018, 66: e108. DOI:10.1097/MPG.0000000000001143 |
| [13] |
T HONGPRAYOON C, KAEWPUT W, THAMCHAROEN N, et al. Incidence and impact of acute kidney injury after liver transplantation:A meta-analysis[J]. J Clin Med, 2019, 8(3): E372. DOI:10.3390/jcm8030372 |
| [14] |
DE HAAN J E, HOORN E J, DE GEUS H R H. Acute kidney injury after liver transplantation:Recent insights and future perspectives[J]. Best Pract Res Clin Gastroenterol, 2017, 31(2): 161-169. |
| [15] |
CHANDAR J, GARCIA J, JORGE L, et al. Transplantation in autosomal recessive polycystic kidney disease:liver and/or kidney?[J]. Pediatr Nephrol, 2015, 30(8): 1233-1242. DOI:10.1007/s00467-014-2887-3 |
| [16] |
郑卫萍, 沈中阳. 肝细胞癌肝移植术后肿瘤复发的危险因素与防治策略[J]. 临床肝胆病杂志, 2019, 35(11): 2391-2395. |
| [17] |
解恩博, 轩凤慧, 孙晓东, 等. 肝移植术后早期并发症的危险因素分析[J]. 临床肝胆病杂志, 2018, 34(6): 1282-1288. DOI:10.3969/j.issn.1001-5256.2018.06.030 |
 2020, Vol. 46
2020, Vol. 46


