扩展功能
文章信息
- 朱亚平, 王成坤, 吴庆翠, 李怡然, 马昂, 秦娇娇, 焦珊, 王静
- ZHU Yaping, WANG Chengkun, WU Qingcui, LI Yiran, MA Ang, QIN Jiaojiao, JIAO Shan, WANG Jing
- 脱敏剂和激光脱敏对牙本质表面形态、硬度和成分的影响
- Effects of desensitizer and laser desensitization on surface morphology, hardness and composition of dentin
- 吉林大学学报(医学版), 2020, 46(01): 121-126
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 121-126
- 10.13481/j.1671-587x.20200121
-
文章历史
- 收稿日期: 2019-10-08
牙本质敏感症是指由于外界的冷、热、化学和渗透性刺激作用于牙齿上暴露的牙本质而出现的一种特殊的疼痛或不适的症状[1]。根据流行病学调查,牙本质敏感症的患病率高达25.5%[2]。但是关于牙本质敏感症的确切病因及有效治疗方法尚不清楚,最常用的治疗方法是阻断暴露的牙本质小管,降低感觉神经的兴奋性[3]。目前临床上应用较多的为生物活性玻璃脱敏剂和激光脱敏,激光脱敏主要包括掺铒钇铝石榴石(erbium-doped:yttrium-aluminium-garnet, Er:YAG)激光和掺钕钇铝石榴石(neodymium-doped:yttrium aluminium garnet,Nd:YAG)激光。奥敏清是一种新型生物活性玻璃脱敏剂。有文献[4]报道:一些脱敏剂会改变人牙本质的化学结构,同样激光系统应用于硬组织时产生的热量也可能会改变牙本质组织的结构和组成。但目前的研究仅限于各类脱敏剂或激光对牙本质表面的影响。本研究首次将奥敏清脱敏剂与Er:YAG激光和Nd:YAG激光进行比较研究,以期为其临床用于牙本质敏感症的治疗提供新的理论依据。
1 材料与方法 1.1 实验材料和仪器奥敏清牙齿脱敏剂(北京大清生物技术有限公司),氯胺T(天津市光复精细化工研究所),人工唾液(长春市鑫盛源商贸有限公司)。STX-202A型金刚石线切割机(沈阳科晶自动化设备有限公司),Fidelis双波长激光治疗仪(德国Fotona公司),HV-1000型普及型手动转塔显微硬度计(上海距晶精密仪器制造有限公司),XL-30 ESEM FEG扫描电子显微镜(SEM)(美国FEI公司);OXFORD INCA X射线能谱仪(EDS) (英国牛津仪器公司),KQ3200DB型数控超声波清洗器(江苏省昆山市超声仪器有限公司)。
1.2 离体牙收集及牙本质敏感症模型制备收集吉林大学口腔医院口腔颌面外科18~20岁志愿者因阻生而拔除的新鲜第三磨牙32颗,牙体均完好无缺损、无龋坏、无隐裂,用刮治器去除根面软组织及牙石后储存于1%氯胺T溶液中,于4℃环境下保存至使用。
将选用的32颗第三恒磨牙用硅橡胶包埋成立方体形状并固定,金刚石线切割机垂直于牙长轴方向切割,获得厚度约2 mm的牙本质片。实验面为远髓端,指甲油标记非实验面,实验面用600目的碳化硅砂纸湿打磨30 s,冲洗至表面光滑,去离子水超声荡洗10 min,17%EDTA处理5 min,蒸馏水冲洗60 s,保存于4℃的人工唾液中备用。所有样本随机分为4组(每组8个样本):空白对照组, 不进行任何处理;奥敏清组,用毛刷将奥敏清脱敏剂轻轻涂抹于样本实验面,保持2 min,用无压力水流冲洗去除;Er:YAG激光组,采用R02手具,0.2 W、每脉冲能量80 mJ、无水无气、3Hz、短脉冲300 μs模式距离样本表面6 mm匀速移动光纤;Nd:YAG激光组,激光应用前于样本表面涂布墨水,采用R21手具,1W、无水无气、10 Hz、短脉冲180 μs模式,距样本2 mm匀速移动光纤。然后将处理后的样本从中心纵向劈开,所得的一半用于硬度检测,另一半用于钙(Ca)和磷(P)含量检测,分别采用显微硬度计测量各组牙本质表面硬度值,采用SEM观察其表面形态表现,采用EDS分析牙本质表面Ca和P含量变化。
1.3 牙本质样本表面显微硬度(surface microhardness, SMH)值检测将显微硬度计接通电源,调节各项参数:试验力1.96N(200gf),加载时间15 s,检测单位0.25 μm/格。将待检样本分别放在测试台上,转动升降旋轮使测试台上升,当试件离物镜下端约1 mm时目镜下观察,在目镜的视野内出现明亮光斑,此时应缓慢微量上升测试台,直至目镜中观察到试样表面清晰成像,将侧方的压头旋转至测试仪的正前方,按“启动键”,此时自动加载试验力,待15s倒计时结束后,加载试验力结束,再将物镜旋转至正前方,通过目镜观察菱形压痕并调节至视野中心,利用测量仪测量该菱形的对角线长度(d1、d2),采用公式计算可得到各个样本维氏(Vicker’ s)微硬度值(HV)。HV (kgf·mm-2) =F/S=2Fsin(θ/2)d2, F为试验力(kgf),S为压痕锥形表面积(mm2),d为压痕对角线平均长度(mm),θ为压头两相对面夹角(136°)。为减小人为误差,对每个样本垂直加压测量5个点,记录平均HV值作为该样本的SMH值。
1.4 牙本质样本表面形态观察和Ca及P含量测定将所有待检样本自然干燥48 h,喷金,导电胶粘固,SEM观察牙本质表面形态表现。在每个样本表面随机选取2个边长1 mm的区域,采用EDS进行X射线能谱分析,记录该区所含的多种组成元素的质量分数,分析并计算Ca和P含量及Ca/P比值。
1.5 统计学分析采用SPSS 23.0统计软件进行统计学分析。各组样本的SMH值、Ca和P含量及Ca/P比值均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组样本牙本质SMH值各组样本牙本质SMH值见表 1。各组样本牙本质SMH值比较差异无统计学意义(P>0.05)。
| (n=8, x±s, kgf·mm-2) | |
| Group | SMH |
| Blank control | 51.230±1.872 |
| Aominqing | 51.917±1.784 |
| Er:YAG laser | 52.750±1.845 |
| Nd:YAG laser | 52.017±1.897 |
采用SEM观察样本所选择的典型区域的表面形态表现:空白对照组牙本质表面无涂片层,小管较宽,表面光滑清洁;奥敏清组样本表面牙本质小管部分封闭,小管内可见阻塞物;Er:YAG组样本牙本质小管很少或未开放,大部分为部分或完全封闭的小管,表面可见熔融状改变;Nd:YAG组样本表面牙本质小管部分或完全封闭,开放小管极少,表面呈熔融状。见图 1。
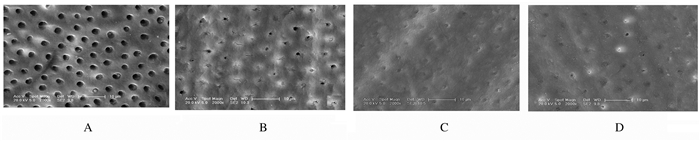
|
| A: Blank control group; B: Aominqing group; C: Er:YAG laser group; D: Nd:YAG laser group. 图 1 各组样本牙本质表面形态表现(SEM, ×2 000) Fig. 1 Morhpology of deatin surface of samples in various groups(SEM, ×2 000) |
|
|
各组样本牙本质表面Ca和P含量比较差异有统计学意义(P < 0.05),各组间Ca/P比值比较差异无统计学意义(P>0.05)。与空白对照组和奥敏清组比较,Er:YAG组和Nd:YAG组样本牙本质表面Ca和P含量明显升高(P < 0.05);与空白对照组比较,奥敏清组样本牙本质表面Ca和P含量差异无统计学意义(P>0.05);与Nd:YAG组比较,Er:YAG组样本牙本质表面Ca和P含量差异也无统计学意义(P>0.05)。见表 2。
| (n=8, x±s) | |||
| Group | Ca(η/%) | P(η/%) | Ca/P ratio |
| Blank control | 20.913±1.129 | 10.715±0.771 | 1.954±0.046 |
| Aominqing | 23.498±3.116 | 11.847±1.422 | 1.988±0.165 |
| Er:YAG laser | 26.673±1.571*△ | 13.797±0.667*△ | 1.933±0.049 |
| Nd:YAG laser | 26.920±2.915*△ | 13.513±1.558*△ | 1.995±0.092 |
| *P < 0.05 compared with blank control group; △P < 0.05 compared with Aominqing group. | |||
近年来,由于医学研究的进步,激光用于脱敏治疗逐步成为临床应用和研究的热点。目前在口腔领域应用的激光种类较多[5], 应用最广泛的为Er:YAG激光和Nd:YAG激光,其操作简单,具有很好的安全性和有效性,无明显刺激性,特别是在低功率使用时不会产生明显的不良反应,这些特点可能使其成为一种有效治疗牙本质敏感症的手段。Er:YAG是美国食品药物管理局(FDA)1977年准许用以临床诊疗的牙体硬组织激光,波长为2.94μm。当Er:YAG激光照射牙体组织时,水和羟基磷灰石能大量的接收激光的能量,导致微爆炸和组织消融[6]。Nd:YAG激光波长为1.06μm,对水和羟磷灰石的吸收率要远低于Er:YAG激光[7],因此当Nd:YAG激光应用于牙本质敏感的治疗时,需在敏感面涂抹黑色墨水,以提高激光束的吸收率[8]。激光治疗牙本质敏感的有效性也取决于波长和参数设置,因此在本研究中是根据Fotona激光厂家所推荐的参数进行的。
大部分传统脱敏剂应用于敏感症的牙齿时,仅沉积于牙本质表面,小管内的闭塞程度仅在表面以下几微米,由于人类口腔的动态性,以及咀嚼、刷牙和唾液流动的局部作用,长期效果通常较差[9]。因此,治疗牙本质敏感症需要一种能与牙本质表面发生化学反应的材料,其紧密地与暴露的牙本质相结合,并明显降低重新打开牙本质小管的可能性[10]。奥敏清是一种具有高度生物相容性的新型材料,在唾液环境下可与牙本质表面发生迅速、持续的反应,释放Ca和P活性成分,对牙齿进行再矿化[11]。由于效果持久、反应迅速,具有较高的临床价值, 值得研究和推广,因此本实验选择了奥敏清脱敏剂作为研究对象。
本研究中,SEM观察到上述2种激光处理的样本表面呈熔融状改变,是由于其光热效应使牙本质表面的无机物熔融,或有机物变性凝固,缩窄或完全封闭牙本质小管[12]。奥敏清组可观察到样本表面牙本质小管部分封闭,小管内可见阻塞物,其原理是在唾液环境下与牙本质表面发生迅速、持续的反应,释放Ca和P活性成分,对牙齿进行再矿化。由于本研究为体外实验,不能最大限度地模拟临床,因此存在一定的局限性。
牙本质的SMH是牙本质的重要物理性能之一。SMH定义为局部变形抗力,其基础是荷载消除后仍存在的永久表面变形,是用来评价牙齿硬组织表面矿物质密度变化的一种方法[13]。因Vicker’ s微硬度可测定从极软到极硬各种金属材料的硬度,可比性高,能测较薄工件,测量精确可靠,在科学研究中广泛应用,因此本实验采用Vicker’ s微硬度来评估奥敏清脱敏剂、Er:YAG激光和Nd:YAG激光治疗后牙本质SMH值的变化。本研究结果表明:各组样本间牙本质SMH值比较差异无统计学意义。对于奥敏清组,是由于牙本质表面形成了矿化层且该矿化层较薄,不足以引起其硬度值的改变;Er:YAG和Nd:YAG激光组可能是由于所用激光功率较小,未能改变牙本质表面的机械性能。HAJIZADEH等[14]研究发现:Er:YAG激光照射后牙本质SMH值无明显提高。研究[15]显示:Nd:YAG激光照射后牙本质硬度会增加,这是由于激光提供有效的消融率,导致组织成分的去除,改变了其形态和机械性能,硬组织中的微熔融和再结晶与表面相对较高的矿物质含量有关。由于本研究样本量相对较少,SMH测定结果仅有一定的参考价值,因此在以后的研究中需要增加样本量加以验证。
在本研究中,样本表面除了SMH值变化之外,牙本质组织的组成成分也会发生变化。牙本质是一种复杂的矿化组织,由约70%的矿物质、20%的有机基质和10%的水组成。羟基磷灰石晶体中的Ca和P元素是牙齿硬组织的主要无机成分,激光及一些脱敏剂的应用可能会引起牙本质的一些形态和化学变化,改变牙本质表面的Ca/P比值[16]。奥敏清脱敏剂在唾液环境下可与牙本质表面发生迅速、持续的反应,释放Ca和P活性成分,对牙齿进行再矿化,Ca和P所产生的沉积,在牙本质之上和之内形成稳定的结晶状羟基磷灰石层,封闭牙本质小管,消除敏感症状。本研究通过EDS分析显示:奥敏清处理后的样本表面Ca和P含量及Ca/P比值与空白对照组比较差异无统计学意义, 可能与在实验过程中未能完全模拟口腔内的环境以及操作方式有关。Er:YAG或Nd:YAG激光处理后牙本质表面Ca和P元素含量明显高于空白对照组和奥敏清组,但各组间Ca/P比值比较差异无统计学意义。该效应可能是由于激光照射过程中有机成分的蒸发,导致浅表Ca和P元素含量同时增加[17]。CONTRERAS-ARRIAGA等研究[18]表明:在较低能量密度下Er:YAG激光照射牙本质后Ca和P元素的含量及Ca/P比值无明显变化。同样,最近的一项研究[4]显示:使用Er:YAG、Nd:YAG和KTP激光照射牙本质表面不会改变Ca、钾(K)、镁(Mg)、钠(Na)和P浓度,也不会改变牙本质表面的Ca/P比值。但TOPÇUOGLU等[19]研究发现:Er:YAG或Nd:YAG激光照射后牙本质中Ca、P、Mg和K等元素含量升高,Ca/P比值不受影响。研究[20-21]显示:Er:YAG激光作用于牙本质后表面后化学成分发生了变化,Ca、P质量百分比明显增加。上述研究结果之间的差异可能是由于激光系统类型或矿物含量的检测方法不同而造成的。关于激光如何影响元素含量变化的原理目前仍存在争议。
综上所述,奥敏清脱敏剂和激光的应用并未明显改变牙本质表面硬度和Ca/P比值,但Er:YAG和Nd:YAG激光可增加牙本质表面Ca和P元素含量,进而引起牙本质的一些形态和化学变化,改变牙本质表面的结构和组成。
| [1] |
樊明文. 牙体牙髓病学[M]. 北京: 人民卫生出版社, 2012: 157-160.
|
| [2] |
QUE K H, RUAN J P, FAN X, et al. A multi-centre and cross-sectional study of dentine hypersensitivity in China[J]. J Clin Periodontol, 2010, 37(7): 631-637. |
| [3] |
SALUJA M, GROVER H S, CHOUDHARY P. Comparative morphologic evaluation and occluding effectiveness of Nd:YAG, CO2 and diode lasers on exposed human dentinal tubules:An invitro SEM study[J]. J Clin Diagn Res, 2016, 10(7): ZC66-ZC70. |
| [4] |
DILBER E, MALKOC M A, OZTURK A N, et al. Effect of various laser irradiations on the mineral content of dentin[J]. Eur J Dent, 2013, 7(1): 74-80. |
| [5] |
LIMA D M, TONETTO M R, DE MENDONÇA A A, et al. Human dental enamel and dentin structural effects after Er:YAG laser irradiation[J]. J Contemp Dent Pract, 2014, 15(3): 283-287. DOI:10.5005/jp-journals-10024-1529 |
| [6] |
STEEN W, MAZUMDER J. Laser processes and equipment[J]. Laser Material Processing, 2010, 22(7): 441-445. |
| [7] |
YAMADA M K, UO M, OHKAWA S, et al. Three-dimensional topographic scanning electron microscope and Raman spectroscopic analyses of the irradiation effect on teeth by Nd:YAG, Er:YAG, and CO2 lasers[J]. J Biomed Mater Res Part B Appl Biomater, 2004, 71(1): 7-15. |
| [8] |
MALEKI-POUR M R, BIRANG R Z, KHOSHAYAND M, et al. Effect of Nd:YAG laser irradiation on the number of open dentinal tubules and their diameter with and without smear of graphite:An in vitro study[J]. J Lasers Med Sci, 2015, 6(1): 32-39. |
| [9] |
XIAO S M, LIANG K N, LIU H L, et al. Effect of water-cooled Nd:YAG laser on dentinal tubule occlusion in vitro[J]. Photomed Laser Surg, 2017, 35(2): 98-104. DOI:10.1089/pho.2016.4169 |
| [10] |
ATHULURU D, REDDY C, SUDHIR K M, et al. Evaluation and comparison of efficacy of three desensitizing dentifrices on dentinalhypersensitivity and salivary biochemical characteristics:A randomized controlled trial[J]. Dent Res J (Isfahan), 2017, 14(2): 150-157. |
| [11] |
葛翘诚, 于莉, 吴佩玲. 两种药物联合治疗老年人牙本质敏感症的临床疗效观察[J]. 中华老年口腔医学杂志, 2017, 15(5): 276-279. DOI:10.3969/j.issn.1672-2973.2017.05.006 |
| [12] |
张德辉, 孙海涛, 周昆. Desensitizer Oravive联合Er:YAG激光治疗牙本质敏感的疗效观察[J]. 实用口腔医学杂志, 2015, 31(6): 837-840. DOI:10.3969/j.issn.1001-3733.2015.06.022 |
| [13] |
CHINELATTI M A, RAUCCI-NETO W, CORONA S A, et al. Effect of erbium:yttrium-aluminum-garnet laser energies on superficial and deep dentin microhardness[J]. Lasers Med Sci, 2010, 25(3): 317-324. DOI:10.1007/s10103-008-0618-3 |
| [14] |
HAJIZADEH H, NEMATI-KARIMOOY A, BABAEE-RISHKHORI P. Effect of erbium:yttrium-aluminum-garnet laser combined with mineralizing agents on microhardness of demineralized dentin[J]. Eur J Dent, 2019, 13(1): 11-16. DOI:10.1055/s-0039-1688730 |
| [15] |
AL-OMARI W M, PALAMARA J E. The effect of Nd:YAG and Er, Cr:YSGG lasers on the microhardness of human dentin[J]. Lasers Med Sci, 2013, 28(1): 151-156. DOI:10.1007/s10103-012-1094-3 |
| [16] |
BELAL M H, YASSIN A. A comparative evaluation of CO2 and erbium-doped yttrium aluminium garnet laser therapy in the management of dentin hypersensitivity and assessment of mineral content[J]. J Periodontal Implant Sci, 2014, 44(5): 227-234. DOI:10.5051/jpis.2014.44.5.227 |
| [17] |
SOARES L E, MARTIN O C, MORIYAMA L T, et al. Relationship between the chemical and morphological characteristics of human dentin after Er:YAG laser irradiation[J]. J Biomed Opt, 2013, 18(6): 068001. DOI:10.1117/1.JBO.18.6.068001 |
| [18] |
CONTRERAS-ARRIAGA B, RODRÍGUEZ-VILCHIS L E, CONTRERAS-BULNES R, et al. Chemical and morphological changes in human dentin after Er:YAGlaser irradiation:EDS and SEM analysis[J]. Microsc Res Tech, 2015, 78(11): 1019-1025. DOI:10.1002/jemt.22579 |
| [19] |
TOPÇUOGLU H S, KÖSEOGLU M. Effect of Er:YAG and Nd:YAG lasers on the mineral content of root canal dentin[J]. Lasers Med Sci, 2015, 30(2): 809-813. DOI:10.1007/s10103-013-1438-7 |
| [20] |
DU Q, GE L H, ZHANG S, et al. Effects of erbium:yttrium-aluminum-garnet laser irradiation on bovine dentin contaminated by cariogenic bacteria[J]. Photobiomodul Photomed Laser Surg, 2019, 37(5): 305-311. DOI:10.1089/photob.2018.4586 |
| [21] |
崔蜜, 马惠珍, 孙斌, 等. 不同类型牙本质保护膜对牙本质粘接性能的影响[J]. 西安交通大学学报(医学版), 2019, 40(5): 774-777. |
 2020, Vol. 46
2020, Vol. 46


