扩展功能
文章信息
- 郭向辉, 郑慧, 吴巍
- GUO Xianghui, ZHENG Hui, WU Wei
- 白头翁皂苷B4对慢性肾功能衰竭大鼠肾组织的保护作用及其机制
- Protetive effects of anemoside B4 on kidney tissue of rats with chronic renal failure and its mechanism
- 吉林大学学报(医学版), 2020, 46(01): 90-95
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 90-95
- 10.13481/j.1671-587x.20200116
-
文章历史
- 收稿日期: 2019-03-17
2. 河北医科大学附属唐山工人医院肾内科, 河北 唐山 063000;
3. 空军军医大学唐都医院麻醉科, 陕西 西安 710038
2. Department of Nephrology, Affiliated Tangshan Workers'Hospital, Hebei Medical University, Tangshan 063000, China;
3. Department of Anesthesiology, Tangdu Hospital, Air Force Military Medical University, Xi'an 710038, China
慢性肾功能衰竭(chronic renal failure,CRF)是由各种原因引起的慢性进行性肾实质损害,导致肾脏明显萎缩,无法维持其基本功能,严重威胁人类健康[1]。白头翁[Pulsatilla chinensis (Bge.) Regel]是一种临床常用中药,具有清热解毒和止痰化湿的功效,常用于湿热痢疾等湿热证。白头翁中分离得到的多种皂苷类化合物,具有抗炎和抗肿瘤等作用[2-4]。白头翁皂苷B4为白头翁皂苷中主要单体成分之一,国内外对于白头翁皂苷B4的药理研究报道较少。研究[5]结果显示:白头翁皂苷B4对内毒素(LPS)所致人胚肾细胞HEK293损伤具有保护作用,但目前白头翁皂苷B4对CRF的作用尚未见相关报道。研究[6]显示:氧化应激导致细胞中线粒体脂质、蛋白质和核酸的过氧化,进一步激活相关的凋亡蛋白,导致细胞凋亡,氧化应激主要通过B淋巴细胞瘤2(B cell lymphoma-2,Bcl-2)家族、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)家族、线粒体途径、内质网途径和死亡受体途径等触发细胞凋亡信号。本研究采用腺嘌呤灌胃法建立CRF大鼠模型,并给予白头翁皂苷B4进行干预,通过检测大鼠血清中血肌酐(Scr)和尿素氮(BUN)水平,观察肾组织中的氧化应激和炎症反应变化及磷脂酰肌醇3激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B,Akt)通路的激活及相关凋亡蛋白Bcl-2、B细胞淋巴瘤2相关X蛋白(Bcl-2 associated X protein,Bax)和含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)表达水平,探讨白头翁皂苷B4对CRF大鼠肾组织的保护作用及其机制。
1 材料与方法 1.1 实验动物、主要试剂及仪器75只雄性SD大鼠购自河北省实验动物中心。白头翁皂苷B4 (C59H96O26,相对分子质量为1221.39),购自美国Sigma公司。超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)检测试剂盒购自广州菲博生物科技有限公司,白细胞介素1β(interleukin-1β, IL-1β)、白细胞介素6(interleukin-6, IL-6)和肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)ELISA试剂盒及Caspase-3、Akt、磷酸化Akt(p-Akt)、Bax、Bcl-2和GAPDH抗体均购自英国Abcam公司。7100型全自动生化分析仪购自日本日立公司。
1.2 实验动物分组、造模及给药75只雄性SD大鼠随机分为对照组、模型组、阳性对照组、低和高剂量白头翁皂苷B4组,每组15只。使用体积分数为2.5%的腺嘌呤溶液进行等体积灌胃21d复制CRF模型。造模后,从内眦静脉取血,检测大鼠血清Scr和BUN水平,判断CRF大鼠模型是否成功[7]。大鼠造模成功后,阳性对照组大鼠灌胃给予0.5 mg·kg-1地塞米松,低剂量组和高剂量白头翁皂苷B4组大鼠灌胃给予剂量为1和2 mg·kg-1的白头翁皂苷B4,连续干预28 d。对照组和模型组大鼠灌胃给予等量生理盐水。
1.3 大鼠血清Scr和BUN水平检测各组大鼠在规定时间点用10%水合氯醛、0.003 mL·g-1经腹腔注射麻醉,从内眦静脉丛各取血5 mL。静置1 h后,离心并分离血清,采用7100型全自动生化分析仪检测大鼠血清中Scr和BUN水平。
1.4 HE染色观察大鼠肾组织病理形态表现将实验大鼠处死,迅速取一部分肾组织,4%甲醛固定后用石蜡包埋,切片,HE染色,在光镜下观察大鼠肾组织病理形态表现并拍照。
1.5 大鼠肾组织中SOD活性和MDA水平检测取各组大鼠肾脏组织称质量,按体积(V)︰质量(W)= 9︰1的比例加入生理盐水,剪碎组织,冰上稀释匀浆,离心并分离上清,采用SOD和MDA试剂盒按照说明书检测SOD活性和MDA水平。
1.6 ELISA法检测大鼠肾组织中IL-1β、IL-6和TNF-α水平取1.5中的组织上清,依照ELISA试剂盒说明书检测大鼠肾组织中IL-1β、IL-6和TNF-α水平。
1.7 Western blotting法检测大鼠肾组织中p-Akt和细胞凋亡蛋白表达水平收集各组大鼠待测肾脏组织,用RIPA进行裂解提取总蛋白,然后SDS-PAGE凝胶电泳分离各组蛋白并转至PVDF膜。用5%的BSA封闭2 h后更换为相应的一抗(Caspase-3、p-Akt、Bax、Bcl-2和GAPDH抗体),4℃过夜孵育。第2天加入二抗室温孵育1 h,最后加入显色液于凝胶成像仪进行曝影。使用Image J软件对蛋白质条带进行半定量分析,以GAPDH为内参,计算目的蛋白相对表达水平。目的蛋白相对表达水平=目的条带灰度值/GAPDH条带灰度值。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠血清中Scr和BUN水平,肾组织中SOD活性、MDA水平、炎性因子水平和细胞凋亡相关蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q法。以P < 0.05表示差异有统计学意义。
2 结果 2.1 大鼠一般状态观察对照组大鼠生理状态良好,精神状态佳,饮食饮水正常,毛色光滑顺泽,因突发人为意外造成1只大鼠死亡,其余14只全部存活良好。模型组大鼠腺嘌呤灌胃3~7 d后,精神不振,反应迟钝,多饮少食,尿量增多;10 d后大鼠皮毛稀疏、无光泽,体质量明显下降,并逐渐出现死亡,共死亡5只,15 d后状态略有恢复。阳性对照组、低和高剂量白头翁皂苷B4组大鼠药物干预结束后分别存活13、12和12只,大鼠精神状态、饮食状况、毛色和尿量等生存状态特征较模型组大鼠均有不同程度的改善,阳性对照组和高剂量白头翁皂苷B4组大鼠改善情况优于低剂量白头翁皂苷B4组。
2.2 各组大鼠血清中Scr和BUN水平与对照组比较,模型组大鼠血清中Scr和BUN水平明显升高(P < 0.01),表明造模成功。与模型组比较,阳性对照组、低和高剂量白头翁皂苷B4组大鼠血清中Scr和BUN水平均明显降低(P < 0.01)。见表 1。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | Scr[cB/ (μmol·L-1)] | BUN [cB/ (mmol·L-1)] | ||||||||||||||||||||||||||
| Control | 14 | 38.47±1.23 | 8.34±2.37 | ||||||||||||||||||||||||||
| Model | 10 | 382.51±27.45* | 26.31±3.42* | ||||||||||||||||||||||||||
| Positive control | 13 | 173.47±15.39△ | 12.65±1.46△ | ||||||||||||||||||||||||||
| Anemoside B4 | |||||||||||||||||||||||||||||
| Low dose | 12 | 201.67±13.75△ | 21.98±3.12△ | ||||||||||||||||||||||||||
| High dose | 12 | 182.48±15.63△ | 13.68±2.84△ | ||||||||||||||||||||||||||
| * P < 0.01 compared with control group; △ P < 0.01 compared with model group. | |||||||||||||||||||||||||||||
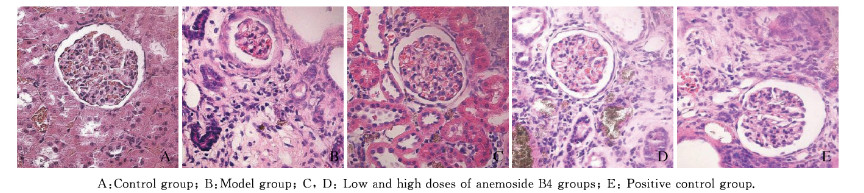
对照组大鼠肾小球和肾小管无病理改变,管腔未见结晶物沉积;模型组大鼠正常肾小体数量减少,肾小球充血,部分肾小球轻度萎缩,个别肾小球管腔可见棕黑色结晶物;阳性对照组大鼠肾小球结构、形态、大小接近正常,血管球未见明显萎缩,肾小管结构正常;低剂量白头翁皂苷B4组大鼠肾小球充血,部分肾小管被增生的纤维组织取代,少数肾小球轻度萎缩;高剂量白头翁皂苷B4组大鼠肾小球部分充血,部分肾小球轻度萎缩,大部分肾小球和肾小管的结构均基本正常。见图 1(插页六)。
|
| 图 1 各组大鼠肾组织病理形态表现(HE,×400) Fig. 1 Pathomorphology of kidney tissue of rats in various groups(HE, ×400) |
|
|
与对照组比较,模型组大鼠肾组织中SOD活性明显降低(P < 0.01),MDA水平明显升高(P < 0.01);与模型组比较,阳性对照组、低和高剂量白头翁皂苷B4组大鼠肾组织中SOD活性明显升高(P < 0.01),MDA水平明显降低(P < 0.01),且呈剂量依赖性。见表 2。
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | SOD[λB /(U·mg-1)] | MDA[mB /(mol·g-1)] | ||||||||||||||||||||||||||
| Control | 14 | 98.53±5.69 | 6.04±0.74 | ||||||||||||||||||||||||||
| Model | 13 | 43.74±7.45* | 9.91±0.65* | ||||||||||||||||||||||||||
| Positive control | 13 | 91.45±5.39△ | 6.35±0.56△ | ||||||||||||||||||||||||||
| Anemoside B4 | |||||||||||||||||||||||||||||
| Low dose | 12 | 65.49±8.75△ | 8.98±0.52△ | ||||||||||||||||||||||||||
| High dose | 12 | 93.44±5.64△ | 6.47±0.44△ | ||||||||||||||||||||||||||
| * P < 0.01 compared with control group; △ P < 0.01 compared with model group. | |||||||||||||||||||||||||||||
与对照组比较,模型组大鼠肾组织中IL-1β、IL-6和TNF-α水平明显升高(P < 0.01);与模型组比较,阳性对照组、低和高剂量白头翁皂苷B4组大鼠肾组织中IL-1β、IL-6和TNF-α水平明显降低(P < 0.01),且呈剂量依赖性。见表 3。
| [x±s, ρB/(mg·L-1)] | |||||||||||||||||||||||||||||
| Group | n | IL-1β | IL-6 | TNF-α | |||||||||||||||||||||||||
| Control | 14 | 68.73±4.69 | 50.04±5.74 | 76.58±8.13 | |||||||||||||||||||||||||
| Model | 10 | 117.68±7.55* | 163.37±12.65* | 193.54±9.85* | |||||||||||||||||||||||||
| Positive control | 13 | 51.35±4.39△ | 51.87±4.56△ | 97.35±8.56△ | |||||||||||||||||||||||||
| Anemoside B4 | |||||||||||||||||||||||||||||
| Low dose | 12 | 89.21±8.75△ | 93.68±11.12△ | 147.89±10.12△ | |||||||||||||||||||||||||
| High dose | 12 | 53.64±5.44△ | 52.67±4.44△ | 102.36±9.44△ | |||||||||||||||||||||||||
| * P < 0.01 compared with control group; △ P < 0.01 compared with model group. | |||||||||||||||||||||||||||||
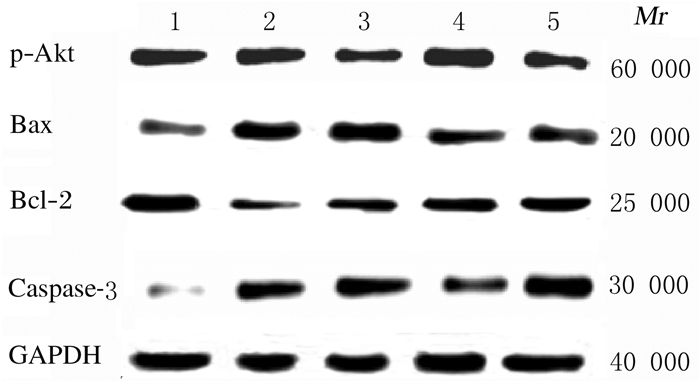
对照组大鼠肾组织中Bax、Caspase-3、Bcl-2和p-Akt蛋白表达水平分别为0.08±0.02、0.07±0.04、0.42±0.04和0.47±0.06,与对照组比较,模型组大鼠肾组织中Bax和Caspase-3蛋白表达水平(0.51±0.07和0.49±0.06)明显升高(P < 0.01),Bcl-2和p-Akt蛋白表达水平(0.090±0.001,0.080±0.001)明显降低(P < 0.01);与模型组比较,阳性对照组及低和高剂量白头翁皂苷B4组大鼠肾组织中Bax蛋白表达水平(0.17±0.02、0.35±0.02及0.19±0.01)和Caspase-3蛋白表达水平(0.22±0.01、0.28±0.01及0.25±0.01)明显降低(P < 0.01),p-Akt蛋白表达水平(0.33±0.01、0.18±0.01及0.36±0.03)和Bcl-2蛋白表达水平(0.30±0.01、0.19±0.01及0.28±0.02)明显升高(P < 0.01)。见图 2。
|
| Lane 1:Control group; Lane 2:Model group; Lane 3: Low dose of anemoside B4 group; Lane 4: High dose of anemoside B4 group; Lane 5: Positive control group. 图 2 Western blotting法检测各组大鼠肾组织中p-Akt、Bax、Bcl-2和Caspase-3蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of p-Akt, Bax, Bcl-2 and Caspase-3 proteins in kidney tissue of rats in various groups detected by Western blotting method |
|
|
CRF是由原发性或继发性慢性肾病引起的进行性肾损伤进而引发的的临床综合征,会出现一系列症状和代谢紊乱,是各种慢性肾病发展的最终阶段,其发生与氧化应激、炎症状态和细胞信号传导机制有关[8]。
Scr和BUN水平是反映肾功能的重要生化指标。本研究结果表明:白头翁皂苷B4能下调CRF模型大鼠Scr和BUN水平,改善CRF大鼠的肾功能。
由于初始应激的存在,自由基清除系统的损害和体内活性氧(ROS)的增加,CRF患者的氧化应激状态增强[9]。临床研究[10]显示:氧化应激可加重CRF患者的肾功能衰竭。因此,慢性肾病患者接受抗氧化药物治疗,清除或灭活ROS可以减少或预防氧化应激,从而减少或抑制由氧化应激引起的肾损伤[11]。SOD是机体中具有重要抗氧化作用的酶,其水平直接反映机体清除活性氧簇的能力;MDA是脂质过氧化的重要产物,其水平高低与机体内自由基水平有关联,主要反映机体受自由基损伤的程度[12-13]。本研究结果显示:与对照组比较,模型组大鼠肾组织中SOD活性明显降低,MDA水平明显增加,表明大鼠肾脏清除氧自由基的能力在肾功能衰竭后降低,并且不饱和脂肪酸过氧化产物增加,细胞损伤增加;白头翁皂苷B4治疗后,大鼠肾组织中SOD活性升高,MDA水平降低,白头翁皂苷B4发挥抗氧化作用,能够抑制CRF的进一步发展。
CRF的原发病多见于慢性肾小球肾炎,慢性肾小球肾炎的发病因素主要是免疫介导的炎症损害。在众多炎症因子中,IL-1β、IL-6及TNF-α最为重要,可以刺激内皮细胞炎症介质的分泌,激活凝血系统,抑制纤维蛋白溶解系统,增加中性粒细胞溶酶体酶的释放和炎性渗出以及氧自由基的产生,促进炎症的发生和发展[14-15]。随着CRF的进展,血清TNF-α和IL-6等炎症生物学指标明显增加,因此即使未并发外源性感染,CRF本身也会引起机体炎症[16-17]。本研究结果显示:与模型组比较,阳性对照组、低和高剂量白头翁皂苷B4组大鼠肾组织中IL-1β、IL-6和TNF-α水平均有不同程度降低,表明白头翁皂苷B4与地塞米松均具有明显的抗炎作用,从而起到保护肾脏组织损伤的作用,且其效果呈剂量依赖性。
研究[18-19]显示:氧化应激可引起细胞凋亡,机体过氧化可以通过多种途径包括内源性或外源性通路诱导细胞凋亡,而且一些构成因素可能通过协同和重叠作用来促进细胞凋亡。此外,PI3K/Akt是生物体内信号转导的经典通路之一,PI3K通过调控激活其下游靶点Akt磷酸化,直接抑制Akt下游信号分子包括Bax、Bad、Bcl-2和Caspase-9等[20-21]。本研究中Western blotting检测结果显示:与模型组比较,阳性对照组、低和高剂量白头翁皂苷B4组大鼠肾组织中Bax和Caspase-3蛋白表达水平明显降低,p-Akt和Bcl-2蛋白表达水平明显升高,表明地塞米松和白头翁皂苷B4均可通过上调抗凋亡蛋白Bcl-2蛋白表达水平,下调促凋亡蛋白Bax和Caspase-3蛋白表达水平,从而减少肾脏细胞凋亡,起到保护CRF大鼠肾脏组织的作用;白头翁皂苷B4还可以通过激活PI3K/Akt通路来减少肾脏细胞凋亡,通路激活与Akt磷酸化有关,提示Akt是白头翁皂苷B4保护肾脏的潜在靶点之一。
综上所述,白头翁皂苷B4可通过抗氧化应激减轻CRF大鼠的肾功能衰竭,通过减少炎症因子释放起到抗炎作用从而保护肾脏的损伤,也能通过激活PI3K通路减少肾脏细胞凋亡,从而多方位地对腺嘌呤诱导的CRF模型大鼠起保护作用。但白头翁皂苷B4对CRF大鼠肾功能的保护作用机制还很复杂,尚有待进一步的研究。
| [1] |
刘娜, 张佩青, 王丽彦, 等. 肾衰泻浊丸对肾间质纤维化大鼠TGF-β1/Smads信号转导通路的影响[J]. 中医药学报, 2010, 38(4): 22-25. |
| [2] |
JIN M M, ZHANG W D, XU Y M, et al. Simultaneous determination of 12 active components in the roots of Pulsatilla chinensis using tissue-smashing extraction with liquid chromatography and mass spectrometry[J]. J Sep Sci, 2017, 40(6): 1283-1292. |
| [3] |
管咏梅, 孙振, 张文秀, 等. 白头翁总皂苷提取物的基本理化性质考察[J]. 中国实验方剂学杂志, 2014, 20(14): 41-44. |
| [4] |
杨连荣, 张丽杰, 姚姣姣, 等. 白头翁皂苷B4在正常大鼠和溃疡性结肠炎大鼠体内组织分布情况的比较[J]. 中国实验方剂学杂志, 2017, 23(21): 93-97. |
| [5] |
龚琴, 王木兰, 何鹿玲, 等. 白头翁皂苷B4对实验性急性肾功能损伤的保护作用[J]. 中国现代中药, 2019, 21(1): 62-67, 70. |
| [6] |
MA J, WU R, ZHANG Q, et al. DJ-1 interacts with RACKl and protects neurons from oxidative-stress-induced apoptosis[J]. Biochem J, 2014, 462(3): 489-497. |
| [7] |
罗颖颖, 严新, 谢欣序, 等. 白头翁总皂苷及其主要成分抗肿瘤药效及其构效关系的研究[J]. 中国现代中药, 2018, 20(7): 791-796. |
| [8] |
晏子友, 王琼, 皮持衡, 等. 肾衰泻浊汤对慢性肾衰大鼠肾小管间质损伤的作用[J]. 现代中西医结合杂志, 2002, 11(16): 1540-1542. |
| [9] |
SINGH D, KAUR R, CHANDER V, et al. Antioxidants in the prevention of renal disease[J]. J Med Food, 2006, 9(4): 443-450. |
| [10] |
TERAWAKI H, YOSHIMURA K, HASEGAWA T, et al. Oxidative stress is enhanced in correlation with renal dysfunction:examination with the redox state of albumin[J]. Kidney Int, 2004, 66(5): 1988-1993. |
| [11] |
COTTONE S, PALERMO A, VACCARO F, et al. Oxidative stress and inflammation in long-term renal transplanted hypertensives[J]. Clinic Nephrol, 2006, 66(1): 32-38. |
| [12] |
李相友, 夏瑗瑜, 张素华, 等. 尿毒清颗粒对慢性肾衰竭主动脉瓣膜钙化患者中氧化应激状态的影响[J]. 中国中西医结合肾病杂志, 2011, 12(5): 438-439. |
| [13] |
陈英, 肖炜, 马云, 等. 肾衰宁分散片对慢性肾衰模型大鼠肾脏NO、NOS、SOD和MDA水平的影响[J]. 中药材, 2008, 31(8): 1190-1193. |
| [14] |
HONDA H, QURESHI A R, HEIMBVRGER O, et al. Serum albumin, c-creactive protein, interleukin 6, and fetuin a as predictors of malnutrition, cardiovascular disease, and mortality in patients with ESRD[J]. Am J Kidney Dis, 2006, 47(1): 139-148. |
| [15] |
MEUWESE C L, STENVINKEL P, DEKKER F W, et al. Monitoring of inflammation in patients on dialysis:forewarned is forearmed[J]. Nat Rev Nephrol, 2011, 7(3): 166-176. |
| [16] |
GUL C B, YILDIZ A, ERSOY A, et al. Correlation between arterial stiffness and inflammatory markers in autosomal dominant polycystic kidney disease patients with preserved renal function[J]. Int Urol Nephrol, 2015, 47(7): 1187-1194. |
| [17] |
HALL T J. Role of Hsp70 in cytokine production[J]. Experientia, 1994, 50(11/12): 1048-1051. |
| [18] |
PARK J M, LEE J S, LEE K R, et al. Cordyceps militaris extract protects human dermal fibroblasts against oxidative stress-induced apoptosis and premature senescence[J]. Nutrients, 2014, 6(9): 3711-3726. |
| [19] |
MA J, WU R, ZHANG Q, et al. DJ-1 interacts with RACKl and protects neurons from oxidative-stress-induced apoptosis[J]. Biochem J, 2014, 462(3): 489-497. |
| [20] |
MACHADO-NETO J A, FAVARO P, LAZARINI M, et al. Knockdown of insulin receptor substrate 1 reduces proliferation and downregulates Akt/mTOR and MAPK pathways in K562 cells[J]. Biochim Biophys Acta, 2011, 1813(8): 1404-1411. |
| [21] |
HU L, SUN Y, HU J. Catalpol inhibits apoptosis in hydrogen peroxide-inducedendothelium by activating the PI3K/Akt signaling pathway and modulatingexpression of Bcl-2 and Bax[J]. Eur J Pharmacol, 2010, 628(1-3): 155-163. |
 2020, Vol. 46
2020, Vol. 46


