扩展功能
文章信息
- 冯杰, 任立群, 陈素贤, 万义增, 徐培斌
- FENG Jie, REN Liqun, CHEN Suxian, WAN Yizeng, XU Peibin
- 葫芦素B联合奥沙利铂对人结肠癌SW480细胞增殖和凋亡的抑制作用及其机制
- Inhibitory effects of cucurbitacin B combined with oxaliplatin on proliferation and apoptosis of human colon cancer SW480 cells and their mechanisms
- 吉林大学学报(医学版), 2020, 46(01): 78-83
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 78-83
- 10.13481/j.1671-587x.20200114
-
文章历史
- 收稿日期: 2019-02-27
2. 锦州医科大学附属第三医院病理科, 辽宁 锦州 121000;
3. 吉林大学药学院实验药理与毒理教研室, 吉林 长春 130021;
4. 长春中医药大学中医学教研室, 吉林 长春 130117
2. Department of Pathology, Third Affiliated Hospital, Jinzhou Medical University, Jinzhou 121000, China;
3. Department of Experimental Pharmacology and Toxicology, School of Pharmacy, Jilin University, Changchun 130021, China;
4. Department of Traditional Chinese Medicine, Changchun Universsity of Chinese Medicine, Changchun 130117, China
结肠癌是常见的恶性肿瘤之一,起病隐匿,易发生远处转移,发现时多为中晚期。奥沙利铂(oxaliplatin,OXA)是周期非特异性抗肿瘤药物,可抑制肿瘤细胞增殖,常用于治疗结肠癌,但长期使用会产生肾毒性、耳毒性和骨髓抑制等不良反应,降低了患者的生活质量[1]。因此,减轻OXA的不良反应,提高患者生存质量是治疗结肠癌的关键。中药对肿瘤细胞有抑制作用,因价格低廉、安全无毒,受到人们的高度关注。葫芦素B(cucurbitacin B, CUB)是葫芦素家族成员之一,一种高度氧化的四环三萜类化合物。国内外研究[2-9]显示:CUB对胃癌、结肠癌、肺癌、乳腺癌、骨肉瘤和淋巴瘤等多种肿瘤有抑制作用。目前国内外尚无CUB联合OXA对结肠癌SW480细胞增殖的影响及机制的相关研究。本研究通过体外实验观察CUB联合OXA对结肠癌SW480细胞增殖及凋亡的影响,探讨其作用机制,为临床治疗结肠癌提供更多的实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人结肠癌SW480细胞株(吉林大学药学院提供)。CUB(南京景竹生物科技有限公司),用二甲基亚砜(DMSO)溶解,浓度为1mol·L-1,置于-20℃冰箱保存,DMSO的浓度控制在0.1%以下。OXA(江苏恒瑞医药股份有限公司),用时现配制成100μmol·L-1。DMEM高糖培养液(美国Hyclone公司),优质胎牛血清(天津灏洋生物制品科技有限责任公司),DMSO、噻唑蓝(MTT)和碘化啶(PI)(美国Sigma公司),Annexin Ⅴ-FITC/PI凋亡检测试剂盒、总蛋白提取试剂盒、细胞裂解液、ECL发光液和Hoechst33258染色液(中国碧云天公司),半胱氨酸天冬氨酸特异性蛋白酶3(cysteiyl aspartate specific protease-3,caspase-3)抗体、活化后的caspase-3(cleaved caspase-3)抗体、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(美国Abcam公司),HRP标记的山羊抗兔/鼠二抗(北京鼎国昌盛公司)。倒置相差显微镜(日本尼康公司),DG5031型酶联免疫检测仪(南京华东电子集团医疗装备有限责任公司),电泳槽、流式细胞仪和CO2培养箱(美国SIM公司),Tanon 4600全自动化学发光图像分析系统(上海Tanon科技有限公司)。
1.2 细胞培养和分组SW480细胞用含10%胎牛血清的DMEM高糖培养液培养,置于37℃、5%CO2恒温箱中培养,每2~3d传代1次。将细胞分为对照组, 10、20和40μmol·L-1CUB组,OXA组(100μmol·L-1)和联合组(40μmol·L-1 CUB + 100μmol·L-1OXA)。
1.3 MTT法检测SW480细胞增殖率用0.25%胰酶消化对数生长期的SW480细胞,按每孔5×103个细胞接种于96孔板中,每组设6个复孔。次日,按照实验分组加药,培养24 h,每孔加入MTT 20μL(5g·L-1),继续培养4h,每孔加入DMSO 150 μL,摇床10min。设调零孔,选择490nm波长,用酶标仪测定各孔吸光度(A)值,计算细胞增殖率。细胞增殖率=实验组A值/对照组A值×100%。实验重复3次。
1.4 Hoechst33258染色法观察SW480细胞形态表现将对数生长期的结肠癌SW480细胞接种于6孔板中,分组同上,每孔4×105个细胞。加药培养24h,PBS洗3遍;加入10%甲醛4℃固定15min;加入Hoechst33258染色液,室温孵育2min;封片后用荧光显微镜观察细胞形态表现,Images Advanced3.2成像系统处理图片。实验重复3次。
1.5 流式细胞术检测SW480细胞周期和细胞凋亡率将对数生长期的结肠癌SW480细胞接种于6孔板中,分组同上,每孔4×105个细胞。加药培养24h后收集细胞,1000g离心5 min;1 mL PBS洗涤后,加入1.0mL 70%乙醇溶液4℃固定过夜;1000g离心5min,预冷PBS洗2遍;加入0.6mL PI染液,避光孵育30min,在1h内上流式细胞仪检测不同细胞周期细胞百分率。实验重复3次。
细胞分组同上。培养24h后收集细胞,1000g离心5 min,弃培养液,按照AnnexinⅤ-FITC细胞凋亡检测试剂盒说明书进行操作。在室温下避光孵育10min,在30min内采用流式细胞仪检测各组细胞凋亡率。实验重复3次。
1.6 Western blotting法检测SW480细胞中caspase-3、cleavedcaspase-3、Bax和Bcl-2蛋白表达水平按照1.5进行分组和加药,24h后提取细胞蛋白,BCA法检测蛋白浓度;SDS-PAGE凝胶电泳,统一蛋白上样量30μg,转移至PVDF膜上;封闭液封闭1h,加一抗4℃过夜;次日加HRP标记的二抗,摇床1h,TBST缓冲液20min/次洗3次,加ECL发光液,实验重复3次。通过Tanon 4600全自动化学发光图像分析系统显影拍摄照片,用ImageProPlus6.0软件分析caspase-3、cleavedcaspase-3、Bax和Bcl-2蛋白的灰度值, 以GAPDH为内参对照,计算蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.7 统计学分析采用SPSS17.0统计软件进行统计学分析。各组细胞增殖率、不同细胞周期细胞百分率、细胞凋亡率及各组细胞中caspase-3、cleavedcaspase-3、Bax、Bcl-2蛋白表达水平和cleavedcaspase-3/caspase-3、Bcl-2/Bax比值均符合正态分布, 以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组SW480细胞增殖率与对照组比较,不同剂量CUB组、OXA组和联合组SW480细胞增殖率明显降低(P < 0.05);与不同剂量CUB组和OXA组比较,联合组细胞增殖率进一步降低(P < 0.05)。见表 1。
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Proliferation rate | ||||||||||||||||||||||||||||
| Control | 99.51±1.47 | ||||||||||||||||||||||||||||
| CUB (μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 85.95±2.40* | ||||||||||||||||||||||||||||
| 20 | 75.97±2.98* | ||||||||||||||||||||||||||||
| 40 | 60.75±4.51* | ||||||||||||||||||||||||||||
| OXA | 62.77±1.75* | ||||||||||||||||||||||||||||
| Combination | 36.61±2.45*△#○□ | ||||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with 10 μmol·L-1CUB group; # P < 0.05 compared with 20 μmol·L-1CUB group; ○ P < 0.05 compared with 40 μmol·L-1CUB group; □ P < 0.05 compared with OXA group. | |||||||||||||||||||||||||||||
Hoechst33258染色后观察SW480细胞形态表现:对照组细胞的细胞核蓝色荧光分布均匀;CUB组和OXA组细胞蓝色荧光较对照组亮,细胞核可见浓染致密的颗粒块状荧光;与CUB组和OXA组比较,联合组细胞蓝色荧光更亮,细胞核浓染颗粒更明显。见图 1(插页五)。
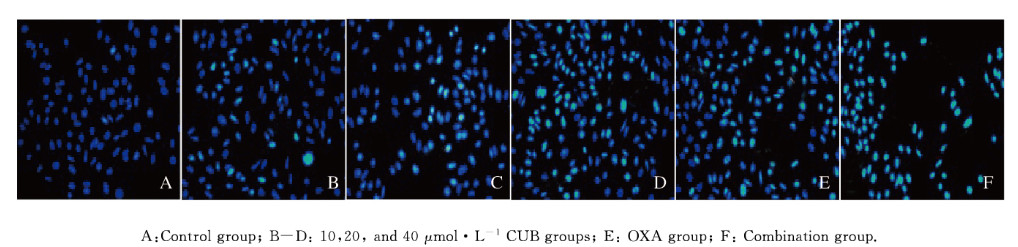
|
| 图 1 各组SW480细胞形态表现(Hoechst 33258,×200) Fig. 1 Morphology of SW480 cells in various groups(Hoechst 33258, ×200) |
|
|
与对照组比较,不同剂量CUB组和联合组G2/M期细胞百分率明显升高(P < 0.05),OXA组、40 μmol·L-1 CUB组和联合组S期细胞百分率明显升高(P < 0.05)。见图 2(插页六)和表 2。
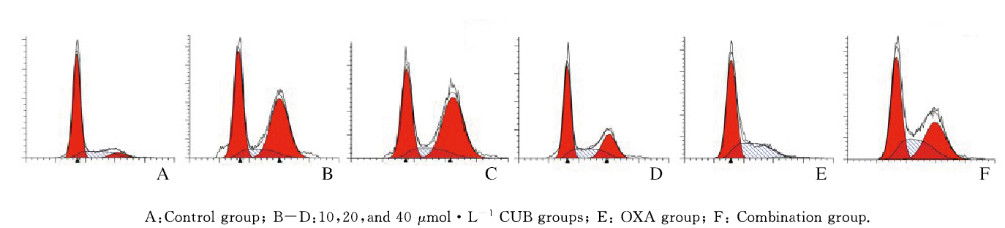
|
| 图 2 流式细胞术检测各组不同细胞周期SW480细胞百分率 Fig. 2 Percentages of SW480 cells in different cell cycles in various groups detected by flow cytometry |
|
|
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | G1/G0 | S | G2/M | ||||||||||||||||||||||||||
| Control | 73.96±1.60 | 19.30±0.44 | 6.74±1.38 | ||||||||||||||||||||||||||
| CUB(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 42.91±1.82 | 15.02±2.32 | 42.07±3.78* | ||||||||||||||||||||||||||
| 20 | 36.64±1.73 | 14.35±1.16 | 49.01±0.71* | ||||||||||||||||||||||||||
| 40 | 52.68±1.87 | 21.53±1.78* | 24.80±2.65* | ||||||||||||||||||||||||||
| OXA | 29.10±1.23 | 64.60±1.40* | 6.28±1.41 | ||||||||||||||||||||||||||
| Combination | 43.91±1.39 | 25.70±2.10* | 30.44±1.15* | ||||||||||||||||||||||||||
| * P < 0.05 compared with control group. | |||||||||||||||||||||||||||||
与对照组比较,不同剂量CUB组、OXA组和联合组细胞凋亡率明显升高(P < 0.05);与不同剂量CUB组和OXA组比较,联合组细胞凋亡率进一步升高(P < 0.05)。见图 3和表 3。
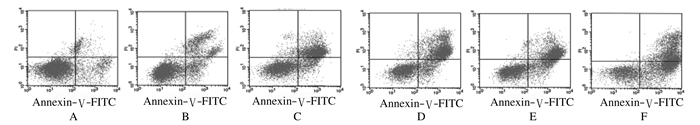
|
| A: Control group; B-D:10, 20, and 40 μmol·L-1 CUB groups; E: OXA group; F: Combination group. 图 3 流式细胞术检测各组SW480细胞凋亡率 Fig. 3 Apoptotic rates of SW480 cells in various groupsdetected by flow cytometry |
|
|
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Apoptotic rate | ||||||||||||||||||||||||||||
| Control | 16.08±3.80 | ||||||||||||||||||||||||||||
| CUB (μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 27.93±1.39* | ||||||||||||||||||||||||||||
| 20 | 49.13±3.55* | ||||||||||||||||||||||||||||
| 40 | 63.75±2.62* | ||||||||||||||||||||||||||||
| OXA | 60.04±3.78* | ||||||||||||||||||||||||||||
| Combination | 78.96±3.88*△#○□ | ||||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with 10 μmol·L-1CUB group; # P < 0.05 compared with 20 μmol·L-1CUB group; ○ P < 0.05 compared with 40 μmol·L-1CUB group; □ P < 0.05 compared with OXA group. | |||||||||||||||||||||||||||||
与对照组比较,不同剂量CUB组、OXA组和联合组SW480细胞中caspase-3和Bcl-2蛋白表达水平及Bcl-2/Bax比值明显降低(P < 0.05),cleaved caspase-3和Bax蛋白表达水平及cleaved caspase-3/caspase-3比值明显升高(P < 0.05);与不同剂量CUB组和OXA组比较,联合组细胞中caspase-3和Bcl-2蛋白表达水平及Bcl-2/Bax比值明显降低(P < 0.05),cleaved caspase-3和Bax蛋白表达水平及cleaved caspase-3/caspase-3比值明显升高(P < 0.05)。见图 4和表 4。
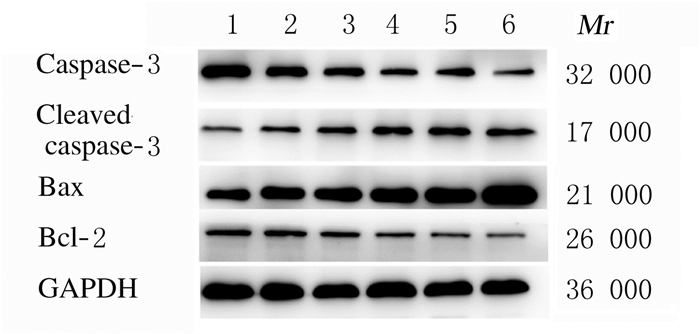
|
| Lane 1: Control group; Lane 2-4:10, 20, and 40μmol·L-1 CUB groups; Lane 5: OXA group; Lane 6: Combination group. 图 4 各组SW480细胞中caspase-3、cleavedcaspase-3、Bax和Bcl-2蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of caspase-3, cleaved caspase-3, Baxand Bcl-2 proteins in SW480 cells in various groups |
|
|
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | Caspase-3 | Cleaved caspase-3 | Bcl-2 | Bax | Cleaved caspase-3/caspase-3 | Bcl-2/Bax | |||||||||||||||||||||||
| Control | 1.25±1.98 | 0.45±1.75 | 2.42±1.82 | 0.50±2.34 | 0.36±1.22 | 2.32±3.26 | |||||||||||||||||||||||
| CUB(μmol·L-1) | |||||||||||||||||||||||||||||
| 10 | 0.87±1.03* | 0.62±2.28* | 1.48±1.96* | 0.71±3.47* | 0.69±2.84* | 1.48±1.43* | |||||||||||||||||||||||
| 20 | 0.68±3.54* | 0.69±1.45* | 1.14±2.10* | 0.76±1.45* | 1.01±2.3* | 1.08±2.64* | |||||||||||||||||||||||
| 40 | 0.62±1.62* | 0.93±4.51* | 0.81±4.63* | 0.89±2.72* | 1.37±4.53* | 0.78±3.22* | |||||||||||||||||||||||
| OXA | 0.53±2.16* | 1.01±2.56* | 0.62±5.32* | 0.96±3.51* | 1.51±2.17* | 0.74±1.25* | |||||||||||||||||||||||
| Combination | 0.38±2.38*△#○□ | 1.14±4.71*△#○□ | 0.34±4.12*△#○□ | 1.42±1.22*△#○□ | 2.38±1.20*△#○□ | 0.39±1.83*△#○□ | |||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with 10 μmol·L-1CUB group; # P < 0.05 compared with 20 μmol·L-1CUB group; ○ P < 0.05 compared with 40 μmol·L-1CUB group; □ P < 0.05 compared with OXA group. | |||||||||||||||||||||||||||||
细胞凋亡是由基因控制的一种自主性死亡,肿瘤细胞的无限增殖使得肿瘤细胞无法凋亡。因此,治疗结肠癌的关键是抑制结肠癌细胞增殖,促进结肠癌细胞凋亡。OXA是治疗结肠癌的常用化疗药物,但不良反应明显,降低了患者的生存质量。因此,寻找高效低毒、增强药物疗效及减轻药物不良反应的新药物极其重要。CUB是广泛存在于葫芦科植物中的一类四环三萜类化合物,具有多种药理作用,如抗病毒、抗炎、抑制细胞生长和降血糖等[10],对肿瘤细胞的促凋亡作用引起人们的密切关注。本研究采用不同浓度CUB、OXA及CUB联合OXA作用于人结肠癌SW480细胞,MTT法检测结果显示:与对照组比较,各加药组细胞增殖率明显降低,提示CUB、OXA及两药联合能够诱导细胞凋亡;流式细胞术检测结果显示:与对照组比较,各加药组细胞凋亡率升高,且联合组细胞凋亡率明显高于CUB组和OXA组。研究[11]显示:CUB可将乳腺癌细胞阻滞在S期和G2/M期,诱导细胞凋亡,且能增加药物对细胞的灵敏性。本研究采用流式细胞术检测SW480细胞周期分布,结果显示:与对照组比较,CUB组和联合组细胞中S期和G2/M期细胞百分率升高,OXA组细胞中S期细胞百分率升高。
Bcl-2家族在细胞凋亡中起重要作用,其中Bcl-2基因抑制肿瘤细胞凋亡,Bax基因促进肿瘤细胞凋亡;Bcl-2与Bax既可形成同源二聚体也可形成异源二聚体。当Bcl-2水平升高时,抑制细胞凋亡;Bax水平升高时,促进细胞凋亡[12-13]。有研究[14]显示:结肠癌细胞中Bcl-2表达水平升高,Bcl-2升高抑制Bax表达,进而抑制细胞凋亡。半胱氨酸天冬氨酸特异性蛋白酶(cysteinylaspartate specific protease,caspase)在细胞凋亡中起促进作用[15],其中caspase-3在细胞凋亡过程中是最关键的执行者,是caspase家族中的重要成员[16-17]。细胞凋亡分为受体依赖性途径和线粒体途径[18];当线粒体受刺激时,如感染和DNA损伤,线粒体膜通透性增加,细胞色素C将通过线粒体膜进入细胞质,与凋亡酶激活因子1(apoptotic protease activating factor-1,Apaf-1)结合,激活半胱氨酸天冬氨酸特异性蛋白酶9(cysteinylaspartate specific protease-9,caspase-9),caspase-9活化下游的无活性的caspase-3,激活caspase-3剪切成有活性的cleavedcaspase-3,进一步激活caspase的级联反应,诱导细胞凋亡[19-20]。Bcl-2家族可调控caspase的活化和灭活[21]。本研究采用Western blotting法检测各组SW480细胞中caspase-3、cleavedcaspase-3、Bcl-2和Bax蛋白表达水平,结果显示:与对照组比较,各加药组caspase-3和Bcl-2蛋白表达水平降低,cleavedcaspase-3和Bax蛋白表达水平升高;与CUB组和OXA组比较,联合组细胞中上述蛋白表达水平变化更加明显,提示CUB可以促进cleavedcaspase-3和Bax蛋白表达,抑制caspase-3和Bcl-2蛋白表达,上调cleavedcaspase-3/caspase-3比值,下调Bcl-2/Bax比值,诱导SW480细胞凋亡。
综上所述,CUB能够抑制结肠癌SW480细胞增殖,CUB联合OXA抑制作用更加明显。CUB联合OXA的具体抗肿瘤机制还有待后续研究,且联合用药在动物体内是否具有抑癌作用还有待进一步研究。
| [1] |
李琪, 任立群, 王亚帝, 等. 芦丁联合奥沙利铂对人胃癌SGC-7901细胞增殖及凋亡的影响[J]. 中国临床药理学与治疗学, 2017, 22(10): 1099-1105. |
| [2] |
TOUIHRI-BARAKATI I, KALLECH-ZIRI O, AYADI W, et al. Cucurbitacin B purified from Ecballium elaterium (L.) A. Rich from Tunisia inhibits α5β1 integrin-mediated adhesion, migration, proliferation of human glioblastoma cell line and angiogenesis[J]. Eur J Pharmacol, 2017, 797: 153-161. DOI:10.1016/j.ejphar.2017.01.006 |
| [3] |
BAKAR F. Cucurbitacin B enhances the anticancer effect of imatinib mesylate through inhibition of MMP-2 expression in MCF-7 and SW480 tumor cell lines[J]. Anticancer Agents Med Chem, 2016, 16(6): 747-754. DOI:10.2174/1871520616666160211124038 |
| [4] |
YAR SAGLAM A S, ALP E, ELMAZOGLU Z, et al. Treatment with cucurbitacin B alone and in combination with gefitinib induces cell cycle inhibition and apoptosis via EGFR and JAK/STAT pathway in human colorectal cancer cell lines[J]. Hum Exp Toxicol, 2015, 35(5): 526-543. |
| [5] |
SHUKLA S, SINHA S, KHANH S, et al. Cucurbitacin B inhibits the stemness and metastatic abilities of NSCLC via downregulation of canonical Wnt/β-catenin signaling axis[J]. Sci Rep, 2016, 6: 21860. DOI:10.1038/srep21860 |
| [6] |
KHAN N, JAJEH F, KHAN M I, et al. Sestrin-3 modulation is essential for therapeutic efficacy of cucurbitacin B in lung cancer cells[J]. Carcinogenesis, 2017, 38(2): 184-195. |
| [7] |
SINHA S, KHAN S, SHUKLA S, et al. Cucurbitacin B inhibits breast cancer metastasis and angiogenesis through VEGF-mediated suppression of FAK/MMP-9 signaling axis[J]. Int J Biochem Cell Biol, 2016, 77((Pt A): 41-56. |
| [8] |
ZHANG Z R, GAO M X, YANG K. Cucurbitacin B inhibits cell proliferation and induces apoptosis in human osteosarcoma cells via modulation of the JAK2/STAT3 and MAPK pathways[J]. Exp Ther Med, 2017, 14(1): 805-812. DOI:10.3892/etm.2017.4547 |
| [9] |
DING X L, CHI J D, HANG X, et al. Cucurbitacin B synergistically enhances the apoptosis-inducing effect of arsenic trioxide by inhibiting STAT3 phosphorylation in lymphoma Ramos cells[J]. Leuk Lymphoma, 2017, 10: 2439-2451. |
| [10] |
潘丁龙.葫芦素B对食管鳞癌细胞放射敏感性影响的相关研究[D].福州: 福建医科大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10392-1015992172.htm
|
| [11] |
REN G W, SHA T Y, GUO J J, et al. Cucurbitacin B induces DNA damage and autophagy mediated by reactive oxygen species (ROS) in MCF-7 breast cancer cells[J]. J Nat Med, 2015, 69(4): 522-530. DOI:10.1007/s11418-015-0918-4 |
| [12] |
黄娟. Bcl-2、Bax蛋白在皮肤鳞状细胞癌组织中的表达水平变化及与病理学特征的关系[J]. 实验与检验医学, 2018, 36(5): 17-19, 28. |
| [13] |
SIQUEIRA E C, SOUZA F T, DINIZ M G, et al. Hsp27(HSPB1) differential expression in normal salivary glands and pleomorphic adenomas and association with an increased Bcl2/Bax ratio[J]. Tumour Biol, 2015, 36(1): 213-217. |
| [14] |
张静玲, 王克利, 闫双宝. 槲皮素对骨肉瘤细胞MG-63细胞色素C、Bcl-2及bax表达影响[J]. 中国实验诊断学, 2018, 22(9): 145-147. |
| [15] |
LIAO Y, YANG F, LI X, et al. The impact of Caspase-8 on non-small cell lung cancer brain metastasis in Ⅱ/Ⅲ stage patient[J]. Neoplasma, 2015, 9(2): 91-94. |
| [16] |
李世清, 陈福敏, 罗君, 等. 顺铂对结肠癌细胞株Caco-2增殖凋亡和Bcl-2、Caspase3、Caspase9蛋白表达的影响[J]. 世界华人消化杂志, 2015, 23(9): 1460-1464. |
| [17] |
KATAYAMA S, SHIMODA K, TAKENAGA Y. Loss of ADAR1 in human iPS cells promotes caspase3-mediated apoptotic cell death[J]. Genes Cells, 2015, 20(8): 675-680. DOI:10.1111/gtc.12261 |
| [18] |
GUM S I, RAHMAN M K, WON J S, et al. A distinctive pattern of beauveriabassiana-biotransformed ginsenoside products triggers mitochondria/FasL-mediated apoptosis in colon cancer cells[J]. Phytother Res, 2016, 30(1): 136-143. DOI:10.1002/ptr.5513 |
| [19] |
梁金媛. OCT4调控STAT3对细胞色素C活性影响及其研究[D].济南: 山东大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10422-1017070498.htm
|
| [20] |
王白燕, 张方方, 韩倩倩, 等. α-细辛醚对食管癌Eca-109细胞线粒体凋亡通路的影响[J]. 医药导报, 2018, 37(1): 27-30. |
| [21] |
杨涛, 费振海, 钟兴明. Caspase家族与细胞凋亡的研究进展[J]. 浙江医学, 2018, 40(18): 2083-2087, 2091. DOI:10.12056/j.issn.1006-2785.2018.40.18.2017-950 |
 2020, Vol. 46
2020, Vol. 46


