扩展功能
文章信息
- 钟越, 李海超, 冯馨锐, 崔雨舒, 郑中华, 王玮瑶, 齐玲
- ZHONG Yue, LI Haichao, FENG Xinrui, CUI Yushu, ZHENG Zhonghua, WANG Weiyao, QI Ling
- 食源性原花青素对SH-SY5Y细胞生长的抑制作用及其机制
- Inhibitory effect of foodborne procyanidins on growth of SH-SY5Y cells and its mechanism
- 吉林大学学报(医学版), 2020, 46(01): 61-65
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 61-65
- 10.13481/j.1671-587x.20200111
-
文章历史
- 收稿日期: 2019-01-21
2. 吉林医药学院病理生理学教研室, 吉林 吉林 132013;
3. 广州医科大学附属第六医院 广东省清远市人民医院, 广东 清远 511518
2. Department of Pathophysiology, Jilin Medical University, Jilin 132013, China;
3. Sixth Affiliated Hospital, Guangzhou Medical University, Qingyuan People's Hospital, Guangdong Province, Qingyuan 511518, China
神经母细胞瘤的病变部位主要始于原始的神经峭[1],是一种较为常见的儿童肿瘤,其具有发病率高、病变部位较多、易转移和恶性度高等特点,其临床治疗非常困难[2-3]。虽然近年来的新型治疗手段使神经母细胞瘤的治疗有所改进,但由于患儿初诊时多数即处于中晚期,再加上化疗药物耐药,患儿的5年生存率仅为15%~25%[4]。原花青素主要来源于葡萄、山楂、银杏和花生等品种[5]。在美国,食源性原花青素是民众最信赖的十大植物药之一,是公认的清除体内自由基的天然抗氧化剂。食源性原花青素水溶性好,对人体无明显的毒副作用。本课题组前期研究[6]显示:越桔原花青素具有良好的抗胶质瘤作用。但目前食源性原花青素对人神经母细胞瘤细胞生长的抑制作用尚未见相关报道。因此,本研究利用人神经母细胞瘤SH-SY5Y细胞作为研究对象,探讨食源性原花青素对SH-SY5Y细胞生长的抑制作用,并阐明其抑制肿瘤细胞生长的作用机制。
1 材料与方法 1.1 细胞、主要试剂和仪器人神经母细胞瘤SH-SY5Y细胞系(吉林医药学院科研实验中心提供)。食源性原花青素(上海阿拉丁生化科技股份有限公司),PBS缓冲液、高糖DMEM培养基、小牛血清和0.25%胰酶(美国Gibco公司),噻唑蓝(MTT)、二甲基亚枫(DMSO)、MuseTM Annexin Ⅴ细胞凋亡试剂盒和细胞周期试剂盒(美国Millipore公司)。Muse智能触控细胞状态分析仪(德国Merck Millipore公司),CB150型CO2培养箱(德国Binder公司),J-26XP型超低温高速离心机(美国贝克曼公司),PLUS 384型全自动酶标仪(美国MDC公司),Ⅸ-70型倒置式相差显微镜(日本Olympus公司)。
1.2 细胞培养自液氮罐中取出冻存的人神经母细胞瘤SH-SY5Y细胞,置于37℃水浴箱中均匀振荡1min,再以800r·min-1离心3min,吸出上清后用含10%小牛血清的DMEM培养基重悬细胞,在37℃、5%CO2培养箱中孵育。每天倒置显微镜下观察细胞的生长情况,待细胞长至80%~90%融合进行传代。
1.3 MTT法检测SH-SY5Y细胞增殖率取对数生长期的SH-SY5Y细胞,0.25%胰酶消化制成单细胞悬液,以每孔6×103个细胞的密度将细胞接种于96孔培养板中,置于37℃、5% CO2培养箱中培养过夜。将细胞分为对照组及10、20和40mg·L-1食源性原花青素组,次日开始分制加入含不同浓度(0、10、20和40mg·L-1)食源性原花青素的培养基,基础培养基为含5%小牛血清的DMEM,每个时间点(24、48和72h)和每个浓度设5个复孔。待实验终止每孔加入20μL MTT孵育4 h,弃上清后每孔加入150μL DMSO均匀振荡10min,在全自动酶标仪570nm处测定各孔吸光度(A)值。根据A值计算细胞增殖率。细胞增殖率=(对照孔A值-用药孔A值)/对照孔A值×100%。
1.4 流式细胞术检测不同细胞周期SH-SY5Y细胞百分率1×106个SH-SY5Y细胞接种于25cm2培养瓶中培养,设对照组及10、20和40mg·L-1食源性原花青素组,待细胞生长至50%~60%,各组分别加入含0、10、20和40mg·L-1食源性原花青素培养液(基础培养基为含5%小牛血清的DMEM培养液)。置于37℃、5% CO2培养箱中培养72h。待实验结束,收集所有细胞,冷PBS洗涤离心,重悬细胞,70%乙醇固定。24h后冷PBS再次洗涤细胞,200μL细胞周期试剂重悬细胞,细胞密度为1×106 mL-1,将试剂与细胞轻轻混匀,避光孵育30min,200目滤网过滤,上机检测各组不同细胞周期细胞百分率。
1.5 AnnexinⅤ凋亡试剂盒检测SH-SY5Y细胞凋亡率分组同1.4,待细胞生长至60%~70%融合,对照组加入含DMEM培养液,不同浓度食源性原花青素组加入含10、20和40mg·L-1食源性原花青素的培养液(基础培养基为含5%小牛血清的DMEM培养液)。置于37℃、5% CO2培养箱培养72h。收集所有细胞,PBS洗涤并重悬细胞,细胞密度为1×106 mL-1。加入Annexin Ⅴ溶液5 μL和PI 10 μL,冰浴10 min,上机检测每组10 000个细胞中凋亡细胞数,计算各组细胞凋亡率。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。SH-SY5Y细胞增殖率、不同细胞周期细胞百分率和细胞总凋亡率均呈正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组SH-SY5Y细胞增殖率与对照组比较,各时间点10、20和40mg·L-1食源性原花青素组细胞增殖率均降低,作用48和72h时20mg·L-1食源性原花青素组细胞增殖率差异有统计学意义(P < 0.05或P < 0.01),作用24、48和72h时40mg·L-1食源性原花青素组细胞增殖率差异有统计学意义(P < 0.01),且不同浓度食源性原花青素组细胞增殖率呈明显的剂量依赖效应。由于72h时作用效果最为明显,选取72h作为后续实验的药物作用时间。见表 1。
| (n=5, x±s, η/%) | ||||
| Group | Proliferation rate | |||
| (t/h) 24 | 48 | 72 | ||
| Control | 100.00±2.64 | 100.00±3.16 | 100.00±7.18 | |
| Foodborneprocyanidins (mg·L-1) | ||||
| 10 | 99.83±5.30 | 96.79±3.41 | 94.62±4.82 | |
| 20 | 88.98±6.80 | 66.38±4.98* | 57.36±2.05** | |
| 40 | 53.42±8.07** | 43.09±1.28** | 41.70±2.07** | |
| * P < 0.05, * * P<0.01 vs control group. | ||||
流式细胞术检测结果显示:G0/G1期细胞百分率随着药物浓度的增加而升高,G2/M期细胞百分率随药物浓度增加而降低。与对照组比较,40mg·L-1食源性原花青素组G0/G1期细胞百分率明显升高(P < 0.01),G2/M期细胞百分率明显降低(P < 0.01);而10和20mg·L-1食源性原花青素组S期细胞百分率略有增加,但差异均无统计学意义(P>0.05)。见图 1和表 2。
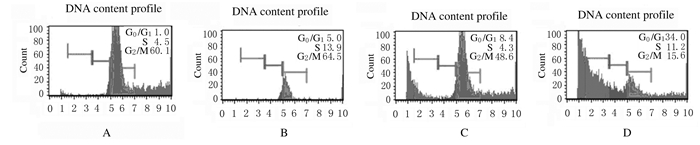
|
| A: Control group; B-D:10,20, and 40 mg·L-1 foodborne procyanidins groups. 图 1 流式细胞术检测各组不同细胞周期SH-SY5Y细胞百分率 Fig. 1 Percentages of SH-SY5Y cells in different cell cycles in various groups detected by flow cytometry |
|
|
| (n=5, x±s, η/%) | ||||
| Group | Percentage of SH-SY5Y cells | |||
| G0/G1 | S | G2/M | ||
| Control | 1.0±0.7 | 4.8±1.8 | 60.1±3.2 | |
| Foodborne procyanidins(mg·L-1) | ||||
| 10 | 5.0±3.9 | 3.9±1.6 | 64.5±3.0 | |
| 20 | 8.4±1.5 | 4.3±1.7 | 48.6±4.8 | |
| 40 | 34.3±2.8* | 11.2±2.1 | 15.6±5.6* | |
| * P < 0.01 vs control group. | ||||
与对照组(19.03%±3.05%)比较,10、20和40 mg·L-1食源性原花青素组细胞凋亡率(66.81%±3.89%、72.81%±5.16%和78.92%±6.84%)均明显升高(P < 0.01)。见图 2。
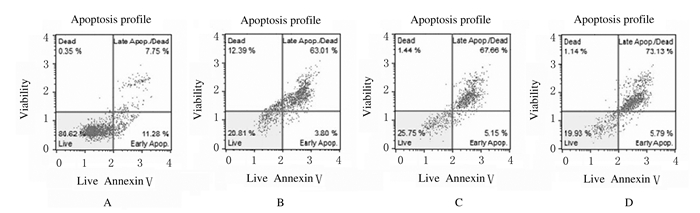
|
| A: Control group; B-D:10, 20, and 40 mg·L-1 foodborne procyanidins group. 图 2 Annexin Ⅴ法检测各组SH-SY5Y细胞凋亡率 Fig. 2 Apoptotic rates of SH-SY5Y cells in various groups detected by Annexin Ⅴ assay |
|
|
原花青素广泛存在于多种可食用植物如花生、苹果和葡萄的核、皮等部位,日常生活中被人们所摄取和利用[6]。研究[7-8]表明:花生红皮中的原花青素可以对抗前列腺癌细胞的增殖,苹果提取出来的原花青素可以上调紧密连接蛋白的表达从而减少氧化应激反应和炎症反应,而红葡萄酒中的原花青素可以预防心血管疾病。吉林省食源性原花青素资源丰富,如越桔、葡萄和苹果等[9-10],因此对食源性原花青素进行深入研究与开发具有重要的意义。
在临床上,人神经母细胞瘤的治疗有多种方法,主要包括手术、化疗、放疗、干细胞移植、诱导分化治疗、脐血移植和基因治疗等[11],但由于神经母细胞瘤生长迅速、易早期转移、且恶性程度高,给治疗带来了诸多的困难。化疗作为综合治疗的主要方法之一,一直被联合应用于神经母细胞瘤的临床治疗中[12-13]。但化疗药物对患儿的不良反应较大,而食源性原花青素作为一种可食用的植物提取成分,具有不良反应轻和价格低廉等特点[14]。因此,本研究针对食源性原花青素,研究其对人神经母细胞瘤SH-SY5Y细胞的抑制作用及机制。
本研究应用MTT法检测食源性原花青素对SH-SY5Y细胞增殖率的影响,结果显示:10、20和40mg·L-1食源性原花青素作用于SH-SY5Y细胞时,细胞的增殖率均降低,且各浓度组的作用呈明显的剂量依赖效应,说明食源性原花青素可以降低SH-SY5Y细胞增殖率。但是,肿瘤细胞之所以可以过度生长,主要是在细胞生长过程中激活了特殊的生长通路或抑制了其死亡通路,从而使细胞过度恶性增殖,在肿瘤细胞死亡的多种途径中,诱导肿瘤凋亡始终是抗肿瘤药物的最佳选择途径[15-16]。
细胞周期异常和细胞发生凋亡与肿瘤细胞化疗敏感性有密切关联,如果肿瘤细胞的细胞周期出现阻滞,则可加速细胞凋亡的发生[17]。因此,研究药物治疗引起的肿瘤细胞周期阻滞及细胞凋亡,对于临床化疗具有十分重要的意义。细胞周期是异常精密的过程,G0/G1期是化疗药物作用的主要位点,而G2/M期是细胞的高度增殖时相[18-19]。为明确食源性原花青素是否参与调控SH-SY5Y细胞的细胞周期,本研究采用流式细胞术检测了SH-SY5Y细胞周期的变化,结果显示:10、20和40mg·L-1食源性原花青素作用于SH-SY5Y细胞后,G0/G1期细胞百分率随着药物浓度的增加而升高,G2/M期细胞的比例则呈现浓度递减趋势,表明食源性原花青素的确参与调控SH-SY5Y细胞的细胞周期,使细胞生长周期发生阻滞。
为了进一步明确食源性原花青素是否影响了SH-SY5Y细胞发生凋亡,本研究采用Annexin Ⅴ法检测了SH-SY5Y细胞的凋亡率,结果显示:各浓度食源性原花青素组SH-SY5Y细胞的凋亡率明显升高,表明食源性原花青素可以诱导SH-SY5Y细胞发生凋亡,但凋亡的信号通路有很多,具体是激活哪条信号通路尚有待证实。总之,食源性原花青素可以明显降低SH-SY5Y细胞的活性,抑制SH-SY5Y细胞的生长,其作用机制主要是使细胞周期发生阻滞和诱导肿瘤细胞凋亡。但食源性原花青素对SH-SY5Y细胞的具体作用机制还需要进一步研究。
| [1] |
杜海松, 康康. PI3K/AKT信号通路对神经母细胞瘤细胞增殖的作用及抑癌机制分析[J]. 实用肿瘤杂志, 2018, 33(4): 329-333. |
| [2] |
王景福. 儿童神经母细胞瘤[J]. 中国实用儿科杂志, 2018, 33(10): 763-768. |
| [3] |
曹振杰. 多柔比星联合蛋氨酸脑啡肽对神经母细胞瘤SH-SY5Y细胞的生长抑制及Tau蛋白磷酸化的调节作用[J]. 肿瘤基础与临床, 2018, 31(4): 283-286. |
| [4] |
李丹.神经母细胞瘤组织中PHOX2B和ALK的表达及意义[D].石家庄: 河北医科大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10089-1016148034.htm
|
| [5] |
ZHANG L, WANG Y J, LI D X, et al. The absorption, distribution, metabolism and excretion of procyanidins[J]. Food Funct, 2016, 7(3): 1273-1281. |
| [6] |
齐玲, 钟越, 任旷, 等. 越桔原花青素抑制胶质瘤细胞生长作用[J]. 中国公共卫生, 2016, 32(3): 315-317. |
| [7] |
丁晓旭, 尹洋, 崔相国, 等. 原花青素对喉癌TU686细胞增殖、凋亡的影响[J]. 解剖科学进展, 2018, 24(6): 584-587. |
| [8] |
CHEN F Y, YE X D, YANG Y D, et al. Procyanidins from the bark of metasequoia glyptostroboides ameliorate allergic contact dermatitis through directly inhibiting T cells activation and Th1/Th17 responses[J]. Phytomedicine, 2015, 22(4): 510-515. |
| [9] |
CHEN L, YAN F F, CHEN W B, et al. Procyanidin from peanut skin induces antiproliferative effect in human prostate carcinoma cells DU145[J]. Chem Biol Interact, 2018, 288: 12-23. |
| [10] |
张娟. 葡萄籽原花青素联合吉西他滨对胰腺癌细胞增殖与凋亡的研究[J]. 中国临床药理学杂志, 2018, 34(15): 1862-1864. |
| [11] |
谈卫强.青蒿素抑制神经母细胞瘤细胞增殖的机制研究[D].上海: 复旦大学, 2013.
|
| [12] |
谢艳丽, 汪力. 手术联合化疗对小儿神经母细胞瘤患者MMP-2、TIMP-1、VEGF、NSE、LDH及细胞免疫功能的影响[J]. 海南医学院学报, 2017, 23(23): 3267-3270. |
| [13] |
司莹莹, 李爱敏, 王晓莉, 等. Am80对神经母细胞瘤细胞化疗敏感性的影响及机制研究[J]. 中国小儿血液与肿瘤杂志, 2018, 23(6): 307-311. |
| [14] |
杜晓芬, 谢笔钧, 杨尔宁, 等. 莲房原花青素对肿瘤细胞及正常细胞毒作用的比较[J]. 肿瘤防治杂志, 2004, 11(11): 1121-1125. |
| [15] |
ZHANG Q R, CHEN K, WU T, et al. Swertiamarin ameliorates carbon tetrachloride-induced hepatic apoptosis via blocking the PI3K/Akt pathway in rats[J]. Korean J Physiol Pharmacol, 2019, 23(1): 21-28. |
| [16] |
CHOUDHARY G S, AL-HARBI S, ALMASAN A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J]. Methods Mol Biol, 2015, 1219: 1-9. |
| [17] |
熊稀霖, 林秀红, 亓凯, 等. 环磷酰胺与阿霉素对神经母细胞瘤SK-N-SH细胞周期的影响[J]. 世界最新医学信息文摘, 2016, 16(61): 210-211. |
| [18] |
LIU S L, LIU Z, ZHANG L D, et al. GSK3β-dependent cyclin D1 and cyclin E1 degradation is indispensable for NVP-BEZ235 induced G0/G1 arrest in neuroblastoma cells[J]. Cell Cycle, 2017, 16(24): 2386-2395. |
| [19] |
ISHIKAWA C, SENBA M, MORI N. Effects of NVP-BEZ235, a dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor, on HTLV-1-infected T-cell lines[J]. Oncol Lett, 2018, 15(4): 5311-5317. |
 2020, Vol. 46
2020, Vol. 46


