扩展功能
文章信息
- 宋续军, 张倩, 王少磊, 柏娜, 刘杰
- SONG Xujun, ZHANG Qian, WANG Shaolei, BAI Na, LIU Jie
- 实验性种植体周围炎小鼠模型的建立及TNF-α在模型小鼠牙龈组织中的表达
- Establishment of mouse model of experimental peri-implantitis and expression of TNF-α in gingival tissue of model mice
- 吉林大学学报(医学版), 2020, 46(01): 40-44
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 40-44
- 10.13481/j.1671-587x.20200107
-
文章历史
- 收稿日期: 2019-11-01
2. 青岛大学口腔医学院, 山东 青岛 266003
2. School of Stomatology, Qingdao University, Qingdao 266003, China
种植体周围炎是与种植体功能丧失相关的不可逆炎症反应,其特征是软组织感染和周围骨质流失,最终导致种植体的脱落[1]。实验动物模型是研究疾病发病机制和发展的重要工具。目前已经通过饲喂含菌饲料法[2]、脂多糖注射法[3]和结扎法[4]建立了实验性种植体周围炎模型。动物实验[5-6]结果表明:种植体周围炎与牙周炎相似,其发生与菌斑定植有关联。
肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)是牙周病发展过程中起破坏组织作用的主要炎症因子,其可促进炎症细胞进入感染部位。研究[7]表明:种植体周围炎龈沟液中炎症因子TNF-α水平较健康种植体组和对照组龈沟液中TNF-α水平升高,表明TNF-α可通过协同作用调节免疫细胞,破坏骨组织,发生骨吸收。目前针对种植体周围炎的动物实验研究主要集中于犬和小型猪等大型哺乳动物[8-9],但其费用、畜牧条件以及抗体试剂、遗传筛检限制等因素均限制了研究的进行[10-11]。本研究拟应用即刻种植及结扎诱导法建立实验性种植体周围炎小鼠模型,探讨TNF-α在实验性种植体周围炎模型小鼠牙龈组织中的表达,阐明其在种植体周围炎中的致病作用,以期为种植体周围炎动物模型的建立提供新思路,并为该类疾病治疗提供新靶点。
1 材料与方法 1.1 实验动物、主要试剂和仪器4周龄雄性C57BL/6J小鼠18只,体质量16~19 g,购自济南朋悦动物中心,动物许可证号:SCXK(鲁)20190003。在实验期间小鼠定时喂软质饮食。Trizol试剂(美国Ambion公司),50×ROX Reference Dye 2和SYBR Green Master Mix购自南京诺唯赞生物科技有限公司,SuperScript Ⅲ Reverse Transcriptase试剂盒(美国Invitrogen公司),dNTP(天根生化科技有限公司),Ribonuclease Inhibitor(北京全式金生物)。螺旋型种植体和定制式驱动器(山东威高集团有限公司),显微组织镊(深圳市瑞沃德生命科技有限公司),5-0丝线(美国Johnson & Johnson公司),微计算机断层扫描(Micro-CT)系统(瑞士SCANCO Medical公司),手术放大镜(德国HEINE公司),组织匀浆器(美国Omni International公司)。
1.2 动物分组及动物模型建立实验前将18只小鼠随机分为空白组、对照组和模型组,每组6只,均饲养在青岛大学动物实验管理中心的SPF级单元中,动物管理符合动物保护条例。3组小鼠在手术之前,腹膜内注射氯胺酮(100 mg·kg-1)和赛拉嗪(5 mg·kg-1)对小鼠进行全身麻醉。所有手术均使用手术放大镜在标准无菌条件下进行。使用显微组织镊按照既定方案拔除右侧上颌第一磨牙,为了防止愈合过程中的牙合创伤,将右侧下颌对应第一磨牙同期拔除,然后采用定制式驱动器将定制的纯钛螺旋型种植体(图 1)即刻植入拔牙后留下的远中腭根窝洞中。术后用软质饮食和无菌水喂养小鼠4周,使种植体植入后进行骨结合。植入种植体后4周,即刻处死空白组小鼠(即结扎处理前);对照组小鼠不做结扎处理,饲喂2周后处死;模型组小鼠采用结扎诱导法建立实验性种植体周围炎模型,将5-0丝线牢固地环种植体的龈下颈部缠绕2圈,腭侧打结,饲喂2周后处死。

|
| 图 1 定制式种植体示意图 Fig. 1 Schematic diagram of a custom implant |
|
|
上述3组小鼠分别处死,获取上颌骨,去除皮肤和肌肉,并在手术放大镜下切取种植体腭侧的牙龈组织,-80℃条件下储存,用于基因表达分析;将剩余颌骨组织储存于75%酒精中,以备Micro-CT扫描使用。
1.4 牙龈组织形态学观察使用手术放大镜在肉眼情况下观察种植体周围牙龈组织的颜色、形态、质地和渗出情况,评估牙龈炎症表现。
1.5 采用Micro-CT扫描法测量种植体周围骨高度和骨密度采用Micro-CT扫描系统扫描小鼠上颌骨。将样品在旋转台上暴露于X射线下,在70 kVp、200 mA电流和10 μm各向同性体素分辨率的操作电压下进行测量,曝光时间为300 ms,并且每个视图平均5帧。使用Mimics Research 20.0软件进行种植体周围骨质的定量三维测量和影像的收集,种植体周围骨高度(Bone height)是通过测量种植体尖端和附着在种植体近端、远端、颊侧、腭侧的边缘骨的最大冠状位置之间的距离来确定的,单位为μm。在每个样本的种植体周围选择相同的感兴趣体积(volume of interest, VOI),其被定义为种植体周围直径为1.0 mm、高度为1.7 mm的圆柱体,使用Scanco micro-CTμ100 Evaluation Program v6.6软件分析VOI内骨密度,单位为mgHA/ccm。
1.6 RT-PCR法检测牙龈组织中TNF-αmRNA表达水平将上述收集的腭侧牙龈使用组织匀浆器在裂解缓冲液中匀浆,采用Trizol试剂提取总RNA,SuperScript Ⅲ Reverse Transcriptase试剂盒合成cDNA。采用RT-PCR法测定种植体周围牙龈组织中TNF-αmRNA表达水平。引物如下:TNF-α,forward 5′-AGCACAGAAAGCATGATCCG-3′, reverse 5′-CTGATGAGAGGGAGGCCATT-3′,GAPDH,forward5′-ATGGGTGTGAACCACG-AGA-3′,reverse5′-CAGGGATGATGTTCTGGGCA-3′。GAPDH为内参照基因。采用2-ΔΔCt法计算TNF-αmRNA表达水平。
1.7 统计学分析采用GraphPad Prism 5软件进行统计学分析。各组小鼠骨高度、骨密度和牙龈组织中TNF-αmRNA表达水平进行正态分布检验,均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD法。以P < 0.05为差异有统计学意义。
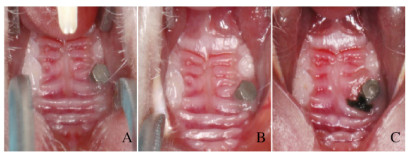
2 结果 2.1 各组小鼠种植体周围牙龈组织的大体形态学表现在种植体植入愈合完全后、施用结扎之前,空白组小鼠种植体周围牙龈未见明显的炎症征象;未结扎的对照组小鼠种植体周围牙龈无肉眼可见的炎症征象;结扎2周后,模型组小鼠种植体周围牙龈组织可见明显的发红、水肿、质地变软和渗出。见图 2(插页三)。通过显微组织镊手动检查时,各组种植体仍然保持不动。
|
| A:Blank group;B:Control group;C:Model group. 图 2 各组小鼠种植体周围牙龈组织大体形态表现 Fig. 2 Gross morphology of gingival tissue around implants of mice in various groups |
|
|
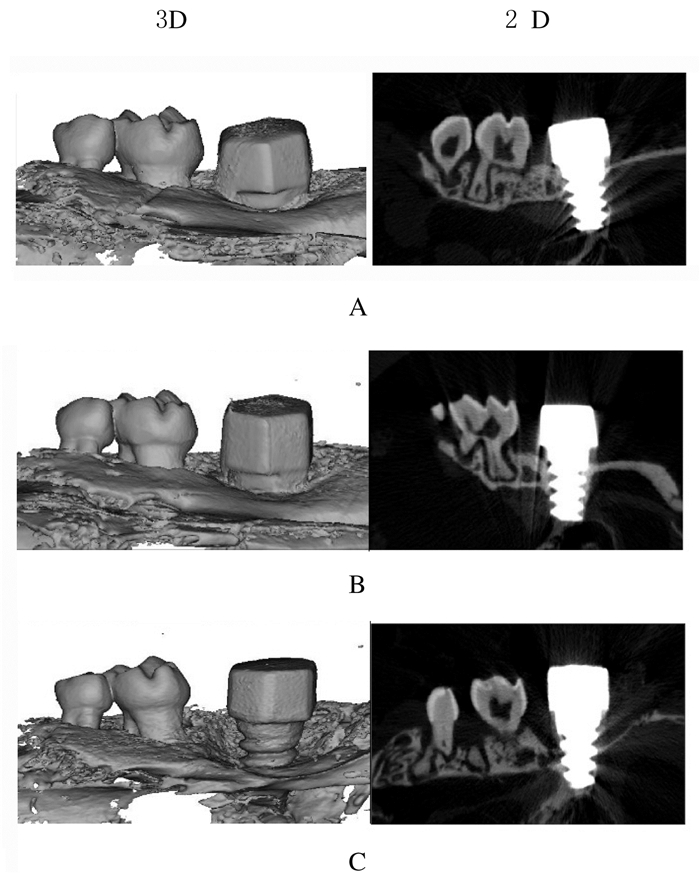
各组小鼠种植体周围骨高度的三维和二维影像变化见图 3。模型组小鼠种植体周围可看到明显的牙槽骨丢失,而空白组和对照组小鼠种植体周围牙槽骨无明显变化。各组小鼠种植体周围骨高度值见表 1。与空白组比较,对照组小鼠种植体的近端、远端、颊侧和腭侧骨高度差异无统计学意义(P > 0.05);与对照组比较,模型组小鼠种植体的近端、远端、颊侧和腭侧骨高度明显降低(P < 0.01)。与空白组[(993.50±10.02)mg HA/ccm]比较,对照组小鼠种植体周围牙槽骨骨密度[(1 034.00±44.05 mg HA/ccm]差异无统计学意义(P > 0.05);与对照组比较,模型组小鼠种植体周围牙槽骨骨密度[(964.60±6.59)mg HA/ccm]明显降低(P < 0.05)。
|
| A:Blank group;B:Control group;C:Model group. 图 3 各组小鼠种植体周围颌骨的Micro-CT扫描结果 Fig. 3 Micro-CT scan results of upper jaw bone around implants of mice in various groups |
|
|
| (n=6, x±s, l/μm) | ||||
| Group | Peri-implant site | |||
| Mesial | Distal | Buccal | Palatal | |
| Blank | 876.60±50.03 | 906.20±87.58 | 1019.00±86.59 | 819.90±42.17 |
| Control | 834.30±37.56 | 864.50±58.70 | 954.40±42.86 | 792.80±78.99 |
| Model | 576.20±55.81* | 555.80±26.61* | 584.30±75.00* | 556.80±60.59* |
| *P < 0.01 compared with control group. | ||||
与空白组(1.060±0.090)比较,对照组小鼠牙龈组织中TNF-αmRNA表达水平(1.291±0.080)差异无统计学意义(P > 0.05);与对照组比较,模型组小鼠牙龈组织中TNF-αmRNA表达水平(3.013±0.580)明显升高(P < 0.01)。
3 讨论牙种植体的植入是目前牙齿缺失患者极为重要的修复方法之一。而种植体周围炎会导致种植体周围骨质的丢失甚至种植手术的失败。先前已在犬[12]、非人类灵长类动物[13]和小型猪[14]中成功诱导了种植体周围炎。与较大的动物不同,以小鼠作为动物模型成本更低,并且可以提供易于操作的多种可修饰基因缺陷,使得小鼠成为了理想的实验动物模型,可以借此进一步深入探讨种植体周围炎发病机制中的细胞和炎症因子变化。
本研究采用的即刻种植的手术方法是基于目前临床上的主流趋势而选择的。近年来不翻瓣即刻种植在临床上广泛开展,其具有疗程短、愈合快、保留软组织能力佳和成功率高的特点[15]。研究[16]表明:延期种植和即刻种植对种植体周围软组织无明显影响,即刻种植在永久修复3个月时的红色美学效果要优于延期种植。本研究采用的拔牙后即刻种植的方法无需翻瓣,手术使用定制的驱动器植入,该方法简单微创,具有侵入性小和最小化出血的特点,最大程度地降低了因为手术操作过久或创伤过大导致的动物死亡问题,与以前的方法[2-3]相比更加具备科学性和适用性,值得推广使用。
在本研究中,模型组小鼠牙龈组织有肉眼可见的炎症征象,为排除这种炎症仅是种植体周围黏膜炎的可能,采用Micro-CT扫描种植体周围的牙槽骨并分析骨高度,结果显示:与对照组比较,模型组小鼠有明显的种植体周围骨质破坏,与人类种植体周围炎的定义基本相符,即病变已突破黏膜屏障累及骨组织造成骨缺损。本研究通过对比空白组和对照组小鼠的检测结果,可以观察到时间因素并未对种植体周围炎起到诱导作用,但也可能是因为时间较短,若种植体长期暴露于小鼠口腔内未得到良好的清洁,也可能会导致菌斑相关性炎症和种植体周围软硬组织的破坏。因此,本研究的结扎干预可以在短期内诱导炎症发生,从而成功建立实验性种植体周围炎小鼠模型。
研究[17]表明:TNF-α水平升高可能与种植体周围炎有关。TNF-α可通过激活细胞因子、趋化因子、细胞黏附分子和转录因子参与炎症过程[18]。研究[19]显示:在慢性炎性骨疾病如牙周炎和类风湿关节炎中,TNF-α能够直接诱导骨丢失,增加破骨细胞活性。本研究中,与对照组比较,模型组小鼠牙龈组织中TNF-αmRNA高表达,表明TNF-α也是重要的炎症介体,促进了种植体周围炎的进展,介导与种植体周围炎相关的骨质破坏。研究[20-21]表明:TNF-α可以通过上调核因子-κB受体活化因子配体(RANKL)的基质细胞产生并增加破骨细胞前体对RANKL的反应性,间接增强破骨细胞的形成。因此,基于以上结果,TNF-α mRNA在模型小鼠牙龈组织中高表达可能对种植体周围炎的发病具有促进作用。本研究结果为今后的种植体周围炎治疗提供了一个新的靶点。
综上所述,本研究成功建立了实验性种植体周围炎小鼠模型,并验证了TNF-α在实验性种植体周围炎模型小鼠牙龈组织中高表达。未来针对TNF-α的研究有望深入揭示种植体周围炎的发病机制,为寻找其潜在的治疗方法探索新的方向。
| [1] |
MOMBELLI A, LANG N P. The diagnosis and treatment of peri-implantitis[J]. Periodontol, 2000, 1998(17): 63-76. |
| [2] |
TZACH-NAHMAN R, MIZRAJI G, SHAPIRA L, et al. Oral infection with Porphyromonas gingivalis induces peri-implantitis in a murine model:Evaluation of bone loss and the local inflammatory response[J]. J Clin Periodontol, 2017, 44(7): 739-748. DOI:10.1111/jcpe.12735 |
| [3] |
PIRIH F Q, HIYARI S, LEUNG H Y, et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis[J]. J Oral Implantol, 2015, 41(5): e158-e164. DOI:10.1563/aaid-joi-D-14-00068 |
| [4] |
YU X, HU Y, FREIRE M, et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis[J]. J Periodont Res, 2018, 53(1): 98-106. DOI:10.1111/jre.12492 |
| [5] |
SCHWARZ F, SCULEAN A, ENGEBRETSON S P, et al. Animal models for peri-implant mucositis and peri-implantitis[J]. Periodontol 2000, 2015, 68(1): 168-181. DOI:10.1111/prd.12064 |
| [6] |
TAKAMORI Y, ATSUTA I, NAKAMURA H, et al. Histopathological comparison of the onset of peri-implantitis and periodontitis in rats[J]. Clin Oral Implants Res, 2017, 28(2): 163-170. DOI:10.1111/clr.12777 |
| [7] |
赵国强, 林海升. 口腔种植体周围炎与炎症细胞因子的相关性研究[J]. 中国现代医学杂志, 2018, 28(2): 106-109. DOI:10.3969/j.issn.1005-8982.2018.02.023 |
| [8] |
FAGGION C M J R, SCHMITTER M, TU Y K. Assessment of replication of research evidence from animals to humans in studies on peri-implantitis therapy[J]. J Dent, 2009, 37(10): 737-747. DOI:10.1016/j.jdent.2009.06.010 |
| [9] |
SCHWARZ F, SAGER M, BECKER J. Peri-implantitis defect model[A]. In: GIANNOBILE W V, NEVINS M. Osteology guidelines for oral and maxillofacial regenerations. Preclinical models for translational research[M]. Berlin: Quintessence, 2011: 1-56.
|
| [10] |
MOURARET S, HUNTER D J, BARDET C, et al. A pre-clinical murine model of oral implant osseointegration[J]. Bone, 2014, 58: 177-184. DOI:10.1016/j.bone.2013.07.021 |
| [11] |
NGUYEN VO T N, HAO J, CHOU J, et al. Ligature induced peri-implantitis:tissue destruction and inflammatory progression in a murine model[J]. Clin Oral Implants Res, 2017, 28(2): 129-136. DOI:10.1111/clr.12770 |
| [12] |
FAGGION C M Jr, SCHMITTER M, TU Y K. Assessment of replication of research evidence from animals to humans in studies on peri-implantitis therapy[J]. J Dent, 2009, 37(10): 737-747. DOI:10.1016/j.jdent.2009.06.010 |
| [13] |
SCHOU S, HOLMSTRUP P, KEIDING N, et al. Microbiology of ligature-induced marginal inflammation around osseointegrated implants and ankylosed teeth in cynomolgus monkeys (Macaca fascicularis)[J]. Clin Oral Implants Res, 1996, 7(3): 190-200. DOI:10.1034/j.1600-0501.1996.070301.x |
| [14] |
PEARCE A I, RICHARDS R G, MILZ S, et al. Animal models for implant biomaterial research in bone:A review[J]. Eur Cell Mater, 2007, 13: 1-10. DOI:10.22203/eCM.v013a01 |
| [15] |
BECKER W, WIKESJÖU M, SENNERBY L, et al. Histologic evaluation of implants following flapless and flapped surgery:A study in canines[J]. J Periodontol, 2006, 77(10): 1717-1722. DOI:10.1902/jop.2006.060090 |
| [16] |
张艳靖, 王柏翔, 刘小利, 等. 即刻种植和延期种植对种植体周围软组织影响的对比研究[J]. 实用口腔医学杂志, 2013, 29(4): 500-503. DOI:10.3969/j.issn.1001-3733.2013.04.010 |
| [17] |
DUARTE P M, DE MENDONÇA A C, MÁXIMO M B, et al. Differential cytokine expressions affect the severity of peri-implant disease[J]. Clin Oral Implants Res, 2009, 20(5): 514-520. DOI:10.1111/j.1600-0501.2008.01680.x |
| [18] |
WAJANT H, PFEFFER K, PFIZENMAIER K, et al. Tumor necrosis factors in 1998[M]. Cytokine Growth Factor Rev, 1998: 297-302.
|
| [19] |
BOYCE B F, LI P, YAO Z Q, et al. TNF-alpha and pathologic bone resorption[J]. Keio J Med, 2005, 54(3): 127-131. DOI:10.2302/kjm.54.127 |
| [20] |
NAKASHIMA T, KOBAYASHI Y, YAMASAKI S, et al. Protein expression and functional difference of membrane-bound and soluble receptor activator of NF-κB ligand:modulation of the expression by osteotropic factors and cytokines[J]. Biochem Biophys Res Communicat, 2000, 275(3): 768-775. DOI:10.1006/bbrc.2000.3379 |
| [21] |
ZOU W, HAKIM I, TSCHOEP K, et al. Tumor necrosis factor-alpha mediates RANK ligand stimulation of osteoclast differentiation by an autocrine mechanism[J]. J Cell Biochem, 2001, 83(1): 70-83. DOI:10.1002/jcb.1202 |
 2020, Vol. 46
2020, Vol. 46


