扩展功能
文章信息
- 同思雅, 杨谦, 张咪娟, 李伟, 王涛
- TONG Siya, YANG Qian, ZHANG Mijuan, LI Wei, WANG Tao
- 大麻素对双环己酮草酰二腙诱导的脱髓鞘模型小鼠髓鞘的修复作用
- Repair effect of cannabinoid on myelin sheath of demyelination model mice induced by cuprizone
- 吉林大学学报(医学版), 2020, 46(01): 35-39
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 35-39
- 10.13481/j.1671-587x.20200106
-
文章历史
- 收稿日期: 2019-05-16
2. 陕西省人民医院神经内二科, 陕西 西安 710068
2. Second Department of Neurology, Shaanxi Provincal People's Hospital, Xi'an 710068, China
多发性硬化是一种以免疫反应及炎症介导的以脱髓鞘及轴突变性为特征的中枢神经系统慢性进展性疾病[1-3]。依病灶的分布部位不同,多发性硬化的症状多种多样,常见肢体无力、感觉障碍、视觉异常、言语困难、括约肌障碍和自主神经功能紊乱等症状[4-5]。上述症状的产生大部分与多发性硬化导致的中枢神经系统脱髓鞘有关,因此保护并促进髓鞘的再生成为治疗多发性硬化的重要方向。目前研究[6]显示:人工合成大麻素(WIN55212-2)可能通过保护并促进髓鞘再生缓解脱髓鞘疾病模型动物的症状,但其具体的作用机制仍不清楚。结侧蛋白(juxtanodin,JN)是髓鞘的重要成分,在髓鞘的合成和发育中具有重要作用[7-8]。在生后表达时间特点上,JN与髓鞘的主要成分髓鞘碱性蛋白(myelin basic protein,MBP)相当,其表达略晚于MBP,是评价少突胶质细胞成熟和髓鞘发育完善的重要指标[8]。本研究采用喂食双环己酮草酰二腙(cuprizone)法建立脱髓鞘小鼠模型,采用WIN55212-2进行治疗,通过治疗前后JN表达的变化来评估髓鞘修复情况及治疗效果,以期为大麻素治疗脱髓鞘疾病的机制研究提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器8周龄雄性C57BL/6小鼠95只,由第四军医大学动物实验中心提供,动物许可证号为SYXK(陕)2014-001。小鼠饲养于第四军医大学实验动物中心,于12h光亮/12h黑暗、环境温度18℃~25℃条件下分笼喂养,每笼不多于5只,普通无菌饲料,自由进食、进水,每2d更换一次垫料。WIN55212-2和cuprizone购自美国Sigma公司,JN抗体黑金Ⅱ髓鞘染色试剂盒(Black-gold Ⅱmyelin staining kit)购自美国Millipore公司,DMEM培养基购自美国Gibco公司,转录因子Nkx2.2抗体和MBP抗体购自英国Abcam公司,GAPDH抗体购自武汉三鹰生物技术有限公司,SYBR Premix Ex Taq购自大连宝生物工程有限公司,RIPA裂解液和蛋白酶抑制剂购自西安晶彩科技有限公司,ECL化学发光试剂购自美国Bio-Rad公司。电泳仪、垂直电泳槽、ECL化学发光试剂和实时荧光定量PCR仪购自美国Bio-Rad公司。
1.2 实验动物模型制备95只C57BL/6小鼠随机分为空白对照组(30只)、模型组(25只)、二甲基亚砜(DMSO)组(15只)和治疗组(25只)。空白对照组小鼠给予普通饲料正常喂养6周。模型组、DMSO组和治疗组小鼠制备脱髓鞘模型,将普通饲料粉碎后,每100 g加入0.2%的cuprizone 0.2g,加入约50 mL水拌匀压成正常饲料的形状并烘干:模型组小鼠连续喂养6周[9];DMSO组小鼠自喂食3周后开始腹腔注射与WIN55212-2等量的DMSO混合液,连续注射10 d;治疗组小鼠自喂养3周后开始每天1次按剂量1mg·kg-1腹腔注射WIN55212-2(WIN55212-2按照小鼠体质量比例溶于10%DMSO:生理盐水1:1的混合液中),连续注射10 d[10]。
1.3 黑金Ⅱ髓鞘染色观察各组小鼠大脑组织形态表现采用黑金Ⅱ髓鞘染色技术对小鼠髓鞘组织进行染色,判断脱髓鞘小鼠模型是否成功。于第3和6周取空白对照组、模型组小鼠各3只,按照10 mL·kg-1剂量用0.5%水合氯醛麻醉后,进行心脏灌注,随后剥离小鼠完整的大脑组织,4%多聚甲醛固定过夜,30%蔗糖沉淀,进行小鼠大脑冠状面的冰冻切片,厚度14~30μm。4%多聚甲醛固定切片,ddH2O浸洗2 min,将切片放入60℃黑金Ⅱ染色液中染色约12min,直到在显微镜下观察到着色均匀、深浅适合的切片。经ddH2O浸洗,60℃硫代硫酸钠中孵育3 min,ddH2O浸洗,结晶紫染色3 min,酒精梯度脱水,二甲苯透明,吸水封片。阳性结果判定:正常情况下小鼠大脑胼胝体区域着色明显,髓鞘结构致密完整;反之,则表明脱髓鞘小鼠模型制备成功。
1.4 Western blotting法检测小鼠大脑组织中JN、MBP和Nkx2.2蛋白表达水平将各组小鼠大脑组织按照1:10(g:mL)比例加入RIPA蛋白裂解液及蛋白酶抑制剂进行冰上研磨,并使用BCA蛋白定量。配制12%SDS-聚丙烯酰胺凝胶,上样后进行蛋白电泳。电泳结束后将胶转移至NC膜上,5%脱脂奶粉中室温封闭1 h,加入一定稀释比例的一抗4℃过夜。次日TBST缓冲液洗膜,室温孵育HRP标记二抗1 h,再次洗膜后,加入ECL化学发光液,Bio-rad成像系统上拍照并利用Image J软件进行图像灰度扫描分析,计算目的蛋白表达水平。目的蛋白表达水平=目的条带灰度值/ GAPDH条带灰度值。
1.5 统计学分析采用SPSS 13.0统计软件进行统计学分析。各组小鼠大脑组织中JN、MBP和Nkx2.2蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
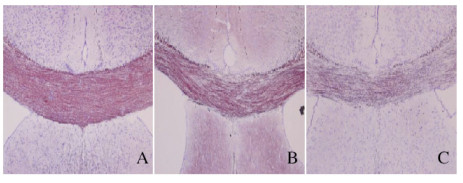
2 结果 2.1 造模不同时间小鼠大脑组织形态表现黑金Ⅱ髓鞘染色结果显示:空白对照组小鼠大脑胼胝体区有明显的着色;6周后模型组小鼠大脑胼胝体区着色减少,提示模型组小鼠的髓鞘发生脱落,造模成功。见图 1(插页三)。
|
| A: Blank control group; B: Model group(3 weeks); C: Model group (6 weeks). 图 1 2组小鼠大脑胼胝体区形态表现(黑金Ⅱ, ×200) Fig. 1 Morphology of corpus callosum of brain of nice In two groups(Black-gold Ⅱ, ×200) |
|
|
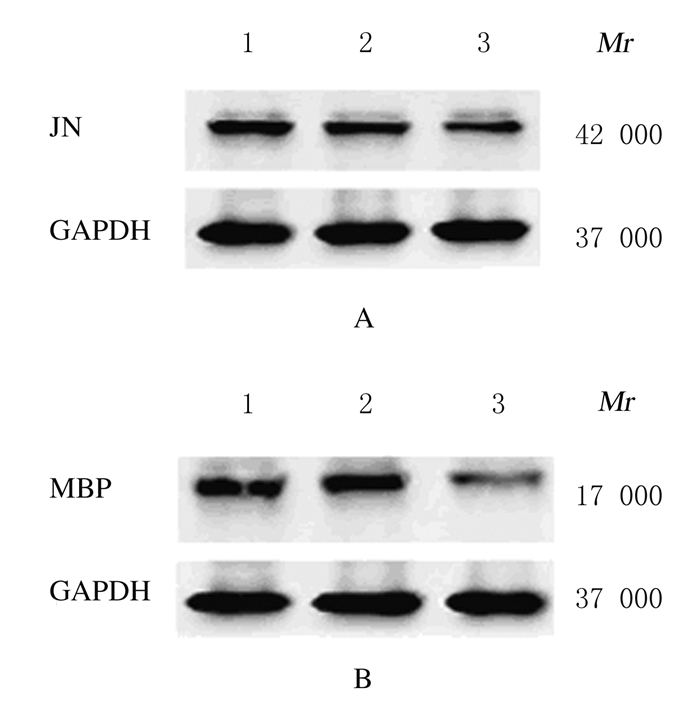
模型制备3周后,脱髓鞘小鼠逐渐出现情感淡漠、发育迟缓和活动减少等表现。与空白对照组(0.58±0.08和0.72±0.06)比较,6周后模型组小鼠大脑组织中JN和MBP蛋白表达水平(0.31±0.05和0.23±0.04)明显降低(P<0.05)。见图 2。
|
| Lane 1: Blank control group; Lane 2: Model group(3 weeks); Lane 3: Model group 图 2 Western blotting法检测空白对照组和模型组小鼠大脑组织中JN(A)和MBP(B)蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of JN(A) and MBP(B) proteins in brain tissue of mice in balnk control group and model group detected by Western blotting method |
|
|
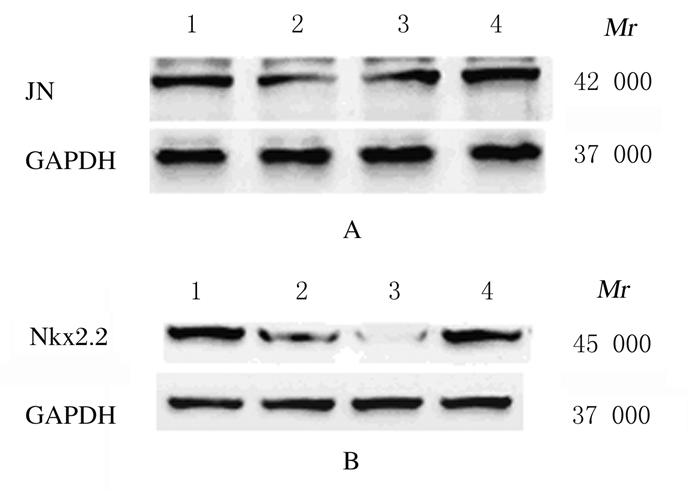
脱髓鞘小鼠制备模型第3周时,治疗组小鼠给予1 mg·kg-1WIN55212-2注射,注射后第10天分别收集空白对照组、模型组、DMSO组和治疗组小鼠大脑组织检测JN和Nkx2.2蛋白表达水平。与空白对照组比较,模型组小鼠大脑组织中JN和Nkx2.2蛋白表达水平明显降低(P<0.05);与模型组和DMSO组比较,治疗组小鼠大脑组织中JN和Nkx2.2蛋白表达水平明显升高(P<0.05或P<0.01)。见图 3和表 1。
|
| Lane 1: Blank control group; Lane 2: Model group; Lane 3: DMSO group; Lane 4: Treatment group. 图 3 Western blotting法检测各组小鼠大脑组织中JN(A)和Nkx2.2(B)蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of JN(A) and Nkx2.2(B) proteins in brain tissue of mice in various groups detected by Western blotting method |
|
|
| (n=15, x±s) | ||
| Group | JN protein | Nkx2.2 protein |
| Blank control | 0.84±0.07 | 1.45±0.25 |
| Model | 0.63±0.09* | 0.58±0.08* |
| DMSO | 0.66±0.10 | 0.52±0.13 |
| Treatment | 0.80±0.12△# | 1.27±0.28△△## |
| * P<0.05 vs blank control group; △ P<0.05, △△ P<0.01 vs model group; # P<0.05, ## P<0.01 vs DMSO group. | ||
多发性硬化表现为中枢神经系统慢性脱髓鞘改变[11],其中炎症性脱髓鞘是重要环节[11-13],其病理特征为大脑和脊髓多个散在的斑块性神经元轴突髓鞘脱失[14],因此保护髓鞘及促进髓鞘再生成为改善多发性硬化患者临床症状的重要治疗手段及方向[15-16]。在多发性硬化等中枢神经系统脱髓鞘疾病中,少突胶质前体细胞分化出具有功能性的少突胶质细胞减少,从而导致髓鞘再生障碍。JN是一种少突胶质细胞特异表达的骨架蛋白,其表达的时间点与髓鞘发生相一致。JN可通过与F-肌动蛋白(F-actin)直接结合引起细胞骨架变动,促进少突胶质细胞突起的生长及形态变化,在少突胶质细胞的分化和髓鞘形成方面具有重要作用[7-8, 17]。因此,促进JN的表达,可能成为治疗脱髓鞘疾病中保护少突胶质细胞及促进髓鞘再生的潜在治疗手段。
cuprizone是一种铜离子螯合剂,通过干扰少突胶质细胞线粒体能量代谢破坏该细胞进而导致髓鞘脱失。但cuprizone并不影响中枢神经系统中其他细胞的功能,是建立脱髓鞘模型的常用诱导药物,模拟脱髓鞘疾病的发生[18-19]。在本实验中,利用cuprizone诱导小鼠发生髓鞘脱失,结果显示:作为髓鞘的主要成分MBP蛋白表达水平降低,其趋势随时间的增加而更明显,表明造模成功,小鼠发生髓鞘的破坏;而JN蛋白的表达随着损伤时间的延长而减少,在第6周时最明显,提示JN参与了髓鞘脱失的病理过程。WIN55212-2能够通过调节免疫应答和抗炎作用促进少突胶质细胞的存活及髓鞘修复,减轻多发性硬化症状[20-21]。本研究结果显示:在给予脱髓鞘小鼠注射WIN55212-2后,与空白组比较,治疗组小鼠脑组织中JN蛋白表达水平明显上调,进一步检测发现WIN55212-2可上调Nkx2.2蛋白表达。有研究[22]表明:Nkx2.2蛋白是中枢神经系统调控少突胶质细胞分化的重要转录因子,能够促进JN蛋白的表达。因此本文作者推测:WIN55212-2可能通过上调转录因子Nkx2.2蛋白的表达进而促进JN蛋白表达,进一步促进髓鞘再生与修复。
综上所述,本研究通过建立cuprizone诱导脱髓鞘小鼠模型,使用WIN55212-2对模型动物进行干预,证实WIN55212-2可能通过上调转录因子Nkx2.2蛋白进而促进JN蛋白表达,发挥保护髓鞘的作用。本研究结果为进一步研究大麻素治疗多发性硬化的机制及相应的干预靶点提供了实验依据和线索。
| [1] |
吴彦青, 郭玉红, 刘清泉. 中医药干预多发性硬化的作用机制与治疗研究展望[J]. 世界中医药, 2017, 12(4): 735-737. DOI:10.3969/j.issn.1673-7202.2017.04.005 |
| [2] |
王春琛, 陈志刚, 马昕宇. 金针王乐亭经验方治疗缓解期复发缓解型多发性硬化8例的临床观察[J]. 世界中医药, 2017, 12(9): 2114-2117. DOI:10.3969/j.issn.1673-7202.2017.09.032 |
| [3] |
COMPSTON A, COLES A. Multiple sclerosis[J]. Lancet, 2008, 372(648): 1502-1517. |
| [4] |
LUBLIN F D, REINGOLD S C, COHEN J A, et al. Defining the clinical course of multiple sclerosis:The 2013 revisions[J]. Neurology, 2014, 83(3): 278-286. DOI:10.1212/WNL.0000000000000560 |
| [5] |
WINGERCHUK D M, CARTER J L. Multiple sclerosis:current and emerging disease-modifying therapies and treatment strategies[J]. Mayo Clin Proc, 2014, 89(2): 225-240. DOI:10.1016/j.mayocp.2013.11.002 |
| [6] |
DE LAGO E, MORENO-MARTET M, CABRANES A, et al. Cannabinoids ameliorate disease progression in a model of multiple sclerosis in mice, acting preferentially through CB1 receptor-mediated anti-inflammatory effects[J]. Neuropharmacology, 2012, 62(7): 2299-2308. DOI:10.1016/j.neuropharm.2012.01.030 |
| [7] |
RUSKAMO S, CHUKHLIEB M, VAHOKOSKI J, et al. Juxtanodin is an intrinsically disordered F-actin-binding protein[J]. Sci Rep, 2012, 2: 899. DOI:10.1038/srep00899 |
| [8] |
ZHANG B, CAO Q, GUO A, et al. Juxtanodin:an oligodendroglial protein that promotes cellular arborization and 2', 3'-cyclic nucleotide-3'-phosphodiesterase trafficking[J]. Proc Natl Acad Sci U S A, 2005, 102(32): 11527-11532. DOI:10.1073/pnas.0500952102 |
| [9] |
MATSUSHIMA G K, MORELL P. The neurotoxicant, cuprizone, as a model to study demyelination and remyelination in the central nervous system[J]. Brain Pathol, 2001, 11(1): 107-116. |
| [10] |
WISSEL J, HAYDN T, MVLLER J, et al. Low dose treatment with the synthetic cannabinoid nabilone significantly reduces spasticity-related pain:A double-blind placebo-controlled cross-over trial[J]. J Neurol, 2006, 253(10): 1337-1341. DOI:10.1007/s00415-006-0218-8 |
| [11] |
王颖.丁苯酞通过抑制PGAM5介导的坏死性凋亡对实验性自身免疫性脑脊髓炎小鼠发挥保护作用[D].石家庄: 河北医科大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10089-1018859577.htm
|
| [12] |
DI F P, REINDL M, BERGER T. New clinical implications of anti-myelin oligodendrocyte glycoprotein antibodies in children with CNS demyelinating diseases[J]. Multiple Sclerosis Related Disord, 2018, 22: 35-37. DOI:10.1016/j.msard.2018.02.023 |
| [13] |
POOREBRAHIM M, ASGHARI M, ABAZARI M F, et al. Immunomodulatory effects of a rationally designed peptide mimetic of human IFNβ in EAE model of multiple sclerosis[J]. Prog Neuro-Psychopharmacol Biol Psychiat, 2018, 82: 49-61. DOI:10.1016/j.pnpbp.2017.11.028 |
| [14] |
王璐, 杨瀚宇, 臧彩霞, 等. CXCR2在多发性硬化症中的作用和机制研究进展[J]. 中国新药杂志, 2018, 27(22): 2630-2635. |
| [15] |
PASQUINI L A, MILLET V, HOYOS H C, et al. Galectin-3 drives oligodendrocyte differentiation to control myelin integrity and function[J]. Cell Death Differ, 2011, 18(11): 1746-1756. DOI:10.1038/cdd.2011.40 |
| [16] |
NARAYAN R N, FORSTHUBER T, STVVE O. Emerging drugs for primary progressive multiple sclerosis[J]. Expert Opin Emerg Drugs, 2018, 23(2): 97-110. DOI:10.1080/14728214.2018.1463370 |
| [17] |
BROCKSCHNIEDER D, SABANAY H, RIETHMACHER D, et al. Ermin, a myelinating oligodendrocyte-specific protein that regulates cell morphology[J]. J Neurosci, 2006, 26(3): 757-762. DOI:10.1523/JNEUROSCI.4317-05.2006 |
| [18] |
KIPP M, CLARNER T, DANG J, et al. The cuprizone animal model:new insights into an old story[J]. Acta Neuropatholo, 2009, 118(6): 723-736. DOI:10.1007/s00401-009-0591-3 |
| [19] |
STEELMAN A J, THOMPSON J P, LI J. Demyelination and remyelination in anatomically distinct regions of the corpus callosum following cuprizone intoxication[J]. Neurosci Res, 2012, 72(1): 32-42. DOI:10.1016/j.neures.2011.10.002 |
| [20] |
穆建坤, 刘宏亮, 姚忠祥, 等. 大麻素WIN55, 212-2对双环己酮草酰二腙诱导的脱髓鞘模型髓鞘修复作用的研究[J]. 第三军医大学学报, 2013, 35(11): 1129-1132. |
| [21] |
MARCIN CZEPIEL, ERIK BODDEKE, SJEF COPRAY, 等. 人类少突胶质细胞在髓鞘修复中的作用[J]. 神经损伤与功能重建, 2015, 10(2): 138-138. |
| [22] |
WANG T, JIA L, YANG G, et al. Identification of Juxtanodin promoter and its transcriptional regulation during the ATRA-induced differentiation of C6 cells[J]. Mol Cell Biochem, 2011, 350(1/2): 177-183. |
 2020, Vol. 46
2020, Vol. 46


