扩展功能
文章信息
- 邓颖, 朱宇珍, 吴科锋, 郑学宝, 叶华
- DENG Ying, ZHU Yuzhen, WU Kefeng, ZHENG Xuebao, YE Hua
- IL-6/STAT3通路介导lncRNA H19上调在小鼠溃疡性结肠炎相关结直肠癌发病中的作用
- Effect of lncRNA H19 up-regulation mediated by IL-6/ STAT3 pathway in pathogenesis of ulcerative colitis-associated colorectal cancer in mice
- 吉林大学学报(医学版), 2020, 46(01): 20-25
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 20-25
- 10.13481/j.1671-587x.20200104
-
文章历史
- 收稿日期: 2019-04-24
2. 茂名市人民医院消化内科, 广东 茂名 525000;
3. 广州中医药大学中医药数理工程研究院, 广东 广州 510006
2. Department of Gastroenterology, Maoming People's Hospital, Maoming 525000, China;
3. Mathematical Engineering Academy of Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
溃疡性结肠炎(ulcerative colitis, UC)是一种主要累及直肠、结肠黏膜和黏膜下层的慢性非特异性炎症,具有癌变的风险。溃疡性结肠炎相关结直肠癌(ulcerative colitis-associated colorectal cancer, CAC)是UC的严重并发症之一,占UC患者死亡原因的10%~15%[1],其发生与UC患者病程和炎症程度有明显关联。其中白细胞介素6 (interleukin-6,IL-6)/信号传导及转录激活蛋白3 (signal transducer and activator of transcription-3,STAT3)信号通路在UC发展为CAC的发病机制中扮演重要角色,是连接炎症与肿瘤的重要通路之一[2]。UC癌变过程中常伴随着p53基因、腺瘤性结肠息肉病基因(APC)和原癌基因K-ras等多种基因变异,但目前尚无基因能有效预测CAC的发生。
长链非编码RNA(long non-coding RNA, lncRNA)是一类核苷酸长度大于200 nt、无蛋白质编码功能的RNA。有研究[3-5]显示:lncRNA参与大多数肿瘤的发生、发展、转移和预后等过程,可在表观遗传、转录和转录后等多种水平上参与细胞生长发育的调控。lncRNA H19(简称H19)同时也是一种母源性印迹基因,在胚胎发育期显著高表达,出生后仅在心肌和骨骼肌中低表达[6]。H19的异常表达与结直肠癌[7]、肝癌[8]、胃癌[9]和胰腺癌[10]等肿瘤有密切关联。H19在不同肿瘤中扮演不同的角色,其中H19在结直肠癌组织中高表达,能够促进肿瘤的增殖、侵袭和迁移[6, 11]。目前关于H19在CAC中的表达情况、功能和作用机制的研究尚未见报道。本研究通过建立CAC小鼠模型,检测H19和IL-6/STAT3通路相关因子的表达水平,探讨其可能的发病机制。
1 材料与方法 1.1 实验动物SPF级雄性C57BL/6小鼠,6~7周龄,体质量(20±2)g,由北京维通利华实验动物技术有限公司提供,动物合格证号:SCXK(京)2012-0001。
1.2 主要试剂及仪器氧化偶氮甲烷(AOM)购自美国Sigma公司,葡聚糖硫酸钠(DSS,相对分子质量36 000~50 000)购自美国MP Bio公司,Trizol总RNA提取试剂盒、DEPC浓缩液、反转录试剂盒RR036A和荧光定量PCR试剂盒RR420A购自宝生物(大连)工程公司,兔抗小鼠IL-6、磷酸化STAT3(p-STAT3)、c-Myc和β-actin购自美国CST公司,BCA蛋白浓度测定试剂盒和SDS-PAGE凝胶配制试剂盒购自碧云天生物科技研究所,小鼠隐血试剂盒购自南京建成生物工程研究所,小鼠IL-6 ELISA检测试剂盒购自武汉博士德生物工程公司。组织包埋机(武汉俊杰电子有限公司),RM2235组织切片机(德国LEICA公司),核酸蛋白定量仪和MasterCycler Gradient PCR仪(德国Eppendorf公司),ABI7500型定量PCR仪(美国ABI公司),稳压稳流电泳仪和垂直板电泳槽(美国Bio-Rad公司)。
1.3 小鼠CAC模型的建立22只小鼠随机分为对照组(10只)和模型组(12只)。模型组小鼠予以生理盐水配制的AOM溶液(12 mg·kg-1)腹腔注射1次,对照组则腹腔注射等量的生理盐水;观察1周后,模型组小鼠先予以蒸馏水配制的2% DSS溶液自由饮用5 d,再换普通洁净水饮用16 d,21 d为1个循环,共4个循环;造模期间对照组小鼠一直饮用普通洁净水,造模于第120天结束。
1.4 观察方法造模期间,每天观察小鼠进食量、精神状态、活动情况和毛发亮泽度等,给予DSS前1 d及后1 d分别记录小鼠体质量、大便性状及便血情况,按Cooper法进行小鼠疾病活动度(DAI)评分。取材前小鼠禁食24 h,处死前摘眼球取血,ELISA法检测血清中IL-6水平;小鼠处死后取盲肠至肛门段结肠,测量长度,并观察结肠大体形态及计数肿瘤个数。最后,将模型组小鼠结肠肿瘤分为3部分,分别用于HE染色、qPCR法检测和Western blotting法检测;同时对照组小鼠取相应结肠段行上述检测。
1.5 HE染色观察结肠组织病理形态表现将新鲜切取的结肠组织迅速浸泡在10%甲醛溶液中固定48 h后脱水、透明、浸蜡、包埋和切片,制作石蜡病理切片,脱蜡复水,苏木素染3 min,自来水冲洗,1%盐酸酒精分化数秒,自来水冲洗,伊红染6~8 s,自来水冲洗后晾干封片,显微镜下观察结肠组织病理形态表现。
1.6 ELISA法检测小鼠血清中IL-6水平将小鼠血液室温静置10 min后4℃、3000r·min-1离心10 min,吸取上层血清,按ELISA试剂盒说明书操作,450 nm波长处测定吸光度(A)值。绘制ELISA标椎曲线,计算小鼠血清中IL-6水平。
1.7 qPCR法检测小鼠结肠组织中H19、let-7a、IL-6、STAT3和c-Myc mRNA表达水平采用Trizol试剂提取2组小鼠结肠组织的总RNA,按照两步法逆转录试剂盒说明书操作,合成cDNA,qPCR扩增目的基因和内参基因。qPCR反应条件:95℃预变性1 min,95℃变性10 s,60℃退火延伸40 s,共40个循环。以上目的RNA引物序列根据NCBI数据库设计获得(表 1),由上海英潍捷基贸易有限公司合成。采用2-ΔΔCt法计算各目的基因mRNA表达水平。
| Name | Sequences(5′-3′) |
| H19 | Forward:CGGCGACGGAGCAGTGAT Reverse:ACCTGTCATCCTCGCCTTCA |
| IL-6 | Forward:ACAACCACGGCCTTCCCTACTT Reverse:AGCCTCCGACTTGTGAAGTGGT |
| STAT3 | Forward:ATTAAGGGCAGTGAGGACAT Reverse:GCCTTGCCTTCCTAAATACC |
| c-Myc | Forward:AACAACCGCAAGTGCTCCAG Reverse:TCTCGTCGTTTCCTCAATAAGTCC |
| β-actin | Forward:GCTTCTAGGCGGACTGTTAC Reverse:CCATGCCAATGTTGTCTCTT |
| let-7a | Forward:GAGGTAGTAGGTTGTATAGT Reverse:GAACATGTCTGCGTATCTC |
| U6 | Forward:CTCGCTTCGGCAGCACA Reverse:AACGCTTCACGAATTTGCGT |
按照蛋白提取试剂盒说明书操作,提取细胞总蛋白,BCA法测定蛋白总量,配制10%的分离胶和5%的浓缩胶,加入样品,90 V恒压浓缩30 min,再120 V恒压分离60 min,继而转膜和封闭,加入一定比例稀释的一抗,4℃孵育过夜;TBST洗膜3次,二抗孵育60 min后继续TBST洗膜3次,化学发光后采集图像,用Gel-Pro软件检测各蛋白条带的A值,以β-actin作为内参,进行半定量分析。目的蛋白表达水平=目的条带A值/β-actin条带A值。
1.9 统计学分析采用SPSS20.0统计软件进行统计学分析。小鼠结肠长度,小鼠血清中IL-6水平,小鼠结肠组织中H19、let-7a、IL-6、STAT3和c-Myc mRNA表达水平及p-STAT3和c-Myc蛋白表达水平, 均以x±s表示,2组间样本均数比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组小鼠一般情况模型组小鼠在饮用DSS后的第3天出现稀便,第7天均有不同程度的腹泻和血便,撤去DSS后的1~2 d较严重,然后逐渐恢复;小鼠第2循环出现肠道症状的时间晚于第1循环,程度较轻;第3和4循环时腹泻、便血等症状均较前一循环加重,小鼠出现精神萎靡、毛发杂乱暗淡、倦怠懒动、拱背、厌食和体质量减轻,部分小鼠甚至出现脱肛现象。造模期间,小鼠因严重便血、极度消瘦而死亡3只。对照组小鼠则精神状态良好,毛发有光泽,活泼好动,大便成形。2组小鼠体质量和DAI评分变化见图 1。

|
| 图 1 2组小鼠体质量(A)和DAI评分(B) Fig. 1 Body weights(A) and DAI scores(B) of mice in two groups |
|
|
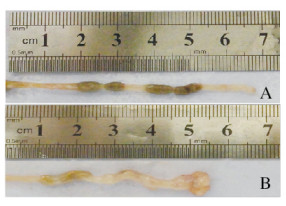
对照组小鼠结肠表面光滑,沿纵轴剖开,可见肠腔内粪便成形,未见明显充血水肿、溃疡和肿物形成。模型组小鼠结肠外观充血水肿、短缩变形及肠腔变窄,可见隆起型或溃疡型肿物形成,表面不规则,多位于近肛门侧(图 2,见插页一)。模型组小鼠成瘤率为100%,肿瘤数目为(2.78 ± 1.30)个,结肠长度为(5.62 ± 0.48)cm,较对照组小鼠结肠长度[(6.27± 0.32) cm]明显缩短(P<0.01)。
|
| A: Control group: B: Model group. 图 2 2组小鼠结肠大体形态表现 Fig. 2 Gross morphology of colon of mice in two groups |
|
|
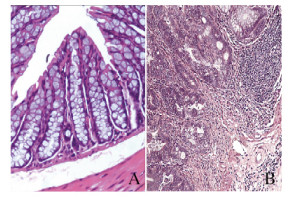
对照组小鼠结肠黏膜上皮完整,腺体排列规则,隐窝结构整齐,可见杯状细胞,无炎症细胞浸润。模型组小鼠结肠组织腺体结构基本消失,细胞异型性明显,细胞核增大深染,细胞极性丧失,排列紊乱,大多呈弥漫性排列,局部伴有炎症细胞浸润,组织呈高级上皮内瘤变,多数局限于黏膜上皮或固有层,极个别侵袭至黏膜肌层。见图 3(插页一)。
|
| A Control group; B: Model group. 图 3 2组小鼠结肠组织病理形态表现(HE, ×200) Fig. 3 Pathomorphology of colon tissue of mice in two groups (HE, ×200) |
|
|
与对照组[(28.00±4.10) μg·L-1]比较,模型组小鼠血清中IL-6水平[(48.00±8.00)μg·L-1]明显升高(P<0.01)。
2.5 2组小鼠结肠组织中H19、let-7a、IL-6、STAT3和c-Myc mRNA表达水平与对照组比较,模型组小鼠结肠组织中H19、IL-6、STAT3和c-Myc mRNA表达水平明显升高(P<0.01),let-7a mRNA表达水平明显降低(P<0.01)。见表 2。
| (x±s) | ||||||
| Group | n | H19 | let-7a | IL-6 | STATA-3 | c-Myc |
| Control | 10 | 1.10±0.47 | 1.50±1.40 | 1.50±1.60 | 1.00±0.13 | 1.00±0.56 |
| Model | 9 | 75.00±26.00* | 0.13±0.09* | 17.00±12.00* | 7.00±2.10* | 12.00±1.70* |
| * P<0.01 vs control group. | ||||||
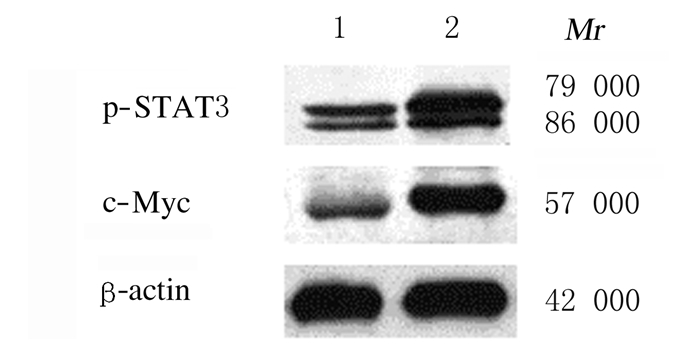
与对照组比较,模型组小鼠结肠组织中p-STAT3和c-Myc蛋白表达水平明显升高(P<0.01)。见表 3和图 4。
| (x±s) | |||
| Group | n | p-STAT3 | c-Myc |
| Control | 10 | 0.15±0.23 | 0.11±0.22 |
| Model | 9 | 0.50±0.05* | 0.43±0.04* |
| * P<0.01 vs control group. | |||
|
| 图 4 2组小鼠结肠组织中p-STAT3和c-Myc蛋白表达电泳图 Fig. 4 Electrophoregram of p-STAT3 and c-Myc proteins in colon tissue of mice in two groups |
|
|
本研究采用AOM/DSS小鼠模型来模拟UC癌变的过程。AOM/DSS模型[12]是目前应用最广泛的化学诱导CAC模型,可以呈现UC活动期与恢复期交替以及慢性非特异性肠炎向肠癌转变的过程,与CAC发病模式“正常肠黏膜→急性炎症→慢性炎症→不典型增生→上皮内瘤变→腺癌”相似,炎症反应在该过程中起重要的推动作用。已有研究[13]表明:约15%肿瘤是由感染和非可控炎症引起的。UC癌变可能与反复的炎症刺激导致肠黏膜微环境中的炎症因子呈持续活跃状态,进而诱导原癌基因过度激活,抑癌基因表达降低有关。
可溶性IL-6是链接炎症与肿瘤的关键因子,主要由巨噬细胞和中性粒细胞分泌,可通过IL-6/STAT3信号通路发挥生物学效应。本研究结果显示:模型组小鼠结肠组织中IL-6 mRNA表达水平较对照组明显升高,血清中IL-6水平也明显升高。高表达的IL-6可诱导胞浆中STAT3持续磷酸化而激活,p-STAT3可转位至细胞核并结合靶基因,发挥转录调控作用。STAT3的靶基因有B淋巴细胞瘤因子2、B细胞淋巴瘤因子2 XL、细胞周期蛋白D1、c-Myc和血管内皮生长因子等,主要参与细胞凋亡、增殖和血管形成等生物过程的调控[14-15]。p-STAT3具有较强的抑制细胞凋亡和促进细胞增殖的作用。本研究结果显示:与对照组比较,模型组小鼠结肠组织中STAT3和c-Myc mRNA和蛋白表达水平明显升高。c-Myc是原癌基因之一,主要参与细胞周期的调控,过度表达的c-Myc可导致细胞无限增殖,诱发癌变。
c-Myc同时可作为转录因子,调控下游靶基因的表达。一项有关肺癌的研究[16]显示:c-Myc可与H19启动子相结合,激活H19表达,促进肿瘤细胞增殖。本研究显示:模型组小鼠结肠组织H19 mRNA表达水平较对照组明显升高,并且H19表达趋势与c-Myc表达一致,提示H19在CAC中也可能受到c-Myc的正调控,UC发生癌变可能与H19过度表达有关。H19可通过多种作用方式参与肿瘤细胞的生长发育调控。研究[17]表明:H19在结直肠癌中主要通过上调其第1个外显子编码产物miR-675表达,使抑癌基因Rb表达下降,从而产生促进肿瘤细胞增殖的作用。另外,关于胰腺导管癌的研究[10]显示:H19可以下调let-7表达,let-7对下游靶蛋白高迁移率族蛋白A2(high mobility group protein A2,HMGA2)的抑制作用减弱,导致HMGA2介导的上皮-间充质转化(epithelial to mesenchymal transition,EMT)增强,肿瘤发生转移的概率增加。
let-7是一种微小RNA(microRNA),最早在秀丽隐杆线虫中被发现,是线虫时序性发育的关键调控因子,在哺乳动物中调节多种细胞的增殖,主要参与细胞周期的调控。AKAO等[18]研究发现:let-7a-1在结肠癌组织和细胞株中的表达均下降;当过表达let-7a-1后,Ras和c-Myc蛋白表达水平均明显下降,结肠癌细胞增殖受到抑制,提示let-7a在结直肠癌中具有抑制肿瘤细胞生长的生物学功能。本研究结果显示:模型组小鼠结肠组织中let-7a mRNA表达水平较对照组明显降低,提示CAC小鼠的发病与let-7a低表达有关。基于let-7a表达趋势与H19的相反,并且已有研究[19]表明:H19可直接干扰let-7a表达,推测CAC小鼠的发病与H19可能抑制let-7a表达有关。let-7a表达还受到“c-Myc-Lin28-let-7a-c-Myc”调控环路调节[20],let-7a对c-Myc表达具有抑制作用。本研究结果显示:let-7a表达趋势与c-Myc表达相反,提示在CAC发病过程中,let-7a有可能下调c-Myc的表达。
综上所述,在CAC小鼠的发病过程中,活动性UC小鼠肠黏膜中可溶性IL-6过度表达,激活IL-6/STAT3通路后作用于下游靶基因c-Myc,c-Myc表达上调能激活H19表达,进而抑制let-7a表达,let-7a对c-Myc表达的抑制作用减弱,导致原癌基因c-Myc过度表达,进一步促进H19表达,降低let-7a表达,导致UC小鼠肠黏膜上皮细胞无限增殖而发生癌变。因此,IL-6/STAT3信号转导通路介导的原癌基因c-Myc、H19过度表达及抑癌基因let-7a表达降低,导致细胞过度增殖而诱发癌变,可能是CAC发病的分子机制之一。但在CAC发病过程中上述各因子之间的相互作用尚不明确,有待进一步的实验研究证实。
| [1] |
HATA K, ANZAI H, IKEUCHI H, et al. Surveillance colonoscopy for ulcerative colitis-associated colorectal cancer offers better overall survival in real-world surgically resected cases[J]. Am J Gastroenterol, 2019, 114(3): 483-489. DOI:10.14309/ajg.0000000000000117 |
| [2] |
LUO C X, ZHANG H. The role of proinflammatory pathways in the pathogenesis of colitis-associated colorectal cancer[J]. Mediators Inflamm, 2017, 2017: 5126048. |
| [3] |
SUN W, SHI Y, WANG Z F, et al. Interaction of long-chain non-coding RNAs and important signaling pathways on human cancers (Review)[J]. Int J Oncol, 2018, 53(6): 2343-2355. |
| [4] |
DHANOA J K, SETHI R S, VERMA R, et al. Long non-coding RNA:its evolutionary relics and biological implications in mammals:a review[J]. J Anim Sci Technol, 2018, 60: 25. DOI:10.1186/s40781-018-0183-7 |
| [5] |
ROBERTS T C, MORRIS K V, WEINBERG M S. Perspectives on the mechanism of transcriptional regulation by long non-coding RNAs[J]. Epigenetics, 2014, 9(1): 13-20. |
| [6] |
GABORY A, JAMMES H, DANDOLO L. The H19 locus:role of an imprinted non-coding RNA in growth and development[J]. Bioessays, 2010, 32(6): 473-480. DOI:10.1002/bies.200900170 |
| [7] |
CHEN S W, ZHU J, MA J, et al. Overexpression of long non-coding RNA H19 is associated with unfavorable prognosis in patients with colorectal cancer and increased proliferation and migration in colon cancer cells[J]. Oncol Lett, 2017, 14(2): 2446-2452. DOI:10.3892/ol.2017.6390 |
| [8] |
LV J, YU Y Q, LI S Q, et al. Aflatoxin B1 promotes cell growth and invasion in hepatocellular carcinoma HepG2 cells through H19 and E2F1[J]. Asian Pac J Cancer Prev, 2014, 15(6): 2565-2570. DOI:10.7314/APJCP.2014.15.6.2565 |
| [9] |
ZHANG E B, HAN L, YIN D D, et al. c-Myc-induced, long, noncoding H19 affects cell proliferation and predicts a poor prognosis in patients with gastric cancer[J]. Med Oncol, 2014, 31(5): 914. DOI:10.1007/s12032-014-0914-7 |
| [10] |
MA C, NONG K, ZHU H, et al. H19 promotes pancreatic cancer metastasis by derepressing let-7's suppression on its target HMGA2-mediated EMT[J]. Tumour Biol, 2014, 35(9): 9163-9169. DOI:10.1007/s13277-014-2185-5 |
| [11] |
LI C F, LI Y C, WANG Y, et al. The effect of LncRNA H19/miR-194-5p axis on the epithelial-mesenchymal transition of colorectal adenocarcinoma[J]. Cell Physiol Biochem, 2018, 50(1): 196-213. DOI:10.1159/000493968 |
| [12] |
SNIDER A J, BIALKOWSKA A B, GHALEB A M, et al. Murine model for colitis-associated cancer of the colon[J]. Methods Mol Biol, 2016, 1438: 245-253. |
| [13] |
MONKKONEN T, DEBNATH J. Inflammatory signaling cascades and autophagy in cancer[J]. Autophagy, 2018, 14(2): 190-198. DOI:10.1080/15548627.2017.1345412 |
| [14] |
HUYNH J, CHAND A, GOUGH D, et al. Therapeutically exploiting STAT3 activity in cancer-using tissue repair as a road map[J]. Nat Rev Cancer, 2019, 19(2): 82-96. DOI:10.1038/s41568-018-0090-8 |
| [15] |
WALDNER M J, FOERSCH S, NEURATH M F. Interleukin-6:A key regulator of colorectal cancer development[J]. Int J Biol Sci, 2012, 8(9): 1248-1253. DOI:10.7150/ijbs.4614 |
| [16] |
CUI J D, MO J M, LUO M, et al. C-Myc-activated long non-coding RNA H19 downregulates miR-107 and promotes cell cycle progression of non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2015, 8(10): 12400-12409. |
| [17] |
TSANG W P, NG E K, NG S S, et al. Oncofetal H19-derived miR-675 regulates tumor suppressor RB in human colorectal cancer[J]. Carcinogenesis, 2010, 31(3): 350-358. DOI:10.1093/carcin/bgp181 |
| [18] |
AKAO Y, NAKAGAWA Y, NAOE T. Let-7 microRNA functions as a potential growth suppressor in human colon cancer cells[J]. Biol Pharm Bull, 2006, 29(5): 903-906. DOI:10.1248/bpb.29.903 |
| [19] |
KALLEN A N, ZHOU X B, XU J, et al. The imprinted H19 lncRNA antagonizes let-7 microRNAs[J]. Mol Cell, 2013, 52(1): 101-112. DOI:10.1016/j.molcel.2013.08.027 |
| [20] |
SAMPSON V B, RONG N H, HAN J, et al. MicroRNA let-7a down-regulates MYC and reverts MYC-induced growth in Burkitt lymphoma cells[J]. Cancer Res, 2007, 67(20): 9762-9770. DOI:10.1158/0008-5472.CAN-07-2462 |
 2020, Vol. 46
2020, Vol. 46


