扩展功能
文章信息
- 王叶, 王红, 张书剑, 姬华祎, 金正勇
- WANG Ye, WANG Hong, ZHANG Shujian, JI Huayi, JING Zhengyong
- 谷氨酰胺通过内质网应激途径对新生大鼠高氧肺损伤的保护作用
- Protective effect of glutamine on hyperoxic lung injury of neonatal rats through endoplasmic reticulum stress pathway
- 吉林大学学报(医学版), 2020, 46(01): 7-13
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 7-13
- 10.13481/j.1671-587x.20200102
-
文章历史
- 收稿日期: 2018-12-08
2. 吉林大学中日联谊医院儿科, 吉林 长春 130033
2. Department of Pediatrics, China-Japan Union Hospital, Jilin University, Changchun 130021, China
随着新生儿重症监护技术的提高,因补充氧引起氧化应激损伤导致肺损伤的发生率逐年升高,因其远期预后差,严重影响患儿身心健康及生存质量,逐渐受到国内外专家学者的广泛关注。高氧肺损伤的机制复杂,尚不十分明确,目前国内外研究认为其与炎症反应、氧化应激反应和细胞凋亡等通路作用有密切关联[1-2], 其中内质网应激(endoplasmic reticulum stress,ERS)信号通路相关蛋白凋亡在高氧肺损伤中发挥重要作用[3-4],国内外很多研究[5-6]已证实谷氨酰胺(glutamine, GLN)对肺损伤具有保护作用,但其具体机制尚未完全清楚, 且目前有关GLN对新生大鼠高氧肺损伤的保护作用及其机制的研究很少。本研究通过构建新生大鼠高氧肺损伤模型,以模拟临床上新生儿长期暴露于高氧致肺损伤,探讨CLN对高氧肺损伤模型大鼠肺组织中ERS信号通路相关标志性蛋白超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、半胱氨酸蛋白酶12(Caspase-12)、生长停滞和DNA损害基因153 (growth arrestand DNA damage-inducible gene 153,GADD153)、葡萄糖调节蛋白78(glucose regulation protein 78, GRP78)、B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达的影响及作用机制,为临床应用GLN防治新生儿高氧肺损伤提供有效的理论依据。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器足月新生Wistar大鼠90只(雌雄不限)和哺乳母鼠,由延边大学动物科提供,动物许可证号:SYXK(吉)2007-0011。GLN(美国Sigma-Aldrich公司),GADD153、GRP78、Caspase-12、Bax和Bcl-2抗体(圣克鲁斯上海生物技术有限公司),SOD和MDA试剂盒(南京建成生物工程研究所)。液氮机由延吉市畜牧局冷冻站提供,TGL-16低速离心机购自湘仪实验室仪器开发有限公司,TD2000彩色病理图像分析仪购自北京天地百年科技有限责任公司。
1.2 高氧肺损伤模型制备足月新生Wistar大鼠90只随机分为对照组、高氧组和高氧+GLN组,每组30只。对照组大鼠在同一室内呼吸常压空气,将高氧组和高氧+GLN组大鼠放在材质相同的玻璃箱内,每天用数字式测氧仪测氧浓度3次,使玻璃箱内氧浓度维持在85%以上,玻璃箱内氧浓度保持一致,在玻璃箱底部加入钠石灰吸收二氧化碳,使室内及玻璃箱内温度稳定在25℃~26℃,湿度维持在60%~70%,每天开箱5 min,记录2组大鼠一般情况,更换垫料,及时加水和饲料。同时对照组和高氧+GLN组母鼠交换,防止母鼠因高氧影响新生鼠喂养及护理导致的实验误差。从实验第1天开始,定时向高氧+GLN组新生大鼠腹腔内注射GLN(0.75g·kg-1·d-1),同时将等剂量生理盐水注射于另外2组新生大鼠相同部位。
1.3 标本采集和处理各组大鼠分别于第3、7和14天采用10%水合氯醛0.7 mL灌肠麻醉,剪开胸腔,完全暴露出心和肺,取右侧肺组织置于-70℃冰箱内保存,用于检测肺组织中SOD活性,MDA水平,GADD153、GRP78、Caspase-12、Bcl-2和Bax蛋白表达水平;留取部分左侧肺组织计算干湿质量比,部分左侧肺组织浸泡于4%多聚甲醛溶液中24 h,然后进行脱水、透明、包埋和切片,行HE染色, 观察大鼠肺组织中肺泡大小、间隔及炎性细胞浸润等形态表现。
1.4 大鼠肺组织含水量测定留取部分左侧肺组织,并用医用棉清洁后立即称量,记为湿质量(W)。放入60℃烤箱内每天称量,持续2 d未见质量变化,记为肺组织干质量(D)。用Elliot公式计算肺组织含水量:[(W-D)/W]×100%,记录结果。
1.5 大鼠肺组织中SOD活性和MDA水平检测取适量左侧肺组织称质量,制备成10%的匀浆液,2500~3000 r·min-1离心10 min后取上清液待测。采用氯化硝基四氮唑蓝(NBT)法测定肺组织中SOD活性,硫代巴比妥酸(TBA)法测定肺组织中MDA水平,按照SOD和MDA检测试剂盒说明书操作,并记录数值, 单位分别为mg·g-1和μmol·g-1。
1.6 采用蛋白免疫印迹(Western blotting)法检测大鼠肺组织中Caspase-12、GRP78、GADD153、Bcl-2和Bax蛋白表达水平取保存的肺组织于液氮低温下磨碎,加入含有裂解缓冲液和苯甲基磺酰氟的EP管中,充分裂解离心后,按步骤操作,包括蛋白提取、蛋白浓度测定、SDS-PAGE凝胶配制、上样、电泳、转膜、封闭和抗体反应。X光片曝光后显影、定影和晾干。图像经扫描后用Image J软件计算目的蛋白条带灰度值与β-actin条带灰度值的比值,即目的蛋白的相对表达水平。
1.7 统计学分析采用SPSS20.0统计软件进行统计学分析。大鼠体质量,大鼠肺组织中SOD活性和MDA水平,大鼠肺组织中Caspase-12、GRP78、GADD153、Bcl-2和Bax蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 不同时间各组大鼠体质量实验第3、7和14天,与同时间对照组比较,高氧组大鼠体质量明显降低(P<0.05);与高氧组比较,高氧+GLN组大鼠体质量明显升高(P<0.05)。见表 1。
| (n=10, x±s, m/g) | |||
| Group | Body weight | ||
| (t/d) 3 | 7 | 14 | |
| Control | 11.70±1.51 | 18.34±1.56 | 33.17±1.40 |
| Hyperoxia | 9.22±0.57* | 14.33±1.60* | 29.84±1.59* |
| Hyperoxia+GLN | 10.54±0.77△ | 15.64±1.73△ | 32.37±1.88△ |
| F | 14.44 | 15.71 | 11.30 |
| P | <0.01 | <0.01 | <0.01 |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | |||
实验第3、7和14天,与对照组比较,高氧组大鼠肺组织含水量明显升高(P<0.05),且高氧暴露时间越长,肺组织含水量升高越明显;与高氧组比较,高氧+GLN组大鼠肺组织含水量明显降低(P<0.05)。见表 2。
| (n=10, x±s, η/%) | |||
| Group | Water content | ||
| (t/d) 3 | 7 | 14 | |
| Control | 5.59±0.44 | 5.68±0.38 | 5.85±0.42 |
| Hyperoxia | 6.26±0.33* | 6.78±0.39* | 7.26±0.75* |
| Hyperoxia+GLN | 5.69±0.55△ | 6.20±0.29△ | 6.60±0.54△ |
| F | 6.478 | 23.310 | 11.270 |
| P | <0.01 | <0.01 | <0.01 |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | |||
对照组大鼠肺组织结构规则,未见肺泡水肿,肺泡大小及肺泡间隔大致一致,无炎性细胞浸润;高氧组大鼠肺组织中支气管及肺泡上皮细胞肿胀,肺泡管腔增大,间质细胞水肿,可见炎性细胞浸润及纤维渗出;与同时间高氧组比较,高氧+ GLN组大鼠肺组织中肺泡损伤程度、炎性渗出及纤维组织增生程度均减轻,介于高氧组和对照组之间。见图 1(插页一)。
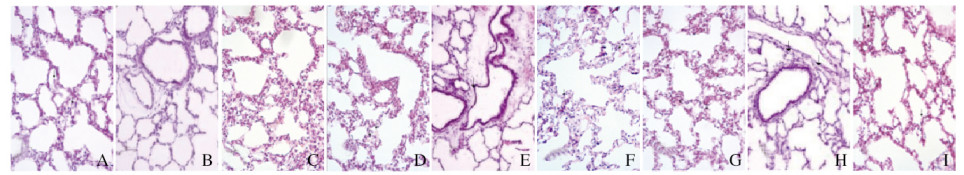
|
| A-C: Control group; D-F: Hyperoxia group; G-I: Hyperoxia+GLN group: A, D, G: 3 d; B, E, H: 7 d: C, F, I: 14 d. 图 1 不同时间各组大鼠肺组织病理形态表现(HE, ×200) Fig. 1 Pathomorphology of lung tissue of rats in various groups at different time (HE, ×200) |
|
|
实验第3、7和14天,与对照组比较,高氧组大鼠肺组织中SOD活性明显降低(P<0.05),MDA水平明显升高(P<0.05);与高氧组比较,高氧+GLN组大鼠肺组织中SOD活性明显升高(P<0.05),MDA水平明显降低(P<0.05)。见表 3。
| (n=10, x±s) | |||||||
| Group | SOD[wB/(mg·g-1)] | MDA[mB/(μmol·g-1)] | |||||
| (t/d) 3 | 7 | 14 | 3 | 7 | 14 | ||
| Control | 95.76±1.63 | 104.17±1.54 | 109.52±1.75 | 1.62±0.10 | 1.83±0.16 | 1.87±0.18 | |
| Hyperoxia | 58.99±1.88* | 53.79±1.62* | 51.45±1.87* | 3.35±0.08* | 4.96±0.40* | 5.98±0.28* | |
| Hyperoxia+GLN | 89.04±1.72△ | 85.28±1.92△ | 80.54±1.69△ | 2.66±0.13△ | 3.58±0.17△ | 3.84±0.35△ | |
| F | 66.300 | 156.700 | 2 686.000 | 4.006 | 344.100 | 543.300 | |
| P | <0.01 | <0.01 | <0.01 | 0.01 | <0.01 | <0.01 | |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | |||||||
与同时间对照组比较,高氧组大鼠肺组织中Caspase-12、GRP78、GADD153和Bax蛋白表达水平明显升高(P<0.05),Bcl-2蛋白表达水平和Bcl-2/Bax比值明显降低(P<0.05);与高氧组比较,高氧+GLN组大鼠肺组织中Caspase-12、GRP78、GADD153和Bax蛋白表达水平明显降低(P<0.05),Bcl-2蛋白表达水平和Bcl-2/Bax比值明显升高(P<0.05)。见图 2和表 4~6。
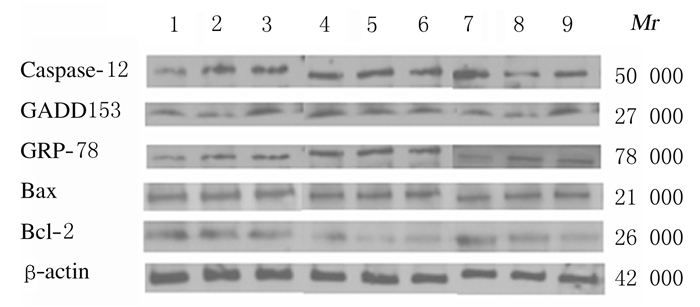
|
| Lane 1-3 :Control group;Lane 4-6 :Hyperoxia group; Lane 7-9:Hyperoxia+GLN group; Lane 1,4,7:3 d; Lane 2,5,8:7 d ;Lane 3,6,9:14 d. 图 2 不同时间各组大鼠肺组织中ERS信号通路相关蛋白表达电泳图 Fig. 2 Electrophoregram of ERS signal pathway-related proteins in lung tissue of rats in various groups at different time |
|
|
| (n=10, x±s) | ||||||
| Group | Caspase-12 | GRP78 | GADD153 | Bcl-2 | Bax | Bcl-2/Bax |
| Control | 0.72±0.06 | 0.70±0.03 | 0.79±0.03 | 0.78±0.01 | 0.75±0.03 | 1.02±0.04 |
| Hyperoxia | 1.01±0.04* | 0.98±0.03* | 0.98±0.02* | 0.61±0.04* | 0.91±0.02* | 0.67±0.03* |
| Hyperoxia+GLN | 0.81±0.05△ | 0.81±0.02△ | 0.82±0.02△ | 0.71±0.03△ | 0.81±0.03△ | 0.86±0.01△ |
| F | 10.744 | 3.628 | 5.483 | 20.936 | 9.530 | 354.200 |
| P | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | ||||||
| (n=10, x±s) | ||||||
| Group | Caspase-12 | GRP78 | GADD153 | Bcl-2 | Bax | Bcl-2/Bax |
| Control | 0.74±0.04 | 0.75±0.04 | 0.78±0.05 | 0.80±0.01 | 0.79±0.04 | 1.01±0.04 |
| Hyperoxia | 1.11±0.06* | 1.03±0.02* | 1.05±0.03* | 0.55±0.03* | 0.95±0.03* | 0.57±0.02* |
| Hyperoxia+GLN | 0.87±0.02△ | 0.88±0.02△ | 0.88±0.02△ | 0.67±0.01△ | 0.86±0.01△ | 0.76±0.01△ |
| F | 5.822 | 4.764 | 3.653 | 45.850 | 6.024 | 695.700 |
| P | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
| * P<0.05 compared with control group;△ P<0.05 compared with hyperoxia group. | ||||||
| (n=10, x±s) | ||||||
| Group | Caspase-12 | GRP78 | GADD153 | Bcl-2 | Bax | Bcl-2/Bax |
| Control | 0.73±0.02 | 0.78±0.03 | 0.80±0.06 | 0.81±0.02 | 0.82±0.01 | 0.98±0.01 |
| Hyperoxia | 1.20±0.02* | 1.11±0.02* | 1.12±0.02* | 0.50±0.02* | 1.04±0.01* | 0.49±0.02* |
| Hyperoxia+GLN | 0.91±0.06△ | 0.91±0.03△ | 0.91±0.03△ | 0.63±0.02△ | 0.90±0.03△ | 0.69±0.01△ |
| F | 12.740 | 5.135 | 9.653 | 126.856 | 55.416 | 3035.000 |
| P | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
| * P<0.05 compared with control group; △ P<0.05 compared with hyperoxia group. | ||||||
GLN是一种必需氨基酸,作为人体内最丰富的游离氨基酸,其作用包括提供最广泛的能量、提高免疫系统功能及参与DNA合成、细胞增殖和组织修复等[7-8]。本研究通过构建新生大鼠高氧肺损伤模型模拟人类新生儿支气管肺发育不良(Bronchopulmonary dysplasia,BPD)典型病理生理改变,结果显示:第3、7和14天时,高氧组大鼠肺组织HE染色均出现典型高氧肺损伤病理生理表现,与甘燕子等[9]研究一致,表明本实验高氧肺损伤模型构建成功。
本研究中高氧组和高氧+GLN组大鼠体质量较对照组均降低,高氧组大鼠体质量降低更明显,表明高氧环境可导致新生鼠及幼鼠生长发育落后,生长延迟,与国内相关学者研究一致[10];而GLN治疗组新生大鼠较同时间高氧大鼠组体质量增加,表明GLN对高氧导致的新生大鼠体质量下降有一定的缓解作用。高浓度氧可引起肺内皮细胞及上皮细胞损伤,破坏肺泡上皮细胞完整性,进而导致肺水肿[11]。本研究结果显示:高氧组和高氧+GLN组大鼠均有不同程度肺水肿,高氧+GLN组大鼠肺水肿程度减轻,表明GLN对高氧导致的肺部水肿具有缓解作用。本研究结果显示:与对照组比较,高氧组大鼠肺泡结构存在一定程度的破坏,在高氧中暴露时间越长,损伤程度越重;与高氧组比较,高氧+GLN组大鼠肺泡损伤程度和炎性渗出等均减轻。本研究结果表明:高浓度氧可导致大鼠肺损伤,出现炎症性改变,与部分研究[12-14]结果相一致,而GLN对高氧导致的肺损伤可起到一定程度的保护作用。
ERS时,可产生MDA,过量自由基生成MDA等脂质过氧化产物及新的自由基,并可链式反应放大损害作用,引起细胞代谢功能障碍和死亡[15]。SOD可通过减少自由基的产生,保护机体所受损伤[16]。本研究结果显示:在高氧中长时间暴露后,新生大鼠肺组织中SOD活性明显降低同时MDA水平明显升高,原因可能与高氧后肺组织产生多量氧化产物,导致抗氧化物质过度消耗有关,表明高氧改变了新生鼠氧化防御,与有关学者研究结果相一致[17];而加入GLN治疗后大鼠肺组织中SOD活性升高,MDA水平降低,表明GLN对细胞凋亡起到干预作用, 与李松涛等[18]研究结果一致,进一步验证GLN在保护高氧肺损伤、阻止细胞凋亡方面起重要作用。
GRP78是ERS的标志性蛋白,其表达水平与内质网的稳态有关,ERS时机体通过增加GRP78的表达减轻炎症反应[19]。C/EBP同源蛋白(CHOP)/GADD153是ERS介导的凋亡通路之一,是诱导细胞凋亡重要的转录因子。CADD153在生理状态下表达水平较低,ERS时以CADD153的表达水平增加为标志[20]。Caspase-12只在ERS通路中被激活, 是ERS的标志性分子[21]。ERS时Caspase-12被激活,Caspase家族的级联反应被启动后促进细胞凋亡的发生,Caspase-12表达水平增加可作为ESR的特异性标志。JNK介导的凋亡可通过线粒体途径上调促凋亡蛋白Bax,或经由死亡受体蛋白发生作用,或者可通过降低Bcl-2的表达直接促凋亡[22]。本研究结果显示:与对照组比较,高氧组大鼠肺组织中Caspase-12、GRP78、GADD153和Bax蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低;与高氧组比较,高氧+GLN组大鼠肺组织中Caspase-12、GRP78、GADD153和Bax蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高。本研究结果表明:高氧诱导的细胞凋亡启动了ERS,通过大鼠体质量变化、肺组织含水量、肺组织病理变化以及肺组织中SOD活性和MDA水平变化证实GLN对高氧诱导的肺损伤具有保护作用;同时通过检测ERS相关的标志性蛋白表达的结果,证明GLN可通过ERS途径对高氧诱导的大鼠肺组织损伤起到保护作用, 与有关研究[23-24]结果相一致。
综上所述,腹腔注射GLN可减轻高氧诱导新生大鼠肺水肿及肺泡结构损伤破坏,其对细胞凋亡的抑制作用是通过调节SOD活性和MDA水平及影响ERS相关标志性分子的表达而实现的。GLN通过ERS途径对高氧诱导的新生大鼠肺损伤发挥保护作用。
| [1] |
张喆, 曹大伟, 张新日. 高氧肺损伤机制研究紧张[J]. 国际呼吸杂志, 2018, 38(6): 461-464. DOI:10.3760/cma.j.issn.1673-436X.2018.06.014 |
| [2] |
郑潇玥, 陈晓. 氧化应激在重症新生儿高氧肺损伤中的作用研究进展[J]. 南昌大学学报(医学版), 2016, 56(1): 92-95. |
| [3] |
王琴, 董文斌, 车忠丽, 等. 内质网应激与高氧诱导早产大鼠肺损伤的作用[J]. 临床儿科杂志, 2014, 32(12): 1171-1175. DOI:10.3969/j.issn.1000-3606.2014.12.24 |
| [4] |
张旋, 邓立普. 内质网应激与急性肺损伤的研究紧张[J]. 蛇志, 2016, 28(4): 491-493. DOI:10.3969/j.issn.1001-5639.2016.04.052 |
| [5] |
WISCHMEYER P E, KAHANA M, WOLFSON R, et al. Glutamine induces heat shock protein and protects against endotoxin shock in the rat[J]. J App1 Physiol, 2001, 90(6): 2403-2410. DOI:10.1152/jappl.2001.90.6.2403 |
| [6] |
高强, 相茹, 徐莉莉, 等. 谷氨酰胺对急性肺损伤患者的保护作用与机制研究[J]. 川北医学院学报, 2017, 32(2): 224-226. DOI:10.3969/j.issn.1005-3697.2017.02.021 |
| [7] |
YUNEVA M, ZAMBONI N, OEFNER P, et al. Deficiency in glutamine but not glucose induces MYC-dependent apoptosis in human cells[J]. J Cell Biol, 2007, 178(1): 93-105. DOI:10.1083/jcb.200703099 |
| [8] |
ANDREWS P J, AVENELL A, NOBLE D W, et al. Randomised trial of glutamine, selenium, or both, to supplement parenteral nutrition for critically ill patients[J]. BMJ, 2011, 342: d1542. DOI:10.1136/bmj.d1542 |
| [9] |
甘燕子, 郝锦丽, 曾其毅, 等. 高氧诱导新生鼠肺上皮细胞凋亡损伤与肺表面活性蛋白的变化[J]. 临床儿科杂志, 2015, 33(9): 817-821. DOI:10.3969/j.issn.1000-3606.2015.09.015 |
| [10] |
宁巍, 李静, 漆秀洁, 等. 高氧致SD大鼠年龄相关的肺损伤及可能机制[J]. 上海交通大学学报(医学版), 2016, 36(11): 1562-1567. DOI:10.3969/j.issn.1674-8115.2016.11.005 |
| [11] |
CARNESECCHI S, DEFFERT C, PAGANO A, et al. NADPH oxidase-1 plays a crucial role in hyperoxia-induced acute lung injury in mice[J]. Am J Respir Crit Care Med, 2009, 180(10): 972-981. DOI:10.1164/rccm.200902-0296OC |
| [12] |
丁璐, 吴本清, 黄进洁, 等. 促红细胞生成素对新生大鼠高氧肺损伤细胞凋亡的影响[J]. 中国当代儿科杂志, 2010, 12(7): 576-579. |
| [13] |
苏立明, 金正勇, 许春花, 等. 异丙酚注射液和微量肝素对新生大鼠高氧肺损伤的影响[J]. 中国妇幼保健杂志, 2015, 30(1): 144-147. |
| [14] |
赵瑜, 岳彩虹, 曹海丽, 等. 上调miR-24对急性肺损伤幼龄大鼠炎症反应的影响及作用机制[J]. 西安交通大学学报(医学版), 2019, 40(5): 684-689. |
| [15] |
NEW K J, REILLY M E, TEMPLETON K, et al. Free radical-mediated lipid peroxidation and systemic nitric oxide bioavailability:implications for postexercise hemodynamics[J]. Am J Hypertens, 2013, 26(1): 126-134. DOI:10.1093/ajh/hps025 |
| [16] |
李园园, 张光亚, 陈凤玲. GRP78基因过表达载体的构建及在人脐静脉内皮细胞的表达[J]. 上海交通大学学报(医学版), 2016, 36(6): 803-808. DOI:10.3969/j.issn.1674-8115.2016.06.004 |
| [17] |
董欣鑫, 姚兰, 方芳, 等. 神经肽P物质对高氧损伤肺泡Ⅱ型上皮细胞氧化/抗氧化状态的影响[J]. 中国生物制品学杂志, 2013, 26(4): 486-490. |
| [18] |
李松涛, 李大鹏, 李松琳. 外源性谷氨酰胺在机体氧化应激中的抗氧化作用[J]. 实用医药杂志, 2018, 35(3): 245-248. |
| [19] |
LI C, HARADA A, OH Y. IGFBP-3 sensitizes antiestrogen-resistant breast cancer cells through interaction with GRP78[J]. Cancer Lett, 2012, 325(2): 200-206. DOI:10.1016/j.canlet.2012.07.004 |
| [20] |
KIMURA K, JIN H, OGAWA M, et al. Dysfunction of the ER chaperone BiP accelerates the renal tubular injury[J]. Biochem Biophys Res Commun, 2008, 366(4): 1048-1053. DOI:10.1016/j.bbrc.2007.12.098 |
| [21] |
WENG S, ZHU X, JIN Y, et al. Protective effect of erythropoietin on myocardial infarction in rats by inhibition of caspase-12 expression[J]. Exp Ther Med, 2011, 2(5): 833. DOI:10.3892/etm.2011.280 |
| [22] |
臧韵, 张学武. 内质网应激介导肿瘤细胞凋亡的研究进展[J]. 时珍国医国药, 2014, 25(8): 1933-1934. |
| [23] |
张向颖, 任锋. 内质网应激在肝衰竭发病机制中的作用[J]. 临床肝胆病杂志, 2019, 35(9): 1920-1923. DOI:10.3969/j.issn.1001-5256.2019.09.006 |
| [24] |
李红子, 金正勇, 金梅花, 等. 谷氨酰胺对产生内质网应激反应的A549细胞JKN, Pjnk, CHOP, GRP78表达水平的影响[J]. 延边大学医学学报, 2018, 41(2): 91-93. |
 2020, Vol. 46
2020, Vol. 46


