扩展功能
文章信息
- 李友筑, 颜晓红, 吴荣锋, 陶萍, 程玲, 叶圆圆, 周卫东
- LI Youzhu, YAN Xiaohong, WU Rongfeng, TAO Ping, CHENG Ling, YE Yuanyuan, ZHOU Weidong
- 序贯培养体系和单一培养体系对人卵母细胞受精和早期胚胎发育的影响
- Effects of sequential and single-step culture media systems on human oocyte fertilization and early embryo development
- 吉林大学学报(医学版), 2020, 46(01): 1-6
- Journal of Jilin University (Medicine Edition), 2020, 46(01): 1-6
- 10.13481/j.1671-587x.20200101
-
文章历史
- 收稿日期: 2019-03-29
体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)是目前治疗不孕症最常用的人类辅助生殖技术(assisted reproductive technology,ART)。自1978年英国的医学工作者利用IVF-ET技术让1例不孕症女性患者成功怀孕并诞生世界上第一例“试管婴儿”以来,IVF-ET技术在世界各国广泛应用于不孕症的治疗。目前,世界范围内每年开展的IVF助孕周期总数已超过百万[1]。如何获得更为优质的可移植胚胎是生殖医学临床医师和胚胎学家们一直关注的热点问题,特别是近年来随着单胚胎移植理念的不断推广,对于移植胚胎的质量提出了更高的要求。胚胎培养是IVF-ET治疗中极为关键的环节,与IVF治疗结局有着密切关系[2]。胚胎培养液是胚胎培养体系中与胚胎关系最为密切、接触时间最长的组成部分。目前商业化供应的人类胚胎培养液主要有序贯培养液(sequential culture medium)和单一培养液(single step culture medium)。目前常用的序贯培养液有Vitrolife、Cook和Quinne’ s等系列产品,而单一培养液有Global和Irvine等系列产品。近年来,研究者对不同培养液体系中胚胎发育的情况进行了初步探索,但主要是研究不同序贯培养液体系对胚胎生长发育的影响[3-4]。MORBECK等[5]比较了不同序贯培养液和单一培养液的组分差异及对小鼠囊胚形成的影响。目前,关于序贯培养体系和单一培养体系对胚胎生长影响的比较还鲜有报道。鉴于上述2种培养体系设计理念的差异及各自的优势,本研究比较分析了Vitrolife的序贯培养液体系和Irvine的单一培养液体系对人类早期胚胎发育的影响,为人类ART中胚胎培养体系的选择和评估提供参考。
1 资料与方法 1.1 研究对象选取2017年3月-2018年1月于本院生殖医学中心行体外受精/卵胞质内单精子显微注射(IVF/ICSI)助孕的患者155例,平均年龄(29.91±4.03)岁,每例患者获卵数≥8枚。同一个患者的卵子分为2组,分别在2种培养体系中进行体外受精和胚胎培养,2组的卵子数基本相同。序贯培养组:体外受精和胚胎在序贯培养体系G-IVF/G1/G2(G-IVF plus、G1 plus和G2 plus培养液,瑞典Vitrolife公司)中培养;单一培养组:体外受精和胚胎在单一培养体系(CSCC培养液,美国Irvine Scientific公司)中培养。
1.2 卵母细胞的收集及培养采用阴道B超引导下卵泡穿刺取卵,抽取所有直径≥10 mm卵泡。取卵日男方手淫取精获取精液,并根据患者情况行常规IVF或ICSI方式授精。授精后16~20 h(第1天,D1)倒置显微镜下观察受精情况,并记录原核(PN)数目:双原核(2PN)为正常受精;单原核(1PN)受精和≥3PN为多PN受精,均为异常受精。第2天(D2)和第3天(D3)评估卵裂期胚胎形态,记录胚胎数;第5天(D5)和第6天(D6)评估囊胚期胚胎形态,记录胚胎数。
1.3 胚胎在不同培养体系中的培养对于序贯培养体系,卵母细胞于G-IVF plus培养液中行受精,卵裂期胚胎于G1 plus培养液中37℃、6% CO2及饱和湿度下培养;D3转入G2 plus培养液中置于37℃、6% CO2、5%O2及饱和湿度下行囊胚培养。对于单一培养体系,卵母细胞从受精、卵裂期及囊胚期,均在CSCC培养液中培养。受精和卵裂期胚胎均于37℃、6% CO2及饱和湿度下培养;D3更换新培养液,转入37℃、6% CO2、5%O2及饱和湿度下行囊胚培养。
1.4 胚胎评估标准本研究D3优质胚胎标准:D1为2PN,细胞数≥6(含桑葚胚),卵裂球大小均匀或略不均匀,形态规则或略不规则,无碎片或<10%;D3可用胚胎标准:D1为2PN,细胞数≥6(含桑葚胚),细胞碎片<40%。根据Gardner评分标准[6]对囊胚进行评估,D5或D6可用囊胚标准:对于扩张期囊胚(3期)内细胞团和外滋养层细胞评级为A或B的囊胚;对于完全扩张囊胚(4期)、孵化囊胚(5期)和已孵出囊胚(6期)外滋养层细胞评级为A或B的囊胚。
1.5 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组患者受精率、2PN受精率、多核受精率、卵裂率、可用胚胎率、优质胚胎率、胚胎致密化率、囊胚形成率和可用囊胚形成率均以百分率(%)表示,2组间比较采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 2种培养体系胚胎形态表现在G1培养体系中,胚胎形态表面光滑、均匀(图 1A和B,见插页一);在CSCC培养体系中胚胎表面较为粗糙、有颗粒状(图 1C和D,见插页一)。在CSCC培养体系中,D2和D3阶段有高于10%比例的胚胎出现致密化现象(图 1E和F,见插页一),而在G1培养体系中,D2和D3胚胎致密化比例低于2%。
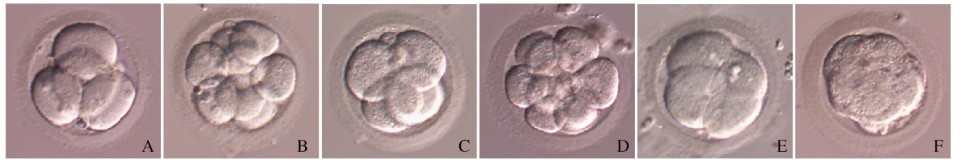
|
| A, B: Embryo cultured in G1 plus: C-F: Embryo cultured in CSCC: A, C, E: D2; B, D, F: D3. 图 1 不同培养时间序贯培养体系和单一培养体系中胚胎形态表现(×200) Fig. 1 Morphology of embryos in single-step and sequential culture media systems at different culture time(× 200) |
|
|
本研究共有155例患者,其中IVF 123例,ICSI 32例,序贯培养组和单一培养组培养体系的卵母细胞来自于相同患者。在IVF中,序贯培养组有921枚卵母细胞,单一培养组有935枚卵母细胞;在ICSI中,序贯培养组有244枚卵母细胞[其中减数第二次分裂中期(MⅡ)卵201枚],单一培养组有234枚卵母细胞(其中MⅡ卵198枚)。单一培养组的受精率和2PN受精率均略高于序贯培养组,但组间比较差异均无统计学意义(P>0.05)。单一培养组的多PN受精率略低于序贯培养组,但组间比较差异无统计学意义(P>0.05)。见表 1。
| [η/%(n/N)] | |||||
| Group | n | No. of oocytes | Fertilization rate | 2PN fertilization rate | Multi-nuclear fertilization rate |
| IVF | 123 | ||||
| Sequential culture | 921 | 76.11(701/921) | 69.60(641/921) | 5.21(48/921) | |
| Single-step culture | 935 | 77.01(720/935) | 70.27(657/935) | 4.92(46/935) | |
| ICSI | 32 | ||||
| Sequential culture | 244 | 71.64(144/201) | 67.66(136/201) | 2.99(6/201) | |
| Single-step culture | 234 | 79.29(157/198) | 74.75(148/198) | 2.02(4/198) | |
在IVF患者中,序贯培养组和单一培养组的卵裂率、可用胚胎率和优质胚胎率比较差异均无统计学意义(P>0.05);在ICSI患者中,序贯培养组和单一培养组的卵裂率和可用胚胎率比较差异均无统计学意义(P>0.05),但序贯培养组的优质胚胎率明显高于单一培养组(P=0.015)。IVF和ICSI患者,单一培养组D3胚胎致密化的比例均明显高于序贯培养组(P=0.001)。见表 2。
| [η/%(n/N)] | |||||
| Group | n | Cleavage rate | Quality embryo rate | High quality embryo rate | Embryo densification rate |
| IVF | 123 | ||||
| Sequential culture | 98.44(631/641) | 73.06(461/631) | 56.74(358/631) | 2.69(17/631) | |
| Single-step culture | 99.39(653/657) | 71.52(467/653) | 53.91(352/653) | 14.40(94/653) | |
| P | 0.097 | 0.537 | 0.308 | 0.001 | |
| ICSI | 32 | ||||
| Sequential culture | 100.00(136/136) | 72.06(98/136) | 60.29(82/136) | 1.47(2/136) | |
| Single-step culture | 98.65(146/148) | 63.70(93/146) | 45.89(67/146) | 11.64(17/146) | |
| P | 0.499 | 0.133 | 0.015 | 0.001 | |
在囊胚形成方面,序贯培养组的囊胚形成率和可用囊胚形成率高于单一培养组,但组间比较差异无统计学意义(P>0.05)。单一培养组D5可用囊胚形成的比例高于序贯培养组,序贯培养组D6可用囊胚形成的比例高于单一培养组,但组间比较差异无统计学意义(P>0.05)。见表 3。
| [η/%(n/N)] | ||||
| Group | Blastocyst formation rate | Available blastocyst formation rate | D5 available blastocyst formation rate | D6 available blastocyst formation rate |
| Sequential culture | 80.18(263/328) | 54.88(180/328) | 21.95(72/328) | 32.93(108/328) |
| Single-step culture | 75.06(310/413) | 49.39(204/413) | 23.00(95/413) | 26.39(109/413) |
自1978年ART开展并应用于临床以来,配子和胚胎培养技术得到了迅猛发展。胚胎体外培养是IVF-ET周期中的主要环节,其可直接影响胚胎体外发育甚至最终妊娠结局[7-8]。因此,一直以来,胚胎学家们期望通过改良胚胎体外培养体系来提高胚胎质量,进而改善IVF的结局。如何创建一种更为理想的胚胎培养体系一直是ART领域的研究热点,目前也尚未明确哪种胚胎培养液对IVF的成功率更高[9]。培养液对于胚胎体外培养至关重要,培养液的组分、各成分含量、配比、pH值和渗透压等均会影响胚胎的体外发育[5, 10]。20世纪80年代IVF和胚胎培养常用的培养液主要参照组织细胞的培养,因此并非理想的胚胎培养体系。近年来,胚胎培养体系有了较大改善,培养液的组成模拟了输卵管的成分及其浓度,从而更好地满足人类胚胎的需求[11]。随着胚胎体外培养液在IVF领域的成功应用,多种商业化供应的培养液陆续出现,目前商业化供应的胚胎体外培养液主要包括序贯培养液和单一培养液。序贯培养液遵循“回归自然”的理念,是根据胚胎在着床前对营养物质的不同需求以及生殖道内的自然环境研制出来的[12]。目前常用的Vitrolife系列培养液就是序贯培养液,主要包括受精液、卵裂液和囊胚培养液。单一培养液遵循“让胚胎来选择”的原则,将胚胎发育过程中需要的营养组合成一个配方,由胚胎自行选择需要的营养来摄取[13]。目前常用的Global和CSCC就是单一培养液,可以用于从合子到囊胚的培养。
本研究主要比较探讨了Vitrolife的序贯培养液体系和Irvine的单一培养液体系对人类早期胚胎发育的影响,结果显示:在受精率和2PN受精率上,Irvine的CSCC培养液稍高于Vitrolife的G-IVF培养液受精率,但组间比较差异无统计学意义。在卵裂率上,Irvine的CSCC培养液与Vitrolife的G1培养液组间比较差异无统计学意义;在D3可用胚胎率上,Irvine的CSCC培养液稍低于Vitrolife的G1培养液,但组间比较差异无统计学意义;在D3优质胚胎率上,Irvine的CSCC培养液稍低于Vitrolife的G1培养液,其中在ICSI组中差异具有统计学意义。
另外,本文作者还观察到:在G1培养体系中,胚胎形态表面光滑、均匀,而在CSCC培养体系中胚胎表面较为粗糙、有颗粒状。无论是IVF组还是ICSI组,在CSCC培养液中培养的胚胎,D3致密化胚胎的比例均明显高于在G1培养液培养的胚胎。CSCC中培养的胚胎其D3可用胚胎率和优胚胎率有低于在G1培养液中培养的趋势,原因也可能与CSCC中胚胎形态较为粗糙和不均匀造成评分时人为主观地降低评分标准有关。致密化是哺乳动物早期胚胎卵裂的重要特征,但其生物学作用尚不清楚。在IVF-ET中D3胚胎发生致密化不是常见的现象,一般情况下人类胚胎培养过程中第4天(D4)胚胎发生致密化是囊胚发育良好的指标,D3发生早期致密化是非典型的胚胎发育现象[14]。PEY等[15]研究发现:鼠胚细胞内钙离子浓度与胚胎致密化有关,并参与调控细胞骨架系统的功能和定位。另有研究[16]显示:胚胎细胞将长E-钙黏蛋白依赖丝状伪足扩展到邻近细胞是胚胎致密化所必需的,丝状伪足成分(E-钙黏蛋白、F-肌动蛋白和肌球蛋白-X等)的破坏可能影响细胞的致密化,肌凝蛋白-X过表达可以诱导小鼠胚胎过早发生致密化。刘秀凤等[17]研究提示:致密化胚胎与未致密化的优质胚胎比较具有相似的植入潜能。王建业等[18]研究显示:D3发生致密化的胚胎具有更好的发育潜能,可以作为IVF-ET中的优选胚胎。
在囊胚形成率上,Vitrolife的G2培养液囊胚形成率和可用囊胚形成率均稍高于Irvine的CSCC培养液,但组间比较差异均无统计学意义;另外,在CSCC中培养的囊胚,D5可用囊胚形成率高于在G2培养液中培养的囊胚;G2培养液中培养的囊胚D6可用囊胚形成率高于CSCC培养液,但差异均无统计学意义。综上,虽然Vitrolife的序贯培养液和Irvine的单一培养液设计理念上有所不同,各有所长,但在总体上2种培养体系中受精和胚胎早期发育无明显差别。
近年来,国内外学者也开始对人类胚胎在不同培养液体系中的发育情况进行了研究。实验室分析比较了GⅢ体系和Quinns体系中卵母细胞的体外受精和胚胎发育的差异,结果提示:Quinns系列培养液似乎有助于卵母细胞的体外受精,而GⅢ培养液体系更有利于胚胎的早期发育及后期的着床。2013年,BASILE等[19]应用实时动态观察系统观察75个赠卵周期中Global单一培养液和Quinns序贯培养液2种培养液体系中培养下的胚胎发育情况,结果显示:2种培养液体系中胚胎发育的各个参数、胚胎植入率和临床妊娠率比较差异均无统计学意义。2014年,顾军[20]探讨Earle’ s培养液和HTF培养液对胚胎质量和IVF-ET妊娠率的影响,结果显示:与Earle’ s培养液比较,采用HTF培养液培养可明显提高优质胚胎率、妊娠率和着床率。2016年,宋冰冰等[4]比较Vitrolife培养基与Cook培养基对胚胎生长与妊娠结局的影响,结果显示:2种培养基对2PN受精率、卵裂率、D3可用胚胎率和临床妊娠率的影响等差异均无统计学意义。SFONTOURIS等[21]在一项前瞻性随机研究中比较了Sage(Orion产品)和CSC(Irvine Scientific产品)2种商业化单一培养基对人类囊胚发育的差异,结果显示:两者在囊胚形成率、可用囊胚形成率和优质囊胚形成率方面均无明显差异。LÓPEZ-PELAYO等[22]比较了SAGE-1单一培养液和Vitrolife序贯培养液对人胚胎受精、发育和临床妊娠的影响,结果显示:2种培养液组受精率比较差异无统计学意义,但是在优质胚胎产量上,SAGE-1单一培养液组明显高于Vitrolife序贯培养液组;在种植率和临床妊娠率上2组培养液体系比较差异无统计学意义。
本研究结果显示:Vitrolife的序贯培养液体系和Irvine的单一培养液体系总体上对人类卵母细胞受精和早期胚胎发育的影响无明显差异,均能较好地应用于早期胚胎的体外培养。本研究结果为人类ART中胚胎培养体系的选择和评估提供参考。近年来,随着培养液的更新换代和更合适的培养室设计及空气处理,IVF的成功率有了较大的提高,但目前体外培养的胚胎着床率仍未能达到人们的高期望值,有待于进一步探索、优化和改善体外胚胎培养体系。此外,商品化的胚胎培养液组成成分的不同是否对子代的表观遗传学产生可遗传的影响,目前也尚不清楚,需要进一步研究。
| [1] |
COWARD K, WELLS D. Textbook of clinical embryology[M]. Cambridge: Cambridge University Press, 2013: 15.
|
| [2] |
CHRONOPOULOU E, HARPER JC. IVF culture media:past, present and future[J]. Hum Reprod Update, 2015, 21(1): 39-55. DOI:10.1093/humupd/dmu040 |
| [3] |
赵济华, 曹云霞. 两种不同培养体系对卵母细胞体外受精及胚胎体外发育的影响[J]. 安徽医科大学学报, 2005, 40(2): 157-160. DOI:10.3969/j.issn.1000-1492.2005.02.020 |
| [4] |
宋冰冰, 谢娟珂, 韦多, 等. Vitrolife与Cook培养基对胚胎生长与妊娠结局的影响[J]. 中华实用诊断与治疗杂志, 2016, 30(5): 443-445. |
| [5] |
MORBECK D E, KRISHER R L, HERRICK J R, et al. Composition of commercial media used for human embryo culture[J]. Fertil Steril, 2014, 102(3): 759-766. DOI:10.1016/j.fertnstert.2014.05.043 |
| [6] |
GARDNER D K, STEVENS J, SHEEHAN C B, et al. Morphological assessment of the human blastocyst. In:ELDER KT, COHEN J. Analysis of Human Embryo[M]. London: Informa Healthcare, 2007: 79-87.
|
| [7] |
CUTTING R, PRITCHARD J, CLARKE H, et al. Establishing quality control in the new IVF laboratory[J]. Hum Fertil(Camb), 2004, 7(2): 119-125. DOI:10.1080/14647270410001709188 |
| [8] |
GARDNER D K, KELLEY R L. Impact of the IVF laboratory environment on human preimplantation embryo phenotype[J]. J Dev Orig Health Dis, 2017, 8(4): 418-435. DOI:10.1017/S2040174417000368 |
| [9] |
MANTIKOU E, YOUSSEF M A, VAN WELY M, et al. Embryo culture media and IVF/ICSI success rates:A systematic review[J]. Hum Reprod Update, 2013, 19(3): 210-220. DOI:10.1093/humupd/dms061 |
| [10] |
MEINTJES M. Media composition:macromolecules and embryo growth[J]. Methods Mol Biol, 2012, 912: 107-127. |
| [11] |
GARDNER D K. Dissection of culture media for embryos:the most important and less important components and characteristics[J]. Reprod Fertil Dev, 2008, 20(1): 9-18. DOI:10.1071/RD07160 |
| [12] |
BIGGERS J D, SUMMERS M C. Choosing a culture medium:making informed choices[J]. Fertil Steril, 2008, 90(3): 473-483. DOI:10.1016/j.fertnstert.2008.08.010 |
| [13] |
MORBECK D E, BAUMANN N A, OGLESBEE D. Composition of single-step media used for human embryo culture[J]. Fertil Steril, 2017, 107(4): 1055-1060. DOI:10.1016/j.fertnstert.2017.01.007 |
| [14] |
ALPHA SCIENTISTS IN REPRODUCTIVE MEDICINE AND ESHRE SPECIAL INTEREST GROUP OF EMBRYOLOGY. The Istanbul consensus workshop on embryo assessment:proceedings of an expert meeting[J]. Hum Reprod, 2011, 26(6): 1270-1283. DOI:10.1093/humrep/der037 |
| [15] |
PEY R, VIAL C, SCHATTEN G, et al. Increase of intracellular Ca2+ and relocation of E-cadherin during experimental decompaction of mouse embryos[J]. Proc Natl Acad USA, 1998, 95(22): 12977-12982. DOI:10.1073/pnas.95.22.12977 |
| [16] |
FIERRO-GONZÁLEZ J C, WHITE M D, SILVA J C, et al. Cadherin-dependent filopodia control preimplantation embryo compaction[J]. Nat Cell Biol, 2013, 15(12): 1424-1433. DOI:10.1038/ncb2875 |
| [17] |
刘秀凤, 刘兰兰. IVF周期中第三天发生致密化胚胎的植入潜能分析[J]. 中国优生与遗传杂志, 2018, 26(8): 128-130. |
| [18] |
王建业, 刘海萍, 唐宁. 早期致密化对IVF-ET临床妊娠结局的影响[J]. 中国优生与遗传杂志, 2018, 26(4): 94-97, 129. |
| [19] |
BASILE N, MORBECK D, GARCÍA-VELASCO J, et al. Type of culture media does not affect embryo kinetics:a time-lapse analysis of sibling oocytes[J]. Hum Reprod, 2013, 28(3): 634-641. DOI:10.1093/humrep/des462 |
| [20] |
顾军. 两种培养基对胚胎质量和IVF-ET妊娠率的影响[J]. 中外医学研究, 2014, 12(27): 37-38. |
| [21] |
SFONTOURIS I A, KOLIBIANAKIS E M, LAINAS G T, et al. Blastocyst utilization rates after continuous culture in two commercial single-step media:a prospective randomized study with sibling oocytes[J]. J Assist Reprod Genet, 2017, 34(10): 1377-1383. DOI:10.1007/s10815-017-0997-0 |
| [22] |
LÓPEZ-PELAYO I, GUTIÉRREZ-ROMERO J M, ARMADA A I M, et al. Comparison of two commercial embryo culture media (SAGE-1 step single medium vs. G1-PLUSTM/G2-PLUSTM sequential media):Influence on in vitro fertilization outcomes and human embryo quality[J]. JBRA Assist Reprod, 2018, 22(2): 128-133. |
 2020, Vol. 46
2020, Vol. 46


