扩展功能
文章信息
- 熊芳, 龙梅芳, 叶小群
- xCT与肿瘤和肿瘤干细胞关系的研究进展
- Research progress in relationship between xCT and cancer and cancer stem cells
- 吉林大学学报(医学版), 2019, 45(06): 1459-1464
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1459-1464
- 10.13481/j.1671-587x.20190646
-
文章历史
- 收稿日期: 2019-01-08
胱氨酸/谷氨酸逆向转运体(cystine/glutamate antiporter system, system xc-)是氨基酸转运蛋白家族成员之一,其首先在体外培养的人二倍体成纤维细胞中被发现,随后在肝细胞和禽类培养细胞中也陆续发现,但尚未在昆虫来源的培养细胞中观察到。该转运体的主要功能性基团为胱氨酸/谷氨酸反向运输溶质载体家族7成员11(cystine/glutamate antiporter solute carrier family 7 member 11,SLC7A11),也称为xCT。多种转录因子、转录后修饰和microRNA等参与了xCT的调控。xCT通过转运胱氨酸进入胞浆内支持巯醇分子半胱氨酸和谷胱甘肽的生物合成,从而参与氧化应激调节。研究[1]证实:xCT在多种肿瘤细胞中高表达,与肿瘤的发生发展,尤其是与肿瘤耐药密切相关。近年来,xCT与肿瘤干细胞(cancer stem cells, CSC)的表面标记蛋白之间的关系受到广泛关注。
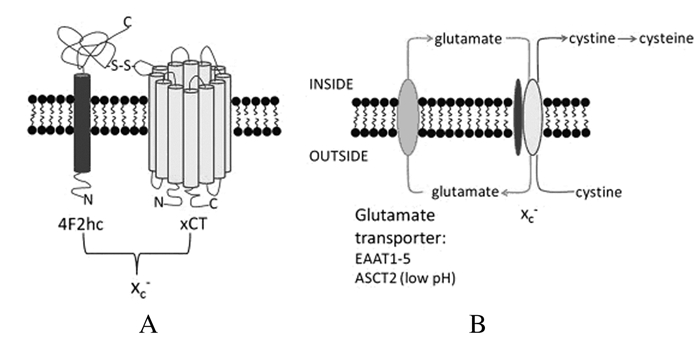
1 system xc-的生物学功能和结构system xc-是存在于细胞膜上逆向转运氨基酸的异源二聚体,其具有电中性及非钠离子(Na+)依赖性的特性。在生理条件下,将细胞外的胱氨酸转运入细胞内同时释放胞浆中的谷氨酸[1-2],进入胞浆内的胱氨酸可迅速还原成半胱氨酸用于谷胱甘肽(glutasthione, GSH)的合成,保护细胞免受氧化应激的伤害。system xc-由轻链xCT和重链4F2hc这2个亚基构成,亚基间通过细胞外的共价二硫键连接,system xc-转运功能的实现需要重链和轻链亚基的共同参与[3],其结构及功能见图 1。
|
| 图 1 system xc-的结构(A)和功能(B) Fig. 1 Structure(A) and function(B) of system xc- |
|
|
xCT是system xc-的轻链亚基,人类xCT基因位于4号染色体,包含14个外显子, 由502个氨基酸编码组成。xCT由12个高度疏水的通道跨膜蛋白构成,其N和C末端均位于胞浆内。xCT具有识别转运氨基酸差异的功能,呈现出氨基酸交换的特异性,主要负责胱氨酸/谷氨酸交换,是主要的功能基团。
4F2hc(也称为SLC3A2或CD98)是异二聚体氨基酸转运蛋白家族的共有亚基,是具有单个跨膜结构的Ⅱ型糖蛋白,N末端位于胞浆内,而具有高度糖基化的C末端位于胞浆外[1]。4F2hc存在于多种氨基酸转运系统的结构中,其本身不具有转运活性,主要作为伴侣蛋白,通过调节xCT的转运活性发挥作用。研究[4]证明:4F2hc的缺失可导致xCT蛋白表达水平的明显降低,提示4F2hc是维持xCT亚基稳定性的关键因素。
2 调控xCT的分子机制xCT的表达受到转录、转录后和翻译等多水平、多因素的调控。在转录水平,核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2,NRF2)、激活转录因子4(activating transcription factor 4,ATF4)、胰岛素样生长因子(insulin-like growth factors,IGFs)、肿瘤抑制基因p53和信号转导和转录激活因子3/5(signal transducer and activator of transcription 3/5, STAT3/STAT5)等参与了xCT的调控[5-8]。NRF2作为一种主要介导抗氧化反应的转录因子,在无应激情况下,NRF2在胞浆中与KEAP1结合,可被依赖KEAP1-Cullin3介导的泛素化和蛋白酶体降解[9];而在亲电子试剂和氧化应激的刺激下,NRF2与xCT启动子的抗氧化元件(antioxidant response elements,AREs)区域结合,诱导xCT表达[5]。ATF4是调控氧化还原平衡、氨基酸代谢和内质网应激的转录因子,在无应激条件下,ATF4 mRNA的翻译受到5′-非翻译区上游开放阅读框架(upstream open reading frames,uORFs)的抑制,从而不能与xCT基因启动子区域的氨基酸应答元件(amino acid response element s,AARE)结合,参与该基因的转录调节[10];当胞浆中氨基酸缺乏时,细胞可通过GCN2 -eIF2α-ATF4信号通路诱导xCT的转录和表达[6],同时NRF2与ATF4对xCT的转录调节并非相互独立。研究[11]显示:应激条件下,NRF2与ATF4相互作用并协调调节xCT表达。与NRF2和ATF4上调xCT转录作用相反,p53可抑制xCT表达,且其抑制作用与NRF2有关。研究[7]显示:突变型p53可通过削弱NRF2的功能抑制xCT表达。在转录后水平,xCT mRNA受到无义介导的mRNA降解(nonsense-mediated mRNA decay,NMD)的监管,导致xCT蛋白表达水平升高和GSH合成增多[12]。此外,xCT mRNA还受到miR-27a、miR-26b和miR-375等miRNA的直接调控[13-15]。
除了上述转录因子和转录后mRNA的调控,xCT也受到其他蛋白及翻译后修饰的调控。黏附分子CD44变体(CD44v)可与xCT亚基相互作用维持其蛋白表达水平[16];雷帕霉素靶蛋白复合体2 (mammalian target of rapamycin complex 2,mTORC2)磷酸化xCT细胞质尾部N末端的丝氨酸26位点,抑制xCT的转运活性[17]。此外,其伴侣蛋白亦可调节xCT亚基的转运活性[4]。
3 xCT与肿瘤细胞增殖、侵袭和转移xCT作为谷氨酸/胱氨酸逆向转运体的功能性基团,将细胞外的胱氨酸转运入细胞内。生理条件下,摄入细胞中的胱氨酸迅速还原成半胱氨酸用于GSH合成,在细胞氧化还原稳态中发挥关键作用;同时,胞浆中的谷氨酸被转运到细胞间隙。谷氨酸是人类20种非必需氨基酸中的一种,是谷氨酰胺的前体物质。研究[1]显示:依赖谷氨酰胺维持细胞功能是肿瘤代谢的标志之一,为了维持细胞内谷氨酰胺水平,肿瘤细胞过表达xCT以满足快速增殖的需求。目前,xCT在多种类型肿瘤中表达水平升高已得到证实。研究[1]显示:xCT与肿瘤的增殖和侵袭能力有关。JI等[18]研究证实:xCT的高表达与肺癌的晚期进展和患者5年生存率降低有关联,下调xCT表达可削弱非小细胞肺癌细胞体内外的增殖与侵袭能力。同时,xCT促进肿瘤细胞侵袭和增殖在前列腺肿瘤模型[19]中得到证实。ZHONG等[19]对165例前列腺癌患者和34例前列腺增生患者术后组织进行微阵列分析结果显示:xCT蛋白表达上调是侵袭性前列腺癌的一种临床特性,尤其是转移性癌症和(或)具有高Gleason评分的前列腺癌。此外xCT与肿瘤的转移也存在关联。xCT高表达可促进肿瘤转移,抑制或下调xCT的表达可阻碍上皮细胞间充质化(epithelial mesenchymal transition, EMT)过程,降低乳腺癌[20]和肝癌[21]的转移能力。研究显示:xCT的过表达与肝癌[22]、喉鳞状细胞癌[23]和口腔鳞状细胞癌[24]等多种恶性肿瘤的不良预后有关联,以上研究均表明xCT在肿瘤侵袭进展中起重要作用。
4 xCT与肿瘤耐药研究[4]证实:xCT在很多肿瘤组织和细胞中的高表达与system xc-转运体的转录活性呈正相关关系,导致胞浆中的GSH合成增多,该生理活动与肿瘤的放化疗耐药密切相关。相应的xCT调控基因活性上调,可保护肿瘤细胞免受活性氧(reactive oxygen species, ROS)、放疗和化疗的攻击,并调控细胞对治疗的反应[1, 4];耗竭胞浆内的半胱氨酸或xCT抑制剂能够有效逆转肿瘤耐药,使肿瘤细胞恢复放化疗敏感性[25]。
POLEWSKI等[26]在神经胶质瘤中进行的一项研究显示:xCT过表达可导致肿瘤细胞对氧化应激敏感性降低;下调xCT表达可增加基础ROS水平和降低细胞中GSH水平,引起氧化应激作用下的细胞凋亡。YE等[11]也证实xCT与肿瘤细胞的耐药相关,通过小干扰RNA或药物抑制剂来降低xCT表达可逆转膀胱癌T24细胞对蛋白酶体抑制剂硼替佐米的耐药性。通过调控xCT的转录、转录后及翻译水平靶向xCT可增加肿瘤细胞对多种治疗药物的敏感性[11, 13-14]。因此xCT是肿瘤耐药治疗的重要靶点之一。
5 xCT与CSC的关系CSC是指存在于肿瘤组织中的极小一部分具有干细胞性质的细胞群体,与正常组织干细胞一样,CSC具有自我更新和分化的能力,并能形成不同分化程度的肿瘤细胞,是肿瘤形成、增殖、复发、转移和耐药的主要原因[27]。与肿瘤细胞比较,CSC具有细胞中ROS水平低及抗氧化能力强等特性[28]。研究[16, 29]表明:CSC的表面标记物可稳定细胞膜上的xCT亚基,xCT也可促进CSC表面标记蛋白表达。
5.1 干细胞标记蛋白稳定xCT亚基CD44是一种跨膜蛋白,作为细胞中透明质酸的黏附分子。CD44主要分为标准和剪切变体(CD44) 2种形式,CD44标准型主要在间充质细胞中表达,与细胞外基质相互作用。CD44有多种变体形式,各变体之间的差别主要取决于剪切过程中插入的不同外显子。CD44对CSC的自我更新、干性维持、黏附和迁移等特性具有调控作用,是实体瘤CSC的标志物。同时,CD44v具有增强CSC抗氧化能力的作用,ISHIMOTO等[16]证实:CD44v 8-10可通过稳定细胞膜表面xCT转运蛋白促进GSH合成,从而降低细胞中ROS水平并促进癌细胞耐药。目前,通过CD44v-xCT轴增加CSC抗氧化能力的机制在胆管癌[30]、胃癌[31]、非小细胞肺癌[32]和膀胱癌[33]等患者肿瘤组织中已得到证实。上述研究表明干性表型对CSC的抗氧化系统存在促进作用,并很有可能与CSC耐药密切相关。
5.2 xCT促进CSC富集肿瘤细胞中xCT的表达与细胞的氧化还原状态密切相关,近年来,研究[29]显示:xCT对CSC表面标记物的表达与干细胞富集也有促进作用。POLEWSKI等[29]发现:xCT过表达的胶质瘤细胞形态和细胞骨架发生改变,并表现出CSC样特性,如干细胞标记蛋白Nanog、Musashi-1、Sox-2和Nestin的表达水平上调,同时伴有迁移、侵袭和细胞黏附能力的改变。LU等[34]证实化疗可通过诱导xCT表达促进GSH合成,间接激活多能干性因子Nanog从而富集乳腺癌CSC;下调xCT可阻断乳腺癌CSC的富集和肿瘤的发生。上述研究结果显示:xCT对CSC干性标记物的表达和干细胞富集有促进作用。
6 xCT在肿瘤筛查诊断中的价值system xc-是肿瘤细胞抵御氧化应激的机制之一,其持续供应胱氨酸用于半胱氨酸和GSH的合成,这为肿瘤的生长及存活提供了优势。研究[1]证实:xCT在肿瘤的增殖、生长与耐药中发挥重要作用。xCT mRNA或蛋白在多种肿瘤组织呈高水平表达,由于xCT亚基并不能区分出谷氨酸和半胱氨酸的衍生物与天然底物的差别,研究者[35-36]设计出一种新的18F-放射性标记的L-谷氨酸类似物(4S)-4-(3-18F-fluoropropyl)-L-glutamate(18F-FSPG, BAY 94-9392),用于评估system xc-转运体转运活性,联合正电子发射断层扫描(PET)可实现肿瘤的可视化成像,弥补18F-FDG的不足。目前,有关18F-FSPG作为一种新型PET放射性药物在肿瘤筛查诊断中价值的临床前试验正在肝癌[37]、脑肿瘤[38]、非小细胞肺癌和乳腺癌[39]等肿瘤模型中开展,BAEK等[36]进行的一项临床前和探索性临床研究显示:在肝细胞癌裸鼠模型体内注射18F-FSPG后120 min,可观察到动态全身PET成像,肿瘤组织区域的高强度摄取与非肿瘤区域的低背景形成鲜明的对比,实现了植入性肝癌的可视化成像,是很有应用前景的肝癌筛查方式。18F-FSPG PET在肝癌中的成像诊断价值在美国肝癌患者进行的临床评估试验研究[37]中得到进一步证实。有关非小细胞肺癌和乳腺癌的探索性研究[39]显示:18F-FSPG PET对不同类型癌症患者的诊断价值存在差异,与乳腺癌比较,其对非小细胞肺癌的检出率更高。因此对于18F-FSPG PET能否成为肿瘤的示踪剂应用于临床仍需要大量的临床样本和数据来证实。
7 xCT抑制剂在肿瘤治疗中的价值柳氮磺胺吡啶(sulfasalazine,SSZ)是常用的治疗炎症性肠病和类风湿性关节炎的药物,同时也是FDA批准的xCT抑制剂。近年来,SSZ可增强肿瘤放化疗敏感性在多种肿瘤模型中得到验证。MA等[40]研究证实:SSZ可有效抑制system xc-的转运活性,降低胞浆中解毒物质GSH的合成,从而极大提高结直肠癌细胞中的顺铂浓度,逆转结直肠癌的顺铂耐药。SSZ联合顺铂增强肿瘤化疗敏感性在胰腺癌[41]和非小细胞肺癌[25]中也得到证实。由于xCT与CSC的表面标记蛋白之间存在相互促进作用,SSZ也可有效地针对CSC,改变CSC中ROS水平低的特点,逆转肿瘤耐药。SONG等[42]发现:SSZ预处理的CD133+肝癌细胞极大地增加了其对顺铂和多柔比星等化疗药物的敏感性,逆转了CD133+肝癌干细胞的化疗耐药。SSZ的增敏功能也在胶质瘤干细胞动物模型[43]中得到验证。HARYU等[43]发现:SSZ以剂量依赖性方式抑制胶质瘤干细胞的增殖活性,同时,SSZ并未引起周围正常组织的损伤。CD44v作为经典的稳定xCT亚基的CSC表面标记蛋白,SSZ选择性地靶向CD44v阳性CSC治疗在进展期胃癌[31]、非小细胞肺癌[32]、膀胱癌[33]、胆管癌[30]和乳腺癌[44]等肿瘤模型中得到证实;亦有文献[45]报道:长期服用SSZ可增加溃疡性结肠炎相关癌症的分化程度、降低肿瘤的恶性程度。上述研究均表明SSZ在肿瘤治疗中的潜在价值, 值得进一步研究探索。
8 展望xCT作为细胞膜上的氨基酸转运活性亚基,在生物体中发挥广泛的生物学效应。同时,xCT调控机制的异常在肿瘤的侵袭、迁移和耐药等进程中起不可忽视的作用,是肿瘤诊断和预后的重要生物标志物[1]。SSZ作为xCT的有效抑制剂在肿瘤治疗中发挥重要作用,目前多项关于SSZ在肿瘤耐药及干细胞治疗的临床试验正在进行中(EPOC1205、EPOC1407和UMIN000017854等)。然而SSZ对xCT的抑制作用并无特异性,脱靶效应的存在限制其功能的实现[2]。因此开发新型靶向xCT的高效小分子药物也是肿瘤治疗的发展方向之一。此外,18F-FSPG是继18F-FDG之后,利用肿瘤生物能量代谢的特点而研发的示踪剂,在肿瘤的早期筛查与诊断中有着广阔的应用前景。相信在不断克服各种弊端后,xCT在将来可能会大规模应用于动物实验和人体试验,成为颇具前景的肿瘤治疗靶点。
| [1] |
KOPPULA P, ZHANG Y, ZHUANG L, et al. Amino acid transporter SLC7A11/xCT at the crossroads of regulating redox homeostasis and nutrient dependency of cancer[J]. Cancer Commun (Lond), 2018, 38(1): 12. DOI:10.1186/s40880-018-0288-x |
| [2] |
LEWERENZ J, HEWETT S J, HUANG Y, et al. The Cystine/Glutamate antiporter system xc- in health and disease: From molecular mechanisms to novel therapeutic opportunities[J]. Antioxid Redox Sign, 2013, 18(5): 522-555. DOI:10.1089/ars.2011.4391 |
| [3] |
LIM J C, DONALDSON P J. Focus on molecules: The cystine/glutamate exchanger (System x(c)(—))[J]. Exp Eye Res, 2011, 92(3): 162-163. DOI:10.1016/j.exer.2010.05.007 |
| [4] |
SHIN C S, MISHRA P, WATROUS J D, et al. The glutamate/cystine xCT antiporter antagonizes glutamine metabolism and reduces nutrient flexibility[J]. Nat Commun, 2017, 8: 15074. DOI:10.1038/ncomms15074 |
| [5] |
CHEN D, TAVANA O, CHU B, et al. NRF2 is a major target of ARF in p53-Independent tumor suppression[J]. Mol Cell, 2017, 68(1): 224-232. DOI:10.1016/j.molcel.2017.09.009 |
| [6] |
LEWERENZ J, MAHER P. Basal levels of eIF2alpha phosphorylation determine cellular antioxidant status by regulating ATF4 and xCT expression[J]. J Biol Chem, 2009, 284(2): 1106-1115. DOI:10.1074/jbc.M807325200 |
| [7] |
CLEMONS N J, LIU D S, DUONG C P, et al. Inhibiting system xC(—) and glutathione biosynthesis-a potential Achilles' heel in mutant-p53 cancers[J]. Mol Cell Oncol, 2017, 4(5): e1344757. DOI:10.1080/23723556.2017.1344757 |
| [8] |
YANG Y, YEE D. IGF-I regulates redox status in breast cancer cells by activating the amino acid transport molecule xC[J]. Cancer Res, 2014, 74(8): 2295-2305. DOI:10.1158/0008-5472.CAN-13-1803 |
| [9] |
WANG X, LI Y, WANG H, et al. Propofol inhibits invasion and proliferation of C6 glioma cells by regulating the Ca2+ permeable AMPA receptor-system x c- pathway[J]. Toxicol in Vitro, 2017, 44: 57-65. DOI:10.1016/j.tiv.2017.06.026 |
| [10] |
PAKOS-ZEBRUCKA K, KORYGA I, MNICH K, et al. The integrated stress response[J]. Embo Rep, 2016, 17(10): 1374-1395. DOI:10.15252/embr.201642195 |
| [11] |
YE P, MIMURA J, OKADA T, et al. Nrf2- and ATF4-dependent upregulation of xCT modulates the sensitivity of t24 bladder carcinoma cells to proteasome inhibition[J]. Mol Cell Biol, 2014, 34(18): 3421-3434. DOI:10.1128/MCB.00221-14 |
| [12] |
MARTIN L, GARDNER L B. Stress-induced inhibition of nonsense-mediated RNA decay regulates intracellular cystine transport and intracellular glutathione through regulation of the cystine/glutamate exchanger SLC7A11[J]. Oncogene, 2015, 34(32): 4211-4218. DOI:10.1038/onc.2014.352 |
| [13] |
DRAYTON R M, DUDZIEC E, PETER S, et al. Reduced expression of miRNA-27a modulates cisplatin resistance in bladder cancer by targeting the cystine/glutamate exchanger SLC7A11[J]. Clin Cancer Res, 2014, 20(7): 1990-2000. DOI:10.1158/1078-0432.CCR-13-2805 |
| [14] |
LIU X X, LI X J, ZHANG B, et al. MicroRNA-26b is underexpressed in human breast cancer and induces cell apoptosis by targeting SLC7A11[J]. Febs Lett, 2011, 585(9): 1363-1367. DOI:10.1016/j.febslet.2011.04.018 |
| [15] |
WU Y, SUN X, SONG B, et al. MiR-375/SLC7A11 axis regulates oral squamous cell carcinoma proliferation and invasion[J]. Cancer Med, 2017, 6(7): 1686-1697. DOI:10.1002/cam4.1110 |
| [16] |
ISHIMOTO T, NAGANO O, YAE T, et al. CD44 variant regulates redox status in cancer cells by stabilizing the xCT subunit of system xc- and thereby promotes tumor growth[J]. Cancer Cell, 2011, 19(3): 387-400. DOI:10.1016/j.ccr.2011.01.038 |
| [17] |
GU Y, ALBUQUERQUE C P, BRAAS D, et al. MTORC2 regulates amino acid metabolism in cancer by phosphorylation of the Cystine-Glutamate antiporter xCT[J]. Mol Cell, 2017, 67(1): 128-138. DOI:10.1016/j.molcel.2017.05.030 |
| [18] |
JI X, QIAN J, RAHMAN S, et al. XCT (SLC7A11)-mediated metabolic reprogramming promotes non-small cell lung cancer progression[J]. Oncogene, 2018, 37(36): 5007-5019. DOI:10.1038/s41388-018-0307-z |
| [19] |
ZHONG W, WEISS H L, JAYSWAL R D, et al. Extracellular redox state shift: A novel approach to target prostate cancer invasion[J]. Free Radical Bio Med, 2018, 117: 99-109. DOI:10.1016/j.freeradbiomed.2018.01.023 |
| [20] |
郑雪婷, 赵飞, 赵瑞, 等. xCT调节乳腺癌细胞转移的作用机制研究[J]. 军事医学, 2015(5): 334-338. |
| [21] |
李杨, 齐建利, 赵立平, 等. xCT影响肝癌细胞转移的作用机制研究[J]. 天津医科大学学报, 2014(2): 93-97. |
| [22] |
KINOSHITA H, OKABE H, BEPPU T, et al. Cystine/glutamic acid transporter is a novel marker for predicting poor survival in patients with hepatocellular carcinoma[J]. Oncol Rep, 2013, 29(2): 685-689. |
| [23] |
MA Z, ZHANG H, LIAN M, et al. SLC7A11, a component of cysteine/glutamate transporter, is a novel biomarker for the diagnosis and prognosis in laryngeal squamous cell carcinoma[J]. 2017, 38(5): 3019-3029. https://www.ncbi.nlm.nih.gov/pubmed/29048627
|
| [24] |
LEE J R, ROH J L, LEE S M, et al. Overexpression of cysteine-glutamate transporter and CD44 for prediction of recurrence and survival in patients with oral cavity squamous cell carcinoma[J]. Head Neck, 2018. DOI:10.1002/hed.25331 |
| [25] |
OTSUBO K, NOSAKI K, IMAMURA C K, et al. Phase Ⅰ study of salazosulfapyridine in combination with cisplatin and pemetrexed for advanced non-small-cell lung cancer[J]. Cancer Sci, 2017, 108(9): 1843-1849. DOI:10.1111/cas.13309 |
| [26] |
POLEWSKI M D, REVERON-THORNTON R F, CHERRYHOLMES G A, et al. Increased expression of system xc- in glioblastoma confers an altered metabolic state and temozolomide resistance[J]. Mol Cancer Res, 2016, 14(12): 1229-1242. DOI:10.1158/1541-7786.MCR-16-0028 |
| [27] |
MAUGERI-SACCA M, VIGNERI P, De MARIA R. Cancer stem cells and chemosensitivity[J]. Clin Cancer Res, 2011, 17(15): 4942-4947. DOI:10.1158/1078-0432.CCR-10-2538 |
| [28] |
YE X Q, LI Q, WANG G H, et al. Mitochondrial and energy metabolism-related properties as novel indicators of lung cancer stem cells[J]. Int J Cancer, 2011, 129(4): 820-831. |
| [29] |
POLEWSKI M D, REVERON-THORNTON R F, CHERRYHOLMES G A, et al. SLC7A11 overexpression in glioblastoma is associated with increased cancer stem cell-like properties[J]. Stem Cells Dev, 2017, 26(17): 1236-1246. DOI:10.1089/scd.2017.0123 |
| [30] |
THANEE M, LOILOME W, TECHASEN A, et al. CD44 variant-dependent redox status regulation in liver fluke-associated cholangiocarcinoma: A target for cholangiocarcinoma treatment[J]. Cancer Sci, 2016, 107(7): 991-1000. DOI:10.1111/cas.12967 |
| [31] |
SHITARA K, DOI T, NAGANO O, et al. Phase 1 study of sulfasalazine and cisplatin for patients with CD44v-positive gastric cancer refractory to cisplatin (EPOC1407)[J]. Gastric Cancer, 2017, 20(6): 1004-1009. DOI:10.1007/s10120-017-0720-y |
| [32] |
OTSUBO K, NOSAKI K, IMAMURA C K, et al. Phase Ⅰ study of salazosulfapyridine in combination with cisplatin and pemetrexed for advanced non-small-cell lung cancer[J]. Cancer Sci, 2017, 108(9): 1843-1849. DOI:10.1111/cas.13309 |
| [33] |
TAKAYAMA T, KUBO T, MORIKAWA A, et al. Potential of sulfasalazine as a therapeutic sensitizer for CD44 splice variant 9-positive urogenital cancer[J]. Med Oncol, 2016, 33(5): 45. DOI:10.1007/s12032-016-0760-x |
| [34] |
LU H, SAMANTA D, XIANG L, et al. Chemotherapy triggers HIF-1-dependent glutathione synthesis and copper chelation that induces the breast cancer stem cell phenotype[J]. Proc Natl Acad Sci U S A, 2015, 112(33): E4600-E4609. DOI:10.1073/pnas.1513433112 |
| [35] |
KOGLIN N, MUELLER A, BERNDT M, et al. Specific PET imaging of xC-transporter activity using a (1)(8)F-labeled glutamate derivative reveals a dominant pathway in tumor metabolism[J]. Clin Cancer Res, 2011, 17(18): 6000-6011. DOI:10.1158/1078-0432.CCR-11-0687 |
| [36] |
BAEK S, MUELLER A, LIM Y S, et al. (4S)-4-(3-18F-fluoropropyl)-L-glutamate for imaging of xC transporter activity in hepatocellular carcinoma using PET: Preclinical and exploratory clinical studies[J]. J Nucl Med, 2013, 54(1): 117-123. DOI:10.2967/jnumed.112.108704 |
| [37] |
KAVANAUGH G, WILLIAMS J, MORRIS A S, et al. Utility of 18F-FSPG PET to image hepatocellular carcinoma: First clinical evaluation in a US population[J]. Mol Imaging Biol, 2016, 18(6): 924-934. DOI:10.1007/s11307-016-1007-0 |
| [38] |
MITTRA E S, KOGLIN N, MOSCI C, et al. Pilot preclinical and clinical evaluation of (4S)-4-(3-[18F]fluoropropyl)-L-Glutamate (18F-FSPG) for PET/CT imaging of intracranial malignancies[J]. PLoS One, 2016, 11(2): e148628. |
| [39] |
BAEK S, CHOI C M, AHN S H, et al. Exploratory clinical trial of (4S)-4-(3-18F fluoropropyl)-L-glutamate for imaging xC-transporter using positron emission tomography in patients with Non-Small cell lung or breast cancer[J]. Clin Cancer Res, 2012, 18(19): 5427-5437. DOI:10.1158/1078-0432.CCR-12-0214 |
| [40] |
MA M Z, CHEN G, WANG P, et al. Xc-inhibitor sulfasalazine sensitizes colorectal cancer to cisplatin by a GSH-dependent mechanism[J]. Cancer Lett, 2015, 368(1): 88-96. DOI:10.1016/j.canlet.2015.07.031 |
| [41] |
LO M, LING V, LOW C, et al. Potential use of the anti-inflammatory drug, sulfasalazine, for targeted therapy of pancreatic cancer[J]. Curr Oncol, 2010, 17(3): 9-16. |
| [42] |
SONG Y, JANG J, SHIN T H, et al. Sulfasalazine attenuates evading anticancer response of CD133-positive hepatocellular carcinoma cells[J]. J Exp Clin Cancer Res, 2017, 36(1): 38. DOI:10.1186/s13046-017-0511-7 |
| [43] |
HARYU S, SAITO R, JIA W, et al. Convection-enhanced delivery of sulfasalazine prolongs survival in a glioma stem cell brain tumor model[J]. J Neurooncol, 2018, 136(1): 23-31. DOI:10.1007/s11060-017-2621-7 |
| [44] |
RODMAN S N, SPENCE J M, RONNFELDT T J, et al. Enhancement of radiation response in breast cancer stem cells by inhibition of thioredoxin- and Glutathione-Dependent metabolism[J]. Radiat Res, 2016, 186(4): 385-395. DOI:10.1667/RR14463.1 |
| [45] |
SEISHIMA R, OKABAYASHI K, NAGANO O, et al. Sulfasalazine, a therapeutic agent for ulcerative colitis, inhibits the growth of CD44v9(+) cancer stem cells in ulcerative colitis-related cancer[J]. Clin Res Hepatol Gastroenterol, 2016, 40(4): 487-493. DOI:10.1016/j.clinre.2015.11.007 |
 2019, Vol. 45
2019, Vol. 45


