扩展功能
文章信息
- 杨宝霞, 黎萍, 王聪, 张鹏, 郑百红, 许忠
- YANG Baoxia, LI Ping, WANG Cong, ZHANG Peng, ZHENG Baihong, XU Zhong
- 预后良好的儿童急性坏死性脑病1例报告及文献复习
- Acute necrotizing encephalopathy of children with good prognosis: A case report and literature review
- 吉林大学学报(医学版), 2019, 45(06): 1449-1453
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1449-1453
- 10.13481/j.1671-587x.20190644
-
文章历史
- 收稿日期: 2019-07-23
2. 吉林大学第二医院发育儿科, 吉林 长春 130041;
3. 吉林大学第二医院放射线科, 吉林 长春 130041
2. Department of Developmental Pediatrics, Second Hospital, Jilin University, Changchun 130041, China;
3. Department of Radiology, Second Hospital, Jilin University, Changchun 130041, China
急性坏死性脑病(acute necrotizing encephalopathy, ANE)是一种病情呈爆发性进展的急性脑病,发病率较低,由MIZUGUCHI[1]在1995年首次报道。ANE在世界范围内均有发生,但多发于亚洲地区;各年龄段均可发病,尤以儿童多见,绝大多数患者为偶发,少数家族性患者常有复发[2-3]。ANE临床表现缺乏特异性,主要临床特点是弥漫性脑水肿伴双侧丘脑对称性多发病变,诊断主要依据典型的神经影像学特征[4];其预后差,病死率高达30%,只有不到10%的患者可完全康复,多数幸存者均伴有神经系统后遗症[5]。日本ANE患者资料[6]显示:ANE患者发生轻、中和重度后遗症的比例分别占23.0%、33.3%和28.2%。研究[7]显示ANE患者预后均不理想。本文作者报道1例急性起病、快速进展的ANE患儿,在放射线科积极协助下,经及时诊断和早期积极治疗后,取得较好的治疗效果,患儿有望达到生活自理。结合相关文献,本文作者分析ANE的临床特点、诊断和治疗方法及国内外最新研究进展,为ANE的准确、有效诊治提供参考。
1 临床资料 1.1 一般资料幼儿,3岁,男性,因“发热、咳嗽3 d”入院,既往史和家族史无特殊,临床诊断为肺炎,经抗感染和对症治疗,第2天热退,咳嗽减轻,病情好转;第4天再次发热,为高热,体温39.7℃,伴流清涕。加用奥司他韦和阿奇霉素抗感染,咳嗽不明显,仍伴高热;第9天时患儿高热伴寒战、嗜睡;第10天晨起一般状态好转,但仍有发热,当晚高热、寒战后出现抽搐,意识丧失,双眼向左上凝视,呼之不应,四肢软,无尿便失禁,压眶无反应,持续约2 min,给予水合氯醛镇静、吸氧、生命体征监护。持续心电监护示心率180~210 min-1,呼吸43~65 min-1,血氧饱和度为88%~90%,血压53~91mmHg/31~48 mmHg。查体:体温41.7℃,意识不清;对疼痛刺激无反应;瞳孔等大等圆,对光反射存在;面色发绀,“三凹征”阳性,双肺可闻及痰鸣音;心率200 min-1,心音低钝,腹软,肝脾触诊不满意。四肢末梢凉,指趾端发绀;项强阴性,腹壁反射、膝腱反射、提睾反射未引出,克氏征、布氏征和双侧巴宾斯基征可疑阳性,肌力Ⅰ级,肌张力增强。转入本院儿科重症监护病房(pediatric intensive care unit,PICU)辅以强心、利尿治疗,患儿呈深昏迷状态,仍有高热。
1.2 实验室检查急检:铁蛋白>2 000 μg·L-1 (参考值:21.81~274.66 μg·L-1),血常规结果正常。EB病毒抗体和DNA定量结果正常;降钙素原(procalcitonin,PCT) 10.92 μg·L-1(参考值:< 0.5 μg·L-1),谷丙转氨酶179 U·L-1 (参考值:9~50 U·L-1),谷草转氨酶212 U·L-1 (参考值:15~40 U·L-1),白蛋白32.4 g·L-1 (参考值:40~55 g·L-1),乳酸脱氢酶1 199 U·L-1 (参考值:120~250 U·L-1),α-羟丁酸脱氢酶823 U·L-1(参考值:72~182 U·L-1); 脑脊液:蛋白升高、白细胞计数降低、乳酸正常,巨细胞病毒及疱疹病毒均阴性; 自身免疫性脑炎抗体:阴性; 凝血功能:凝血酶原时间(prothrombin time,PT)24.8 s(参考值:9.4~12.5 s),国际标准化比率(international normalized ratio, INR) 2.09(参考值:0.8~1.2),活化部分凝血活酶时间(activated partial thromboplastin time, APTT) 54.2 s(参考值:22.0~42.0 s),凝血酶原活动度35%(参考值:80%~150%),凝血酶时间(thrombin time,TT) 25.1 s(参考值:10.3~16.6 s),D-二聚体25.20 mg·L-1(参考值:0~1.0 mg·L-1),纤维素原(fibrinogen, FIB) 1.15 g·L-1(参考值:2.0~4.0 g·L-1)。
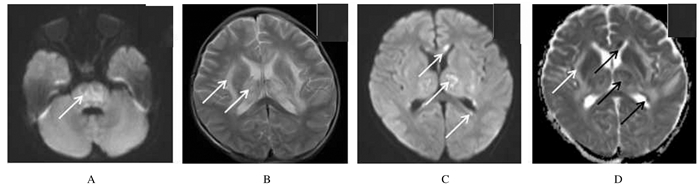
1.3 脑电图和影像学检查脑电图提示背景为弥漫性慢波活动。头部CT:双侧丘脑、左侧颞叶和脑干可见条片状低密度影。头部核磁共振(MRI)提示双侧丘脑、基底节、侧脑室下角、胼胝体、脑干、左侧颞叶和左侧额顶叶见长T1长T2信号影,扩散加权成像(DWI)提示脑干、丘脑、双侧基底节区和胼胝体等可见多发点片状高信号,丘脑等部位表观弥散系数(apparent dispersion coefficient, ADC)呈片状稍高信号,外囊呈高信号,脑干和丘脑等部位呈低信号(图 1),符合ANE影像学表现。

|
| Arrows indicated; A: DWI; B: T2WI; C: DWI; D: ADC.The arrows referred to lesion. 图 1 ANE患儿发病后第1天头部MRI图像 Fig. 1 Brain MRI images of one children with ANE on 1st day after acute-onset |
|
|
临床诊断:ANE和全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)。24 h内给予糖皮质激素冲击(甲泼尼龙20 mg·kg-1·d-1,3 d后逐渐减量)、输注人免疫球蛋白(1 g·kg-1·d-1,2 d)、同型新鲜冰冻血浆及冷沉淀,肝素抗凝、脱水,并继续抗感染和对症治疗。
1.5 转归第11天患儿昏迷状态下仍有抽搐。吸痰时患儿四肢强直,不睁眼,Glasgow评分4分。入院第13天患儿进入浅昏迷,吸痰时仍有四肢僵直,Glasgow评分5分。入院后第20天,患儿生命体征平稳,Glasgow评分9分。查体:昏迷;声音刺激能睁眼,疼痛刺激无反应;双侧瞳孔等大同圆,对光反射存在,角膜反射可引出,双眼向左侧偏斜,右眼为重;不能吞咽,右侧中枢性面瘫,项强阴性,腹壁反射消失,双侧巴氏征、克氏征阳性,肌力Ⅱ级,右侧肢体肌张力增高,上肢为著;左侧肢体肌张力略高。双侧膝腱反射亢进。尿便失禁。复查:转氨酶、白蛋白、铁蛋白和凝血功能恢复正常。脑电图背景慢波活动较前减少,但双侧额区、颞区见多棘波。头部MRI提示双侧基底节区病变范围较前片明显缩小,双侧丘脑区T1WI出现高信号,T2WI出现混杂信号,提示出血可能,DWI胼胝体区病变范围较前片略增大(图 2)。患儿病情明显好转,第27天转入外院行康复治疗。
|
| Arrows indicated. A: DWI; B: T2WI; C: DWI; D: ADC.The arrows referred to lesion. 图 2 ANE患儿发病后第10天头部MRI图像 Fig. 2 Brain MRI images of a patient with ANE on 10th day after acute-onset |
|
|
患儿定期到本院儿科门诊随访3个月,目前患儿能听懂指令,并进行简单交流,父母扶持可行走。社会生活能力量表评估结果:9分,边缘水平。采用Gesell发育评分测查发育商值:大运动25分(重度落后),细动作78分(边缘水平),应物能78分(边缘水平),言语能85分(边缘水平),应人能76分(边缘水平);整体发育商为边缘水平。粗大运动评估显示患儿站立位及行走功能较同龄儿存在明显落后。仍需继续接受康复治疗。
2 讨论目前认为ANE发病是由免疫系统介导的,但其确切发病机制尚不清楚。研究[5]表明:ANE是病毒感染导致发热后发生的急性脑病,多见于流感病毒、EB病毒和人疱疹病毒-6等感染。遗传和环境因素均影响ANE的发病,Ran结合蛋白2(RANBP2)是家族性和复发性ANE患者的易感基因,RANBP2基因突变导致的ANE称为ANE1,为常染色体显性遗传,外显率为40%,但表现度差异较大[3, 8]。另外,KOBAYASHI等[9]发现肉碱棕榈酰转移酶Ⅱ(carnitine palmitoyl transferase Ⅱ, CPT Ⅱ)基因突变也与ANE有关。而目前较认可的发病假说是易感个体继发于病毒感染后产生的“细胞因子风暴”[10]。炎症反应和凝血系统激活是机体抗感染的两大防御机制,且两者相互作用,形成级联放大效应,感染失控则可引起SIRS和凝血功能障碍[11]。该患儿临床表现符合SIRS临床表现,并伴有凝血功能障碍。病毒感染患儿病程中出现凝血功能异常时应全面考虑,提示凝血功能异常可能是病情快速进展的预警。此外,研究[12]显示:基于个体人类白细胞抗原(human leukocyte antigen,HLA)基因型的异常免疫反应可能导致ANE发生。肾素B型受体2(ephrin type B receptor 2,EphB2)在人脑微血管内皮细胞表达,研究[13-14]显示:该受体是系统性红斑狼疮并发ANE患者自身抗体的靶点,在单纯的系统性红斑狼疮患者中未检测到该抗体,提示其可能是ANE潜在的生物标记物。ANE易侵袭脑组织,有研究[13]显示ANE可能是一种自身免疫性神经系统疾病。
ANE起病急,前驱症状不典型,仅表现为致病病毒感染症状,如呕吐、腹泻或上呼吸道感染等,常伴有高热,病情进展快,在数天内达到高峰,出现癫痫样抽搐或昏迷,该阶段可伴过度通气、去皮层僵直、去大脑僵直和锥体束征等表现[6, 15]。该患儿病情好转后再次出现高热、嗜睡、寒战、抽搐和昏迷,进展迅速,病情危重。本研究结果提示在临床工作中,面对病情反复、持续高热、寒战、嗜睡和抽搐的患儿需注意ANE的可能。头部MRI对称性多发性丘脑受累是ANE的重要特点,急性期病变部位呈长T2信号影,在DWI和ADC图上呈现特征性的三色版模式,对应水肿、出血和坏死等病理改变[16-17]。该患儿急性期头部MRI提示双侧丘脑、基底节、侧脑室、胼胝体、脑干和外囊等部位多发病变,符合ANE影像学特征。复查后T1WI出现高信号,T2WI出现混杂信号,考虑毛细血管通透性增加所致出血,胼胝体区病变范围略增大,考虑与影像学表现落后于临床表现有关。该患儿头部CT提示上述部位呈低密度改变,与文献[18]报道一致。但超急性期ANE的特征性表现在CT上不能显示,而此时DWI对脑实质损伤的显现更有优势,建议早期行头部MRI检查[19]。急性期约96%的患儿脑电图显示慢波信号[20]。本例患儿脑电检查发现弥漫性慢波活动。文献[21]报道:ANE最常见的生化改变为肝酶和乳酸脱氢酶升高,大部分患者有低蛋白血症,脑脊液检查见蛋白水平升高和白细胞减少。该患儿昏迷后血生化和脑脊液检查同上述研究结果一致。
1995年MIZUGUCHI[1]提出ANE诊断标准:①病毒感染发热后的急性脑病,伴意识改变及抽搐等,病情迅速恶化;②脑脊液白细胞数减少,蛋白水平增加;③CT或MRI等影像学改变显示丘脑、脑室周围白质、内囊、壳核、脑干和小脑髓质等对称性多灶性损伤,而中枢神经系统其他部位病变罕见;④血清转氨酶水平不同程度升高,而血氨水平无明显升高;⑤排除遗传代谢性脑病和缺氧缺血性脑病等疾病。但现有观点[13]认为脑脊液及血清转氨酶改变是很多急性疾病的反应过程,对ANE无特异性,建议符合①③⑤三条主要标准及②④任1条次要标准即可诊断。该患儿符合上述五条标准,故诊断明确。
ANE需与瑞士综合征(Reye’ s syndrome,RS)、Leigh综合征(Leigh syndrome,LS)、儿童双侧丘脑坏死和中毒性脑病进行鉴别[6]。有文献[10]报道:早期使用糖皮质激素冲击、静脉注射人免疫球蛋白或血浆置换可改善ANE患者的预后。该患儿发病后经及时诊断,起病24 h内给予激素冲击并输注人免疫球蛋白,预后相对良好。国外最新病例报告[22]显示:ANE患儿发病早期给予IL-6受体拮抗剂托珠单抗可改善危重患儿的预后,降低致残率,提示国内亦可尝试采用IL-6受体拮抗剂治疗ANE。该患儿在基础治疗的基础上,同时给予肝素抗凝治疗,输注冷沉淀和新鲜冰冻血浆纠正凝血功能障碍,取得良好疗效。另外低温治疗在某些ANE患者中的疗效确切[23],该患儿接受了低温治疗。如果未来能明确ANE是一种自身免疫性神经系统疾病并发现特异性自身抗体,单克隆抗体治疗将会成为一种潜在有效的治疗选择[13]。ANE患者预后差,死亡率约为30%,多数幸存者伴有神经系统后遗症[5, 7]。该患儿治疗后整体发育水平和社会生活能力水平呈边缘水平,能听懂指令,并进行简单交流,扶持可行走,尚无癫痫,后期继续康复治疗有望达到生活自理。
综上所述,ANE发病率低,病情进展快,临床表现无特异性,导致临床医生对该病认识不够,易延误最佳治疗时机,从而导致患儿预后不理想,甚至死亡。因此首先应该提高临床医生对ANE的认识,临床工作中,面对病情反复、持续高热、寒战、嗜睡和抽搐的患儿需注意ANE,早期行头部MRI检查,把握治疗的最佳时机,早期行激素冲击及人免疫球蛋白治疗。亦可尝试早期使用IL-6受体拮抗剂改善ANE患者的预后。此外明确ANE特异性自身免疫抗体并给予特异性治疗也值得关注。ANE的早诊断和早治疗对有效控制疾病进展、提高患儿生存率和生活质量尤为重要。
| [1] |
MIZUGUCHI M. Acute necrotizing encephalopathy of childhood: a novel form of acute encephalopathy prevalent in Japan and Taiwan[J]. Brain Dev, 1997, 19(2): 81. |
| [2] |
TANIGUCHI D, NAKAJIMA S, HAYASHIDA A, et al. Deep cerebral venous thrombosis mimicking influenza-associated acute necrotizing encephalopathy: a case report[J]. J Med Case Report, 2017, 11(1): 281-286. DOI:10.1186/s13256-017-1444-7 |
| [3] |
LEE Y J, HWANG S K, LEE S M, et al. Familial acute necrotizing encephalopathy with RANBP2 mutation: The first report in Northeast Asia[J]. Brain Dev, 2017, 39(7): 625-628. DOI:10.1016/j.braindev.2017.02.005 |
| [4] |
ONOZAWA Y, IWASAKI T, IIZUKA T, et al. Evoked potential studies for predicting functional recovery in a case of acute necrotizing encephalopathy[J]. Clin Case Rep, 2018, 6(5): 813-816. |
| [5] |
STEVANOVI V, BARUI Z, VIKOVI K, et al. Acute necrotizing encephalopathy of childhood associated with human herpes virus 6 in Croatia[J]. Neurol Sci, 2019, 40(3): 639-641. |
| [6] |
WU X, WU W, PAN W, et al. Acute necrotizing encephalopathy: An underrecognized clinicoradiologic disorder[J]. Mediators Inflamm, 2015, 2015: 792578. |
| [7] |
王玉静, 裴亮, 许巍, 等. 儿童急性坏死性脑病十例临床特点分析[J]. 中国小儿急救医学, 2018, 25(8): 590-596. DOI:10.3760/cma.j.issn.1673-4912.2018.08.009 |
| [8] |
朱金兰, 黄铁栓, 段婧, 等. RANBP2基因突变导致的家族性急性坏死性脑病一家系报道[J]. 中华实用儿科临床杂志, 2015, 30(21): 1672-1675. DOI:10.3760/cma.j.issn.2095-428X.2015.21.020 |
| [9] |
KOBAYASHI Y, KANAZAWA H, HOSHINO A, et al. Acute necrotizing encephalopathy and a carnitine palmitoyltransferase 2 variant in an adult[J]. J Clin Neurosci, 2019, 61: 264-266. DOI:10.1016/j.jocn.2018.11.045 |
| [10] |
SORIANO-RAMOS M, NAVARRO-ABIA V, ENAMORADO N N, et al. Steroids for familial acute necrotizing encephalopathy: A future investment?[J]. Clin Neurol Neurosurg, 2018, 174: 134-136. DOI:10.1016/j.clineuro.2018.09.014 |
| [11] |
YAO Y M, LUAN Y Y, ZHANG Q H, et al. Pathophysiological aspects of sepsis: An overview[J]. Methods Mol Biol, 2015, 1237: 5-15. |
| [12] |
HOSHINO A, SAITH M, MIYAGAWA T, et al. Specific HLA genotypes confer susceptibility to acute necrotizing encephalopathy[J]. Genes Immun, 2016, 17(6): 367-369. DOI:10.1038/gene.2016.32 |
| [13] |
LEE Y J, HWANG S K. Acute necrotizing encephalopathy in children: A long way to go[J]. J Korean Med Sci, 2019, 34(19): e143. DOI:10.3346/jkms.2019.34.e143 |
| [14] |
SHIRAI T, FUJII H, ONO M, et al. A novel autoantibody against ephrin type B receptor 2 in acute necrotizing encephalopathy[J]. J Neuroinflammat, 2013, 10(1): 128-134. |
| [15] |
CAMPISTOL J, GASSI R, PINEDA M, et al. Acute necrotizing encephalopathy of childhood (infantile bilateral thalamic necrosis): Two non-Japanese cases[J]. Dev Med Child Neurol, 2010, 40(11): 771-774. |
| [16] |
BISWAS A, VARMAN M, GUNTURI A, et al. Teaching neuroimages: Acute necrotizing encephalopathy of childhood[J]. Neurology, 2018, 90(2): 177-178. DOI:10.1212/WNL.0000000000004800 |
| [17] |
朱红敏, 刘智胜. 急性坏死性脑病临床影像表现[J]. 中华儿科杂志, 2017, 55(11): 865-868. DOI:10.3760/cma.j.issn.0578-1310.2017.11.017 |
| [18] |
LIM H Y, HO V P Y, LIM T C C, et al. Serial outcomes in acute necrotising encephalopathy of childhood: A medium and long term study[J]. Brain Dev, 2016, 38(10): 928-936. DOI:10.1016/j.braindev.2016.05.002 |
| [19] |
ODAGIRI A, YAMAOKA A, MIYATA K, et al. Elderly-onset acute necrotizing encephalopathy mimicking severe heat stroke: A case report and review of the literature[J]. Acute Med Surg, 2019, 6(3): 316-320. |
| [20] |
OZAWA T, NAKASHIMA Y, ITO R, et al. EEG findings in a case of acute necrotizing encephalopathy of childhood associated with influenza a virus infection[J]. No To Hattatsu, 2001, 33(1): 63-68. |
| [21] |
HASSANZADEH R A, AMINZADEH V. Acute necrotizing encephalopathy of childhood (ANEC): A case report[J]. Iran J Child Neurol, 2017, 11(1): 75-77. |
| [22] |
KOH J C, MURΜGASU A, KRISHNAPPA J, et al. Favorable outcomes with early interleukin 6 receptor blockade in severe acute necrotizing encephalopathy of childhood[J]. Pediatr Neurol, 2019, 98: 80-84. DOI:10.1016/j.pediatrneurol.2019.04.009 |
| [23] |
VARGAS W S, MERCHANT S, SOLOMON G. Favorable outcomes in acute necrotizing encephalopathy in a child treated with hypothermia[J]. Pediatr Neurol, 2012, 46(6): 387-389. |
 2019, Vol. 45
2019, Vol. 45


