扩展功能
文章信息
- 郑剑霄, 詹文婷, 周晓春, 孔怡琳, 高蕾, 李工, 王苏美
- ZHENG Jianxiao, ZHAN Wenting, ZHOU Xiaochun, KONG Yilin, GAO Lei, LI Gong, WANG Sumei
- 复方苦参注射液对鼻咽癌CNE-2细胞的放射增敏作用
- Radiosensitization of Compound Sophora Flavescens Injection on nasopharyngeal carcinoma CNE-2 cells
- 吉林大学学报(医学版), 2019, 45(06): 1384-1388
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1384-1388
- 10.13481/j.1671-587x.20190632
-
文章历史
- 收稿日期: 2019-09-01
2. 广州中医药大学第二附属医院肿瘤科 广东省中医院肿瘤科, 广东 广州 510120
2. Department of Oncology, Sencond Affiliated Hospital, Guangzhou University of Traditional Chinese Medicine, Guangdong Provincial Hospital of Traditional Chinese Medicine, Guangzhou 510120, China
鼻咽癌是我国南方一种常见的头颈部恶性肿瘤[1],目前,鼻咽癌首选的治疗方法仍是以放疗为主的综合治疗, 但其对中晚期患者治疗效果并不理想[2-3],初治后20%~30%患者发生局部复发或远处转移[4]。有研究[5]显示放射野内复发约占复发总例数一半, 说明肿瘤可能对放疗不敏感,因此提高肿瘤细胞对放射线的敏感性是改善鼻咽癌患者预后的重要途经。分子靶向药物和化疗药物均有一定的放射增敏作用[6-7],但其不良反应较大,费用昂贵,目前尚未有理想的放射增敏剂。复方苦参注射液是一种具有广谱抗肿瘤作用的中药制剂,其通过直接杀伤肿瘤细胞和保护机体免疫功能等途径增强放射治疗的疗效,并减轻不良反应进而提高患者生活质量[8-9]。目前国内外关于复方苦参注射液对鼻咽癌放射敏感性的影响及其机制的研究尚未见报道。本研究观察复方苦参注射液对X射线辐射后人鼻咽癌CNE-2细胞增殖、凋亡和存活率的影响,并探讨其相关机制,为复方苦参注射液联合放疗治疗鼻咽癌提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人鼻咽癌CNE-2细胞由广东省中医药科学院提供。复方苦参注射液(国药准字Z14021231)由山西振东制药股份有限公司生产,100 mL注射液中含生药40 g。DMEM培养基(批号C1195500BT)、胰酶(批号25200-056)和胎牛血清(批号A3160801)购自美国Gibco公司,青霉素-链霉素(批号SV30010)和PBS缓冲液(批号SH30256.01)购自美国HyClone公司,Annexin Ⅴ-FITC/PI apoptosis Kit-AP101细胞凋亡检测试剂盒(批号AP101)购自中国联科生物公司。Infinite M1000 PRO多功能酶标仪由奥地利Tecan公司生产,5430R低温高速离心机由德国Eppendorf公司生产,IC1000全自动细胞计数仪由美国Countstar公司生产,FC500流式细胞仪由美国Beckman公司生产,MultiRad225放射仪由美国Faxitron公司生产。
1.2 细胞培养和分组培养基配方为含100 mL·L-1胎牛血清(fetal bovine serum,FBS)、100 U·mL-1青霉素和100 U·mL-1链霉素的高糖DMEM,于37℃、5% CO2、饱和湿度的细胞培养箱中培养,待细胞融合度达到70%~80%时进行传代,取对数生长期细胞进行实验,将细胞随机分为对照组、放射组和苦参+放射组(联合组)。对照组:不给药,不照射;放射组:只照射,不给药;联合组:给予浓度为20%半数抑制浓度(IC50)的复方苦参注射液处理细胞48 h后照射。
1.3 四甲基偶氮唑盐(MTT)法检测各组CNE-2细胞增殖抑制率取对数生长期细胞接种于96孔板,每孔200μL,培养24 h,按2倍梯度稀释法加入复方苦参注射液,使其终浓度分别为1、2、4、8和16 g·L-1,每个剂量设5孔,培养细胞24、48和72 h后,弃上清,PBS清洗,每孔加入MTT溶液20μL,继续培养4 h后,弃上清,加入150μL DMSO,震荡10 min,采用酶标仪检测各孔在波长为450 nm时的吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率= (对照组A值-实验组A值)/对照组A值×100%。实验重复3次,取平均值。计算复方苦参注射液对CNE-2细胞的IC50。取对数生长期细胞随机分为对照组、放射组和苦参+放射组(联合组),X射线照射剂量分别为2和4 Gy,计算各组细胞增殖抑制率。实验重复3次,取平均值。
1.4 流式细胞术检测各组CNE-2细胞凋亡率取对数生长期细胞制成单细胞悬液,接种1×105个细胞于60 mm培养皿中,X射线照射剂量为2 Gy,处理后PBS冲洗待检测细胞,加入500 μL Binding Buffer重悬细胞,每管加入5μL Annexin Ⅴ-FITC和10μL PI,混匀后室温避光孵育5 min,采用流式细胞术进行检测。实验重复3次,取平均值。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.5 细胞克隆形成实验检测各组CNE-2细胞存活率取各组对数生长期细胞接种于培养皿中,X射线照射剂量为2 Gy,细胞照射后继续培养10~14 d,倒掉培养基,PBS洗涤2次,加甲醇固定15 min,0.1%结晶紫染色10 min,清水冲洗后于荧光显微镜下观察克隆细胞集落形态。细胞存活率=处理组克隆形成率/对照组克隆形成率×100%。
1.6 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组细胞增殖抑制率、细胞凋亡率和细胞存活率以x±s表示,多组间样本均数比较采用单因素方差分析,两两多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 不同浓度复方苦参注射液处理后CNE-2细胞增殖抑制率不同浓度复方苦参注射液处理CNE-2细胞24、48和72 h后,细胞增殖抑制率较未经复方苦参注射液处理的细胞升高(P<0.05),且随着药物剂量而增加,细胞增殖抑制率也升高,提示复方苦参注射液对CNE-2细胞增殖的抑制作用呈现一定的剂量依赖关系。当处理时间小于48 h时,细胞增殖抑制率随着时间的延长呈现逐渐升高的趋势,48 h时细胞增殖抑制率高于24 h时(P<0.05)。但处理时间延长至72 h时,细胞抑制率较48 h反而减少,组间比较差异无统计学意义(P>0.05)。24、48和72 h时CNE-2细胞的IC50分别为14.53、5.46和7.10 g·L-1。见表 1。放射剂量为2和4 Gy时联合组鼻咽癌CNE-2细胞增殖抑制率分别为(54.10±2.77)%和(57.18±4.30)%,高于放射组(37.97%±2.38%和40.56%±1.72%),组间比较差异有统计学意义(P<0.05)。
| (x±s, η/%) | |||||||||||||||||||||||||||||
| Concentration(g·L-1) | Inhibitory rate of proliferation | ||||||||||||||||||||||||||||
| (t/h) 24 | 48 | 72 | |||||||||||||||||||||||||||
| 0 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | ||||||||||||||||||||||||||
| 1 | 6.81±2.52* | 35.84±1.97*△ | 32.80±1.13*△ | ||||||||||||||||||||||||||
| 2 | 7.88±4.14* | 37.96±1.95*△ | 35.94±1.91*△ | ||||||||||||||||||||||||||
| 4 | 11.31±8.68* | 48.51±1.17*△ | 42.73±4.55*△ | ||||||||||||||||||||||||||
| 8 | 18.27±2.90* | 59.86±0.81*△ | 55.26±5.86*△ | ||||||||||||||||||||||||||
| 16 | 58.71±3.39* | 76.24±2.83*△ | 70.90±3.06*△ | ||||||||||||||||||||||||||
| * P<0.05 compared with 0 g·L-1; △ P<0.05 compared with 24 h. | |||||||||||||||||||||||||||||
放射组CNE-2细胞凋亡率高于对照组,差异有统计学意义(P<0.05);联合组CNE-2细胞的凋亡率较放射组升高,组间比较差异有统计学意义(P<0.05)。见表 2和图 1。
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Apoptotic rate | Survival rate | |||||||||||||||||||||||||||
| Control | 2.2±0.3 | 100.0±0.0 | |||||||||||||||||||||||||||
| Irradiation | 4.3±1.0* | 42.3±3.6* | |||||||||||||||||||||||||||
| Combination | 8.3±2.6*△ | 33.5±3.8*△ | |||||||||||||||||||||||||||
| * P<0.05 compared with control group; △ P<0.05 compared with irradiation group. | |||||||||||||||||||||||||||||
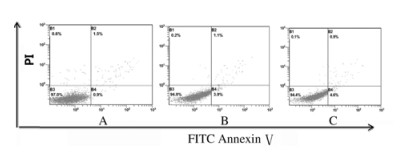
|
| A: Control group; B: Irradiation group; C: Combination group. 图 1 各组CNE-2细胞凋亡率 Fig. 1 Apoptotic rates of CNE-2 cells in various groups |
|
|
放射组CNE-2细胞存活率高于联合组,组间比较差异有统计学意义(P<0.05),见表 2。各组CNE-2细胞克隆形成情况见图 2(插页六)。
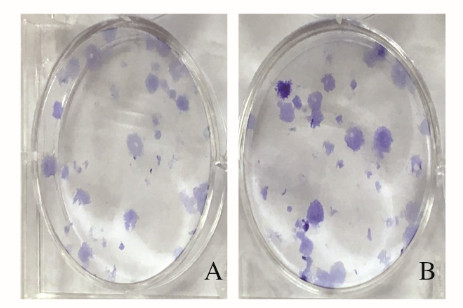
|
| A:Combination group; B:Irradiation group. 图 2 各组CNE-2细胞克隆形成情况 Fig. 2 Clone formation of CNE-2 cells in various groups |
|
|
天然抗肿瘤药物具有抑制肿瘤细胞增殖、诱导其凋亡且不良反应小等优点, 是目前国内外的研究热点[10-11]。复方苦参注射液是苦参、白土苓两味中药经现代技术加工制成的中药复方制剂,研究显示复方苦参注射液可通过抑制肿瘤细胞增殖、促进其凋亡、抑制肿瘤新生血管生成的作用发挥抗肿瘤活性[12],但其对鼻咽癌抑制作用的研究尚未见报道。本研究结果显示:不同浓度复方苦参注射液均可明显抑制CNE-2细胞增殖,并呈现一定的剂量和时间依赖关系。
有学者[13]报道复方苦参注射液体外对肿瘤细胞的放射增敏作用,但对其作用浓度和作用机制未做深入探讨。本实验结果显示:当作用时间为0~48 h时,复方苦参注射液对CNE-2细胞的增殖抑制率与作用时间呈正相关关系,因此,选择48 h为复方苦参注射液处理CNE-2细胞的时间。通常选用不敏感、低细胞毒性的药物浓度即IC50的1/5来测定药物的放射增敏作用[14], 因此本研究选择复方苦参注射液的浓度为1.1 g·L-1。本研究比较放射联合复方苦参注射液与单纯放射对CNE-2细胞增殖和存活率的影响,结果发现放射联合复方苦参注射液干预后,CNE-2细胞增殖抑制率增加,存活率降低,说明复方苦参注射液提高了鼻咽癌CNE-2细胞的放射敏感性。
细胞凋亡在放射反应机制中占有重要地位,放射敏感性与肿瘤细胞自发性凋亡水平呈正相关关系[15-17]。有研究[18]显示鼻咽癌组织中细胞自发凋亡率与瘤体的消退率呈正相关关系,对离体鼻咽癌细胞株的研究证实辐射相对敏感的CNE-2细胞较辐射相对抵抗的CNE-1细胞,其早、晚期凋亡率更高,进一步支持鼻咽癌细胞凋亡与放射敏感性之间可能存在一定相关性[19]。流式细胞术可以在凋亡的早期阶段细胞还未出现形态学改变时检测细胞凋亡率,本研究通过流式细胞仪检测发现:经过放射后联合组CNE-2细胞凋亡率较放射组增加,与文献[20-21]报道一致,提示复方苦参注射液通过促进放射线诱导的CNE-2细胞凋亡,从而提高鼻咽癌CNE-2细胞的放射敏感性。
本研究初步探讨了复方苦参注射液对人鼻咽癌细胞的放射增敏作用,但尚停留在体外细胞实验阶段,未来应进行更多动物实验和临床研究探讨复方苦参注射液对鼻咽癌细胞的放射增敏作用,为提高鼻咽癌放射治疗的疗效提供依据。
| [1] |
TANG L L, CHEN W Q, XUE W Q, et al. Global trends in incidence and mortality of nasopharyngeal carcinoma[J]. Cancer Lett, 2016, 374(1): 22-30. |
| [2] |
MARKS J E, BEDWINEK J M, LEE F, et al. Dose response analysis fornasopharyngeal carcinoma: an historical perspective[J]. Cancer, 1982, 50(6): 1042-1050. |
| [3] |
HSU H C, CHEN C L, HSU M M, et al. Pathology of nasopharyngeal carcinoma. Proposal of a new histologic classification correlatedwith prognosis[J]. Cancer, 2015, 59(5): 945-951. |
| [4] |
SU S F, HAN F, ZHAO C, et al. Treatment outcomes for different subgroups of nasopharyngeal carcinoma patients treated with intensity-modulated radiation therapy[J]. Chin J Cancer, 2011, 30(8): 565-573. |
| [5] |
李博, 康敏, 陆颖, 等. 鼻咽癌调强放射治疗后局部与区域复发模式[J]. 中国癌症防治杂志, 2018, 10(2): 124-128. |
| [6] |
MU XQ, MA J, ZHANG ZJ, et al. Famitinib enhances nasopharyngeal cancer cell radiosensitivity by attenuating radiation-induced phosphorylation of platelet-derived growth factor receptor and c-kit and inhibiting microvessel formation[J]. Int J Radiat Biol, 2015, 91(9): 771-776. |
| [7] |
SUN Z Y, PAN X, ZOU Z W, et al. Increased SHP-1 expression results in radioresistance, inhibition of cellular senescence, and cell cycle redistribution in nasopharyngeal carcinoma cells[J]. Radiat Oncol, 2015, 10: 152. |
| [8] |
肖冰. 复方苦参注射液对宫颈癌患者免疫功能及炎症反应的影响[J]. 内蒙古中医药, 2019, 38(2): 91-92, 97. |
| [9] |
张志聪, 张慧芝, 万永红. 复方苦参注射液对宫颈鳞癌放疗增敏效果观察和评价[J]. 大同大学学报:自然科学版, 2018, 34(5): 51-53. |
| [10] |
PIEME C A, SANTOSH G K, TEKWU E M, et al. Fruits and barks extracts of Zanthozyllum heitzii a spice from Cameroon induce mitochondrial dependent apoptosis and G0/G1 phase arrest in human leukemia HL-60 cells[J]. Biol Res, 2014, 47(1): 54-59. |
| [11] |
陈红红, 莫书荣, 吴忧. 黄芪注射液对人鼻咽癌CNE-1细胞增殖、凋亡及细胞周期阻滞的影响研究[J]. 广西医科大学学报, 2019, 36(1): 10-14. |
| [12] |
董俊, 晏菲, 邓洁, 等. 复方苦参注射液抗肿瘤机制及其临床应用进展[J]. 天津医学, 2019, 31(1): 71-74. |
| [13] |
袁选举, 王贤和. 复方苦参注射液对宫颈癌细胞体外放射增敏作用研究[J]. 现代中西医结合杂志, 2016, 25(23): 2509-2511, 2525. |
| [14] |
张均田. 现代药理实验方法[M]. 2版. 北京: 北京医科大学、中国协和医科大学联合出版社, 1998: 952-953.
|
| [15] |
MEYN R E, STEPHENS L C, ANG K K, et al. Heterogeneity in the development of apoptosis in irradiated murine tumours of different histologies[J]. Int J Radiat Biol, 1993, 64(5): 583-591. |
| [16] |
VELLANKI S H, GRABRUCKER A, LIEBAU S, et al. Small-molecule XIAP inhibitors enhance gamma-irradiation induced apoptosis in glioblastoma[J]. Neoplasia, 2009, 11(8): 743-752. |
| [17] |
刘国慧, 谷安鑫, 殷洪涛, 等. 原苏木素A对胃癌SGC-7901细胞系放疗增敏作用的研究[J]. 实用肿瘤学杂志, 2017, 31(6): 500-505. |
| [18] |
钟晓鸣, 邬蒙. 鼻咽癌中自发凋亡与临床放射敏感性的研究[J]. 实用癌症杂志, 2008, 23(6): 619-621. |
| [19] |
王若峥, 吴冉, 黄莉, 等. 人鼻咽癌细胞株自发性凋亡与放射敏感性的研究[J]. 中国肿瘤临床, 2013, 40(9): 491-495. |
| [20] |
胡万宁, 王晓红, 王建功, 等. 复方苦参注射液体外诱导鼻咽癌CNE-2细胞凋亡的作用及机制[J]. 山东医药, 2011, 51(9): 92-93. |
| [21] |
陆佳扬, 黄宝添, 李梅, 等. 应用放射生物学模型比较早期鼻咽癌不同放疗剂量分割方案[J]. 中国医学物理学杂志, 2019, 36(6): 626-631. |
 2019, Vol. 45
2019, Vol. 45


