扩展功能
文章信息
- 赵翠, 王淼, 张颖, 冯玉梅, 曹亚文, 蒋海森, 李伟
- ZHAO Miao, WANG Yi, ZHANG Ying, FENG Yumei, CAO Yawen, JIANG Haisen, LI Wei
- 姜黄素对睡眠剥夺小鼠认知功能的改善作用及其机制
- Improvement effect of curcumin on cognitive function in mice with sleep deprivation and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1373-1378
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1373-1378
- 10.13481/j.1671-587x.20190630
-
文章历史
- 收稿日期: 2019-01-14
2. 解放军第309医院心理医学科, 北京 100080
2. Department of Psychological Medicine, No. 309 Hospital of PLA, Beijing 100080, China
睡眠具有促进生长发育、维持个体生存和形成记忆等功能,睡眠剥夺是指由于自身原因或者环境原因无法满足正常的睡眠(一般指24 h睡眠不足4 h),从而引起的学习记忆、情绪和免疫功能等一系列的变化,并伴有疲劳增加引起的心理、生理甚至行为的改变。研究[1]显示:睡眠剥夺对学习、记忆和行为等认知能力的损伤比较明显,但睡眠剥夺引起认知功能障碍的机制尚不清楚,免疫功能和睡眠关系密切,失眠时间过长可影响免疫功能,抑郁症等和免疫功能相关的疾病与睡眠剥夺有关,免疫系统的激活可由Toll样受体4(Toll-like receptors,TLRs)介导,引起核转录因子κB(nuclear transcription factor-κB,NF-κB)激活和转位,产生白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)等致炎因子,从而引起睡眠剥夺[2]。姜黄素具有清除自由基、抗氧化、抗肿瘤和抗炎等作用,可通过抑制NF-κB信号通路发挥抑制炎症反应的作用[3]。研究[4]显示:姜黄素可改善睡眠剥夺小鼠的学习记忆能力,但姜黄素改善睡眠剥夺小鼠学习记忆能力的机制尚不清楚。本文作者研究姜黄素对睡眠剥夺小鼠认知功能和海马组织中TLR4/NF-κB信号通路的影响,探讨姜黄素是否通过TLR4/NF-κB信号通路改善睡眠剥夺小鼠的认知功能。
1 材料与方法 1.1 动物、主要试剂和仪器清洁级、健康、雄性C57小鼠100只,8~12周龄,体质量20~22 g,购自中国科学院微生物研究所,动物许可证号:SYXK(京)2014-0032。ELISA试剂盒和RT-PCR试剂盒(美国Sigma公司),TLR4兔抗鼠抗体和NF-κB p65兔抗鼠抗体(美国BD公司)。CFX Manager RT-PCR仪(美国BIO-RAD公司)。
1.2 小鼠分组将100只小鼠根据随机数字表法分为对照组(不做任何处理)、模型组(建立睡眠剥夺模型)、低剂量姜黄素组(睡眠剥夺模型+低剂量姜黄素)、中剂量姜黄素组(睡眠剥夺模型+中剂量姜黄素)和高剂量姜黄素组(睡眠剥夺模型+高剂量姜黄素),每组20只。
1.3 睡眠剥夺小鼠模型的建立小鼠睡眠剥夺模型采用改良多平台水环境睡眠剥夺法[5]:自制20 cm×30 cm×40 cm透明水箱,水箱内设高5 cm、直径2 cm圆形平台10个,每个平台之间距离为5 cm,水箱中注入自来水至水面低于平台1 cm,水温约22°,将小鼠放到平台上连续睡眠剥夺72 h(若小鼠睡眠会因头触水或者落入水中惊醒),并持续给予日光灯照射。正常组小鼠在规格相同的水箱中放入直径15 cm的平台,小鼠可以在平台上自由活动。
1.4 各组小鼠给药公试建立睡眠剥夺模型后给予小鼠药物处理,低、中和高剂量姜黄素组小鼠分别腹腔注射5、10和20 mg·kg-1姜黄素[4],每天1次,共3 d,对照组和模型组小鼠每天腹腔注射等量生理盐水。
1.5 Morris水迷宫实验[6]每组取10只小鼠进行水迷宫实验,自制直径100 cm、高50 cm水池,将其分为4个象限,水池中任一象限中放置圆柱形平台,水池注水至超过平台2 cm,水迷宫实验分为定位航行实验和空间探索试验。第1天进行定位航行实验:将水池中注水至高出圆柱形平台2 cm,水温约25°,将小鼠放入水池中进行训练,依次将小鼠从各个象限放入水中,小鼠在水中找到平台,并爬上平台停留30 s,如果小鼠在2 min内未找到平台,则指引小鼠找到平台,并爬上平台停留30 s,然后休息2 min再进行下一次训练,每次训练2 min,每天上午训练4次,下午训练4次,每次1个象限,平台逃避潜伏期为大鼠找到平台的时间。第2天进行空间探索实验:去除水池中圆柱形平台,从任一象限放入小鼠,记录小鼠在各象限的游泳时间、在原圆柱形平台所在象限内停留时间、小鼠游泳速度和穿越原平台象限次数。
1.6 旷场实验每组剩余10只小鼠进行旷场实验,对小鼠进行行为学评价:将小鼠放置在正方形的旷场箱中央,记录小鼠5 min内水平得分和垂直得分,水平得分为小鼠水平穿越格子的数量,垂直运动得分为小鼠直立次数。
1.7 标本采集水迷宫实验结束后,麻醉断头处死小鼠,取出小鼠大脑,并分离得到海马组织,用于ELISA检测。旷场实验结束后,麻醉断头处死小鼠,取出小鼠大脑,并分离得到海马组织,用于免疫组织化学染色。
1.8 小鼠海马组织中IL-1β和IL-6水平测定取小鼠海马组织加入生理盐水匀浆,匀浆液离心(10 000 g)20 min,取上清液,采用ELISA法测定小鼠海马组织中IL-1β和IL-6水平。
1.9 小鼠海马组织中TLR4和NF-κB p65蛋白表达水平测定采用Western blotting法测定小鼠海马组织中TLR4和NF-κB p65蛋白表达水平,取小鼠海马组织,使用液氮将海马组织研磨,取20 mg海马组织加入EP管中,加入RIPA裂解液,充分裂解后离心(14 000 g)5 min,取上清液采用BCA法测定海马蛋白浓度,制备凝胶、蛋白变性、电泳、转膜、封闭,加入一抗过夜孵育,以β-actin为内参照,加入二抗孵育1 h,采用ECL发光,采用成像系统拍照分析条带灰度值,计算TLR4和NF-κB p65蛋白表达水平。TLR4/NF-κB p65蛋白表达水平=TLR4/NF-κB p65蛋白条带灰度值/β-actin条带灰度值。
1.10 小鼠海马组织中IL-1β、IL-6、TLR4和NF-κB mRNA表达水平测定采用RT-PCR法测定小鼠海马组织中IL-1β、IL-6、TLR4和NF-κB mRNA表达水平。取小鼠海马组织研磨后装入EP管中,加入RNA提取试剂提取海马组织总RNA,加入三氯甲烷静置5 min,加入异丙醇静置10 min,测定总RNA浓度和纯度,将RNA反转录合成cDNA,进行PCR扩增,PCR反应条件为95℃、2 min,95℃、15 s,58℃、20 s,65℃、30 s,共40个循环。采用2-ΔΔCt法计算海马组织中IL-1β、IL-6、TLR4和NF-κB mRNA表达水平。
1.11 统计学分析采用SPSS 20.0统计软件进行统计学分析。小鼠逃避潜伏期,停留原平台象限时间,穿越原平台次数和速度,旷场实验垂直得分和水平得分,海马组织中IL-1β和IL-6水平,海马组织中TLR4和NF-κB p65蛋白表达水平以及海马组织中IL-1β、IL-6、TLR4和NF-κB mRNA表达水平均符合正态分布,均以x±s表示,多组间样本均数比较采用方差分析,组内两两比较采用LSD检验。以α=0.05为检验水准。
2 结果 2.1 各组小鼠水迷宫实验检测指标与对照组比较,模型组和各剂量姜黄素组小鼠逃避潜伏期延长(P < 0.05),停留原平台象限时间缩短(P < 0.05),穿越原平台次数减少(P < 0.05);与模型组比较,各剂量姜黄素组小鼠逃避潜伏期缩短(P < 0.05),停留原平台象限时间延长(P < 0.05),穿越原平台次数增加(P < 0.05),且呈剂量依赖性;各组小鼠游泳速度比较差异无统计学意义(P>0.05)。见表 1。
| (n=10, x±s) | |||||||||||||||||||||||||||||
| Group | Escape latency(t/s) | Time of staying on original platform quadrant (t/s) | Times of clossing original platform | Swimming speed[v/(cm·s-1)] | |||||||||||||||||||||||||
| Control | 85.63±13.24 | 43.91±5.73 | 6.89±0.87 | 15.12±2.36 | |||||||||||||||||||||||||
| Model | 114.27±14.83* | 21.57±4.72* | 2.25±0.64* | 16.24±2.15 | |||||||||||||||||||||||||
| Curcumin | |||||||||||||||||||||||||||||
| Low dose | 106.47±12.15*△ | 26.86±5.03*△ | 3.37±0.71*△ | 14.97±2.22 | |||||||||||||||||||||||||
| Middle dose | 99.53±13.05*△ | 32.46±5.12*△ | 4.15±0.74*△ | 15.21±2.17 | |||||||||||||||||||||||||
| High dose | 92.13±13.75*△#○ | 37.97±4.98*△#○ | 5.04±0.83*△#○ | 15.78±2.38 | |||||||||||||||||||||||||
| F | 7.113 | 29.614 | 53.049 | 0.554 | |||||||||||||||||||||||||
| P | < 0.01 | < 0.01 | < 0.01 | 0.697 | |||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of curcumin group; ○ P < 0.05 compared with middle dose of curcumin group. | |||||||||||||||||||||||||||||
与对照组比较,模型组和各剂量姜黄素组小鼠旷场实验垂直得分和水平得分升高(P < 0.05);与模型组比较,各剂量姜黄素组小鼠旷场实验垂直得分和水平得分降低(P < 0.05),且呈剂量依赖性。见表 2。
| (n=10, x±s) | |||||||||||||||||||||||||||||
| Group | Rearing score | Crossing score | |||||||||||||||||||||||||||
| Control | 15.46±4.25 | 42.15±6.47 | |||||||||||||||||||||||||||
| Model | 29.54±4.37* | 69.43±6.24* | |||||||||||||||||||||||||||
| Curcumin | |||||||||||||||||||||||||||||
| Low dose | 25.63±4.28*△ | 63.25±6.18*△ | |||||||||||||||||||||||||||
| Middle dose | 22.13±4.41*△ | 56.72±6.41*△ | |||||||||||||||||||||||||||
| High dose | 17.64±4.15*△#○ | 49.79±6.32*△#○ | |||||||||||||||||||||||||||
| F | 17.878 | 28.964 | |||||||||||||||||||||||||||
| P | < 0.01 | < 0.01 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of curcumin group; ○ P < 0.05 compared with middle dose of curcumin group. | |||||||||||||||||||||||||||||
与对照组比较,模型组和各剂量姜黄素组小鼠海马组织中IL-1β和IL-6水平升高(P < 0.05);与模型组比较,各剂量姜黄素组小鼠海马组织中IL-1β和IL-6水平降低(P < 0.05),且呈剂量依赖性。见表 3。
| [n=10, x±s, ρB/(ng·L-1)] | |||||||||||||||||||||||||||||
| Group | IL-1β | IL-6 | |||||||||||||||||||||||||||
| Control | 86.46±11.43 | 32.14±4.57 | |||||||||||||||||||||||||||
| Model | 354.23±13.24* | 143.25±4.86* | |||||||||||||||||||||||||||
| Curcumin | |||||||||||||||||||||||||||||
| Low dose | 276.56±12.75*△ | 118.75±5.46*△ | |||||||||||||||||||||||||||
| Middle dose | 221.48±13.03*△ | 95.33±4.92*△ | |||||||||||||||||||||||||||
| High dose | 175.35±12.54*△#○ | 61.42±4.87*△#○ | |||||||||||||||||||||||||||
| F | 644.310 | 803.236 | |||||||||||||||||||||||||||
| P | < 0.01 | < 0.01 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with high low of curcumin group; ○ P < 0.05 compared with middle dose of curcumin group. | |||||||||||||||||||||||||||||
与对照组比较,模型组和各剂量姜黄素组小鼠海马组织中TLR4和NF-κB p65蛋白表达水平升高(P < 0.05);与模型组比较,各剂量姜黄素组小鼠海马组织中TLR4和NF-κB p65蛋白表达水平降低(P < 0.05),且呈剂量依赖性。见表 4和图 1。
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | TLR4 | NF-κB p65 | |||||||||||||||||||||||||||
| Control | 0.09±0.04 | 0.13±0.05 | |||||||||||||||||||||||||||
| Model | 0.63±0.08* | 0.66±0.10* | |||||||||||||||||||||||||||
| Curcumin | |||||||||||||||||||||||||||||
| Low dose | 0.52±0.10*△ | 0.49±0.09*△ | |||||||||||||||||||||||||||
| Middle dose | 0.38±0.07*△ | 0.34±0.08*△ | |||||||||||||||||||||||||||
| High dose | 0.27±0.06*△#○ | 0.23±0.07*△#○ | |||||||||||||||||||||||||||
| F | 84.094 | 69.201 | |||||||||||||||||||||||||||
| P | < 0.01 | < 0.01 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of curcumin group; ○ P < 0.05 compared with middle dose of curcumin group. | |||||||||||||||||||||||||||||
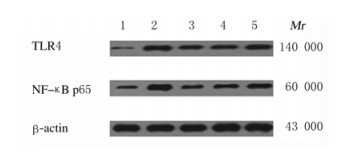
|
| Lane 1: Control group; Lane 2: Model group; Lane 3: High dose of group; Lane 4: Middle dose of curumin group; Lane 5: Low dose of curcumin group. 图 1 Western blotting法检测各组小鼠海马组织中TLR4和NF-κB p65蛋白表达电泳图 Fig. 1 Electrophoregram of expressions of TLR4 and NF-κB p65 proteins in hippocampus tissue of mice in various groups detected by Western blotting method |
|
|
与对照组比较,模型组和各剂量姜黄素组小鼠海马组织中IL-1β、IL-6、TLR4和NF-κB mRNA表达水平升高(P < 0.05);与模型组比较,各剂量姜黄素组小鼠海马组织中IL-1β、IL-6、TLR4和NF-κB mRNA表达水平降低(P < 0.05),且呈剂量依赖性。见表 5。
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | IL-1β mRNA | IL-6 mRNA | TLR4 mRNA | NF-κB mRNA | |||||||||||||||||||||||||
| Control | 0.31±0.07 | 0.11±0.03 | 0.15±0.06 | 0.21±0.05 | |||||||||||||||||||||||||
| Model | 0.83±0.09* | 0.77±0.08* | 0.59±0.05* | 0.64±0.04* | |||||||||||||||||||||||||
| Curcumin | |||||||||||||||||||||||||||||
| Low dose | 0.70±0.11*△ | 0.61±0.10*△ | 0.45±0.05*△ | 0.51±0.03*△ | |||||||||||||||||||||||||
| Middle dose | 0.58±0.08*△ | 0.42±0.07*△ | 0.36±0.04*△ | 0.42±0.04*△ | |||||||||||||||||||||||||
| High dose | 0.46±0.10*△#○ | 0.26±0.05*△#○ | 0.27±0.03*△#○ | 0.33±0.06*△#○ | |||||||||||||||||||||||||
| F | 49.343 | 141.356 | 127.387 | 133.186 | |||||||||||||||||||||||||
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of curcumin group; ○ P < 0.05 compared with middle dose of curcumin group. | |||||||||||||||||||||||||||||
睡眠剥夺的损伤过程比较复杂,持续睡眠缺失或者睡眠剥夺可引起机体应激反应,造成机体代谢紊乱、免疫功能受损和TLR4/NF-κB信号通路激活,从而产生大量炎性细胞因子,引起脑细胞损伤,导致患者认知能力降低[6-8]。TLR4为脂多糖受体之一,TLR4活化后与MyD88相结合,引起NF-κB信号激活,从而引起IL-1β和IL-6等炎性细胞因子的释放[9]。郭尚函等[10]研究显示:睡眠剥夺后TLR4信号通路关键基因(TLR4和NF-κB等)水平升高,认为失眠影响机体免疫功能,激活TLR4/NF-κB信号通路。IL-1β为免疫系统和中枢神经系统相互作用的关键信使之一[11];睡眠剥夺时间越长脑组织中IL-1β水平越高,高水平IL-1β可对海马部位的神经元兴奋性和突触功能产生抑制作用,导致认知功能异常[12]。IL-6为一种具有多种功能的细胞因子,参与睡眠剥夺的发病过程[13-14];IL-6水平升高和认知功能障碍关系密切,脑组织中IL-6水平升高可引起脑组织细胞损伤,从而引起认知功能障碍[15-16]。本文作者对睡眠剥夺小鼠的认知功能和海马组织中TLR4/NF-κB信号通路以及IL-1β和IL-6水平进行研究发现:睡眠剥夺小鼠的逃避潜伏期延长,停留原平台象限时间和穿越原平台次数降低,旷场实验的水平得分和垂直得分升高,海马组织中TLR4、NF-κB、IL-1β和IL-6水平升高,表明睡眠剥夺小鼠存在学习、记忆和行为等认知功能方面障碍,其机制可能与睡眠剥夺引起应激反应导致海马组织中TLR4/NF-κB信号通路激活,引起其下游IL-1β和IL-6等炎性细胞因子水平升高有关,高水平IL-1β和IL-6抑制海马神经元的兴奋性和突触功能,从而导致小鼠认知功能异常。姜黄素为姜黄根茎中的一种化学成分,其毒性低、不良反应比较小,具有抗肝纤维化、抗凝、抗肿瘤、抗动脉粥样硬化、抗感染、抗病毒、抗氧化、调节免疫反应、抗炎和清除自由基等多种药理活性[17-18],可改善脑缺血、自身免疫性疾病、动脉粥样硬化及代谢性疾病等多种疾病症状[19]。姜黄素可改善睡眠剥夺小鼠的学习记忆能力[4],可通过提高心肌组织的抗氧化能力、降低炎症因子水平、减轻氧化应激损伤等机制保护睡眠剥夺小鼠的心肌组织[20]。有研究[21]显示姜黄素可通过TLR4/NF-κB信号通路发挥抑制炎症反应的作用。周燕利等[21]研究发现姜黄素可通过抑制TLR4/NF-κB信号通路减轻癫痫小鼠神经元损伤。但姜黄素是否通过TLR4/NF-κB信号通路抑制炎症反应从而改善睡眠剥夺小鼠的认知功能尚不清楚。本研究结果显示:姜黄素可缩短睡眠剥夺小鼠的逃避潜伏期,增加停留原平台象限时间和穿越原平台次数,降低旷场实验的水平得分和垂直得分,降低海马组织中TLR4、NF-κB、IL-1β和IL-6水平,表明姜黄素可改善睡眠剥夺小鼠的认知功能,考虑其机制可能为姜黄素通过抑制TLR4/NF-κB信号通路,降低睡眠剥夺小鼠海马组织中IL-1β和IL-6等炎性细胞因子水平,从而减轻IL-1β和IL-6对海马神经元兴奋性和突触功能的抑制作用,从而改善小鼠认知功能。
综上所述,姜黄素可能通过抑制TLR4/NF-κB信号通路降低海马组织中炎性细胞因子水平从而改善睡眠剥夺小鼠的认知功能。
| [1] |
NIR Y, ANDRILLON T, MARMELSHTEIN A, et al. Selective neuronal lapses precede human cognitive lapses following sleep deprivation[J]. Nat Med, 2017, 23(12): 1474-1480. DOI:10.1038/nm.4433 |
| [2] |
秦冰, 杨莉, 杨树利, 等. 异丙酚预处理对睡眠剥夺小鼠诱导学习记忆障碍和神经炎症的影响[J]. 中国卫生检验杂志, 2015, 25(9): 1336-1338. |
| [3] |
周银霞, 张崇, 傅海珍, 等. 姜黄素类组分通过下调TLR4/NF-κB通路抑制LPS诱导的血管内皮细胞损伤[J]. 中南药学, 2018, 16(11): 1521-1525. |
| [4] |
侯良绢, 夏菁, 黄小环. 姜黄素对睡眠剥夺小鼠学习记忆力的影响[J]. 中国生物制品学杂志, 2017, 30(6): 618-622. |
| [5] |
PHILIPS T, BENTO-ABREU A, NONNEMAN A, et al. Oligodendrocyte dysfunction in the pathogenesis of amyotrophic lateral sclerosis[J]. Brain, 2013, 136(Pt 2): 471-482. |
| [6] |
周娇娇, 阙建宇, 于雯雯, 等. Morris水迷宫检测动物学习记忆水平的方法学[J]. 中国老年学杂志, 2017, 15(24): 6274-6277. PATRICK Y, LEE A, RAHA O, et al. Effects of sleep deprivation on cognitive and physical performance in university students[J]. Sleep Biol Rhythms, 2017, 15(3): 217-225. |
| [8] |
KALIYAPERUMAL D, ELANGO Y, ALAGESAN M, et al. Effects of sleep deprivation on the cognitive performance of nurses working in shift[J]. J Clin Diagn Res, 2017, 11(8): CC01-CC03. |
| [9] |
SANTOS P D, TARGA A D S, NOSEDA A C D, et al. Cholinergic oculomotor Nnucleus activity is induced by REM sleep deprivation negatively impacting on Cognition[J]. Mol Neurobiol, 2017, 54(7): 5721-5729. DOI:10.1007/s12035-016-0112-z |
| [10] |
夏力, 董翔, 康燕, 等. 姜黄素预处理对沙漠干热环境热射病大鼠肠黏膜的损伤保护作用及对TLR4/NF-κB信号通路的影响[J]. 现代生物医学进展, 2017, 17(34): 6648-6652. |
| [11] |
郭尚函, 林炎龙, 赵仓焕, 等. 耳穴贴压对睡眠剥夺大鼠脾脏TLR4信号通路关键基因mRNA表达的影响[J]. 暨南大学学报:自然科学与医学版, 2015, 36(4): 313-318. |
| [12] |
NAKADA T, KATO T, NUMABE Y. Effects of fatigue from sleep deprivation on experimental periodontitis in rats[J]. J Periodontal Res, 2015, 50(1): 131-137. DOI:10.1111/jre.12189 |
| [13] |
SAMATRA D P G P, PRATIWI N M D, WIDYADHARMA I P E. High Il-1β serum as a predictor of decreased cognitive function in mild traumatic brain injury patients[J]. Open Access Maced J Med Sci, 2018, 6(9): 1674-1677. |
| [14] |
IRWIN M R, OLMSTEAD R, CARROLL J E. Sleep disturbance, sleep duration, and inflammation: a systematic review and meta-analysis of cohort studies and experimental sleep deprivation[J]. Biol Psychiatry, 2016, 80(1): 40-52. DOI:10.1016/j.biopsych.2015.05.014 |
| [15] |
ZOU X, HUANG W, LU F, et al. The effects of Jiao-Tai-Wan on sleep, inflammation and insulin resistance in obesity-resistant rats with chronic partial? sleep deprivation[J]. BMC Complement Altern Med, 2017, 17(1): 165. DOI:10.1186/s12906-017-1648-9 |
| [16] |
TIAN H T, DUAN X H, YANG Y F, et al. Effects of propofol or sevoflurane anesthesia on the perioperative inflammatory response, pulmonary function and cognitive function in patients receiving lung cancer resection[J]. Eur Rev Med Pharmacol Sci, 2017, 21(23): 5515-5522. |
| [17] |
KIM Y S, LEE K J, KIM H. Serum tumour necrosis factor-α and interleukin-6 levels in Alzheimer's disease and mild cognitive impairment[J]. Psychogeriatrics, 2017, 17(4): 224-230. DOI:10.1111/psyg.12218 |
| [18] |
PANAHI Y, AHMADI Y, TEYMOURI M, et al. Curcumin as a potential candidate for treating hyperlipidemia: A review of cellular and metabolic mechanisms[J]. J Cell Physiol, 2018, 233(1): 141-152. DOI:10.1002/jcp.25756 |
| [19] |
MOMTAZI-BOROJENI A A, HAFTCHESHMEH S M, ESMAEILI S A, et al. Curcumin: A natural modulator of immune cells in systemic lupus erythematosus[J]. Autoimmun Rev, 2018, 17(2): 125-135. DOI:10.1016/j.autrev.2017.11.016 |
| [20] |
MARINI E, Di GIULIO M, MAGI G, et al. Curcumin, an antibiotic resistance breaker against a multiresistant clinical isolate of Mycobacterium abscessus[J]. Phytother Res, 2018, 32(3): 488-495. DOI:10.1002/ptr.5994 |
| [21] |
刘刚, 侯良绢. 姜黄素对睡眠剥夺小鼠血清心肌酶、氧化应激酶和炎症因子表达的影响[J]. 中国生物制品学杂志, 2018, 31(9): 969-973. |
| [22] |
周燕利, 吴晓兰, 聂琼芳, 等. TLR4/NF-κB信号通路在姜黄素减轻癫痫小鼠神经元损伤中的作用[J]. 中成药, 2018, 40(9): 2065-2068. DOI:10.3969/j.issn.1001-1528.2018.09.039 |
 2019, Vol. 45
2019, Vol. 45


