扩展功能
文章信息
- 尤杨, 夏岳, 戚国庆, 高宏阳, 杨志瑜, 李柳, 赵红亮
- YOU Yang, XIA Yue, QI Guoqing, GAO Hongyang, YANG Zhiyu, LI Liu, ZHAO Hongliang
- 非布司他对高尿酸血症模型大鼠血清尿酸水平和肾组织中NLRP3蛋白表达水平的影响
- Effects of febuxostat on serum uric acid level and expression level of NLRP3 protein in kidney tissue in hyperuricemia model rats
- 吉林大学学报(医学版), 2019, 45(06): 1367-1372
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1367-1372
- 10.13481/j.1671-587x.20190629
-
文章历史
- 收稿日期: 2019-03-01
2. 河北医科大学第一医院骨二科, 河北 石家庄 050031
2. Department of Orthopaedics, First Hospital, Hebei Medical University, Shijiazhuang 050031, China
高尿酸血症是由于嘌呤代谢紊乱引起的尿酸排泄减少和(或)尿酸生成过多所导致的一种代谢性疾病,是慢性非传染性疾病的一种。高尿酸血症是痛风发生最直接和最重要的生化基础,是心血管疾病、代谢综合征和高血压等疾病的危险因素。高尿酸血症也可引起肾脏损伤,体内的尿酸大部分经肾脏排出体外,在肾脏内尿酸经肾小球滤过、肾小管的重吸收、分泌和再吸收4个过程,当体内的尿酸水平升高到超过尿酸的溶解度时便在肾组织中沉积,引起肾脏的慢性间质型炎症,导致尿酸性肾病的发生[1]。尿酸性肾病的发生机制比较复杂,炎症反应在尿酸性肾病的发生中发挥重要作用,核甘酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3; NLRP3)炎症信号通路的激活在炎症反应中具有重要作用[2]。研究[3]显示NLRP3炎症小体的激活在尿酸性肾病的发病中发挥重要作用。非布司他是黄嘌呤氧化剂抑制剂,具有抑制尿酸生成的作用,可通过抑制炎症反应在高尿酸血症的治疗中发挥作用[4-5]。非布司他是否通过抑制NLRP3炎症小体的激活发挥对高尿酸血症患者肾损伤的肾脏保护作用尚不清楚。本文作者对非布司他对高尿酸血症模型大鼠血清尿酸和肾组织中NLRP3炎症小体的影响进行研究,探讨非布司他治疗高尿酸血症肾损伤的可能机制。
1 材料与方法 1.1 实验动物和主要试剂健康、清洁级SD大鼠45只,体质量230~260 g、雌雄各半,购自中国科学院微生物研究所,动物许可证号:SYXK(京)2014-0032。非布司他片(中国江苏万邦生化医药股份有限公司),戊巴比妥钠、氧嗪酸钾和羧甲基纤维素钠(美国Sigma公司),HE染色液、DAB显色试剂盒和ELISA试剂盒(美国Abcam公司),兔抗鼠凋亡相关斑点样蛋白(apoptosis-assaciated speck-like protein, ASC)多克隆抗体和兔抗鼠NLRP3多克隆抗体(美国Santa Cruz公司)。
1.2 大鼠高尿酸血症模型复制、分组和药物处理将45只大鼠按照随机数字法分为对照组、高尿酸血症组和非布司他组,每组15只。高尿酸血症组和非布司他组大鼠建立高尿酸血症模型[6]:将150 mg·kg-1尿酸酶抑制剂氧嗪酸钾溶解至0.5%羧甲基纤维素钠溶液中,每只大鼠每天上午9点给予1 mL·100 g-1氧嗪酸钾溶液灌胃,对照组大鼠每天上午9点给予等量0.5%羧甲基纤维素钠溶液灌胃,共4周。大鼠尿酸水平为正常大鼠的1.5~3.0倍,且出现相应的肾脏病理变化表示高尿酸血症模型建立成功。建模的同时,非布司他组大鼠每天下午3点给予7.2 mg·kg-1非布司他灌胃[7](非布司他片剂混悬液的配制:按照每组大鼠的平均体质量计算7.2 mg·kg-1混悬液所需非布司他片剂粉末的质量。用电子天平称取后溶于双蒸水中,4℃贮藏备用;使用前放置于室温中充分振荡摇匀后使用),对照组和高尿酸血症组大鼠每天下午3点给予等量生理盐水灌胃,共4周。用药结束后进行各项指标检查。
1.3 标本采集用药结束后,记录大鼠24 h饮水量,称取并记录大鼠体质量,将大鼠禁食不禁水留取24 h尿液,计算总尿量。禁食24 h后戊巴比妥钠腹腔麻醉大鼠,麻醉成功后采集大鼠心脏血液,3 500 r·min-1离心15 min,留取血清,分为2份备用。大鼠采血结束后脱颈处死,腹部消毒备皮,切开腹壁,暴露腹腔脏器,寻找肾脏,游离肾周筋膜组织和脂肪组织,快速取下双侧肾脏,洗去血迹,切开肾脏,取2块肾组织,分别用于HE染色和免疫组织化学染色。
1.4 HE染色观察各组大鼠肾组织形态表现将肾组织放入甲醛中固定,将固定好的肾组织脱水、透明、浸蜡、包埋,切成厚4μm的切片,烘干,将石蜡切片脱蜡、梯度酒精水化,苏木素染色10 min,盐酸乙醇分化,蒸馏水洗涤后返蓝10 min,加入伊红复染(复染时间根据镜下染色情况决定),梯度酒精脱水、透明、封片。拍照观察。
1.5 各组大鼠血清尿酸、肌酐和尿素氮水平测定取各组大鼠分离的血清送检,采用全自动生化仪测定大鼠血清尿酸、肌酐和尿素氮水平。
1.6 各组大鼠血清IL-1β和IL-18水平测定取各组大鼠分离血清,采用ELISA法测定血清IL-1β和IL-18水平。
1.7 各组大鼠肾组织中ASC和NLRP3蛋白表达水平测定采用免疫组织化学SP法检测各组大鼠肾组织中ASC和NLRP3蛋白表达水平:将各组大鼠肾脏组织切片脱蜡至水,将切片组织放入过氧化氢溶液中浸泡孵育20 min,消除内源性过氧化物酶的活性,PBS冲洗,将组织切片浸入修复液中修复,加入封闭液封闭20 min,加入一抗过夜孵育,加入二抗孵育1 h。加入DAB显色剂显色10 min,苏木素复染、自来水冲洗返蓝,脱水、透明、封片。阴性对照采用PBS液替代一抗。图像分析:随机选择8个不重复的100倍视野,采用Image J软件分析肾组织中ASC和NLRP3阳性染色面积,肾组织中ASC和NLRP3蛋白表达水平以阳性染色面积百分比表示。阳性染色面积百分比=阳性染色面积/总面积×100%。
1.8 统计学分析采用SPSS20.0统计软件进行统计学分析。各组大鼠尿量,饮水量,体质量,血尿酸、肌酐和尿素氮水平,血清IL-1β和IL-18水平,肾组织中ASC和NLRP3蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠尿量、饮水量和体质量与对照组比较,高尿酸血症组大鼠尿量和饮水量升高(P < 0.05),体质量降低(P < 0.05);与高尿酸血症组比较,非布司他组大鼠尿量和饮水量降低(P < 0.05),体质量升高(P < 0.05)。见表 1。
| (n=15, x±s) | |||||||||||||||||||||||||||||
| Group | Urine volume(V/mL) | Water intake(V/mL) | Body weight(m/mg) | ||||||||||||||||||||||||||
| Control | 13.92±2.74 | 33.36±3.47 | 412.53±32.64 | ||||||||||||||||||||||||||
| Hyperuricemia | 19.95±3.12* | 38.71±3.52* | 342.16±27.86* | ||||||||||||||||||||||||||
| Febuxostat | 15.28±2.96*△ | 35.25±3.69*△ | 365.37±31.14*△ | ||||||||||||||||||||||||||
| F | 17.311 | 8.706 | 20.582 | ||||||||||||||||||||||||||
| P | 0.000 | 0.000 | 0.000 | ||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with hyperuricemia group. | |||||||||||||||||||||||||||||
对照组大鼠肾组织未见明显异常;高尿酸血症组大鼠肾间质有明显纤维化形成,见大量炎性细胞浸润,肾小管局灶受损,肾小管部分管腔变大、上皮细胞变性坏死,肾小球部分萎缩或肿胀;非布司他组大鼠肾间质纤维化较轻,见少量炎性细胞浸润,肾小管和肾小球病变较轻,介于对照组和高尿酸血症组大鼠之间。见图 1(插页六)。
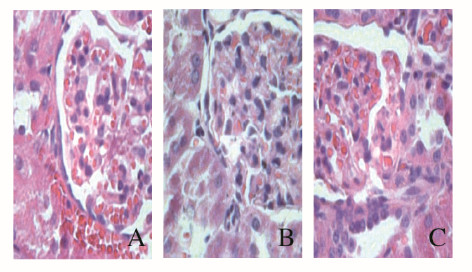
|
| A:Control group; B:Hyperuricemia group; C:Febuxostat group. 图 1 各组大鼠肾组织形态表现(HE,×400) Fig. 1 Morphology of kidney tissue of rats in various groups(HE, ×400) |
|
|
与对照组比较,高尿酸血症组大鼠血清尿酸、肌酐和尿素氮水平升高(P < 0.05);与高尿酸血症组比较,非布司他组大鼠血清尿酸、肌酐和尿素氮水平降低(P < 0.05)。见表 2。
| (n=15, x±s) | |||||||||||||||||||||||||||||
| Group | Uric acid[cB/(μmol·L-1)] | Creatinine[cB/(μmol·L-1)] | Urea nitrogen[cB/(mmol·L-1)] | ||||||||||||||||||||||||||
| Control | 142.51±9.25 | 28.18±2.14 | 5.07±1.24 | ||||||||||||||||||||||||||
| Hyperuricemia | 312.86±11.42* | 37.86±1.97* | 6.95±1.18* | ||||||||||||||||||||||||||
| Febuxostat | 178.58±12.13*△ | 33.24±2.31*△ | 6.12±1.31*△ | ||||||||||||||||||||||||||
| F | 998.675 | 76.459 | 8.597 | ||||||||||||||||||||||||||
| P | 0.000 | 0.000 | 0.000 | ||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with hyperuricemia group. | |||||||||||||||||||||||||||||
与对照组比较,高尿酸血症组大鼠血清IL-1β和IL-18水平升高(P < 0.05);与高尿酸血症组比较,非布司他组大鼠血清IL-1β和IL-18水平降低(P < 0.05)。见表 3。
| [n=15, x±s, ρB/(mg·L-1)] | |||||||||||||||||||||||||||||
| Group | IL-1β | IL-18 | |||||||||||||||||||||||||||
| Control | 15.63±3.12 | 17.52±2.87 | |||||||||||||||||||||||||||
| Hyperuricemia | 42.13±2.98* | 51.49±3.14* | |||||||||||||||||||||||||||
| Febuxostat | 22.14±3.07*△ | 26.47±3.03*△ | |||||||||||||||||||||||||||
| F | 306.056 | 511.430 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with hyperuricemia group. | |||||||||||||||||||||||||||||
免疫组织化学染色显示:对照组大鼠肾组织中有基本无ASC和NLRP3蛋白表达,高尿酸血症组大鼠肾组织中ASC和NLRP3蛋白表达量明显升高,主要在近端肾小管上皮细胞中表达,非布司他组大鼠肾组织中ASC和NLRP3蛋白表达量少于高尿酸血症组。见图 2和3(插页六)。与对照组比较,高尿酸血症组大鼠肾组织中ASC和NLRP3蛋白表达水平升高(P < 0.05);与高尿酸血症组比较,非布司他组大鼠肾组织中ASC和NLRP3蛋白表达水平降低(P < 0.05)。见表 4。
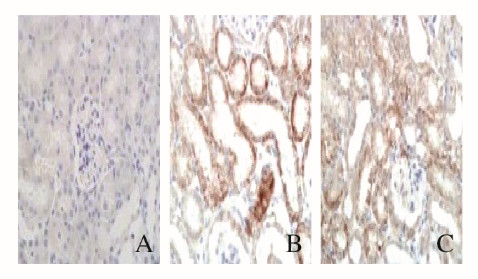
|
| A:Control group; B:Hyperuricemia group; C:Febuxostat group. 图 2 各组大鼠肾组织中ASC表达情况(免疫组织化学,×100) Fig. 2 Expressions of ASC in kidney tissue of rats in various groups (Immunohistochemistry, ×100) |
|
|
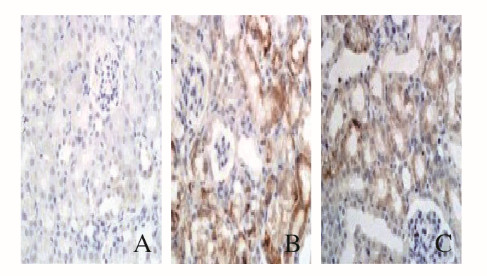
|
| A:Control group; B:Hyperuricemia group; C:Febuxostat group. 图 3 各组大鼠肾组织中NLRP3表达情况(免疫组织化学,×100) Fig. 3 Expressions of NLRP3 in kidney tissue of rats in various groups (Immunohistochemistry, ×100) |
|
|
| (n=15, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | ASC | NLRP3 | |||||||||||||||||||||||||||
| Control | 0.07±0.02 | 0.05±0.01 | |||||||||||||||||||||||||||
| Hyperuricemia | 0.29±0.06* | 0.47±0.08* | |||||||||||||||||||||||||||
| Febuxostat | 0.14±0.05*△ | 0.19±0.06*△ | |||||||||||||||||||||||||||
| F | 87.462 | 203.762 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with hyperuricemia group. | |||||||||||||||||||||||||||||
血尿酸水平超过一定量时可引起炎症细胞浸润,引起氧化应激和炎症反应[8]。当体内尿酸水平升高至超过尿酸的溶解度时则在肾组织中沉积,引起尿酸性肾病[9]。高尿酸血症引起尿酸性肾病的机制比较复杂,炎症反应在尿酸性肾病的发生中具有重要作用,高尿酸血症可导致肾脏处于炎症状态,肾组织和血清中炎性细胞因子水平升高,炎性因子水平的升高促进肾脏纤维化,从而引起尿酸性肾病[10-11]。NALP3炎症体的激活在炎症反应中发挥重要作用,高尿酸血症引起的尿酸盐结晶体作为炎症体活化剂以及外源危险相关分子模式配体,诱导活性氧类的生成,激活NALP3炎症体通路,尿酸盐结晶体被NALP3识别,激活炎症信号通路[12],信号通路的激活可引起IL-1β的释放,从而引发级联反应,导致IL-18和肿瘤坏死因子等细胞因子的产生,造成炎症反应程度放大[13-14]。ASC和NLRP3是NLRP3炎症小体的主要组成部分,ASC在炎症小体结构中具有重要作用,NLRP3和ASC的表达量同时增加可促进NF-κB的活化,NF-κB的活化促进IL-1β的释放,从而引发级联反应,导致多种其他细胞因子的产生,造成炎症反应程度放大[15]。肾脏是高尿酸血症容易损坏的靶器官之一,NLRP3炎症小体在高尿酸所致肾脏损害中发挥重要作用,张燕子等[16]发现:高尿酸血症所致肾损伤患者外周血单核细胞中NLRP3炎症小体激活,表明NLRP3炎症小体在高尿酸血症致肾脏损伤中发挥重要作用。本研究建立高尿酸血症肾损伤模型,发现高尿酸血症组大鼠血清尿酸、肌酐和尿素氮水平升高,血清IL-1β和IL-18水平升高,肾组织中ASC及NLRP3蛋白表达水平升高,肾脏明显损伤,表明高尿酸血症引起肾损伤的机制可能为血尿酸水平升高,超过尿酸的溶解度,从而在肾脏中沉积,肾脏中的尿酸盐结晶体诱导活性氧类的生成;NLRP3蛋白表达水平升高表明NALP3炎症体通路激活,尿酸盐结晶体被NALP3识别,激活炎症信号通路,信号通路的激活可引起IL-1β的释放,IL-1β引发级联反应,导致IL-18等炎性细胞因子的产生,造成炎症反应程度放大,导致肾脏损伤。
高尿酸血症的主要治疗手段为抑制尿酸生成和促进尿酸排泄,黄嘌呤氧化酶抑制剂是抑制尿酸生成药物,非布司他是黄嘌呤氧化酶抑制剂,可以抑制氧化型黄嘌呤氧化酶,还可抑制还原型黄嘌呤氧化酶,明显降低血清尿酸水平,可以通过肾脏代谢,适合在高尿酸血症并发轻、中度肾功能不全患者中应用,且取得较好效果[17-18]。非布司他可通过抑制炎症反应治疗高尿酸血症[19],林章梅等[20]研究显示:非布司他可通过降低高尿酸血症大鼠血清IL-6和转化生长因子β1水平发挥对高尿酸血症的治疗作用,但非布司他治疗高尿酸血症肾损伤是否与NALP3炎症小体通路的激活有关尚不清楚。本研究结果显示:非布司他治疗后大鼠血清血尿酸、肌酐和尿素氮水平降低,血清IL-1β和IL-18水平降低,肾组织中ASC和NLRP3蛋白表达水平降低,肾损伤明显减轻,表明非布司他可能通过抑制尿酸生成,抑制肾组织中NLRP3蛋白炎症小体激活发挥高尿酸血症肾损伤的肾脏保护作用,其机制可能为非布司他抑制尿酸生成,降低血尿酸水平,减少肾脏中的尿酸盐结晶,抑制活性氧类的生成,抑制NALP3炎症体通路的激活,从而抑制通路下游IL-1β和IL-18等炎性细胞因子的产生,减轻肾脏炎症反应,发挥肾脏保护作用。
综上所述,非布司他可通过降低血尿酸水平、抑制NALP3炎症体通路的激活发挥对高尿酸血症大鼠肾损伤的保护作用。
| [1] |
SRIVASTAVA A, KAZE A D, MCMULLAN C J, et al. Uric acidand the risks ofkidneyfailure and death in individuals with CKD[J]. Am J Kidney Dis, 2018, 71(3): 362-370. DOI:10.1053/j.ajkd.2017.08.017 |
| [2] |
胡庆华, 缪明星, 卢国, 等. 槲皮素对尿酸性肾病大鼠肾脏NLRP3和TLRs表达的影响[J]. 中草药, 2013, 44(24): 3496-3502. |
| [3] |
ROMERO C A, REMOR A, LATINI A, et al. Uric acidactivates NRLP3 inflammasome in an in-vivo model of epithelial to mesenchymal transition in thekidney[J]. J Mol Histol, 2017, 48(3): 209-218. DOI:10.1007/s10735-017-9720-9 |
| [4] |
KIM H S, LIM S W, JIN L, et al. The protective effect offebuxostaton chronic tacrolimus-induced nephrotoxicity inrats[J]. Nephron, 2017, 135(1): 61-71. DOI:10.1159/000449289 |
| [5] |
罗来敏, 陈钦开, 杨小娟. 降尿酸治疗对痛风高尿酸血症患者IL-1β和NALP3水平的影响[J]. 南昌大学学报:医学版, 2016, 56(1): 63-66. |
| [6] |
MAZZALI M, HUGHES J, KIM Y G, et al. Elevateduricacidincreasesbloodpressurein theratby a novel crystal-independent mechanism[J]. Hypertension, 2001, 38(5): 1101-1106. DOI:10.1161/hy1101.092839 |
| [7] |
林章梅, 张荣山, 范晨雪, 等. 非布司他对高尿酸血症大鼠肾小管上皮间质转化及血清IL-6、转化生长因子β1的影响[J]. 中华内科杂志, 2017, 56(5): 363-367. DOI:10.3760/cma.j.issn.0578-1426.2017.05.012 |
| [8] |
CICERELLO E. Uric acidnephrolithiasis: an update[J]. Urologia, 2018, 85(3): 93-98. DOI:10.1177/0391560318766823 |
| [9] |
LI C C, CHIEN T M, WU W J, et al. Uric acidstones increase the risk of chronickidneydisease[J]. Urolithiasis, 2018, 46(6): 543-547. DOI:10.1007/s00240-018-1050-1 |
| [10] |
RAZI F, NASLI-ESFAHANI E, BANDARIAN F. Association of serumuric acidwithnephropathyin Iranian type 2 diabetic patients[J]. J Diabetes Metab Disord, 2018, 17(1): 71-75. DOI:10.1007/s40200-018-0340-z |
| [11] |
YANG Q, FU C, XIAO J, et al. Uric acidupregulates the adiponectin adiponectin receptor1 pathway in renal proximal tubule epithelial cells[J]. Mol Med Rep, 2018, 17(3): 3545-3554. |
| [12] |
王缘, 白雪, 王艳秋, 等. NALP3在痛风炎症反应中的作用[J]. 黑龙江医药科学, 2015, 38(3): 17-18, 20. DOI:10.3969/j.issn.1008-0104.2015.03.008 |
| [13] |
HOSEINI Z, SEPAHVAND F, RASHIDI B, et al. NLRP3 inflammasome: its regulation and involvement in atherosclerosis[J]. J Cell Physiol, 2018, 233(3): 2116-2132. DOI:10.1002/jcp.25930 |
| [14] |
LÜTOLF R, HUGHES F M JR, INOUYE B M, et al. NLRP3/IL-1β mediates denervation during bladder outlet obstruction in rats[J]. Neurourol Urodyn, 2018, 37(3): 952-959. DOI:10.1002/nau.23419 |
| [15] |
VAN LIESHOUT M H P, DE VOS A F, DESSING M C, et al. ASC and NLRP3 impair host defense during lethal pneumonia caused by serotype 3 Streptococcus pneumoniae in mice[J]. Eur J Immunol, 2018, 48(1): 66-79. DOI:10.1002/eji.201646554 |
| [16] |
张燕子, 隋晓露, 许云鹏, 等. NLRP3炎症小体信号通路对痛风性肾病的影响[J]. 中华肾脏病杂志, 2018, 34(5): 387-388. DOI:10.3760/cma.j.issn.1001-7097.2018.05.011 |
| [17] |
ALSHAHAWEY M, SHAHIN S M, ELSAID T W, et al. Effect of febuxostat on the endothelial dysfunction in hemodialysis patients: a randomized, placebo-controlled, double-blinded study[J]. Am J Nephrol, 2017, 45(5): 452-459. DOI:10.1159/000471893 |
| [18] |
SABÁN-RUIZ J, ALONSO-PACHO A, FABREGATE-FUENTE M, et al. Xanthine oxidase inhibitor febuxostat as a novel agent postulated to act against vascular inflammation[J]. Antiinflamm Antiallergy Agents Med Chem, 2013, 12(1): 94-99. DOI:10.2174/1871523011312010011 |
| [19] |
NISHIZAWA T, TANIURA T, NOMURA S. Effects of febuxostat on platelet-derived microparticles and adiponectin in patients with hyperuricemia[J]. Blood Coagul Fibrinolysis, 2015, 26(8): 887-892. DOI:10.1097/MBC.0000000000000335 |
| [20] |
林章梅, 张彩香, 梁艳玲, 等. 非布司他对高尿酸血症大鼠血清白介素6和转化生长因子β1水平的影响[J]. 中国糖尿病杂志, 2017, 25(7): 655-658. DOI:10.3969/j.issn.1006-6187.2017.07.017 |
 2019, Vol. 45
2019, Vol. 45


