扩展功能
文章信息
- 王闯, 于淑莉, 李桃, 呂蓉蓉, 齐洁敏
- WANG Chuang, YU Shuli, LI Tao, LYU Rongrong, QI Jiemin
- 乙酰肝素酶和整合素α5β1蛋白在葡萄胎组织中的表达及其临床意义
- Expressions of heparanase and integrin α5β1 proteins in hydatidform mole tissue and their clinnical significances
- 吉林大学学报(医学版), 2019, 45(06): 1361-1366
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1361-1366
- 10.13481/j.1671-587x.20190628
-
文章历史
- 收稿日期: 2019-01-27
2. 河北省承德市妇幼保健院病理科, 河北 承德 067000;
3. 河北省秦皇岛市第一医院病理科, 河北 秦皇岛 066000
2. Department of Pathology, Chengde Women and Children Health Hospital, Chengde 067000, China;
3. Department of Pathology, First Hospital, Qinhuangdao City, Qinhuangdao 066000, China
依据生物学行为,葡萄胎分为良性葡萄胎和恶性葡萄胎(又称为侵袭性葡萄胎),是女性生殖系统滋养细胞疾病中常见的一大类疾病,随着计划生育二胎政策的开放,良、恶性葡萄胎的发病率呈现上升趋势,但二者预后和治疗方案明显不同。良性葡萄胎病变主要局限于子宫腔内, 一般情况下通过彻底清宫可到达治愈的疗效,而恶性葡萄胎的滋养细胞具有局部侵袭和远处转移的能力, 是导致临床治疗失败和患者死亡的根本原因,严重危害女性的身心健康。因此早期鉴别其良、恶性成为提高该病治愈率的关键性因素。侵袭和转移是恶性葡萄胎的重要临床表现之一,乙酰肝素酶(heparanase, HPA)和细胞黏附因子整合素α5β1与肿瘤侵袭和转移有关。目前HPA和整合素α5β1在良、恶性葡萄胎组织中的表达及其相关性研究未见报道,本研究采用免疫组织化学技术SP法和Western blotting法分别检测正常胎盘绒毛组织和良、恶性葡萄胎组织中HPA蛋白和整合素α5β1蛋白的表达情况以及二者的相关性,初步探讨其在葡萄胎组织发生发展过程中的作用,进而为良、恶性葡萄胎早期诊断的鉴别和精准治疗及预后评价提供实验依据。
1 资料与方法 1.1 标本来源和分组收集2016年1月~2018年10月河北省秦皇岛市第一医院、河北省承德市妇幼保健医院和承德医学院附属医院的组织标本共107例,分为正常胎盘绒毛组织标本50例(正常胎盘绒毛组)、良性葡萄胎组织标本40例(良性葡萄胎组)和恶性葡萄胎组织标本17例(恶性葡萄胎组)。所收集的标本分为两部分使用,一部分新鲜标本储存于-80℃低温冰箱备用,行Western blotting法检测,另一部分标本经过10%中性甲醛液固定,以60%、70%、80%、90%、95%和100%梯度酒精逐级进行脱水,石蜡包埋,均用石蜡切片机进行连续切片,厚度均为5 μm,行HE染色和免疫组织化学检测。
1.2 主要试剂和仪器HPA多克隆抗体(兔抗人)、整合素α5β1多克隆抗体(兔抗人)、DAB显色试剂盒、IgG二抗、免疫组织化学SP法试剂盒、β-actin多克隆抗体、BCA蛋白浓度检测试剂盒、蛋白Marker、PVDF膜和ECL发光液均购自石家庄坤渤生物科技有限公司。显微镜图像采集系统购自日本Olympus公司,石蜡切片机购自德国LEICA公司,酶标仪购自美国Thermo Scientific公司,电泳仪和转膜仪购自北京六一生物科技有限公司,全自动化学发光成像分析系统购自美国BIO-RAD有限公司。
1.3 免疫组织化学染色SP法和结果判定免疫组织化学染色SP法检测正常胎盘绒毛组织、良性葡萄胎组织和恶性葡萄胎组织中HPA蛋白和整合素α5β1蛋白的表达。实验步骤严格按照试剂公司提供的试剂盒说明书进行,HPA蛋白和整合素α5β1蛋白抗体工作浓度为1:100和1:130。DAB显色,苏木素复染。阴性对照片:PBS液代替一抗,阳性对照片:试剂公司提供已知阳性的切片。结果判定:以细胞质内呈现黄色颗粒为阳性反应。图像分析:采用CMIAS病理彩色图像分析系统,计算阳性表达率。阳性表达率=阳性细胞数/总细胞数×100%,阳性细胞率<10%为0分,10%≤阳性细胞率 < 阳性细胞率 < 45%为1分,45%≤阳性细胞率 < 70%为2分,阳性细胞率≥70%为3分。根据染色深度分别计分,染色深度以大多数细胞的呈色反应为准:不着色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分。根据上述两项的计分相乘将HPA蛋白和整合素α5β1蛋白阳性结果分成为4级:阴性为0分,以“-”表示;弱阳性为1~2分,以+表示;阳性为3~4分,以++表示;强阳性为5~6分,以+++表示。
1.4 Western blotting法检测各组组织中HPA蛋白和整合素α5β1蛋白表达量水平提取0.1 g新鲜的正常胎盘绒毛组织、良性葡萄胎组织和恶性葡萄胎组织中的总蛋白,按照BCA蛋白定量试剂盒说明书测定总蛋白浓度。12% SDS-PAGE凝胶电泳,蛋白上样量为30 μg,经10% SDS-PAGE凝胶电泳、湿转法转膜,洗膜后采用ECL化学发光法观察。一抗工作浓度:兔抗人整合素α5β1抗体浓度为1:400,兔抗人HPA抗体浓度为1:400,内参β-actin抗体浓度为1:3 000。采用Image J软件分析条带的灰度值,以目的条带灰度值与内参条带灰度值的比值表示目的蛋白表达水平。
1.5 统计学分析采用SPSS 19.0软件系统进行统计学分析。各组组织中HPA蛋白和整合素α5β1蛋白的阳性表达率比较采用χ2检验,HPA蛋白和整合素α5β1蛋白的表达强度和相对表达水平比较均采用非参数Mann-Whitney秩和检验,葡萄胎组织中HPA蛋白和整合素α5β1蛋白表达的相关性分析采用Spearman等级相关分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组组织中HPA蛋白和整合素α5β1蛋白的阳性表达率和阳性表达强度HPA蛋白和整合素α5β1蛋白的阳性表达部位均主要定位于细胞质,呈棕黄色颗粒,见图 1(插页六)。HPA蛋白在正常胎盘绒毛组组织中阳性表达率为12.0%,在良性葡萄胎组组织中阳性表达率为52.5%,在恶性葡萄胎组组织中阳性表率为88.2%。3组组织中HPA蛋白阳性表达率和阳性表达强度逐渐呈现升高趋势,组间比较差异有统计学意义(P < 0.05)。见表 1。整合素α5β1蛋白在正常胎盘绒毛组组织中阳性表达率为16.0%,良性葡萄胎组组织中阳性表达率为45.0%,恶性葡萄胎组组织中阳性表率为88.2%,3组组织中整合素α5β1蛋白阳性表达率和阳性表达强度也呈现逐渐升高趋势,各组间比较差异有统计学意义(P < 0.05)。见表 2。
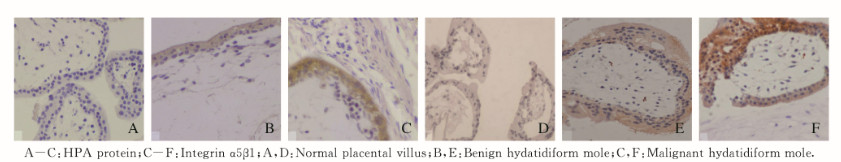
|
| 图 1 3种组织中HPA蛋白和整合素α5β1蛋白表达情况(Immunohistochemistry,×200) Fig. 1 Expressions of HPA protein and integrin α5β1 protein in three kinds of tissues(Immunohistochemistry, ×200) |
|
|
| Group | n | HPA protein | Positive expression rate (η/%) | |||
| - | + | ++ | +++ | |||
| Normal placental villus | 50 | 44 | 3 | 2 | 1 | 12.0 |
| Benign hydatidiform mole | 40 | 19 | 5 | 4 | 12 | 52.5* |
| Malignant hydatidiform mole | 17 | 2 | 3 | 5 | 7 | 88.2*△ |
| H /χ2 | H=62.674 | χ2 =35.623 | ||||
| P | P<0.05 | P<0.05 | ||||
| * P < 0.05 vs normal placental villus group; △ P < 0.05 vs benign hydatidiform mole group. | ||||||
| Group | n | Integrin α5β1 protein | Positive expression rate (η/%) | |||
| - | + | ++ | +++ | |||
| Normal placental villus | 50 | 42 | 8 | 0 | 0 | 16.0 |
| Benign hydatidiform mole | 40 | 22 | 4 | 5 | 9 | 45.0* |
| Malignant hydatidiform mole | 17 | 2 | 3 | 4 | 8 | 88.2*△ |
| H /χ2 | H=52.616 | χ2=29.215 | ||||
| P | P<0.05 | P<0.05 | ||||
| * P < 0.05 vs normal placental villus group; △ P < 0.05 vs benign hydatidiform mole group. | ||||||
Spearman相关分析显示:在40例良性葡萄胎组织中整合素α5β1蛋白和HPA蛋白的表达呈正相关关系(r=0.506,P<0.05),见表 3。在17例恶性葡萄胎组织中整合素α5β1蛋白和HPA蛋白的表达呈正相关关系(r=0.555,P<0.05)。见表 4。
| Integrin α5β1 protein | HPA protein | |||
| - | + | ++ | +++ | |
| - | 15 | 3 | 2 | 2 |
| + | 1 | 0 | 1 | 2 |
| ++ | 1 | 1 | 0 | 3 |
| +++ | 2 | 1 | 1 | 5 |
| Integrinα5β1 protein | HPA protein | |||
| - | + | ++ | +++ | |
| - | 2 | 0 | 0 | 0 |
| + | 0 | 1 | 1 | 1 |
| ++ | 0 | 1 | 2 | 1 |
| +++ | 0 | 1 | 2 | 5 |
在正常胎盘绒毛组、良性葡萄胎组和恶性葡萄胎组组织中HPA蛋白表达水平分别为0.325±0.024、0.750±0.066和1.364±0.189,组间比较差异均有统计学意义(H=29.795,P<0.05);在正常胎盘绒毛组、良性葡萄胎组和恶性葡萄胎组组织中整合素α5β1蛋白表达水平分别为0.518±0.035、0.836±0.039和1.080±0.084,组间比较差异均有统计学意义(H=29.787,P<0.05)。见图 2和表 5。

|
| Lane 1: Normal placental vill group; Lane 2:Benign hydatidiform mole group; Lane 3:Malignant hydatidiform mole group. 图 2 Westem blotting法检测各组组织中HPA蛋白和整合素α5β1蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of HPA and integrinα5β1 proteins in tissues in various groups detected by Western blotting method |
|
|
| (x±s) | |||||||||||||||||||||||||||||
| Group | n | HPA protein | Integrin α5β1 protein | ||||||||||||||||||||||||||
| Normal placental villus | 50 | 0.325±0.024 | 0.518±0.035 | ||||||||||||||||||||||||||
| Benign hydatidiform mole | 40 | 0.750±0.066* | 0.836±0.039* | ||||||||||||||||||||||||||
| Malignant hydatidiform mole | 17 | 1.364±0.189*△ | 1.080±0.084*△ | ||||||||||||||||||||||||||
| * P < 0.05 vs normal placental villus group; △ P < 0.05 vs benign hydatidiform mole group. | |||||||||||||||||||||||||||||
多数情况下,在切除后的子宫标本肌层或血管中见到水肿的绒毛浸润后才能确诊恶性葡萄胎,而子宫切除术并非临床常规的治疗手段。目前临床上对恶性葡萄胎的诊断主要依据侵袭、转移后或清宫后随访人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)水平,致使诊断明显滞后于病情发展。如何及时准确、早期预测和发现恶性葡萄胎诊断指标以精准给予预防性化疗,是目前临床医生急需解决的难题。
HPA是近年来发现的恶性肿瘤中一个重要功能酶,目前是人体内能够在特定部位进行裂解硫酸乙酰肝素蛋白聚糖的酶,能够破坏细胞外基质(extracellular matrix,ECM)和基底膜(basement membrane,BM)而促进肿瘤的恶性进展,有助于恶性肿瘤细胞顺利通过ECM和血管壁,最终出现周围组织侵袭和远处脏器转移[1]。HPA在恶性肿瘤组织中,例如乳腺癌[2]、胃癌[3]、肝癌[4]和甲状腺癌[5]组织中均有异常高表达。TANG等[6]研究结果显示:HPA在乳腺癌组织中出现高表达,且与乳腺癌的侵袭和转移有关,可作为乳腺癌进展、临床治疗的靶点及判断肿瘤生物学特性的标志物。HU等[7]应用免疫组织化学法研究显示宫颈鳞状细胞癌淋巴结转移组细胞中HPA的表达明显高于淋巴结未转移组。JIN等[8]发现HPA基因沉默抑制了胆囊癌细胞的侵袭和迁移。PISANO等[9]研究显示:HPA的活性与癌细胞的恶性行为和肿瘤的进展有关,并与预后不良有关。恶性肿瘤组织中HPA活性升高,促进肿瘤的侵袭与转移,而HPA表达的下调可以抑制肿瘤细胞的转移,是肿瘤治疗的潜在靶点[10-11]。HPA在葡萄胎组织中的表达国内外尚未见文献报道。本实验中免疫组织化学SP法和Western blotting法检测结果均一致显示:HPA蛋白在正常胎盘绒毛组织、良性葡萄胎组织和恶性葡萄胎组织中阳性表达率、阳性表达强度和表达水平均呈升高趋势,尤其是在恶性葡萄胎组织中呈现高表达,说明HPA蛋白在葡萄胎的发生及恶变过程中起关键性作用,可以为良、恶性葡萄胎鉴别诊断提供理论依据。
整合素由α和β2个亚单位形成,含有细胞内、外结构域和跨膜α螺旋。迄今发现至少由18种α亚基和8种β亚基,共可形成24种功能不同的整合素分子。整合素α5β1是由α5和β1 2个亚基结合而成的异二聚体,是黏附分子中的一大类,主要介导细胞之间、细胞与ECM间的黏附[12]。王闯等[13]采用组织芯片结合免疫组织化学SP法检测结果显示:整合素α5β1蛋白参与宫颈鳞癌发生,并且与宫颈鳞癌的发展(分化程度、临床分期、浸润深度和淋巴结转移)也有密切关系。CHI等[14]发现整合素α5β1的表达与胃癌的分化程度、TNM分期和淋巴结转移有关。整合素α5β1高表达也与大肠癌的发生密切相关[15]。SHAO等[16]研究显示:大肠癌组织中整合素α5β1在肝转移癌细胞上的表达明显高于原位癌细胞,说明高表达的整合素α5β1也与肿瘤转移有关。RENNER等[17]研究显示整合素α5β1蛋白的表达或激活能驱动胶质瘤细胞的迁移途径。在人类乳腺癌细胞中,整合素α5β1的下调能明显降低细胞的增殖率[18]。整合素α5β1在卵巢癌中高表达且与其转移、侵袭和预后密切相关[19]。徐律韵等[20]认为:整合素α5β1通过多种途径在肿瘤的发生、侵袭和转移中发挥重要作用,整合素α5β1在肿瘤组织中表达的变化也有助于肿瘤的辅助诊断和检测。目前国内外关于整合素α5β1在良、恶性葡萄胎组织中的表达及相关性的研究尚未见报道。本实验采用免疫组织化学法SP法和Western blotting法检测了正常胎盘绒毛组织和良、恶性葡萄胎组织中整合素α5β1蛋白表达结果显示:在正常胎盘绒毛组织、良性葡萄胎组织和恶性葡萄胎组织中整合素α5β1蛋白阳性表达率、阳性表达强度及相对表达水平均呈升高趋势,尤其是在恶性葡萄胎组织中其呈高表达,说明整合素α5β1蛋白在葡萄胎的发生发展中起到重要作用,可以为良、恶性葡萄胎的鉴别诊断提供理论依据。
关于HPA蛋白和整合素α5β1蛋白二者之间相关性国内外未见文献报道。本研究结果显示:在良性葡萄胎和恶性葡萄胎组织中整合素α5β1蛋白和HPA蛋白的表达均呈正相关关系,说明二者在葡萄胎发生发展过程中可能起正协同作用。
综上所述,HPA蛋白和整合素α5β1蛋白与葡萄胎的发生密切相关,其表达的异常上调可能促进葡萄胎的发生发展。临床上联合检测HPA蛋白和整合素α5β1蛋白水平可有望作为良、恶性葡萄胎鉴别诊断及评价临床预后的生物学指标,并且可以为临床医生治疗葡萄胎尤其是该病的抗恶性进展方面提供理论基础和基因治疗的候选靶点。但目前由于恶性葡萄胎患者大部分采用化学疗法,本实验采集恶性葡萄胎例数有限,实验结果得出的只是初步结论,其在葡萄胎发生发展过程中的作用及其详细机制还有待于进一步研究。
| [1] |
ZENG C, CHEN LL, YANG Z, et al. The close correlation between heparanase and COX-2 expression in lymphangiogenesis of cervical cancer[J]. Med Oncol, 2014, 31(12): 314. DOI:10.1007/s12032-014-0314-z |
| [2] |
ZHANG L X, NGO J A, WETZEL M D, et al. Heparanase mediates a novel mechanism in lapatinib-resistant brain metastatic breast cancer[J]. Neoplasia, 2015, 17(1): 101-113. DOI:10.1016/j.neo.2014.11.007 |
| [3] |
LI H L, GU J, WU J J, et al. Heparanase mRNA and protein expression correlates with clinicopathologic features of gastric cancer patients: A Meta-analysis[J]. Asian Pac J Cancer Prev, 2015, 16(18): 8653-8658. |
| [4] |
杨其容, 张平安. 肝癌组织乙酰肝素酶的表达及其与微血管密度的关系[J]. 实用肝脏病杂志, 2015, 18(6): 643-646. DOI:10.3969/j.issn.1672-5069.2015.06.019 |
| [5] |
杨传家, 宫建, 吴锋, 等. 乙酰肝素酶与甲状腺乳头状癌淋巴结转移的相关性研究[J]. 广西医学, 2015, 22(1): 45-47. |
| [6] |
TANG D B, PIAO Y, ZHAO S, et al. Expression and correlation of matrix metalloproteinase-9 and heparanase in patients with breast cancer[J]. Med Oncol, 2014, 31(7): 26. DOI:10.1007/s12032-014-0026-4 |
| [7] |
HU B, WANG Q, SHI Y Y, et al. Significance of heparanase in metastatic lymph nodes of cervical squamous cell cancer[J]. Oncol Lett, 2017, 13(5): 3219-3224. DOI:10.3892/ol.2017.5804 |
| [8] |
JIN H, CUI M. Gene silencing of heparanase results in suppression of invasion and migration of gallbladder carcinoma cells[J]. Biosci Biotechnol Biochem, 2018, 82(7): 1116-1122. DOI:10.1080/09168451.2018.1456316 |
| [9] |
PISANO C, VLODAVSKY I, ILAN N, et al. The potential of heparanase as a therapeutic target in cancer[J]. Biochem Pharmacol, 2014, 89(1): 12-19. |
| [10] |
MASOLA V, SECCHI M F, GAMBARO G, et al. Heparanase as a target in cancer therapy[J]. Curr Cancer Drug Targets, 2014, 14(3): 286-293. DOI:10.2174/1568009614666140224155124 |
| [11] |
VLODAVSKY I, BECKHOVE P, LERNER I, et al. Significance of heparanase in cancer and inflammation[J]. CancerMicroenviron, 2012, 5(2): 115-132. |
| [12] |
吕帅, 王艳林, 刘彦廷, 等. 整合素αvβ3拮抗剂HYPOO23对耐药神经胶质瘤细胞U251凋亡的影响[J]. 实用医学杂志, 2018, 34(7): 1089-1091. DOI:10.3969/j.issn.1006-5725.2018.07.011 |
| [13] |
王闯, 王明娟, 王一帆, 等. 宫颈鳞癌整合素α5β1蛋白和乙酰肝素酶蛋白的表达及生物学行为[J]. 中国老年学杂志, 2016, 36(13): 3131-3133. DOI:10.3969/j.issn.1005-9202.2016.13.016 |
| [14] |
CHI F S, FU D, ZHANG X P, et al. Expression of the c-met proto-oncogene and integrin α5β1 in human gastric cardia adenocarcinoma[J]. Biosci Biotechnol Biochem, 2012, 76(8): 1471-1476. |
| [15] |
TOQUET C, COLSON A, JARRY A, et al. ADAM15 to α5β1 integrin switch in colon carcinoma cells: A late event in cancer progression associated with tumor dedifferentiation and poor prognosis[J]. Int J Cancer, 2012, 130(2): 278-287. DOI:10.1002/ijc.25891 |
| [16] |
SHAO S, ZHT Y, MENG T, et al. Targeting high expressed α5β1 integrin in liver metastatic lesions to resist metastasis of colorectal cancer by RPM peptide-modified chitosan-stearic micelles[J]. Mol Pharm, 2018, 15(4): 1653-1663. |
| [17] |
RENNER G, NOULET F, MERCIER M C, et al. Expression/activation of α5β1 integrin is linked to the β-catenin signalingpathway to drive migration in glioma cells[J]. Oncotarget, 2016, 7(38): 62194-62207. |
| [18] |
KOZLOVA N I, MOROZEVICH G E, USHAKOVA N A, et al. Implication of integrin alpha5beta1 signal pathways in proliferation and apoptosis of MCF-7/Dox human breast carcinoma cells[J]. Biomed Khim, 2016, 62(3): 272-278. DOI:10.18097/PBMC20166203272 |
| [19] |
MITRA A K, SAWADA K, TIWARI P, et al. Ligand-independent activation of c-Met by fibronectin and α(5)β(1)-integrin regulatesovarian cancer invasion and metastasis[J]. Oncogene, 2011, 30(13): 1566-1576. DOI:10.1038/onc.2010.532 |
| [20] |
徐律韵, 朱从健, 陈洪. 整合素α5β1与肿瘤发生、发展相关性的研究进展[J]. 临床肿瘤学杂志, 2014, 19(1): 86-89. |
 2019, Vol. 45
2019, Vol. 45


