扩展功能
文章信息
- 周春, 王光华, 张帮柱
- ZHOU Chun, WANG Guanghua, ZHANG Bangzhu
- miR-367对人乳腺癌MCF-7细胞增殖、侵袭和迁移的影响及其机制
- Effects of miR-367 on proliferation, invasion and migration of human breast cancer MCF-7 cells and their mechanisms
- 吉林大学学报(医学版), 2019, 45(06): 1353-1360
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1353-1360
- 10.13481/j.1671-587x.20190627
2. 攀枝花学院附属医院普外科, 四川 攀枝花 617000
2. Department of General Surgery, Affiliated Hospital, Panzhihua University, Panzhihua 617000, China
由于饮食结构、生活方式、相关环境因素和生化因素的变化,近年来乳腺癌的患病率有所增加[1]。目前,乳腺癌已成为女性癌症相关死亡的重要原因[2-3]。据报道[4-5]肿瘤的转移和快速生长加速了乳腺癌患者的死亡过程。因此,寻找与转移和增殖相关的分子标记物有助于提高患者的诊断成功率,并为乳腺癌患者提供可能的治疗靶点。研究[1]表明微小RNA(microRNA,miRNA)的失调在肿瘤的发生发展中起重要作用。miR-367是众多miRNA家族中的一员,而关于miR-367与乳腺癌关系的报道较少,目前只有1篇研究[6]表明:与乳腺癌MCF-7细胞比较,MCF-7细胞分化而来的球囊中miR-367的表达水平明显降低,这种球囊与肿瘤细胞的干性密切相关[7-10],提示miR-367可能与乳腺癌MCF-7细胞增殖、迁移和侵袭能力有关。miR-367在肺小细胞肺癌[11]、肾细胞癌[12]和肝癌[13]等肿瘤组织中的表达水平呈特异性升高,发挥促癌作用;而在胃癌[14]组织中呈低表达,发挥抑癌作用,说明miR-367在不同肿瘤中表达模式和潜在作用不同。本研究探讨miR-367对乳腺癌MCF-7细胞增殖、侵袭和迁移的影响以及潜在的机制,旨在为miR-367应用于乳腺癌诊断和治疗提供新的依据。
1 材料与方法 1.1 组织样本、细胞、主要试剂和仪器选取2017年3月-2018年3月攀枝花学院附属医院行肿瘤切除术的36例首次确诊且未进行过放化疗的Ⅱ-Ⅲ期乳腺癌患者(包括11例侵润性导管癌、12例侵润性小叶癌、4例粘液腺癌、2例髓样癌、3例管状癌、2例乳头状癌和2例混合型乳腺癌),收集乳腺癌组织和距侵润边缘2 cm的癌旁组织,其中癌旁组织经攀枝花学院附属医院病理科确认为非癌变组织。人乳腺癌MCF-7细胞系和正常乳腺上皮MCF-10A细胞系均购自南京凯基生物公司。蛋白酶抑制剂和细胞裂解试剂均购自南京凯基生物公司,胎牛血清购自美国Gibco公司,DMEM培养基购自美国HyClone公司,RNeasy Mini试剂盒、QuantiTect逆转录试剂盒和SYBR Green PCR Master Mix试剂盒均购自美国Applied Biosystems公司,CCK-8试剂盒购自美国Biotool公司,Krüppel样因子4(Kruppel factor 4, KLF4)和GAPDH抗体均购自美国Bioworld公司,Ki67抗体购自美国Abcam公司,miR-367-mimic、miR-367-inhibitor和阴性对照miR-NC均购自广州锐博生物公司,Lipofectamine 2000试剂购自美国Invitrogen公司。Elx800型多功能酶标仪购自美国Bio-Tek公司,ABI 7300型实时荧光定量PCR系统购自美国Applied Biosystems公司,Ⅸ53型倒置荧光显微镜购自日本Olympus公司。
1.2 细胞培养人乳腺癌MCF-7细胞系和正常乳腺MCF-10A细胞系接种于含有10%胎牛血清和1%青链霉素的DMEM培养基中,在37℃、5%CO2的细胞孵育箱中培养。
1.3 RT-qPCR法检测乳腺癌组织、癌旁组织、MCF-7细胞和MCF-10A细胞中miR-367mRNA表达水平使用RNeasy Mini试剂盒从组织和细胞中提取总RNA,并采用分光光度计行总RNA定量。取2 μg总RNA根据QuantiTect逆转录试剂盒说明书步骤逆转录为cDNA。采用各样本cDNA、miR-367引物和U6引物根据SYBR Green PCR Master Mix试剂盒说明书的步骤进行qRT-PCR反应。miR-367引物:上游5′-TCCACCACCCAGTTGCTGTA-5′,下游5′-CGAGCAATTGCACTTTAGCAAT-5′;内参U6引物:上游5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游5′-CGCTTCACGAATTTGCGTGTCAT-3′。反应结束后,miR-367以U6为内参,采用2-ΔΔCt法进行量化分析。
1.4 MCF-7细胞转染miR-NC或miR-367-inhibitor将MCF-7细胞按照每5×105个接种于12孔培养板中,待细胞贴壁后,更换无血清培养基培养12 h,然后根据转染试剂说明书步骤,使用Lipofectamine 2000试剂进行辅助转染miR-NC和miR-367-inhibitor。待细胞转染48 h后,收集细胞并采用RT-qPCR法检测细胞中miR-367相对表达量(方法同1.3)后,分别命名为阴性对照组和miR-367敲减(miR-367-inhibitor)组。
1.5 CCK-8法检测阴性对照组和miR-367-inhibitor组MCF-7细胞活性采用CCK-8法检测阴性对照组和miR-367-inhibitor组MCF-7细胞活性。分别取阴性对照组和miR-367-inhibitor组MCF-7细胞,按照每孔2×103个细胞的密度接种于含100 μL完全DMEM培养基的96孔板中,在37℃、5%CO2条件下培养1~4 d。待细胞达到培养时间终点后,样品孔分别加入10 μL CCK-8溶液并继续孵育2 h。在酶标仪上读取450 nm处的吸光度(A)值。实验重复4次,以A(450)值的平均值表示细胞活性。
1.6 集落形成实验检测阴性对照组和miR-367-inhibitor组MCF-7细胞集落数分别将阴性对照组和miR-367-inhibitor组MCF-7细胞按照每孔500个细胞的密度接种在6孔板中,每5 d换液1次,持续培养细胞15 d。待培养结束后,将细胞固定于75%甲醇中,在室温条件下采用0.2%结晶紫染色5 min,并拍摄细胞图片。采用Image J图像软件对每个视野下细胞集落进行计数。实验重复4次,取细胞集落数的平均值。
1.7 免疫荧光法检测阴性对照组和miR-367-inhibitor组MCF-7细胞中Ki67阳性表达率分别将阴性对照组和miR-367-inhibitor组MCF-7细胞固定在10%甲醛中40 min后,用5%牛血清封闭1 h。然后在4℃的条件孵育Ki67(1:1 000稀释)过夜。采用PBS洗涤后,在37℃避光条件下孵育二抗(1:400稀释)30 min。采用PBS洗涤后,在室温、避光条件下用DAPI染核5 min。处理结束后,使用荧光显微镜观察细胞,各样品随机取6个视野拍摄荧光图片。实验重复4次,使用Image J图像软件分析拍摄图片的Ki67阳性细胞数,计算Ki67阳性表达率。Ki67阳性表达率=Ki67阳性细胞数/DAPI染色细胞数×100%。
1.8 划痕愈合实验检测阴性对照组和miR-367-inhibitor组MCF-7细胞划痕愈合率分别将阴性对照组和miR-367-inhibitor组MCF-7细胞接种于12孔板中。待细胞形成单细胞层完全融合时,使用移液管尖端沿孔直径刮擦细胞层,使形成一条直线划痕。使用PBS洗除刮掉的细胞,然后更换完全DMEM培养基继续培养24 h。在显微镜下拍摄起始时间(0 h)和培养24 h时的细胞图片。实验重复4次,使用Image J图像软件将划痕间隙距离进行量化,计算各组细胞划痕愈合率。细胞划痕愈合率=[划痕间隙距离(24 h)-划痕间隙距离(0 h)]/划痕间隙距离(0 h)×100%。
1.9 Transwell法检测阴性对照组和miR-367-inhibitor组MCF-7细胞侵袭数Transwell上室(8.0 μm孔径)涂覆100 μL按1:8稀释的基质胶。待基质胶完全晾干后,用无血清含有0.2%BSA的DMEM培养基调整阴性对照组和miR-367-inhibitor组MCF-7细胞的密度至5×104mL-1,各样品分别接种100 μL细胞悬液。下室加入600 μL含有10%胎牛血清的DMEM培养基。细胞培养12 h后,用棉签除去残留在上室上表面上的非侵入细胞,下表面上的侵入性细胞固定在75%甲醇中,然后在室温条件下用0.2%结晶紫染色5 min。使用显微镜观察,并随机拍摄6个视野的细胞侵袭图片。实验重复4次,使用Image J图像软件(v.1.8.0版)分析拍摄图片的细胞侵袭数。细胞侵袭数以每个视野下侵袭细胞数的平均值表示。
1.10 MCF-7细胞转染miR-NC或miR-367-mimic对MCF-7细胞使用Lipofectamine 2000试剂辅助转染miR-NC和miR-367-mimic(方法同1.4)。待细胞转染48 h后,收集细胞并采用RT-qPCR法检测细胞中miR-367相对表达量(方法同1.3)后,分别命名为阴性对照组和miR-367过表达(miR-367-mimic)组。
1.11 阴性对照组和miR-367-mimic组MCF-7细胞的细胞集落数、细胞划痕愈合率和细胞侵袭数检测分别取阴性对照组和miR-367-mimic组MCF-7细胞,采用集落形成实验检测细胞集落数(方法同1.6);采用划痕愈合实验检测细胞划痕愈合率(方法同1.8);采用Transwell法检测细胞侵袭数(方法同1.9)。
1.12 蛋白印迹法检测MCF-10A细胞和各组MCF-7细胞中KLF4蛋白表达水平分别收集MCF-10A细胞和各组MCF-7细胞,然后加入含有1%蛋白酶抑制剂的细胞裂解试剂提取全细胞蛋白质。在12%聚丙烯酰胺凝胶的条件下对全细胞蛋白质进行电泳。将电泳分离的蛋白质转移到聚偏二乙烯二氟化物膜上。用5%脱脂乳在37℃下封闭膜40 min,然后在4℃的条件孵育KLF4抗体(1:2 000稀释)和GAPDH抗体(1:5 000稀释)过夜。TBST洗膜后,室温条孵育过氧化物酶共聚的抗IgG(1:5 000稀释)1 h。TBST洗膜后,采用ECL化学显影发光液使得目的蛋白条带形象化,并从ImageQuant LAS500型多功能凝胶成像系统获得图像。实验重复4次,使用Image J图像软件(v.1.8.0版)分析图像的目的条带灰度值,并以GAPDH条带的灰度值为对照,对目的条带灰度值进行量化分析。KLF4蛋白表达水平=实验组(KLF4灰度值/GAPDH灰度值)/阴性对照组(KLF4灰度值/GAPDH灰度值)×100%。
1.13 统计学分析采用SPSS 19.0统计软件进行统计学分析。乳腺癌组织、癌旁组织、MCF-7细胞和MCF-10A细胞中miR-367mRNA表达水平、各组MCF-7细胞中miR-367 mRNA表达水平、A(450)值、细胞集落数、Ki67阳性表达率、细胞划痕愈合率、细胞侵袭数和KLF4蛋白表达水平均以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
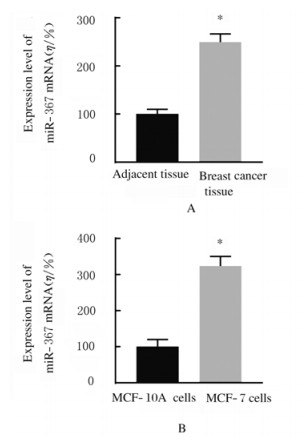
2 结果 2.1 乳腺癌组织和MCF-7细胞中miR-367相对表达水平与癌旁组织比较,乳腺癌组织中miR-367 mRNA表达水平明显升高(P < 0.01);与MCF-10A细胞比较,MCF-7细胞中miR-367 mRNA表达水平明显升高(P < 0.01)。见图 1。
|
| A: n=36, *P < 0.01 vs adjacent tissue; B: n=4, *P < 0.01 vs MCF-10A cells. 图 1 乳腺癌组织(A)和MCF-7细胞(B)中miR-367mRNA表达水平 Fig. 1 Expression levels of miR-367 mRNA in breast cancer tissue(A) and MCF-7 cells(B) |
|
|
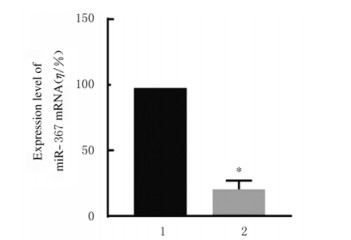
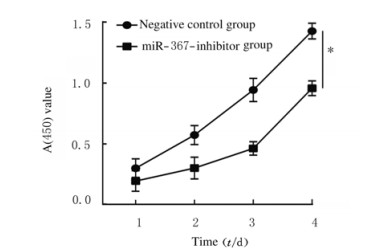
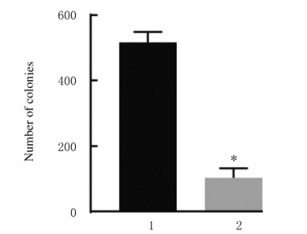
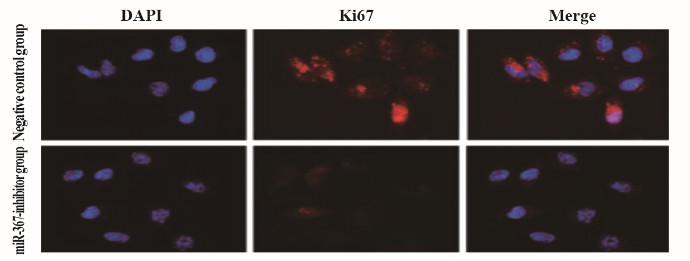
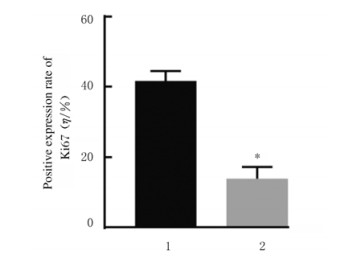
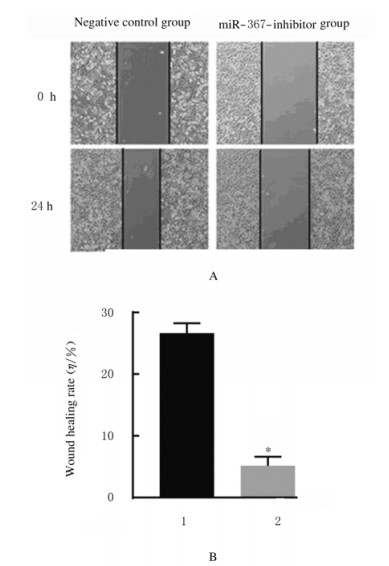
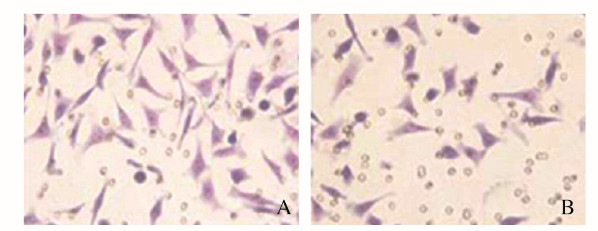
与阴性对照组比较,miR-367-inhibitor组MCF-7细胞中miR-367mRNA表达水平(图 2)、细胞活性(图 3)、细胞集落数(图 4)、Ki67阳性细胞率[图 5(插页五)和6)]、细胞划痕愈合率(图 7)和细胞侵袭数[图 8(插页五)和9]均明显降低(P < 0.01)。
|
| 1:Negative control group; 2:miR-367-inhibitor group.n=4, *P < 0.01 vs negative control group. 图 2 阴性对照组和miR-367-inhibitor组MCF-7细胞中miR-367 mRNA表达水平 Fig. 2 Expression levels of miR-367 mRNA in MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
|
| n=4, *P < 0.01 vs negative control group. 图 3 阴性对照组和miR-367-inhibitor组MCF-7细胞活性 Fig. 3 Viabilities of MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
|
| 1:Negative control group; 2:miR-367-inhibitor group.n=4, *P < 0.01 vs negative control group. 图 4 阴性对照组和miR-367-inhibitor组MCF-7细胞集落数 Fig. 4 Number of colonies of MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
|
| 图 5 阴性对照组和miR-367-inhibitor组MCF-7细胞中Ki67表达情况(免疫荧光,×200) Fig. 5 Expressions of Ki67 in MCF-7 cells in negative control group(A) and miR-367-inhibitor group(B)(Immunofluorescence, ×200) |
|
|
|
| 1:Negative control group; 2:miR-367-inhibitor group.n=4, *P < 0.01 vs negative control group. 图 6 阴性对照组和miR-367-inhibitor组MCF-7细胞中Ki67阳性表达率 Fig. 6 Positive expression rates of Ki67 in MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
|
| A:Diagram of wound healing; B: Histogram of wound healing rate; 1:Negative control group; 2:miR-367-inhibitor group.n=4, *P < 0.01 vs negative control group. 图 7 阴性对照组和miR-367-inhibitor组MCF-7细胞划痕愈合情况(A)和划痕愈合率(B) Fig. 7 Wound healing (A) and wound healing rates(B) of MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
|
| 图 8 阴性对照组(A)和miR-367-inhibitor组(B)MCF-7细胞侵袭形态表现(结晶紫,×200) Fig. 8 Morphology of invasion of MCF-7 cells in negative control group(A)and miR-367-inhibitor group(B)(Crystal violet, ×200) |
|
|

|
| 1:Negative control group; 2:miR-367-inhibitor group.n=4, *P < 0.01 vs negative control group. 图 9 阴性对照组和miR-367-inhibitor组MCF-7细胞侵袭数 Fig. 9 Number of invasive MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
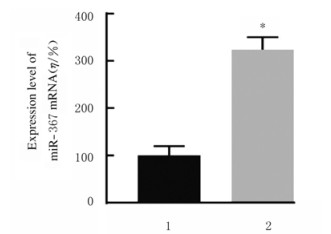
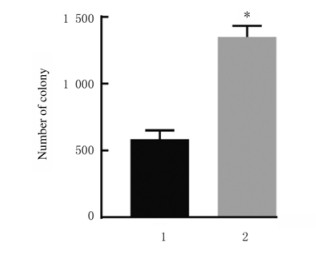
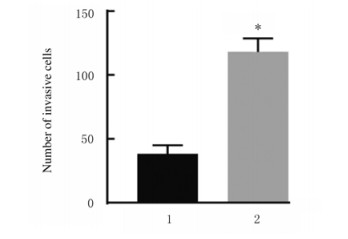
与阴性对照组比较,miR-367-mimic组MCF-7细胞中miR-367mRNA表达水平(图 10)、细胞集落数(图 11)、细胞划痕愈合率(图 12)和细胞侵袭数[图 13和14(插页五)]均明显升高(P < 0.01)
|
| 1:Negative control group; 2:miR-367-mimic group.n=4, *P < 0.01 vs negative control group. 图 10 阴性对照组和miR-367-mimic组MCF-7细胞中miR-367 mRNA表达水平 Fig. 10 Expression levels of miR-367 mRNA in MCF-7 cells in negative control group and miR-367-mimic group |
|
|
|
| 1:Negative control group; 2:miR-367-mimic group.n=4, *P < 0.01 vs negative control group. 图 11 阴性对照组和miR-367-mimic组MCF-7细胞集落数 Fig. 11 Number of colonies of MCF-7 cells in negative control group and miR-367-mimic group |
|
|

|
| 1:Negative control group; 2:miR-367-mimic group.n=4, *P < 0.01 vs negative control group. 图 12 阴性对照组和miR-367-mimic组MCF-7细胞划痕愈合情况(A)和细胞划痕愈合率(B) Fig. 12 Wound healing (A) and wound healing rates (B) of MCF-7 cells in negative control group and miR-367-mimic group |
|
|
|
| 1:Negative control group; 2:miR-367-mimic group.n=4, *P < 0.01 vs negative control group. 图 13 阴性对照组和miR-367-mimic组MCF-7细胞侵袭数 Fig. 13 Number of invasive MCF-7 cells in negative control group and miR-367-mimic group |
|
|

|
| 图 14 阴性对照组(A)和miR-367-mimic组(B)MCF-7细胞的侵袭情况(结晶紫,×200) Fig. 14 Invasion of MCF-7 cells in negative control group(A) and miR-367-mimic group(B)(Crystal violet, ×200) |
|
|
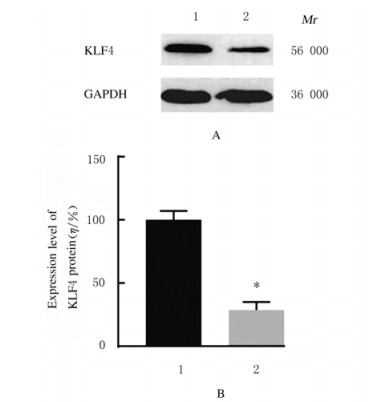
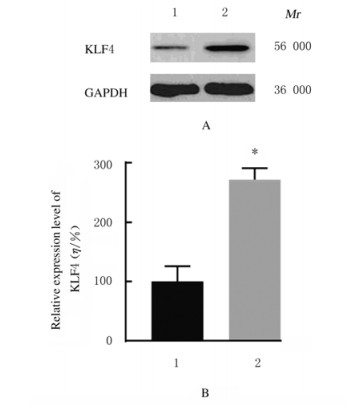
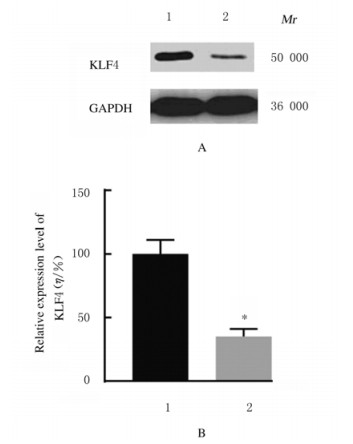
与MCF-10A细胞比较,MCF-7细胞中KLF4蛋白表达水平明显降低(P < 0.01);与阴性对照组比较,miR-367-inhibitor组MCF-7细胞中KLF4蛋白表达水平明显增加(P < 0.01),而miR-367-mimic组MCF-7细胞中KLF4蛋白表达水平明显降低(P < 0.01)。见图 15~17。
|
| Lane 1:MCF-10A cells; Lane 2:MCF-7 cells; 1:MCF-10A cells; 2:MCF-7 cells.n=4, *P < 0.01 vs MCF-10A cells. 图 15 MCF-7和MCF-10A细胞中KLF4蛋白表达电泳图(A)和表达水平直条图(B) Fig. 15 Electrophoregarm of expressions(A) and histogram(B) of expression levels of KLF4 protein in MCF-7 cells and MCF-10A cells |
|
|
|
| Lane 1:Negative control group; Lane 2:miR-367-inhibitor group.1:Negatie control group; 2:miR-367-inhibitor group.n=4, *P < 0.01 vs negative control group. 图 16 阴性对照组和miR-367-inhibitor组MCF-7细胞中KLF4蛋白表达电泳图(A)和表达水平直条图(B) Fig. 16 Electrophoregram of expressions(A) and histogram(B) of expression levels of KLF4 protein in MCF-7 cells in negative control group and miR-367-inhibitor group |
|
|
|
| Lane 1:Negative control group; Lane 2:miR-367-mimic group; 1:Negative control group; 2:miR-367-mimic group.n=4, *P < 0.01 vs negative control group. 图 17 阴性对照组和miR-367-mimic组MCF-7细胞中KLF4蛋白表达电泳图(A)和表达水平直条图(B) Fig. 17 Electrophoregram of expressions(A) and histogram(B) of expression levels of KLF4 protein in MCF-7 cells in negative control group and miR-367-mimic group |
|
|
乳腺癌是全世界女性中最常见的肿瘤,其发病率和死亡率均占据女性肿瘤中首位[7]。乳腺癌细胞的高速增殖和转移是乳腺癌预后不良的重要原因[4-5]。因此,寻找与乳腺癌细胞转移和增殖相关的新型分子标记对于诊断与治疗乳腺癌具有重要意义。
miRNAs在肿瘤细胞增殖和转移中发挥重要作用[7]。研究[7, 14]显示:miR-367在多数肿瘤细胞中发挥促癌作用,而在胃癌发挥抑癌作用,提示miR-367在不同肿瘤细胞中的作用具有差异性,而miR-367对乳腺癌的作用及其机制尚未阐明。本研究通过RT-qPCR分析表明:miR-367在乳腺癌组织和MCF-7细胞中呈高表达;进一步的研究显示:敲减miR-367可抑制MCF-7细胞增殖、侵袭和迁移;而过表达miR-367则可促进MCF-7细胞增殖、侵袭和迁移。本研究结果提示:miR-367在乳腺癌中发挥促癌作用,而抑制miR-367表达则具有一定的治疗作用。
miRNA是通过结合靶基因3′UTR区域,从而影响靶基因转录后调控生物学效应[7]。靶基因在线软件预测KLF4是miR-367的1个靶基因。已有关于KLF4在乳腺癌组织中表达的研究[15-16]表明:KLF4在乳腺癌组织中低表达,敲除KLF4表达可促进乳腺癌MCF-7细胞增殖、迁移和侵袭;过表达KLF4可抑制乳腺癌MDA-MB-23l细胞增殖、迁移和侵袭,提示KLF4表达负调控乳腺癌进展。且已有研究[17]证实了KLF4是miR-367的一个靶基因。本研究通过Western blotting实验证实了miR-367可以负调控KLF4表达。上述研究结果说明:miR-367对乳腺癌MCF-7细胞增殖、迁移和侵袭的影响可能是通过负调控靶基因KLF4来实现的。
综上所述,miR-367对乳腺癌MCF-7细胞发挥促癌作用,而下调miR-367则能抑制MCF-7细胞增殖、迁移和侵袭;miR-367这一作用可能与负调控靶基因KLF4有关。
| [1] |
DESANTIS C, MA J, BRYAN L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2014, 64(1): 52-62. DOI:10.3322/caac.21203 |
| [2] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
FAN L, STRASSER-WEIPPL K, LI J J, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279-e289. DOI:10.1016/S1470-2045(13)70567-9 |
| [4] |
DESANTIS C E, MA JM, GODING SAUER A, et al. Breast cancer statistics, 2017, racial disparity in mortality by state[J]. CA Cancer J Clin, 2017, 67(6): 439-448. DOI:10.3322/caac.21412 |
| [5] |
ZUO T T, ZHENG R S, ZENG H M, et al. Female breast cancer incidence and mortality in China, 2013[J]. Thorac Cancer, 2017, 8(3): 214-218. DOI:10.1111/1759-7714.12426 |
| [6] |
OUZOUNOVA M, VUONG T, ANCEY P B, et al. MicroRNA miR-30 family regulates non-attachment growth of breast cancer cells[J]. BMC Genomics, 2013, 14(1): 139. DOI:10.1186/1471-2164-14-139 |
| [7] |
陈万青, 郑荣寿. 中国女性乳腺癌发病死亡和生存状况[J]. 中国肿瘤临床, 2015, 42(13): 668-674. |
| [8] |
REDDY K B. MicroRNA (miRNA) in cancer[J]. Cancer Cell Int, 2015, 15(1): 38. DOI:10.1186/s12935-015-0185-1 |
| [9] |
RUPAIMOOLE R, CALIN G A, LOPEZ-BERESTEIN G, et al. MiRNA deregulation in cancer cells and the tumor microenvironment[J]. Cancer Discov, 2016, 6(3): 235-246. DOI:10.1158/2159-8290.CD-15-0893 |
| [10] |
TUTAR L, ÖZGÜ R A, TUTAR Y. Involvement of miRNAs and pseudogenes in cancer[J]. Methods Mol Biol, 2018, 1699: 45-66. |
| [11] |
XU J, WU W B, WANG J, et al. MiR-367 promotes the proliferation and invasion of non-small cell lung cancer via targeting FBXW7[J]. Oncol Rep, 2017, 37(2): 1052-1058. DOI:10.3892/or.2016.5314 |
| [12] |
DING D X, ZHANG Y, WEN L, et al. MiR-367 regulates cell proliferation and metastasis by targeting metastasis-associated protein 3(MTA3) in clear-cell renal cell carcinoma[J]. Oncotarget, 2017, 8(38): 63084-63095. |
| [13] |
MENG X, LU P, FAN Q. miR-367 promotes proliferation and invasion of hepatocellular carcinoma cells by negatively regulating PTEN[J]. Biochem Biophys Res Commun, 2016, 470(1): 187-191. DOI:10.1016/j.bbrc.2016.01.025 |
| [14] |
ZHANG B, HE D D, FANG X J, et al. The microRNA-367 inhibits the invasion and metastasis of gastric cancer by directly repressing Rab23[J]. Genet Test Mol Biomarkers, 2015, 19(2): 69-74. DOI:10.1089/gtmb.2014.0210 |
| [15] |
JIA Y L, ZHOU J C, LUO X, et al. KLF4 overcomes tamoxifen resistance by suppressing MAPK signaling pathway and predicts good prognosis in breast cancer[J]. Cell Signal, 2018, 42: 165-175. DOI:10.1016/j.cellsig.2017.09.025 |
| [16] |
SONG X, XING Y M, WU W, et al. Expression of Krüppel-like factor 4 in breast cancer tissues and its effects on the proliferation of breast cancer MDA-MB-231 cells[J]. Exp Ther Med, 2017, 13(5): 2463-2467. DOI:10.3892/etm.2017.4262 |
| [17] |
WANG G C, HE Q Y, TONG D K, et al. MiR-367 negatively regulates apoptosis induced by adriamycin in osteosarcoma cells by targeting KLF4[J]. J Bone Oncol, 2016, 5(2): 51-56. DOI:10.1016/j.jbo.2016.02.002 |
 2019, Vol. 45
2019, Vol. 45


