扩展功能
文章信息
- 田鹏飞, 陈娟娟, 尹俊杰, 李冰, 郭珊
- TIAN Pengfei, CHEN Juanjuan, YIN Junjie, LI Bing, GUO Shan
- 柔红霉素对人B细胞淋巴瘤OCI-LY7细胞凋亡的诱导作用及其机制
- Inductive effect of daunorubicin on apoptosis of human B-cell lymphoma OCI-LY7 cells and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1340-1345
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1340-1345
- 10.13481/j.1671-587x.20190625
-
文章历史
- 收稿日期: 2019-06-26
2. 南昌大学第二附属医院临床检验科, 江西 南昌 330006;
3. 河南省新乡市中心医院血液科, 河南 新乡 453000
2. Department of Clinical Laboratory, Second Affiliated Hospital, Nanchang University, Nanchang 330006, China;
3. Department of Hematology, Xinxiang Central Hospital, Xinxiang City, Henan Province, Xinxiang 453000, China
淋巴瘤是一种可侵犯到全身任何组织和器官的血液系统恶性肿瘤,而非霍奇金淋巴瘤是其主要的病理类型,约占80%[1];非霍奇金淋巴瘤包括B细胞和T细胞两种类型,B细胞型非霍奇金淋巴瘤占非霍奇金淋巴瘤发病率的80%以上,以弥漫大B细胞淋巴瘤最为常见[2-3]。目前,柔红霉素+长春新碱+环磷酰胺+泼尼松(简称CHOPE)化疗方案是弥漫大B细胞淋巴瘤治疗的经典方案,但仍有部分患者不能得到缓解或治愈。越来越多的研究[4-5]显示:在治疗过程中弥漫大B细胞淋巴瘤细胞产生的多药耐药现象是影响CHOPE治疗效果的重要因素。因此,深入探讨弥漫大B细胞淋巴瘤发生发展的分子机制,给予患者个性化治疗具有重要意义。目前,关于柔红霉素耐药机制的研究多集中在急性白血病方面[6-7],而关于柔红霉素在弥漫大B细胞淋巴瘤中耐药机制的研究较少。survivin是一种众所周知的凋亡抑制蛋白,其高表达与肿瘤细胞化疗药物耐药关系密切,干扰其表达有望成为提高白血病细胞对柔红霉素敏感性的重要靶点[8-11]。survivin是否参与柔红霉素诱导的弥漫大B细胞淋巴瘤凋亡尚不明确。因此本研究以人B细胞淋巴瘤OCI-LY7细胞为研究对象进行体外细胞实验,旨在阐述柔红霉素对OCI-LY7细胞凋亡的影响及survivin的作用,为探讨B细胞淋巴瘤对柔红霉素的耐药提供新线索。
1 材料与方法 1.1 细胞、主要试剂和仪器人B细胞淋巴瘤OCI-LY7细胞购于南京科佰生物科技有限公司。RPMI1640培养基和胎牛血清购于中国北京Hyclone公司,二甲基亚枫购于中国北京索莱宝科技有限公司,柔红霉素购于意大利Pharmacia Italia SPA公司,BCA蛋白定量分析试剂盒和总蛋白提取试剂盒购于上海市申能博彩生物科技有限公司,TRIzol试剂和脂质体2000购于美国Invitrogen生命技术公司,Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒购于南京市凯基公司,鼠抗β-actin多克隆抗体和HRP标记的羊抗鼠/兔的二抗购于北京市中杉金桥生物技术有限公司,兔抗Bcl-2、cleaved caspase-3单克隆抗体和survivin多克隆抗体购于美国CST公司,ECL发光液购于美国Millipore公司,PVDF膜购于美国Amersham公司,pcDNA3.1-survivin过表达载体和pcDNA3.1空载体购于百奥迈科生物技术有限公司。Epics XL流式细胞仪购于美国贝克曼库尔特公司,PHOMO型号酶标仪购于郑州安图生物科技有限公司,GelDocXR型号凝胶成像仪购于美国Bio-Rad公司。
1.2 细胞培养和分组采用含10%胎牛血清的RPMI1640培养基在温度为37℃、饱和湿度、5% CO2常规条件的细胞培养箱中培养OCI-LY7细胞,每2~3 d传代。选取长势良好的对数生长期细胞进行实验。实验分为4组,分别为0、0.1、1.0和10.0 mg·L-1柔红霉素组,依次加入终浓度为0、0.1、1.0和10.0 mg·L-1柔红霉素。
1.3 MTT法检测各组OCI-LY7细胞存活率将对数生长期的OCI-LY7细胞按照每孔6×104个种植于96孔细胞板上,置于常规条件下的细胞培养箱中培养过夜。将细胞分为4组,分别加入终浓度为0、0.1、1.0和10.0 mg·L-1柔红霉素,另设不含细胞的空白组,每组设置3个复孔。置于细胞培养箱内培养48 h后,弃培养液,加入20μL浓度为5 g·L-1MTT工作液于细胞培养箱内反应4 h,再加入二甲基亚枫,至MTT结晶充分溶解。采用酶标仪检测各组细胞在490 nm处的吸光度(A)值,计算细胞存活率。细胞存活率=(药物组A值-空白组A值)/(对照组A值-空白组A值)×100%。实验重复3次。
1.4 流式细胞术检测各组OCI-LY7细胞凋亡率将对数生长期的OCI-LY7细胞以每孔106个种植于6孔细胞板上,置于细胞培养箱中常规培养过夜。将细胞分为4组,每组设3个复孔,分别加入终浓度为0、0.1、1.0和10.0 mg·L-1柔红霉素处理48 h后,收集各组细胞于离心管中,以1 000 r·min-1转速离心5 min后,弃上清液,加入预冷的磷酸缓冲液洗涤细胞3次后,加入200 μL 1×Binding Buffer重悬细胞,再分别加入体积均为5 μL Annexin-Ⅴ-FITC和PI染色液,混匀后置于避光条件下反应15 min。补加300μL 1×binding buffer后,1 h内上流式细胞仪检测各组细胞的凋亡率。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数/总细胞数×100%。实验重复3次。
1.5 Western blotting法检测各组OCI-LY7细胞中凋亡相关蛋白Bax、cleaved caspase-3和survivin表达水平收集不同浓度(0、0.1、1.0和10.0 mg·L-1)柔红霉素处理48 h后的OCI-LY7细胞,其中每个处理组设3个复孔。参照总蛋白提取试剂盒说明书步骤提取各组细胞总蛋白,并采用BCA法检测总蛋白浓度。加入等体积上样缓冲液与蛋白样品充分混匀后,放入95℃水浴锅中加热5 min。将变性后的蛋白样品以每孔80 μg上样至10% SDS-PAGE凝胶中进行电泳分离。分离结束后,采用湿转法将蛋白样品转至PVDF膜上。将膜浸于5%脱脂奶粉中封闭1 h后,加入一抗工作液(Bax 1:1 000、cleaved caspase-3 1:800、survivin 1:800和β-actin 1:1 000),在4℃下孵育24 h后,再加入二抗工作液(1:2 000)室温孵育2 h。滴加ECL发光液成像,以β-actin为内参,采用凝胶成像系统扫描分析各组细胞中Bax、cleaved caspase-3和survivin蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin灰度值。
1.6 OCI-LY7细胞转染将对数生长期的OCI-LY7细胞以每孔105个种植于6孔细胞板上后,置于细胞培养箱内常规条件下培养过夜。待细胞融合度达75%时,将细胞分为对照组(未处理)、柔红霉素组(加入终浓度为0.1 mg·L-1柔红霉素)、柔红霉素+空载体组(转染pcDNA3.1空载体后给予0.1 mg·L-1柔红霉素)和柔红霉素+survivin组(转染pcDNA3.1-survivin过表达载体后给予0.1 mg·L-1柔红霉素),每组设置3个平行孔。其中后3组细胞均给予终浓度为0.1mg·L-1柔红霉素处理48 h,而柔红霉素+空载体组和柔红霉素+survivin组细胞在给予柔红霉素前24 h,参照脂质体2000说明书步骤将pcDNA3.1空载体和pcDNA3.1-survivin过表达载体分别转染至OCI-LY7细胞中。收集各组细胞,采用Western blotting法检测各组细胞中survivin、Bax和cleaved caspase-3蛋白表达水平,MTT法和流式细胞术检测各组细胞存活率和细胞凋亡率。
1.7 统计学分析采用SPSS 22.0统计软件进行统计学分析。各组细胞存活率、凋亡率和细胞中cleaved caspase-3、Bax及survivin蛋白表达水平以x±s表示,多组间样本均数比较使用单因素方差分析,组间多重比较采用SNK-q检验,两组间比较采用独立样本t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组OCI-LY7细胞存活率与0 mg·L-1柔红霉素组比较,处理48 h后0.1、1.0和10.0 mg·L-1柔红霉素组OCI-LY7细胞存活率均明显降低(P < 0.05),且呈现一定的浓度依赖性。见表 1。
| (n=9, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Survival rate | Apoptotic rate | |||||||||||||||||||||||||||
| Daunorubicin (mg·L-1) | |||||||||||||||||||||||||||||
| 0 | 97.36±6.48 | 3.62±1.05 | |||||||||||||||||||||||||||
| 0.1 | 82.75±5.12* | 17.28±2.13* | |||||||||||||||||||||||||||
| 1.0 | 63.48±5.05* | 32.36±2.65* | |||||||||||||||||||||||||||
| 10.0 | 48.13±3.28* | 48.28±3.06* | |||||||||||||||||||||||||||
| F | 53.514 | 201.991 | |||||||||||||||||||||||||||
| P | 0.000 | 0.000 | |||||||||||||||||||||||||||
| * P < 0.05 compared with 0 mg·L-1 daunorubicin group. | |||||||||||||||||||||||||||||
处理48 h后,0.1、1.0和10.0 mg·L-1柔红霉素组OCI-LY7细胞凋亡率呈浓度依赖性升高,且与0 mg·L-1柔红霉素组比较差异均有统计学意义(P < 0.05)。见图 1和表 1。
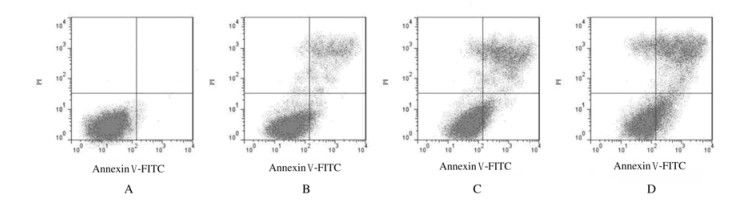
|
| A:0 mg·L-1 daunorubicin group; B:0.1 mg·L-1 daunorubicin group; C:1.0 mg·L-1daunorubicin group; D:10.0 mg·L-1 daunorubicin group. 图 1 流式细胞术检测各组OCI-LY7细胞凋亡情况 Fig. 1 Apoptosis of OCI-LY7 cells in various groups detected by flow cytometry |
|
|
0.1、1.0和10.0 mg·L-1柔红霉素OCI-LY7细胞中cleaved caspase-3和Bax蛋白表达水平逐渐升高,而survivin蛋白表达水平逐渐降低,且与0 mg·L-1柔红霉素组比较差异均有统计学意义(P < 0.05)。见图 2和表 2。

|
| Lane 1-4: 0, 0.1, 1.0 and 10.0 mg·L-1daunorubicin groups. 图 2 Western blotting法检测各组OCI-LY7细胞中cleaved caspase-3、Bax和survivin蛋白表达电泳图 Fig. 2 Electrophoregram of expressions of cleaved caspase-3, Bax and survivin proteins in OCI-LY7 cells in various groups detected by Western blotting method |
|
|
| (n=9, x±s) | |||||||||||||||||||||||||||||
| Group | Cleaved caspase-3 | Bax | Survivin | ||||||||||||||||||||||||||
| Daunorubicin (mg·L-1) | |||||||||||||||||||||||||||||
| 0 | 0.09±0.02 | 0.13±0.02 | 1.12±0.09 | ||||||||||||||||||||||||||
| 0.1 | 0.27±0.03* | 0.22±0.03* | 0.51±0.03* | ||||||||||||||||||||||||||
| 1.0 | 0.48±0.03* | 0.36±0.03* | 0.30±0.03* | ||||||||||||||||||||||||||
| 10.0 | 0.76±0.05* | 0.62±0.04* | 0.11±0.02* | ||||||||||||||||||||||||||
| F | 211.915 | 150.421 | 223.767 | ||||||||||||||||||||||||||
| P | 0.000 | 0.000 | 0.000 | ||||||||||||||||||||||||||
| * P < 0.05 compared with 0 mg·L-1 daunorubicin group. | |||||||||||||||||||||||||||||
与对照组比较,0.1 mg·L-1柔红霉素组OCI-LY7细胞存活率、细胞中survivin蛋白表达水平明显降低(P < 0.05),而细胞凋亡率和细胞中cleaved caspase-3及Bax蛋白表达水平明显升高(P < 0.05)。与柔红霉素组比较,转染pcDNA3.1-survivin过表达载体成功上调survivin表达后,柔红霉素+survivin组OCI-LY7细胞存活率升高,细胞凋亡率降低(P < 0.05),survivin蛋白表达水平升高(P < 0.05),Bax和cleaved caspase-3蛋白表达水平降低(P < 0.05)。见图 3和4及表 3。

|
| A:Control group; B:Daunorubicin group; C:Daunorubicin+Vector group; D:Daunorubicin+survivin group. 图 3 上凋survivin后流式细胞术检测各组OCI-LY7细胞凋亡情况 Fig. 3 Apoptosis of OCI-LY7 cells in various groups detected by flow cytometryafter up-regulation of survivin |
|
|

|
| Lane 1:Control group; Lane 2:Daunorubicin group; Lane 3:Daunorubicin+vector group; Lane 4:Daunorubicin+survivin group. 图 4 上凋survivin后Western blotting法检测各组OCI-LY7细胞中cleaved caspase-3、Bax和survivin蛋白表达电泳图 Fig. 4 Electrophoregram of expressions of cleaved caspase-3, Bax and survivin proteins in OCI-LY7 cells in various groups detected by Western blotting methodafter up-regulation of survivin |
|
|
| (n=9, x±s) | |||||||||||||||||||||||||||||
| Group | Survival rate(η/%) | Apoptotic rate(η/%) | Cleaved caspase-3 protein | Bax protein | Survivin protein | ||||||||||||||||||||||||
| Control | 97.52±5.06 | 2.46±1.12 | 0.08±0.02 | 0.12±0.02 | 1.23±0.11 | ||||||||||||||||||||||||
| Daunorubicin | 71.28±4.15* | 19.84±2.26* | 0.21±0.03* | 0.26±0.03* | 0.45±0.04* | ||||||||||||||||||||||||
| Daunorubicin+vector | 70.36±4.48* | 20.17±2.31* | 0.23±0.03* | 0.24±0.03* | 0.43±0.03* | ||||||||||||||||||||||||
| Daunorubicin+survivin | 86.68±5.12*△ | 12.25±2.03*△ | 0.13±0.02*△ | 0.18±0.02*△ | 0.92±0.06*△ | ||||||||||||||||||||||||
| F | 99.225 | 22.983 | 52.595 | 18.462 | 22.577 | ||||||||||||||||||||||||
| P | 0.000 | 0.000 | 0.000 | 0.001 | 0.000 | ||||||||||||||||||||||||
| * P < 0.05 compared with control group; △ P < 0.05 compared with daunorubicin group. | |||||||||||||||||||||||||||||
柔红霉素除了是治疗小儿急性白血病的常用化疗药物外,还对乳腺癌和肝癌等多种肿瘤细胞具有杀伤作用[11-12]。诱导细胞凋亡是化疗药物杀伤肿瘤细胞的重要分子机制,以0.1、1.0和10.0 mg·L-1柔红霉素处理人B细胞淋巴瘤OCI-LY7细胞后,细胞存活率明显降低,而细胞凋亡率和细胞中促凋亡蛋白cleaved caspase-3和Bax的表达水平均明显升高,且呈一定的浓度依赖性,与HASHEMZAEI等[13]的研究结果部分吻合。
survivin是与细胞凋亡密切相关的基因,属于人类凋亡抑制蛋白家族成员,位于人17q25染色体上,虽无锌指结构,但在N-末端含有一个杆状病毒凋亡抑制蛋白重复序列,而该序列是发挥细胞凋亡抑制作用的重要结构;survivin在卵巢癌、胃癌和头颈部鳞状细胞癌等多种肿瘤组织中呈异常高表达,可通过调控细胞增殖、凋亡、周期进程和耐药等调控肿瘤的发生发展[14-18]。survivin在弥漫型大B细胞淋巴瘤组织中呈异常高表达,并且抑制其表达可通过激活caspase-3诱导人B细胞淋巴瘤细胞凋亡[19-21]。研究[10]显示:柔红霉素可通过下调survivin诱导白血病Jurkat细胞凋亡,而干扰survivin可能提高白血病细胞对柔红霉素的敏感性。本研究结果显示:0.1、1.0和10.0 mg·L-1柔红霉素处理后,OCI-LY7细胞中survivin蛋白表达水平呈浓度依赖性降低,提示survivin可能参与柔红霉素诱导的OCI-LY7细胞凋亡。为了进一步验证上述猜想,本研究通过转染pcDNA3.1-survivin过表达载体成功上调survivin表达后发现:柔红霉素作用下OCI-LY7细胞存活率升高,细胞凋亡率和细胞中促凋亡蛋白cleaved caspase-3及Bax表达水平明显降低,提示survivin下调是柔红霉素诱导OCI-LY7细胞凋亡的重要机制,survivin可通过影响Bax和cleaved caspase-3的表达介导OCI-LY7细胞凋亡,而干扰survivin表达可能是提高人B细胞淋巴瘤对柔红霉素敏感性的重要策略。
综上所述,柔红霉素可通过下调survivin表达诱导人B细胞淋巴瘤OCI-LY7细胞凋亡,survivin有望成为提高人B细胞淋巴瘤对柔红霉素敏感性的潜在靶基因。
| [1] |
王猛, 周晓莹, 王立新. 超声造影在非霍奇金淋巴瘤中的应用进展[J]. 临床与病理杂志, 2018, 38(9): 2030-2033. |
| [2] |
SCHMITZ R, WRIGHT G W, HUANG D W, et al. Genetics and pathogenesis of diffuse large B-cell lymphoma[J]. New Engl J Med, 2018, 378(15): 1396-1407. DOI:10.1056/NEJMoa1801445 |
| [3] |
刘靖, 刘芳, 刘连, 等. 经典Wnt信号通路与弥漫大B细胞淋巴瘤[J]. 佛山科学技术学院学报:自然科学版, 2015, 33(4): 1-4. |
| [4] |
MIZUNO S, HANAMURAI, OT AA, et al. Establishment and characterization of a novel vincristine‐resistant diffuse large B-cell lymphoma cell line containing the 8q24 homogeneously staining region[J]. FEBS Open Biol, 2018, 8(12): 1977-1991. DOI:10.1002/2211-5463.12538 |
| [5] |
GUTSCH J, WERTHMANN P G, ROSENWALD A, et al. Complete remission and long-term survival of a patient with a diffuse large B-cell lymphoma under viscum album extracts after resistance to R-CHOP: a case report[J]. Anticancer Res, 2018, 38(9): 5363-5369. DOI:10.21873/anticanres.12865 |
| [6] |
YANG L, JIAN G E, XIA R. Resistance to daunorubicin in acute myeloid leukemia is associated with mutations in the TET2 gene[J]. Acta Univer Med Anhui, 2018, 53(2): 246-250. |
| [7] |
LIU YH, LEI PC, QIAO H, et al. MiR-9 Enhances the chemosensitivity of AML cells to daunorubicin by targeting the EIF5A2/MCL-1 axis[J]. Int J Biol Scil, 2019, 15(3): 579-586. DOI:10.7150/ijbs.29775 |
| [8] |
WANG M, CAI W R, MENG R, et al. miR-485-5p suppresses breast cancer progression and chemosensitivity by targeting survivin[J]. Biochem Biophys Res Commun, 2018, 501(1): 48-54. DOI:10.1016/j.bbrc.2018.04.129 |
| [9] |
CHAWLA D, KAR R, GUPTA B, et al. Role of survivin and p53 expression in response of primary culture of ovarian cancer cells to treatment with chemotherapeutic agents[J]. Int J Gynecol Cancer, 2018, 28(6): 1239-1246. DOI:10.1097/IGC.0000000000001281 |
| [10] |
侯燕, 胡群, 熊昊, 等. Survivin及其异变体、P53和MDM2在柔红霉素诱导Jurkat细胞凋亡中的变化[J]. 临床血液学杂志, 2013, 26(4): 482-484, 487. |
| [11] |
JU R J, CHENG L, QIU X, et al. Hyaluronic acid modified daunorubicin plus honokiol cationic liposomes for the treatment of breast cancer along with the elimination vasculogenic mimicry channels[J]. J Drug Target, 2018, 26(9): 793-805. DOI:10.1080/1061186X.2018.1428809 |
| [12] |
陈燕燕, 付丽香, 周欢, 等. EGCG衍生物Y6联合柔红霉素对人肝癌裸鼠移植瘤生长及血管生成的影响[J]. 广西医科大学学报, 2018, 35(5): 597-602. |
| [13] |
HASHEMZAEI M, KARAMI S P, DELARAMIFAR A, et al. Anticancer effects of co-administration of daunorubicin and resveratrol in MOLT-4, U266 B1 and RAJI cell lines[J]. Farmacia, 2016, 64(1): 36-42. |
| [14] |
李莉, 贾慧, 李保平, 等. 上皮性卵巢癌中Let-7a及其靶基因HMGA2、Cyclin D1的表达[J]. 郑州大学学报:医学版, 2017, 52(4): 398-402. |
| [15] |
WEI M, SHI G, LIU J, et al. Effect of small interfering RNA targeting survivin gene on the expression of survivin and biological function of a human cutaneous squamous cell carcinoma cell line A431[J]. Chin J Dermatol, 2018, 51(4): 305-309. |
| [16] |
杨惠雲, 秦国慧, 杨黎, 等. 食管鳞状细胞癌患者外周血和肿瘤组织来源的髓源抑制性细胞中PD-1和TIM-3的表达[J]. 郑州大学学报:医学版, 2019, 54(3): 336-340. |
| [17] |
徐芝立, 张丽红, 张翼, 等. RNA干扰肾癌Survivin基因表达降低786-O细胞增殖能力[J]. 河北医科大学学报, 2017, 38(11): 1283-1286, 1291. DOI:10.3969/j.issn.1007-3205.2017.11.010 |
| [18] |
刘馨莲, 綦黄鹏, 魏仙. 凋亡抑制因子Survivin的研究进展[J]. 中外医学研究, 2017, 15(20): 161-163. |
| [19] |
王潇. miR-205通过靶向调控caspase-3表达调节神经胶质瘤的生物学行为[J]. 河北医科大学学报, 2017, 38(9): 1024-1028, 1032. DOI:10.3969/j.issn.1007-3205.2017.09.008 |
| [20] |
张文婷, 江莲, 朱秀丽, 等. 地高辛对人B细胞淋巴瘤细胞增殖、凋亡的影响及其分子机制的研究[J]. 转化医学杂志, 2018, 7(2): 74-78. DOI:10.3969/j.issn.2095-3097.2018.02.003 |
| [21] |
KANEKO N, KITA A, YAMANAKA K, et al. Combination of YM155, a survivin suppressant with A STAT3 inhibitor: A new strategy to treat diffuse large B-cell lymphoma[J]. Leuk Res, 2013, 37(9): 1156-1161. DOI:10.1016/j.leukres.2013.05.010 |
 2019, Vol. 45
2019, Vol. 45
