扩展功能
文章信息
- 朱中博, 钱建升, 杨硕, 李康乐, 窦建卫
- ZHU Zhongbo, QIAN Jiansheng, YANG Shuo, LI Kangle, DOU Jianwei
- 不同剂量125I粒子植入对人乳腺癌裸鼠荷瘤增殖的抑制作用及其机制
- Inhibitory effect of different doses of 125I seed implantation on tumor-bearing proliferation in nude mice with breast cancer and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1305-1309
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1305-1309
- 10.13481/j.1671-587x.20190619
-
文章历史
- 收稿日期: 2018-12-04
2. 西安交通大学第一附属医院放射科, 陕西 西安 710061;
3. 西安交通大学医学部药学院, 陕西 西安 710061
2. Department of Radiology, First Affiliated Hospital, Xi'an Jiaotong University, Xi'an 710061, China;
3. School of Pharmacy, Faculty of Medical Sciences, Xi'an Jiaotong University, Xi'an 710061, China
乳腺癌是世界范围内女性的常见恶性肿瘤[1],在美国其患病率一直处于女性癌症的首位,而我国乳腺癌发病率也呈逐年升高趋势[2]。尽管随着肿瘤外科学的发展,绝大多数进展期乳腺癌患者仍只能接受改良根治或根治性手术,但改良根治或根治性手术的手术范围广、创伤大且术后并发症多,对患者的生理和心理健康造成了巨大的影响[4]。多年来国内外学者致力于研究乳腺癌患者的保乳手术,其中组织间植入内放射治疗乳腺癌因其不良反应少、适形治疗、操作简单和疗效较好为患者所接受[5]。通过植入放射性粒子,进而达到近距离治疗恶性肿瘤的目的,这一方法现已较广泛应用于临床,其中125I粒子是目前组织放疗最常用的放射性粒子[6]。125I粒子是一种人工合成的同位素,半衰期为60.1 d,相对较长[7];与传统体外放射治疗比较,125I粒子具有精度高、创伤小和射线杀伤半径适当等优点[8]。目前,国内外采用125I粒子治疗各种恶性肿瘤,取得了较好的临床效果[9-11]。本研究观察不同剂量125I粒子干预乳腺癌裸鼠荷瘤后对其肿瘤增殖的影响,并初步分析其作用机制,为后续研究125I粒子干预单核巨噬细胞-肿瘤干细胞近分泌信号转导通路提供理论依据。
1 材料与方法 1.1 实验动物、细胞和质粒雌性小鼠40只,月龄2~3个月,体质量(20 ± 2) g,由西安交通大学实验动物中心提供,SPF级,动物合格证号:SCXK(陕)2017-003。乳腺癌干细胞HMLER90hi由西北农林科技大学提供。实验所用BT-125-1型放射性125I粒子表面活度为27.75 MBq,半衰期为60.1 d;空粒子表面活度为0 MBq,半衰期为0 d,均购自中国同位素公司。
1.2 细胞培养和动物模型的建立采用MEGM(Lonza)培养基培养HMLER90hi细胞(CD90hiCD24-,转入H-RasV12癌基因,高表达CD90,具有肿瘤干细胞特性),培养过程中常规进行支原体污染检测。将培养传代至第3代的HMLER90hi细胞约3×105个接种于2月龄雌性裸鼠第4乳脂肪垫。接种后的裸鼠置于层流架内无特殊病原体环境下饲养,观察小鼠肿瘤生长情况。
1.3 动物分组和治疗方法体表测量小鼠肿瘤长短径,待肿瘤长至约5 mm×5 mm时视为造模成功。根据肿瘤造模情况,将40只小鼠随机分为4组(随机数字表法):空白对照组、低剂量125I粒子组、中剂量125I粒子组和高剂量125I粒子组,每组10只。空白对照组小鼠仅植入1粒空白粒子(不含放射性元素);低、中和高剂量125I粒子组小鼠分别植入放射剂量为1.48×10-7、2.22×10-7和2.96×10-7Bq125I粒子。植入方法:测量肿瘤长短径后,按照无菌原则用粒子植入针沿肿瘤长径方向将粒子植入到肿瘤中央,使粒子到肿瘤各边缘距离均<1.0 cm。小鼠在SPF条件下于动物实验室饲养,各饲养笼之间的距离>50.0 cm。
1.4 各组小鼠肿瘤体积和质量的测量分别于125I粒子植入后7、14和28 d时,每组随机(随机数字表法)抽取3只荷瘤鼠处死,剥取瘤体称质量,并测量肿瘤长短径,计算肿瘤体积。肿瘤体积(mm3)=长径(mm)×短径(mm)2/2。电子天平称取肿瘤质量,计算肿瘤生长抑制率。肿瘤生长抑制率=(空白对照组肿瘤体积-干预组肿瘤体积)/空白对照组肿瘤体积×100%。在相应的实验观察时间点处死余下荷瘤裸鼠后,剥离瘤体组织,液氮保存。
1.5 ELISA法检测各组小鼠肿瘤组织中端粒酶蛋白水平取部分瘤体,加入2 mL PBS, 采用超声波匀浆器对组织进行冰上均浆。离心后取上清液加样、洗板和加底物。反应后在492 nm处测吸光度(A)值。绘制标准曲线,计算蛋白水平。端粒酶蛋白水平=实验组A值-标准品A值。
1.6 qRT-PCR法检测各组小鼠乳腺癌干细胞HMLER90hi中CD90和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF) mRNA表达水平取部分瘤体,以4 ℃预冷的PBS缓冲液洗涤2次,每次10 min;采用剪碎机械法制备单细胞悬液样品,然后加入PBS缓冲液,吹打收集的细胞,制成细胞悬液。采用磁性细胞分选技术(MACS)(CD45-、CD31-和Ter-119磁珠)和FACS技术(anti-CD90-APC)从细胞悬液中获取肿瘤细胞HMLER 90 h。按照TRIzol试剂盒说明书对肿瘤细胞悬液提取总RNA,离心弃上清,肿瘤干细胞HMLER90hi纯度为5 × 106 mL-1时加入1 mL RNAiso Plus,离心取上清,加入氯仿,静置5 min后于高速离心得到分层匀浆液。取无色上清液(含RNA),加入500 μL异丙醇,上下颠倒混匀后室温静置10 min,离心。离心后弃上清,加入1 mL 75%乙醇洗沉淀,离心弃上清,打开离心管盖,室温干燥沉淀后加入溶解于DEPC处理水中。提取后进行逆转录,扩增目的基因。引物由宝生物工程大连有限公司合成。CD90正义引物5′-CCCAGTGAAGATGCATTTTT-3′,反义引物5′-GACAGCCTGAGAGGGTCTTG-3′,扩增产物长度为185 bp;GM-CSF正义引物5′-GGAGCATGTGAATGCCATCCAG-3′,反义引物5′-CTGGAGGTCAAACATTTCTGAGAT-3′,扩增产物长度为174 bp;β-actin正义引物5′-CATGGAGTCCTGTGGCATC-3′,反义引物5′-CAGGGCAGTGATCTCCTTCT-3′,扩增产物长度为157 bp。
逆转录反应体系为20 μL,其中5 × PrimescriptTM Buffer 4 μL,PrimescriptTM RT EnzymeMix I 1 μL,Oligo dT Primer (50 μmol·L-1) 1 μL,Random 6 mers (100 μmol·L-1) 1 μL,Total RNA 13 μL;反应条件为37℃ ×15 min,85℃ × 5 s。PCR反应体系15 μL,其中SYBR superMix荧光7.5 μL,模板混合液(上、下游引物)0.5 μL,超纯水4 μL,稀释2倍cDNA 3 μL;反应步骤:95℃ × 10 min,95℃ × 10 s,60℃ × 1 min,循环35次。目的基因的相对表达水平=目的基因表达水平/内参基因表达水平。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组小鼠肿瘤质量和肿瘤体积、肿瘤组织中端粒酶蛋白水平、肿瘤干细胞HMLER90hi中CD90和GM-CSF mRNA表达水平以x±s表示,采用Prism5.0 (GraohPad)软件绘图,计量资料进行正态分布检验,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠肿瘤质量、肿瘤体积和肿瘤生长抑制率裸鼠在接种人肿瘤细胞5 d后,均可见皮下肿瘤的形成,成瘤率为100%,生长迅速,组间肿瘤体积比较差异无统计学意义(P>0.05),造模成功。裸鼠精神状态、活动、进食和排便情况无变化。植入125I粒子7、14和28 d后,不同剂量125I粒子组小鼠肿瘤生长明显抑制,肿瘤体积与质量逐渐减小,与相应时间点空白对照组比较差异均有统计学意义(P < 0.05或P < 0.01)。见表 1和2。
| (n=10, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Volume of transplanted tumor | Inhibitory rate of growth of tumor | |||||||||||||||||||||||||||
| (t/d) 7 | 14 | 28 | 28 | 7 | 14 | ||||||||||||||||||||||||
| Blank control | 1.63±0.24 | 2.98±0.24 | 4.56±0.46 | 0 | 0 | 0 | |||||||||||||||||||||||
| 125I particle | |||||||||||||||||||||||||||||
| Low dose | 1.58±0.22* | 2.54±0.51* | 4.02±0.35* | 16.87±1.22* | 8.20±0.56* | 5.21±0.23* | |||||||||||||||||||||||
| Middle dose | 1.54±0.14* | 2.58±0.11* | 3.58±0.15** | 17.47±1.31* | 13.43±1.69* | 11.26±1.12* | |||||||||||||||||||||||
| High dose | 1.28±0.47* | 1.34±0.11** | 1.47±0.12** | 21.47±1.78* | 55.04±4.75** | 67.76±5.89** | |||||||||||||||||||||||
| * P < 0.05,** P < 0.01 vs blank control group. | |||||||||||||||||||||||||||||
| (n=10, x±s, m/g) | |||||||||||||||||||||||||||||
| Group | Weight of transplanted tumor | ||||||||||||||||||||||||||||
| (t/d) 7 | 14 | 28 | |||||||||||||||||||||||||||
| Blank control | 1.66±0.12 | 2.44±0.27 | 3.64±0.40 | ||||||||||||||||||||||||||
| 125I particle | |||||||||||||||||||||||||||||
| Low dose | 1.38±0.12* | 2.24±0.13* | 3.45±0.35* | ||||||||||||||||||||||||||
| Middle dose | 1.37±0.13* | 2.17±0.21* | 3.23±0.14* | ||||||||||||||||||||||||||
| High dose | 1.04±0.17* | 1.16±0.15* | 1.22±0.13** | ||||||||||||||||||||||||||
| * P < 0.05,** P < 0.01 vs blank control group. | |||||||||||||||||||||||||||||
在植入粒子7、14和28 d后,与空白对照组比较,不同剂量125I粒子组小鼠肿瘤组织中端粒酶蛋白水平明显降低,组间比较差异有统计学意义(P < 0.05或P < 0.01)。见表 3。
| [n=10, x±s, ρB/(μg·L-1)] | |||||||||||||||||||||||||||||
| Group | Level of telomerase protein | ||||||||||||||||||||||||||||
| (t/d) 7 | 14 | 28 | |||||||||||||||||||||||||||
| Blank control | 17.86±2.88 | 29.98±3.79 | 48.87±5.56 | ||||||||||||||||||||||||||
| 125I particle | |||||||||||||||||||||||||||||
| Low dose | 15.31±3.12* | 25.14±2.96* | 41.32±6.88* | ||||||||||||||||||||||||||
| Middle dose | 13.78±2.56* | 22.45±3.14* | 32.33±5.36* | ||||||||||||||||||||||||||
| High dose | 10.69±2.48* | 15.89±3.21** | 24.66±4.13** | ||||||||||||||||||||||||||
| * P < 0.05,* * P < 0.01 vs blank control group. | |||||||||||||||||||||||||||||
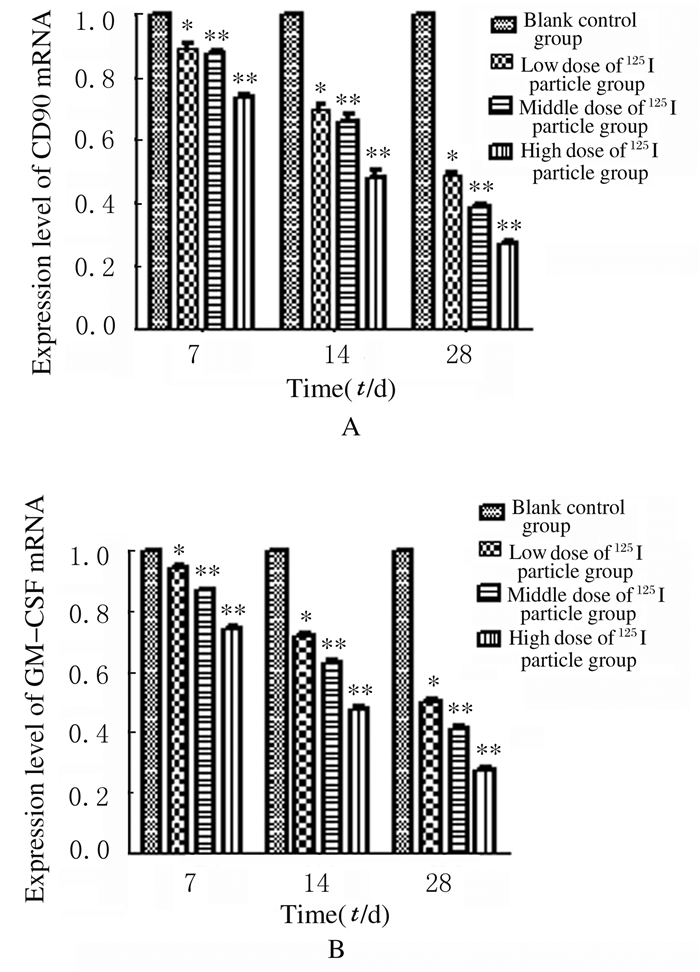
与空白对照组比较,不同剂量125I粒子组小鼠肿瘤干细胞HMLER90hi中CD90和GM-CSF mRNA表达水平降低,差异有统计学意义(P < 0.05或P < 0.01)。见图 1。
|
| A: CD90 mRNA; B: GM-CSF mRNA; *P < 0.05, * *P < 0.01 vs blank control group. 图 1 各组小鼠肿瘤干细胞HMLER90hi中CD90和GM-CSF mRNA表达水平 Fig. 1 Expression levels of CD90 and GM-CSF mRNA in tumor stem cells HMLER90hi of mice in various groups |
|
|
研究[12]表明:放射性125I粒子通过直接损伤肿瘤细胞,破坏其细胞核DNA双链,使肿瘤细胞死亡。夏寿萱[8]认为:放射性125I粒子的一定剂量及持续性照射能够诱发肿瘤细胞凋亡,这是杀伤肿瘤的重要途径。
目前,临床乳腺癌治疗中的主要难题就是如何有效清除肿瘤细胞,使其丧失增殖及转移能力。近来年,肿瘤相关单核巨噬细胞(tumor-associated macrophage, TAM)对肿瘤的影响已成为了研究热点[13]。研究[14]显示:TAM可通过一种特殊的信号转导方式——近分泌信号通路,促进肿瘤干细胞形成,并维持肿瘤干细胞活性,从而参与肿瘤干细胞巢的建立。但是,TAM转导不依赖相应的递质,而通过邻近细胞的物理接触及受体配对。TAM可通过表面标志CD11b和Ephrin分别与间充质细胞的表面受体CD90和EphA4结合[15]。另有研究[16]表明:肿瘤干细胞HMLER90hi能够高表达CD90。本课题组前期研究[17-18]显示:乳腺癌干细胞特征性标志之一的CD90在肿瘤干细胞增殖及转移过程中起了关键作用。CD90作为单核巨噬细胞近分泌通路的锚定蛋白,其与TAM的CD11b结合发挥锚定作用,是信号转导的起始点[19]。研究[20]表明:TAM能够通过近分泌通路促使癌症干细胞分泌各种细胞因子,以此来维持干细胞状态。其中,GM-CSF作为单核巨噬细胞近分泌通路的终产物,发挥维持肿瘤干细胞状态的作用。本文作者结合前期研究[17-18]工作认为:125I粒子可通过调控CD90和GM-CSF表达干预单核巨噬细胞-肿瘤干细胞近分泌信号转导通路,从而发挥抗肿瘤作用。
综上所述,高剂量125I粒子对于肿瘤生长有明显抑制作用,不同剂量125I粒子可抑制肿瘤组织中端粒蛋白酶蛋白水平以及HMLER90hi细胞中CD90和GM-CSFmRNA表达水平,并呈现时-量效关系,但对于放疗时机、放疗靶区范围以及放疗剂量分割等以及不同患者行部分乳腺照射或者免除放疗的选择,仍需要结合临床工作进行深入的探讨。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer Statistics, 2019[J]. CAA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
GINSBURG O, BRAY F, COLEMAN M P, et al. The global burden of women's cancers: a grand challenge in global health[J]. Lancet, 2017, 389(10071): 847-860. DOI:10.1016/S0140-6736(16)31392-7 |
| [3] |
WEN D, WEN X, YANG Y, et al. Urban rural disparity in female breast cancer incidence rate in China and the increasing trend in parallel with socioeconomic development and urbanization in a rural setting[J]. Thorac Cancer, 2018, 9(2): 262-272. |
| [4] |
方文涛, 谷志涛, 陈克能. 胸腺肿瘤微创手术研究进展[J]. 中国肺癌杂志, 2018, 21(4): 269-272. |
| [5] |
刘伟欣, 王淑莲, 宋永文, 等. 乳腺导管内原位癌治疗趋势和预后单中心分析[J]. 中华放射肿瘤学杂志, 2019, 28(2): 96-101. DOI:10.3760/cma.j.issn.1004-4221.2019.02.004 |
| [6] |
孙文, 牛洪欣. 放射性125I粒子植入治疗消化道肿瘤的研究进展[J]. 中国微创外科杂志, 2018, 18(9): 842-845. DOI:10.3969/j.issn.1009-6604.2018.09.019 |
| [7] |
罗开元. 实用组织间植入内放射治疗恶性肿瘤学[M]. 北京: 人民卫生出版社, 2008: 9-16.
|
| [8] |
夏寿萱. 放射生物学[M]. 北京: 军事医学科学出版社, 1998: 178-218.
|
| [9] |
王巧瑜, 潘洁, 周元敏. 经肝动脉化疗栓塞术联合门静脉内125I粒子植入治疗原发性肝癌合并门静脉癌栓的效果观察[J]. 临床肝胆病杂志, 2018, 34(1): 137-141. DOI:10.3969/j.issn.1001-5256.2018.01.028 |
| [10] |
曲昂, 王俊杰, 姜伟娟, 等. 125I粒子植入挽救性治疗放疗后盆腔复发宫颈癌的疗效分析[J]. 中华核医学与分子影像杂志, 2018, 38(1): 17-21. DOI:10.3760/cma.j.issn.2095-2848.2018.01.005 |
| [11] |
MORRISON H, MENON G, LAROCQUE M P, et al. Initial evaluation of advanced collapsed cone engine dose calculations in water medium for I-125 seeds and COMS eye plaques[J]. Med Phys, 2018, 45(3): 1276-1286. DOI:10.1002/mp.12776 |
| [12] |
王珂, 任予, 陈武科. 恶性肿瘤的放射性粒子植入治疗[J]. 现代肿瘤医学, 2004, 12(5): 485-487. DOI:10.3969/j.issn.1672-4992.2004.05.050 |
| [13] |
JELENA K, DRENKA T, ALEKSANDRA J, et al. Metabolic plasticity of stem cells and macrophages in cancer[J]. Front Immunol, 2017, 8(8): 1-9. |
| [14] |
NETEA-MAIER R T, SMIT J W A, NETEA M G. Metabolic changes in tumor cells and tumor-associated macrophages: a mutual relationship[J]. Cancer Lett, 2018, 413: 102-109. DOI:10.1016/j.canlet.2017.10.037 |
| [15] |
IONESCU L, BYRNE R N, VAN HAAFTEN T, et al. Stem cell conditioned medium improves acute lung injury in mice: in vivo evidence for stem cell paracrine action[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 303(11): L967-L977. |
| [16] |
GUPTA P B, ONDER T T, JIANG GZ, et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening[J]. Cell, 2009, 138(4): 645-659. DOI:10.1016/j.cell.2009.06.034 |
| [17] |
窦建卫, 黄芊, 赵天一, 等. 阳和汤对乳腺癌MDA-MB-231细胞NF-κB、IL-8表达的影响[J]. 四川中医, 2017, 35(2): 44-47. |
| [18] |
沈伟, 李康乐, 尚荣国, 等. 阳和汤对乳腺癌干细胞CD90、IL-8 mRNA表达水平的影响[J]. 四川中医, 2019, 37(3): 44-46. |
| [19] |
CHO H, SEO Y, LOKE K M, et al. Cancer-stimulated CAFs enhance monocyte differentiation and pro-tumoral TAM activation via IL-6 and GM-CSF secretion[J]. Clin Cancer Res, 2018, 24(21): 5407-5421. DOI:10.1158/1078-0432.CCR-18-0125 |
| [20] |
王正林, 孔繁学, 胡祥. 肿瘤相关巨噬细胞研究进展[J]. 中华实验外科杂志, 2016, 33(2): 546-549. DOI:10.3760/cma.j.issn.1001-9030.2016.02.084 |
| [21] |
王守杰, 王建莉, 蔡志坚. Th17细胞及其在肿瘤免疫中作用的最新进展[J]. 中国肿瘤生物治疗杂志, 2018, 25(3): 293-299. |
| [22] |
罗益贤, 马捷, 刘永光, 等. 动态增强MRI对乳腺癌新辅助化疗的疗效评价及预测[J]. 中国医学物理学杂志, 2019, 36(7): 794-799. DOI:10.3969/j.issn.1005-202X.2019.07.010 |
 2019, Vol. 45
2019, Vol. 45


