扩展功能
文章信息
- 陈文娟, 冯海波, 赵征, 曹培培, 韩乐
- CHEN Wenjuan, FENG Haibo, ZHAO Zheng, CAO Peipei, HAN Le
- DKK1蛋白对SBC-3细胞增殖、迁移和侵袭能力的促进作用及其机制
- Effects of DKK1 protein on proliferation, migration and invasion of SBC-3 cells and their mechanisms
- 吉林大学学报(医学版), 2019, 45(06): 1294-1298
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1294-1298
- 10.13481/j.1671-587x.20190617
-
文章历史
- 收稿日期: 2019-05-31
2. 陕西省肿瘤医院头颈外科, 陕西 西安 710061;
3. 陕西省西安市中心医院肿瘤科, 陕西 西安 710003;
4. 陕西省肿瘤医院胸外科, 陕西 西安 710061
2. Department of Head and Neck Surgery, Tumor Hospital, Shaanxi Province, Xi'an 710061, China;
3. Department of Oncology, Xi'an Central Hospital, Shaanxi Province, Xi'an 710003, China;
4. Department of Thoracic Surgery, Tumor Hospital, Shaanxi Province, Xi'an 710061, China
全球范围内肺癌仍位于恶性肿瘤发病率和死亡率的首位。最新的全球癌症统计报告[1]显示:2018年新增的肺癌病例数为210万人,因肺癌死亡的患者有180万(占癌症死亡人数的18.4%)。小细胞肺癌(small cell lung cancer, SCLC)约占所有肺癌发病率的14%[2],SCLC具有高度侵袭性,且生长速度快,约2/3患者就诊时已处于广泛期。因此深入探讨SCLC发生发展的可能分子机制并寻找可能的潜在干预靶点对SCLC的防治至关重要。SCLC患者血清中Dickkopf-1 (DKK1)蛋白表达水平较高,本文作者推测DKK1可能与SCLC的发生发展、特别是转移有关联。DKK1是一种分泌型的蛋白,是Wnt信号通路的负性调控因子。研究[3]证实:Wnt信号通路对细胞的增殖和凋亡等发挥着重要作用,其异常调控会引起细胞发育异常及癌变,但DKK1与SCLC的关系目前尚未见相关报道。本研究采用慢病毒感染构建DKK1蛋白过表达的SBC-3细胞株,观察上调DKK1蛋白表达对SBC-3细胞增殖、迁移和侵袭能力的影响,初步探讨其可能的分子机制。
1 材料与方法 1.1 细胞、主要试剂和仪器人SCLC细胞株SBC-3为陕西省肿瘤医院基础实验室保存。RPMI1640和10%胎牛血清购自美国Gibco公司,RNA提取试剂盒购自德国Qiagen公司,RT-PCR试剂盒购自日本TaKaRa公司,蛋白定量试剂盒购自美国Thermo公司,DKK1抗体和基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)抗体(兔抗人)购自美国Abcam公司,β-actin(鼠抗人)抗体购自美国Sigma公司,相应的二抗分别购自中杉金桥公司和GeneText公司。慢病毒由吉凯公司合成,PCR引物由上海生工合成。细胞培养瓶和培养板等购自美国Corning公司。其他试剂和仪器为陕西省肿瘤医院内三科实验室保存。
1.2 细胞培养人SCLC SBC-3细胞培养在完全培养基中,置于37 ℃、5% CO2孵箱中常规培养,待细胞生长至对数期时进行实验。
1.3 DKK1过表达SBC-3-DKK1细胞的构建常规处理处于对数生长期的细胞,采用无血清培养基制成密度为1 × 104mL-1的细胞悬液,按照每孔2×104个将细胞接种于6孔板中继续培养,细胞密度达20%且细胞状态良好时按照预感染实验结果,当感染复数(multiplicity of infection, MOI)为80时取相应体积的过表达慢病毒及对照病毒,在含有Polybrene的ENi.S感染液中,按照操作步骤进行细胞感染。基因名称:DKK1(NM_012242),载体名称:GV358,元件顺序:Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin。感染24 h后将无血清培养基更换为完全培养基,72 h后倒置荧光显微镜下观察绿色荧光率大于80%提示感染成功。常规扩大培养,并加入1 mg·L-1嘌呤霉素进行筛选1周。获得稳定表达DKK1蛋白的细胞系(SBC-3-DKK1组)和对照细胞系(SBC-3-NC组)。
1.4 RT-PCR法检测2组SBC-3细胞中DKK1 mRNA表达水平根据RNA提取试剂盒的操作流程,分别收集SBC-3-DKK1组和SBC-3-NC组细胞各5 ×106个,加入裂解液Buffer RLT,逐步进行RNA提取。测定RNA浓度和纯度,按照试剂盒说明书进行反转录和RT-PCR实验,以β-actin作为内参,采用2-ΔΔCT法计算2组细胞中DKK1 mRNA表达水平。
1.5 Western blotting法检测2组SBC-3细胞中DKK1蛋白表达量常规裂解SBC-3-DKK1和SBC-3-NC组细胞,提取总蛋白。按照蛋白定量分析试剂盒说明书准确进行蛋白定量并制备蛋白样品; 采用SDS-聚丙烯酰胺凝胶电泳,应用湿转法进行转膜,将蛋白质转移至裁剪好的PVDF膜上,标记好膜的正反面; 5% BSA摇床室温封闭1 h,采用1 × TBST洗膜3次,每次15 min,5% BSA稀释抗体至相应的浓度(1:2 000 DKK1和1:8 000 β-actin)用于一抗杂交,水平摇床4℃过夜。1 × TBST洗涤3次,每次15 min,加入1:2 000的二抗稀释液室温封闭杂交1 h,1×TBST洗涤二抗3次,每次15 min,ECL液暗区显影、曝光。
1.6 平板克隆形成实验检测2组SBC-3细胞克隆形成率取对数生长期的SBC-3-DKK1和SBC-3-NC组细胞,调整细胞密度至2 ×103mL-1,以每孔100 μL细胞悬液接种至6孔板,补足细胞悬液至2 mL,混匀细胞置于孵箱中常规培养。倒置显微镜下观察,肉眼可见细胞克隆形成时终止培养,弃掉培养液,预冷的PBS轻轻洗涤2 ~ 3次,甲醇固定15 min,弃掉甲醛,结晶紫染液染色20 min,采用流动的自来水轻轻冲洗,置于空气中干燥。肉眼计数可见的克隆数,计算克隆形成率。克隆形成率= (克隆数/接种细胞数) × 100%。实验重复3次。
1.7 Transwell细胞迁移和侵袭实验侵袭实验:Matrigel基质胶包被Transwell小室基底膜,注意避免气泡的产生,室温风干; 常规处理细胞,无血清培养基重悬,密度调整为5 ×104mL-1,取每孔200 μL在含8 μm孔径膜的Transwell上室沿着孔的边缘向下室中加入500 μL完全培养基。迁移实验:不需要铺基质胶,其余同侵袭实验。常规培养至24 h,取出小室,以预冷的PBS淋洗,采用洁净的棉签擦去微孔膜内层细胞,进行甲醇固定(15 min)和结晶紫染液染色(20 min),冲洗染色液、室温风干。采用倒置显微镜计数穿过微孔膜的细胞数,随机计数10个视野,取平均值。实验重复3次。
1.8 Western blotting法检测2组SBC-3细胞中MMP-9蛋白表达量常规裂解2组细胞、提取总蛋白、定量并制备蛋白样品; 采用SDS-聚丙烯酰胺凝胶电泳、转膜、标记膜、封闭和洗涤,1:2 000 MMP-9和1:8 000 β-actin一抗杂交,水平摇床4℃过夜,洗涤,以1:2 000的二抗稀释液室温封闭杂交1 h,洗涤; ECL液暗区显影、曝光。
1.9 统计学分析采用SPSS 24.0统计软件进行统计学分析。2组SBC-3细胞中DKK1 mRNA表达水平、DKK1蛋白表达水平、克隆形成率、细胞迁移数和细胞侵袭数以x±s表示,组间样本均数比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
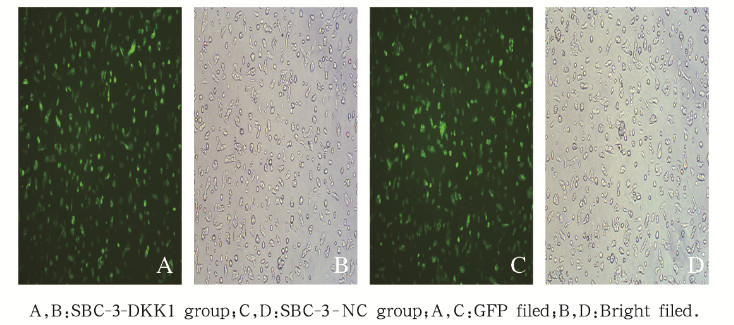
2 结果 2.1 过表达DKK1蛋白的SBC-3-DKK1细胞的构建感染72 h时倒置荧光显微镜下观察慢病毒感染的SBC-3-DKK1细胞和SBC-3-NC细胞,显示绿色荧光率大于80%,提示感染成功。见图 1(插页四)。
|
| 图 1 倒置荧光显微镜下观察慢病毒感染SBC-3细胞荧光率(×200) Fig. 1 Fluorescence rate of lentivirus-infected SBC-3 cells observed under inverted fluorescence microscope(×200) |
|
|
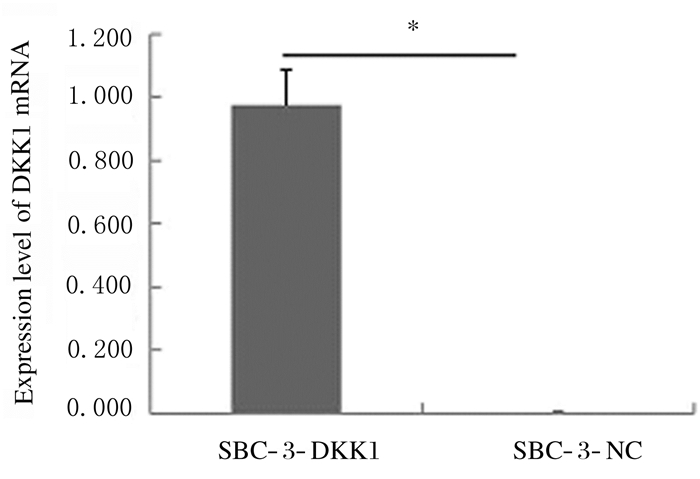
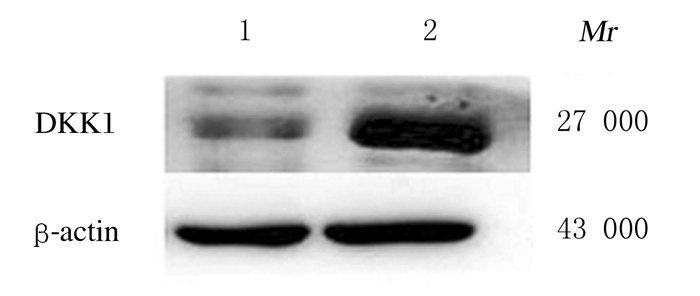
RT-PCR结果显示:SBC-3-DKK1组细胞中DKK1mRNA表达水平明显高于SBC-3-NC组(P<0.05)(图 2)。Western blotting法检测结果显示:SBC-3-DKK1组细胞中DKK1蛋白表达量高于SBC-3-NC组(图 3)。
|
| *P < 0.05 vs SBC-3-NC group. 图 2 SBC-3-DKK1和SBC-3-NC组细胞中DDK1 mRNA表达水平 Fig. 2 Expression levels of DKK1 mRNA in cells in SBC-3-DKK1 and SBC-3-NC groups |
|
|
|
| Lane 1:SBC-3-NC group; Lane 2:SBC-3-DKK1 group. 图 3 Western blotting法检测SBC-3-DKK1和SBC-3-NC组细胞中DDK1蛋白表达电泳图 Fig. 3 Electrophoregram of expressions of DKK1 protein in cells in SBC-3-DKK1 and SBC-3-NC groups detected by Western blotting method |
|
|
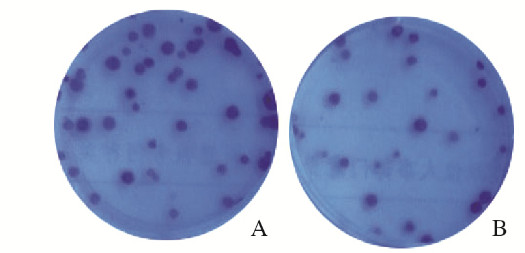
SBC-3-DKK1组细胞克隆形成率(31%±2%)高于SBC-3-NC组(14%±1%),组间比较差异有统计学意义(P=0.002 6)。见图 4(插页四)。
|
| 图 4 平板克隆法检测SBC-3-DKK1组(A)和SBC-3-NC组(B)细胞克隆形成率 Fig. 4 Clone formation rate of cells in SBC-3-DKK1 group(A) and SBC-3-NC(B) group detected by plate cloning method |
|
|
迁移实验:每高倍视野(×200)下SBC-3-DKK1组穿膜细胞数为131.00±5.67,SBC-3-NC组穿膜细胞数为70.00±2.52,2组穿膜细胞数比较差异有统计学意义(P=0.006 2)。侵袭实验:SBC-3-DKK1组穿膜细胞数为101.00±3.51,SBC-3-NC组穿膜细胞数为57.00 ±3.00,2组穿膜细胞数比较差异有统计学意义(P=0.0214)。见图 5(插页四)。
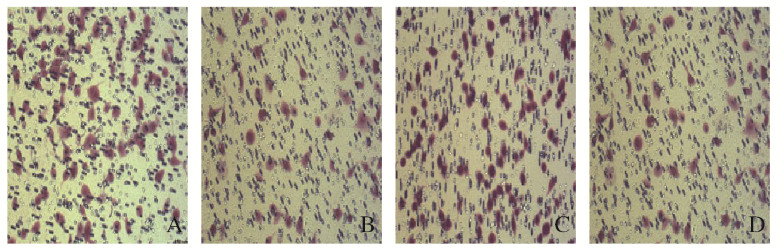
|
| A, B: Migration; C, D: Invasion; A, C: SBC-3-DKK1 group; B, D: SBC-3-NC group. 图 5 实验检测SBC-3-DKK1组和SBC-3-NC组细胞迁移和侵袭能力(×200) Fig. 5 Migration and invasion abilities of cells in SBC-3-DKK1 group and SBC-3-NC group detected by Transwell assay (×200) |
|
|
Western blotting法检测结果显示:与SBC-3-NC组比较,SBC-3-DKK1组SBC-3细胞中MMP-9蛋白表达量明显升高。见图 6。
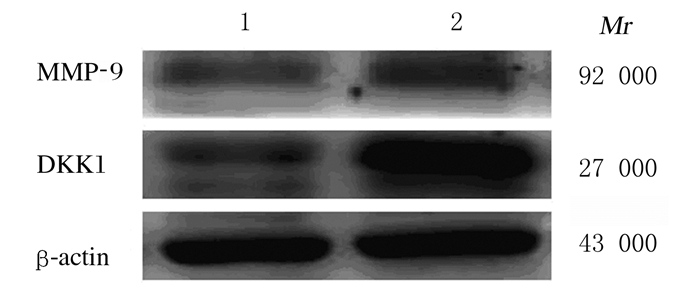
|
| Lane 1:SBC-3-NC group; Lane 2:SBC-3-DKK1 group. 图 6 Western blotting法检测SBC-3-DKK1和SBC-3-NC组SBC-3细胞中MMP-9蛋白表达电泳图 Fig. 6 Electrophoregram of expressions of MMP-9 protein in SBC-3 cells in SBC-3-DKK1 and SBC-3-NC groups detected by Western blotting method |
|
|
DKK1基因是DKK基因家族中的一员,长度为1 815 000 bp,位于10号染色体10q11.2上,其编码的DKK1蛋白相对分子质量约为27 000,属于分泌型糖蛋白,定位于细胞浆内,包含有2个富含半胱氨酸的保守结构域。DKK1可以通过与LRP5/LRP6受体和Kremen-1/2结合成复合物[4],诱导快速的细胞内吞,减少细胞膜上的LRP5/LRP6,以此阻断Wnt信号向胞内传递,也可以通过竞争性地与LRP5/LRP6受体结合,特异性地抑制Wnt信号通路,从而在肿瘤细胞的增殖、侵袭、转移和肿瘤新生血管等过程中发挥重要作用[5]。DKK1在除胎盘及前列腺以外的正常组织中几乎无表达,但是在非小细胞肺癌、乳腺癌、胰腺癌、肝癌和宫颈癌等多种肿瘤组织中均存在异常高表达[6-7],提示DKK1蛋白通过调控Wnt信号通路与多种恶性肿瘤的发生发展有关。但是DKK1蛋白在SCLC发生发展中的作用机制目前仍不明确。
既往的实验[6]结果显示:SCLC患者血清中DKK1蛋白高表达,因此推测DKK1与SCLC的发生发展具有相关性。本研究选择人SCLC细胞株SBC-3,通过慢病毒转染的方法获得稳定表达的SBC-3-DKK1细胞,上调DKK1蛋白表达可以促进SBC-3细胞的增殖、迁移和侵袭能力,提示DKK1蛋白可以影响SBC-3细胞的生物学功能。这一结论与既往文献[7]报道的DKK1蛋白在其他恶性肿瘤中的表现一致,初步揭示了DKK1蛋白在SCLC发生发展中的作用。
DKK1蛋白在Wnt信号调控中具有双向作用。作为内源性抑制剂,DKK1蛋白可以对经典的Wnt信号通路进行抑制,同时其也受到Wnt/β-catenin信号通路的负反馈调节[8]。本研究初步探讨了DKK1蛋白促进SCLC发生发展的机制,发现DKK1蛋白表达上调时,MMP-9蛋白表达水平升高。MMP-9属于基质金属蛋白酶(matrix metalloproteinases,MMPs)家族中的一员,是目前研究最广泛的MMPs之一,在癌细胞侵袭和肿瘤转移中发挥重要作用。人MMP-9基因定位于20号染色体20q13.12[9]。MMP-9蛋白的催化结构域包括纤连蛋白Ⅱ型(FN2)结构域、活性位点和锌结合区[10],是依赖于锌的内肽酶成员之一[11]。MMP-9蛋白的主要功能是降解细胞外基质和基底膜,而基底膜的破坏是肿瘤发生发展的重要环节,因此MMP-9蛋白在肿瘤的发生发展中起重要的作用[12],其在SCLC、乳腺癌及肝癌中均存在过表达[13-15]。文献[16]报道:MMP-9蛋白与血管生成拟态(vasculogenic mimicry, VM)具有相关性,属于VM相关蛋白。MANIOTIS等[17]在1999年首次提出了一种与经典肿瘤血管生成途径不同,不依赖机体内皮细胞的全新肿瘤微循环模式,即VM的概念。随后研究不断发现在肝癌、前列腺癌及卵巢癌等瘤种中均存在VM,VM的存在与肿瘤的生长、分化程度和侵袭性等密切相关。DKK1蛋白与VM及其相关蛋白之间具有明确的相关性[16, 18]。在非小细胞肺癌(NSCLC)的癌组织中DKK1蛋白的表达与VM相关蛋白MMP-9的表达具有一致性,在NSCLC细胞株A549和H460中上调DKK1蛋白表达后,MMP-9蛋白表达随之升高,初步证实DKK1蛋白可能通过上调MMP-9蛋白的表达介导SCLC的发生发展。
综上所述,在SCLC细胞中高表达DKK1蛋白可通过调控VM相关蛋白MMP-9蛋白的表达促进人SCLC的生物学功能,初步揭示了DKK1蛋白在人SCLC发生发展中的作用及其机制,为进一步研究其在人SCLC中的作用机制奠定了实验基础,同时为研究DKK1蛋白相关抑制药物在人SCLC防治中的临床应用提供了理论依据。
| [1] |
FREDDIE B, JACQUES F, ISABELLE S, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
BYERS L A, RUDIN C M. Small cell lung cancer: where do we go from here?[J]. Cancer, 2015, 121(5): 664-672. |
| [3] |
NELSON W J, NUSSE R. Convergence of Wnt, beta-catenin, and cadherin pathways[J]. Science, 2004, 303(5663): 1483-1487. DOI:10.1126/science.1094291 |
| [4] |
ZEBISCH M, JACKSON V A, ZHAO Y G, et al. Structure of the dual-mode Wnt regulator kremen1 and insight into ternary complex formation with LRP6 and dickkopf[J]. Structure, 2016, 24(9): 1599-1605. DOI:10.1016/j.str.2016.06.020 |
| [5] |
KRUPNIK V E, SHARP J D, JIANG C, et al. Functional and structural diversity of the human Dickkopf gene family[J]. Gene, 1999, 238(2): 301-313. DOI:10.1016/S0378-1119(99)00365-0 |
| [6] |
YAMABUKI T, TAKANO A, HAYAMA S, et al. Dikkopf-1 as a novel serologic and prognostic biomarker for lung and esophageal carcinomas[J]. Cancer Res, 2007, 67(6): 2517-2525. DOI:10.1158/0008-5472.CAN-06-3369 |
| [7] |
SATO N, YAMABUKI T, TAKANO A, et al. Wnt inhibitor Dickkopf-1 as a target for passive cancer immunotherapy[J]. Cancer Res, 2010, 70(13): 5326-5336. DOI:10.1158/0008-5472.CAN-09-3879 |
| [8] |
WANG K, ZHANG Y Z, LI X F, et al. Characterization of the Kremen-binding site on Dkk1 and elucidation of the role of Kremen in Dkk-mediated Wnt antagonism[J]. J Biol Chem, 2008, 283(34): 23371-23375. DOI:10.1074/jbc.M802376200 |
| [9] |
VANDOOREN J, VAN DEN STEEN P E, OPDENAKKER G. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9(MMP-9): the next decade[J]. Crit Rev Biochem Mol Biol, 2013, 48(3): 222-272. |
| [10] |
VAN DEN STEEN P E, DUBOIS B, NELISSEN I, et al. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9(MMP-9)[J]. Crit Rev Biochem Mol Biol, 2002, 37(6): 375-536. DOI:10.1080/10409230290771546 |
| [11] |
AGRAWAL A, ROMERO-PEREZ D, JACOBSEN J A, et al. Zinc-binding groups modulate selective inhibition of MMPs[J]. Chem Med Chem, 2008, 3(5): 812-820. DOI:10.1002/cmdc.200700290 |
| [12] |
HOU H L, ZHANG G J, WANG H Y, et al. High matrix metalloproteinase-9 expression induces angiogenesis and basement membrane degradation in stroke-prone spontaneously hypertensive rats after cerebral infarction[J]. Neural Regen Res, 2014, 9(11): 1154-1162. DOI:10.4103/1673-5374.135318 |
| [13] |
BLANCO-PRIETO S, BARCIA-CASTRO L, PAEZ DELA CADENA M, et al. Relevance of matrix metalloproteases in non-small cell lung cancer diagnosis[J]. BMC Cancer, 2017, 17(1): 823. DOI:10.1186/s12885-017-3842-z |
| [14] |
GOLUBNITSCHAJA O, YEGHIAZARYAN K, ABRAHAM J A, et al. Breast cancer risk assessment: a non-invasive multiparametric approach to stratify patients by MMP-9 serum activity and RhoA expression patterns in circulating leucocytes[J]. Amino Acids, 2017, 49(2): 273-281. |
| [15] |
YEH H C, LIN S M, CHEN M F, et al. Evaluation of serum matrix metalloproteinase (MMP)-9 to MMP-2 ratio as a biomarker in hepatocellular carcinoma[J]. Hepatogastroenterology, 2010, 57(97): 98-102. |
| [16] |
YAO L L, ZHANG D F, ZHAO X L, et al. Dickkopf-1-promoted vasculogenic mimicry in non-small cell lung cancer is associated with EMT and development of a cancer stem-like cell phenotype[J]. J Cell Mol Med, 2016, 20(9): 1673-1685. DOI:10.1111/jcmm.12862 |
| [17] |
MANIOTIS A J, FOLBERG R, HESS A, et al. Vascular Channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry[J]. Am J Pathol, 1999, 155(3): 739-752. |
| [18] |
LIU T J, SUN B C, ZHAO X L, et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer[J]. Oncogene, 2013, 32(5): 544-553. DOI:10.1038/onc.2012.85 |
 2019, Vol. 45
2019, Vol. 45


