扩展功能
文章信息
- 任爱华, 王大伟
- REN Aihua, WANG Dawei
- CRISPR/Cas9介导TKI对非小细胞肺癌基因靶向吉非替尼耐药敏感性的影响及其机制
- Effect of CRISPR/Cas9-mediated TKI on sensitivity of non-small cell lung cancer gene targeting gefitinib resistance and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1288-1293
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1288-1293
- 10.13481/j.1671-587x.20190616
-
文章历史
- 收稿日期: 2018-12-25
2. 北华大学医学院病理教研室, 吉林 吉林 132013
2. Department of Pathology, College of Medical Sciences, Beihua University, Jilin 132013, China
肺癌是最常见的恶性肿瘤,也是发病率最高的恶性肿瘤,死亡率居恶性肿瘤死亡率的第一位[1]。肺癌发病原因较多,吸烟、空气污染、肺部慢性感染和遗传因素等均能引起肺癌的发生[2]。非小细胞肺癌又称非小细胞癌,属于肺癌的一种,约占肺癌总数的85%[3], 临床上非小细胞肺癌患者初期的主要症状为咳嗽、胸痛、发热和血痰等,晚期会出现呼气困难、淋巴结肿大、面部或上臂出现肿胀和体质量降低等症状[4]。早期肺癌一般采取手术的治疗方式,晚期需要进行多学科综合治疗,包括放化疗,但化疗后的一段时期,患者会产生一定的耐药性,因此急需寻找一种新的方法克服耐药性的产生[5]。CRISPR相关核酸酶9(clustered regularly interspaced short palindromic repeat/CRISPR-associated nuclease 9,CRISPR/Cas9)由效率最高的基因编辑技术[6]将入侵质粒DNA的片段或者入侵噬菌体整合到CRISPR中,对同源序列进行降解,提高免疫性[7]。CRISPR/Cas9也是最近几年发现的一种基因编码技术,由于其自身具有精确性和高效性,目前已经广泛应用于肿瘤治疗[8],这种基因编码技术可以鉴别肿瘤的耐药基因,并且对耐药基因进行敲除可以预防肿瘤对药物的耐药性。小分子酪氨酸激酶(tyrosinekinases, TKs)通过各种底物酶影响下游信号的传导,通过一系列反应影响细胞的增殖、凋亡和迁移等。酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)对TKs产生抑制作用,对于转移非小细胞癌通常,采用表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)靶向治疗方式[9],其主要特点是具有选择性和可逆性,主要通过TKs催化区域的ATP位点阻断传导信号,从而抑制肿瘤的生长[10],但EGFR二次突变会引起吉非替尼耐药,影响肿瘤的治疗[11],所以需要对肿瘤的耐药基因进行敲除,以提高治疗效果。本研究主要探讨CRISPR/Cas9介导TKI对非小细胞肺癌基因靶向治疗疗效的影响,提高吉非替尼耐药的敏感性。
1 材料与方法 1.1 细胞株、主要试剂和仪器非小细胞肺癌细胞株A549(上海生命科学研究院)。phU6-sgRNA骨架质粒、胎牛血清和DMEM培养基(苏州碧云天生物技术有限公司),LipofectamineTM2000转染试剂盒和CCK-8检测试剂盒和miRNA分离试剂盒(上海吉凯基因化学公司),TRIzol试剂(美国Invitrogen公司),无内毒素质粒大提试剂盒(美国Hyclone公司),碘化丙啶(PI,南京建成生物工程研究所),BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),MDM2、Bax、Bcl-2和TKI抗体(上海苏彭化学试剂公司)。
1.2 Lenti-Cas9-gRNA-EGFP表达质粒的构建在NCBI网站上检索到TKI的基因序列,利用网站(http://crispr.mit.edu)设计3个不同TKI sgRNA序列,sgRNA1上游引物为5′-ACCGCACTACTCTCAAATCTGTTC-3′,sgRNAl下游引物为5′-AAACGAACAGATTTGAGAGTAGTG-3′;sgRNA2上游引物为:5′-ACCGTTTGTCAATTCGTTCTGAAG-3′,sgRNA2下游引物为5′-CAGTCCAGCCCATACTTTTCTTAG-3′; sgRNA3上游引物为5′-ATGGCCTTCCGTGTTCCTACGC CGA-3′, sgRNA3下游引物为5′-CACCTTCTTGATGTCATCATACTG-3′。在每条sgRNA序列的正义链5′端添加AACG, 正义链添加ACAG, 与经BsaⅠ酶切后的phU6-sgRNA骨架质粒形成的黏性末端互补,构建Lenti-Cas9-gRNA-EGFP表达质粒。
1.3 细胞株转染和DNA提取将A549细胞株置于6孔培养板中进行培养,采用显微镜观察细胞达到80%~90%的融合状态时,使用转染试剂进行细胞转染,质粒终浓度为1 mg·L-1, 以相同的空白载体为参照,待细胞转染48 h,提取各组A549细胞基因,严格按照细胞基因试剂盒使用说明标准提取细胞基因。
1.4 TKI基因敲除A549细胞株的筛选将Lenti-Cas9-gRNA-EGFP质粒转染到A549细胞株24 h后,将细胞株接种于96孔板中,采用有限稀释法进行操作,待细胞扩增,进行传代和蛋白提取。根据TKI基因序列,合成3个gRNA寡核苷酸序列,分别为gRNAl、gRNA2和gRNA3,并与Lenti-Cas9-gRNA-EGFP质粒重组,将重组后的Lenti-Cas9-gRNA-EGFP质粒混链合成到A549细胞中,根据TKI表达情况分为A549细胞株、A549TKs-/+细胞株和A459TKs-/-细胞株,Western blotting法检测细胞中提取蛋白的表达水平。
1.5 Western blotting法检测细胞中TKI、P53、MDM2、Bcl-2和Bax蛋白表达水平将A549细胞株置于EP管中,注入2 μL胰酶消化,3 min后终止,不断地吹打细胞,收集液体进行沉淀后,加入200 μL RIPA裂解液,收集上清,13 000 r·min-1低温离心20 min,加入已经配好的裂解液均匀搅拌,待沉淀后,在冰上裂解10 min。采用BCA检测蛋白浓度,注入金属浴进行蛋白变性处理,-80℃冻存,取10μg蛋白样品,电泳后,转移至PVDF膜上,用5%脱脂奶粉封闭1 h,加入配比为1:400的MDM2、Bax、Bcl-2和TKI抗体一抗,4℃孵育过夜,加入配比为1:500山羊抗兔AF555标记二抗,室温孵育60 min,PBS清洗3次,ECL显影,胶片曝光。目标蛋白表达水平=目标蛋白条带灰度值/β-actin条带灰度值。
1.6 CCK-8法检测细胞活性取对数生长期A549、A549TKs-/+和A549TKs-/-细胞株接种在96孔板中,在24、48和72 h替换原培养基1次,加入CCK-8溶液之前以每孔200μL不含药物的无血清培养基取代原培养液,再加入浓度为5 g/L的CCK-8溶液20μL,孵育4 h。酶标仪参数设置为450 nm,检测各孔的吸光度(A)值,以A值代表细胞活性。
1.7 细胞划痕实验检测细胞迁移能力取对数生长期的3种细胞株接种于6孔板中, 采用200μL黄枪头的枪尖在6孔板中间位置划出1条贯穿培养孔的划痕, 各孔的划痕要一致, 弃去培养液, PBS漂洗3次, 培养48 h, 弃去悬浮细胞株, 对各孔进行拍照, 观察划痕附近的细胞迁移情况。细胞划痕愈合率=愈合面积/划痕面积×100%。
1.8 流式细胞术检测细胞凋亡率取3种细胞株, 采用0.25%胰酶消化, 接种于6孔培养板中, 置入37℃、CO2培养箱中培养, 24 h后收集细胞, 调整细胞浓度, PBS洗涤3次, 离心处理, 4℃、3 000 r·min-1离心10 min, 弃去上清。加入5μL Annexin Ⅴ-FITC, 摇匀, 避光孵育5 min, 2 h后检测细胞凋亡率,采用计算机WinMDI软件计算细胞凋亡率。
1.9 克隆形成实验检测细胞株集落形成取对数生长期的3种细胞株,采用0.25%胰酶消化并计数,将细胞株接种于培养皿中,放在培养箱培养2周,培养皿中能看见细胞株增多时,丢弃原培养液,PBS漂洗3次, 加入1 mL的3%多聚甲醛固定20 min,弃去固定液,加入甲紫染色60 min,洗去染色液,拍照并记录克隆细胞株数,计算集落生成率。集落生成率=集落形成数/接种细胞数×100%。
1.10 药物敏感性实验取对数生长期的3种细胞株, 采用0.25%胰酶消化, 接种于96孔培养板中, 细胞壁增厚,更换培养基原液,并加入6 mmol·L-1吉非替尼,置于培养箱中恒温下培养,24、48和72 h时替换原培养基1次,培养120 min,按照上述方法检测吉非替尼干预后细胞活性、细胞凋亡率、细胞迁移能力、细胞中蛋白表达水平和细胞集落生成率。
1.11 统计学分析采用SPSS 22.0统计软件进行统计学分析。A549、A549TKs-/+和A549TKs-/-细胞活性、细胞凋亡率、细胞迁移能力、细胞集落生成率、细胞中蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 TKs基因敲除A549细胞株的建立和鉴定与原始A549细胞株比较,A549TKs-/+细胞株中TKI蛋白表达水平较低,A549TKs-/-细胞株中无TKI蛋白表达。经测序,插入序列与预期相符,无碱基突变,证明敲除质粒构建成功。见图 1和2(插页四)。
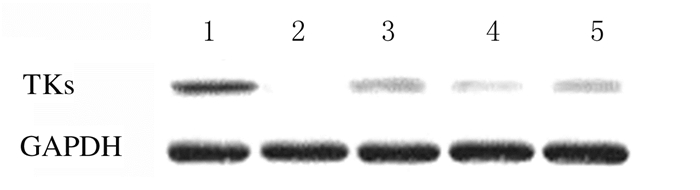
|
| Lane 1: Normal A549 cell strain; Lane 2: A1 cell strain; Lane 3: A2 cell strain; Lane 4: A3 cell strain; Lane 5: A4 cell strain. 图 1 Western blotting法检测A549细胞株中TKs蛋白表达电泳图 Fig. 1 Electrophoregram of expression of TKs protein in A549 cell strains detected by Western blotting method |
|
|
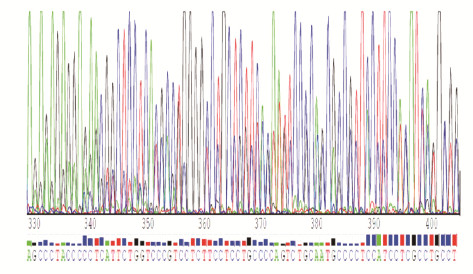
|
| 图 2 DNA测序图谱 Fig. 2 DNA sequencing map |
|
|
A549、A549TKs-/+和A549TKs-/-细胞活性分别为1.127±0.594、1.019±0.627和1.292±0.686,细胞活性比较差异无统计学意义(P>0.05),见图 3。细胞凋亡率检测结果显示:敲除TKI基因后,A549、A549TKs-/+和A549TKs-/-细胞凋亡率为(8.237±3.581)%、(7.918±3.074)%和(7.193±2.981)%,细胞凋亡率比较差异无统计学意义(P>0.05),见图 4。细胞划痕实验结果显示:A549、A549TKs-/+和A549TKs-/-细胞迁移能力无差异, 见图 5(插页四)。
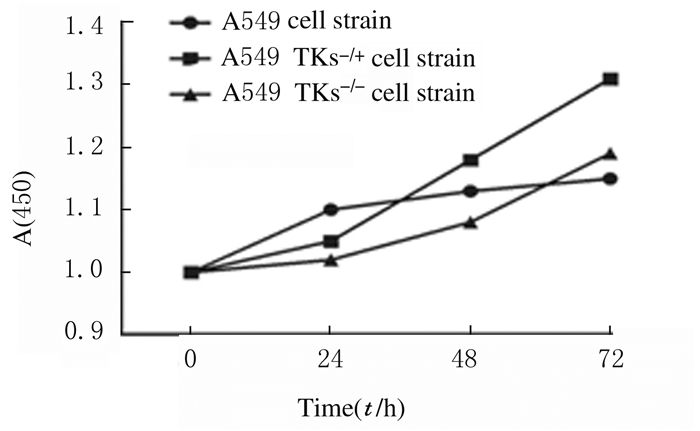
|
| 图 3 CCK-8法检测细胞株活性 Fig. 3 Activities of cell strains detected by CCK-8 method |
|
|
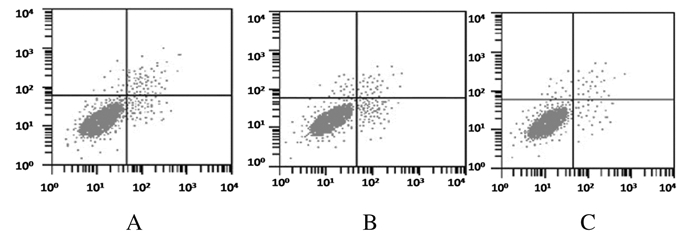
|
| A: A549 cell strain; B: A549TKs-/+ cell strain; C: A549TKs-/- cell strain. 图 4 流式细胞术检测细胞凋亡率 Fig. 4 Apoptotic rates of cells detected by flow cytometry |
|
|

|
| A: A549 cell strain; B: A549TKs-/+ cell strain; C: A549TKs-/-cell strain. 图 5 细胞划痕实验检测各组细胞迁移能力 Fig. 5 Migration abilities of cells in various groups detected by cell scratch test |
|
|
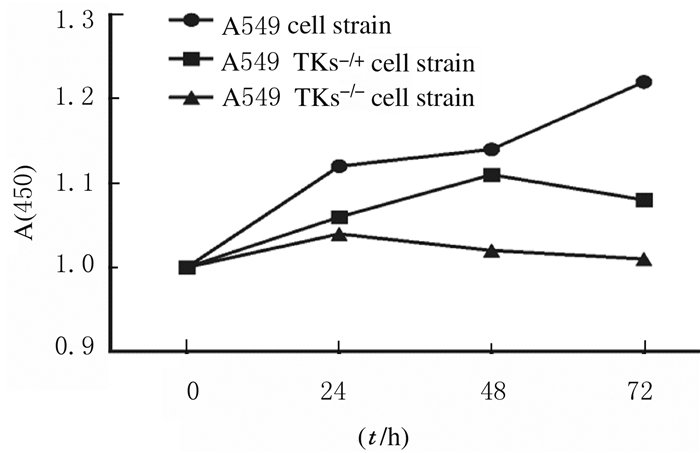
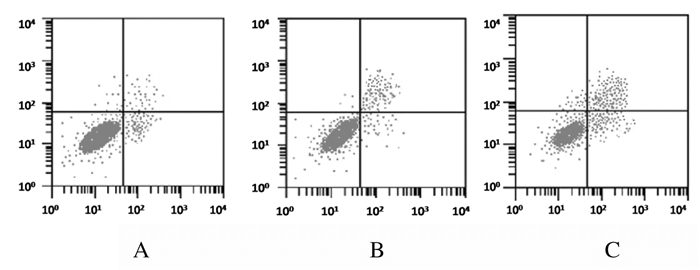
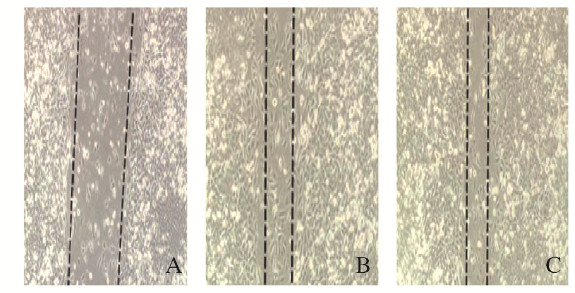
6 mol·L-1吉非替尼干预72 h后,A549、A549TKs-/+和A549TKs-/-细胞活性分别为1.278±0.912、1.031±0.527和0.892±0.364;与A549细胞比较,A549TKs-/+和A549TKs-/-细胞的细胞活性降低(P < 0.05), 见图 6。细胞凋亡率检测结果显示:A549、A549TKs-/+和A549TKs-/-细胞凋亡率分别为(14.782±8.923)%、(21.864±11.325)%和(32.132±14.981)%;与A549细胞株比较,A549TKs-/+和A549TKs-/-细胞株的细胞凋亡率升高(P < 0.05), 见图 7。A549、A549TKs-/+和A549TKs-/-细胞株细胞划痕愈合率为(23.581±0.238)%、(34.147±1.674)%和(48.734±3.562)%,即细胞迁移能力明显降低。见图 8(插页四)。
|
| 图 6 CCK-8法检测吉非替尼干预后细胞活性 Fig. 6 Activities of cells after gefitinib intervention detected by CCK-8 method |
|
|
|
| A: A549 cell strain; B: A549TKs-/+ cell strain; C: A549TKs-/- cell strain. 图 7 吉非替尼干预后流式细胞术检测各组细胞凋亡率 Fig. 7 Apoptotic rates of cells after gefitinib intervention detected by flow cytometry |
|
|
|
| A: A549 cell strain; B: A549TKs-/+cell strain; C: A549TKs-/- cell strain. 图 8 吉非替尼干预后细胞划痕实验检测各组细胞株迁移能力 Fig. 8 Migration abilities of cell strains in various groups detected by cell scratch test after gefitinib intervention |
|
|
A549、A549TKs-/+和A549TKs-/-细胞株中P53蛋白表达水平分别为0.628± 0.256、1.432±0.573、1.892±0.634;与A549细胞株比较,A549TKs-/+和A549TKs-/-细胞株中P53蛋白表达水平明显升高(P < 0.05)。A549、A549TKs-/+和A549TKs-/-细胞株中MDM2蛋白表达水平分别为3.019±1.264、0.937± 0.473、0.515±0.234;与A549细胞株比较,A549TKs-/+和A549TKs-/-细胞株中MDM2蛋白表达水平明显降低(P < 0.05)。A549、A549TKs-/+和A549TKs-/-细胞株中Bcl-2蛋白表达水平分别为2.875±1.073、1.332±0.398和0.617±0.295;与A549细胞株比较,A549TKs-/+和A549TKs-/-细胞株中Bcl-2蛋白表达水平明显降低(P < 0.05)。A549、A549TKs-/+和A549TKs-/-细胞株中Bax表达水平分别为0.314±0.175、1.278±0.362和1.479± 0.416;与A549细胞株比较,A549TKs-/+和A549TKs-/-细胞株中Bax蛋白表达水平明显升高(P < 0.05)。见图 9。

|
| Lane 1: A549 cell strain; Lane 2:A549TKs-/+ cell strain; Lane 3:A549TKs-/- cell strain. 图 9 Western blotting法检测细胞株中P53、MDM2、Bcl-2和Bax蛋白表达电泳图 Fig. 9 Electrophoregram of expressions of P53, MDM2, Bcl-2, and Bax proteins in cell strains detected by Western blotting method |
|
|
吉非替尼作用72 h后,A549、A549TKs-/+和A549TKs-/-细胞株的细胞集落生成率分别为(38.214±3.175)%、(21.361±2.163)%和(14.526±1.267)%,A549TKs-/+和A549TKs-/-细胞株的细胞集落生成率明显低于A549细胞株(P < 0.05)。见图 10。

|
| A: A549 cell strain; B: A549TKs-/+ cell strain; C: A549TKs-/- cell strain. 图 10 吉非替尼干预后细胞集落形成能力 Fig. 10 Colony formation abilities of cells after gefitinib intervention |
|
|
肺癌是一种发病率和死亡率最高的恶性肿瘤,而且预后比较差,主要原因为肺癌细胞发生了转移和入侵[12],EGFR是TKs受体,是非小细胞肺癌的主要驱动因素,参与了细胞增殖、迁移和凋亡[13]。近年来,分子靶向EGFR药物的出现提高了非小细胞肺癌的治疗效果[14],吉非替尼属于一种小分子TKI[15],在非小细胞肺癌治疗方面取得了明显的进展,但治疗6~8个月后,患者会出现吉非替尼的耐药性,因此需要研究新的治疗手段克服肺癌的耐药性。MDM2是一种癌症基因,能导致p53失去对肿瘤的抑制能力,所以阻断p53和MDM2的相互作用[16]现已成为治疗非小细胞肺癌的主要方法之一,采用CRISPR/Cas9靶向技术可以验证Nutlin活性,Nutlin可以阻碍p53与MDM2相互结合,具体方法为利用CRISPR/Cas9技术设计不同sgRNA,建立非小细胞肺癌细胞对EGFR抑制剂耐药的模型,敲除A549细胞株中的TKs基因,评估用药效果[17-18]。
本实验结果显示:经6 mmol·L-1吉非替尼干预后,与A549细胞株比较,A549TKs-/+和A549TKs-/-细胞株的细胞活性明显受到抑制,细胞凋亡率明显升高,细胞划痕愈合率明显降低,细胞迁移能力明显降低。经吉非替尼干扰后细胞活性和迁移能力降低、细胞凋亡率升高,说明敲除TKI基因的A549细胞株对吉非替尼的药物敏感性明显升高。PAZ-ARES等[17]采用CRISPR/Cas9基因编码技术对结肠癌SW1116细胞系敲除IL-6基因,提高了其对顺铂耐药的敏感性。
CRISPR/Cas9技术操作简单,而且能够精确敲除基因,目前在乳腺癌、结肠癌、白血病和黑素瘤等的耐药中广泛应用,能够快速建模,对体内体外细胞进行快速编辑,精确设计sgRNA,为克服肿瘤的耐药性提供更多可能。TKs的受体和配体与许多肿瘤关系密切,较多癌症中会出现TKs蛋白过表达,导致癌细胞增殖和存活[18],所以需要对TKI进行抑制,降低TKs水平,增加治疗药物的敏感性。本研究结果显示:与A549细胞株比较,另外2种细胞株中P53和Bax蛋白表达水平明显降低,MDM2和Bcl-2明显升高。吉非替尼作用72 h后,基因敲除细胞株抑制菌落的生成能力明显强于A549细胞株,说明TKI不表达或者表达较低的情况下,非小细胞肺癌细胞对吉非替尼的敏感性增加。有研究[19]表明:利用CRISPR/Cas9系建立MET敲除的HEK293细胞,MET蛋白表达水平会更高,活性更强,对MET抑制剂的敏感性也更强。SCHULER等[20]研究表明:CRISPR/Cas9系统构建对顺铂(CDDP)敏感,敲除白细胞介素6(interleukin 6, IL-6)的SW1116细胞系为IL-6介导的结肠癌化疗耐药提供了可靠基础。
综上所述,利用CRISPR/Cas9系统建立TKs敲除A549细胞系,经过吉非替尼的干预,细胞活性明显降低,细胞凋亡率升高,细胞迁移能力明显增强,说明敲除TKs的A549细胞系对吉非替尼的药物敏感性升高,本研究为探索TKI介导的非小细胞肺癌化疗耐药机制提供了可靠依据。
| [1] |
周建英, 刘震天, 陈颖兰. MiRNA-25在非小细胞肺癌吉非替尼耐药细胞中的表达及其作用机制[J]. 实用癌症杂志, 2016, 31(10): 1567-1571. DOI:10.3969/j.issn.1001-5930.2016.10.001 |
| [2] |
姜秀秀, 佟金平, 李剑, 等. Mcl-1参与非小细胞肺癌对吉非替尼耐药的实验研究[J]. 现代生物医学进展, 2018, 18(9): 119-122. |
| [3] |
张立文. 吉非替尼对非小细胞肺癌患者免疫功能的影响[J]. 中国药物与临床, 2018, 18(9): 96-98. |
| [4] |
WANG N, ZHANG T. Downregulation of microRNA-135 promotes sensitivity of non-small cell lung cancer to gefitinib by targeting TRIM16[J]. Oncol Res, 2018, 26(7): 1005-1014. DOI:10.3727/096504017X15144755633680 |
| [5] |
张钰, 周建国, 马虎. 非小细胞肺癌分子靶向治疗及其耐药[J]. 国际肿瘤学杂志, 2016, 43(1): 45-48. DOI:10.3760/cma.j.issn.1673-422X.2016.01.013 |
| [6] |
赵佳, 陈建业, 汤建才. 非小细胞肺癌吉非替尼耐药机制及治疗研究进展[J]. 中国现代应用药学, 2017, 53(6): 139-143. |
| [7] |
皮灿, 张一辰, 徐崇锐, 等. 表皮生长因子受体敏感突变阳性非小细胞肺癌耐药后的精准治疗[J]. 中华肿瘤杂志, 2017, 39(2): 94-97. DOI:10.3760/cma.j.issn.0253-3766.2017.02.004 |
| [8] |
王筱雨, 李士军. MALAT1降低非小细胞肺癌对吉非替尼药物敏感性的研究[J]. 中华检验医学杂志, 2017, 40(1): 55-59. DOI:10.3760/cma.j.issn.1009-9158.2017.01.012 |
| [9] |
LIU W, NING J, LI C, et al. Overexpression of Sphk2 is associated with gefitinib resistance in non-small cell lung cancer[J]. Tumor Biol, 2016, 37(5): 6331-6336. DOI:10.1007/s13277-015-4480-1 |
| [10] |
KAZANDJIAN D, BLUMENTHAL G M, YUAN W, et al. FDA approval of gefitinib for the treatment of patients with metastatic EGFR mutation-positive non-small cell lung cancer[J]. Clin Cancer Res, 2016, 22(6): 1307-1312. DOI:10.1158/1078-0432.CCR-15-2266 |
| [11] |
虞莉, 黄沙, 吕望, 等. 上皮间质转化在非小细胞肺癌EGFR-TKIs耐药中的研究进展[J]. 中国肺癌杂志, 2018, 21(12): 29-33. |
| [12] |
谢刚强, 刘春田, 张永庆, 等. 吉非替尼治疗非小细胞肺癌患者的临床疗效分析[J]. 现代生物医学进展, 2016(34): 6754-6757. |
| [13] |
王海霞, 帅帅, 廖雪阳, 等. TIP30逆转人非小细胞肺癌吉非替尼耐药的实验研究[J]. 中国肿瘤临床, 2018, 45(18): 14-19. |
| [14] |
林顺欢, 江冠铭, 刘淳, 等. 贝伐珠单抗联合EGFR-TKI治疗EGFR外显子19或21突变晚期非小细胞肺癌的疗效差异[J]. 新医学, 2016, 47(7): 472-476. DOI:10.3969/j.issn.0253-9802.2016.07.011 |
| [15] |
臧家兰, 胡勇, 秦晓冰, 等. 脂多糖对核转录因子-κB的激活在人肺非小细胞肺癌获得性耐药细胞中的作用[J]. 国际免疫学杂志, 2017, 40(03): 238-242. DOI:10.3760/cma.j.issn.1673-4394.2017.03.002 |
| [16] |
HAN S Y, ZHAO W, HAN H B, et al. Marsdenia tenacissima extract overcomes Ax1-and Met-mediated erlotinib and gefitinib cross-resistance in non-small cell lung cancer cells[J]. Oncotarget, 2017, 8(34): 56893. |
| [17] |
PAZ-ARES L, TAN E H, O'Byrne K, et al. Afatinib versus gefitinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: overall survival data from the phase IIb LUX-Lung 7 trial[J]. Ann Oncol, 2017, 28(2): 270-277. DOI:10.1093/annonc/mdw611 |
| [18] |
YANG J J, ZHOU Q, YAN H H, et al. A phase Ⅲ randomised controlled trial of erlotinib vs gefitinib in advanced non-small cell lung cancer with EGFR mutations[J]. Br J Cancer, 2017, 116(5): 568-574. DOI:10.1038/bjc.2016.456 |
| [19] |
XUETING C, JIE Y, CHUNPING H U, et al. Dihydroartemisinin enhances the sensitivity of gefitinib in non-small cell lung cancer cells by inhibiting STAT3[J]. Chin Sci Bull, 2017, 62(18): 2013-2019. DOI:10.1360/N972017-00204 |
| [20] |
SCHULER M, YANG J, PARK K, et al. Afatinib beyond progression in patients with non-small-cell lung cancer following chemotherapy, erlotinib/gefitinib and afatinib: phase Ⅲ randomized LUX-Lung 5 trial[J]. Ann Oncol, 2016, 27(3): 417-423. DOI:10.1093/annonc/mdv597 |
 2019, Vol. 45
2019, Vol. 45


