扩展功能
文章信息
- 杨智源, 闻乃妍, 林杨, 梁航, 王乾, 胡馨丹, 张灵, 任辉, 郭宝锋
- YANG Zhiyuan, WEN Naiyan, LIN Yang, LIANG Hang, WANG Qian, HU Xindan, ZHANG Ling, REN Hui, GUO Baofeng
- SF2523对人源脑胶质瘤干细胞TS576增殖的抑制作用及其机制
- Inhibitory effect of SF2523 on proliferation of human glioma stem cells TS576 and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1281-1287
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1281-1287
- 10.13481/j.1671-587x.20190615
-
文章历史
- 收稿日期: 2019-08-29
2. 长春医学高等专科学校, 吉林 长春 130031;
3. 吉林大学基础医学院病理生理学系, 吉林 长春 130021
2. Changchun Medical College, Changchun 130031, China;
3. Department of Pathophysiology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
多形性胶质母细胞瘤是最常见的恶性脑肿瘤,约占胶质瘤的51%[1]。由于高侵袭性和低生存率,多形性胶质母细胞瘤被认为是最致命的脑肿瘤[2]。SF2523是PI3K和BRD4的双重抑制剂,可以有效地抑制Myc的表达、活性和稳定性,从而起到抑制肿瘤细胞增殖的作用[3-4]。有文献[5]报道:在体内实验中SF2523小鼠几乎无不良反应,利用SF2523进行治疗的小鼠体质量基本无变化。与单独使用PI3K或BRD4的抑制剂比较,SF2523几乎无不良反应,使其更具有应用于临床来治疗肿瘤的潜力。近年来,SF2523在许多癌症的临床前期实验中发挥了非常好的抗肿瘤作用,但是关于SF2523在人脑胶质瘤中作用的研究较少。本研究从细胞活性、细胞增殖、细胞周期、细胞凋亡和蛋白表达等多方面探讨SF2523对TS576细胞增殖的抑制作用及其机制。
1 材料与方法 1.1 细胞、主要试剂和仪器人源脑胶质瘤干细胞TS576细胞由吉林大学基础医学院病理生理学系实验室保存。Neurobasal培养基(美国Thermo Fisher公司),表皮生长因子(epidermal growth factor, EGF)和碱性成纤维细胞生长因子(b-FGF)(美国Peperotech公司), 无血清细胞冻存液(美国Wako Chemicals公司),稳定型胰蛋白酶替代液(美国Gibco公司),CCK-8和SF2523抑制剂(中国MCE公司),细胞周期试剂盒(中国天津三箭生物技术有限公司), Annexin Ⅴ-FITC / PI凋亡检测试剂盒(中国万类生物技术有限公司), B淋巴细胞瘤2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)和β-actin抗体(美国Proteintech公司),cyclin D1抗体(中国ABclonal公司)。CO2恒温孵箱(日本Sanyo公司), 流式细胞仪(美国BD公司),核酸蛋白定量检测仪和高速离心机(德国Eppendorf公司), 蛋白电泳仪和蛋白转膜仪(美国Bio-Rad公司)。
1.2 细胞培养利用DMEM/F-12培养液对TS576细胞进行培养。在DMEM/F-12培养液中添加EGF和b-FGF使其终浓度分别达到20 μg·L-1和10 μg·L-1。将细胞放至于37℃、5% CO2的细胞孵箱中进行培养,隔日进行传代。
1.3 CCK-8法检测各组TS576细胞存活率将对数生长期的TS576细胞按照每孔1× 104个的密度接种于96孔板中。将细胞分为对照组和SF2523组(浓度分别为0.25、0.50、1.00和2.00 μmol·L-1),每组设置5个复孔。次日,在SF2523组每孔中加入10 μL不同浓度SF2523,使其终浓度分别为0.25、0.50、1.00和2.00 μmol·L-1。将培养板放入细胞孵箱中分别培养24、48和72 h。到达规定培养时间后,每孔加入10 μL CCK-8溶液,避光孵育1~4 h,观察培养液颜色变化并用酶标仪在450 nm波长处检测每孔的吸光度(A)值,计算细胞存活率。细胞存活率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)× 100%。
1.4 细胞生长计数法检测TS576细胞数将TS576细胞按照每孔1× 105个的细胞密度接种于6孔板中。次日,在细胞悬液中加入SF2523,使其终浓度为2 μmol·L-1, 每组设3个复孔,同时设置对照组。将培养板放入细胞孵箱中分别培养24、48、72和96 h。到达规定培养时间后,使用离心机收集细胞,采用Tryple将离心下来的细胞团消化为单细胞悬液,加入PBS终止消化并计数,根据细胞计数结果绘制细胞生长曲线。
1.5 应用流式细胞术检测不同细胞周期TS576细胞百分比取对数生长期TS576细胞,使细胞密度为1×106 mL-1,接种于6孔板,分为对照组、1 μmol·L-1SF2523组和2 μmol·L-1 SF2523组,每组设3个复孔。将细胞培养72 h后收集细胞,采用预冷的70%乙醇固定细胞,4℃过夜。次日收集细胞,采用预冷的PBS洗涤细胞2次,0.5 mL PI/RNase染液重悬细胞,轻轻混匀并室温避光孵育0.5 h。采用流式细胞术检测不同细胞周期TS576细胞百分比。
1.6 Annexin Ⅴ/PI染色法检测TS576细胞凋亡率取对数生长期TS576细胞,按照每孔1×105个细胞的密度接种于6孔板,分为对照组、1 μmol·L-1 SF2523组和2 μmol·L-1 SF2523组,每组设3个复孔。将细胞作用72 h后,收集细胞,利用不含EDTA的胰酶将细胞消化为单细胞悬液,采用PBS漂洗细胞2次,离心(1 050 r·min-1,5 min)收集细胞,加入500 μLBinding Buffer将细胞团重悬,加入5 μL Annexin Ⅴ-FITC混匀后,加入10 μLPI, 混匀,室温避光孵育5~15 min,1 h内采用流式细胞仪检测细胞凋亡率。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.7 Western blotting法检测TS576细胞中Bax、Bcl-2和cyclinD1蛋白表达水平取对数生长期的TS576细胞,对TS576细胞进行计数并按照1×105个细胞的密度接种于6孔板中,每孔加入3 mL新鲜培养基,分为对照组、1 μmol·L-1 SF2523组和2 μmol·L-1 SF2523组,后2组加入SF2523, 作用72 h, 每组设置3个复孔。培养72 h后,收集细胞,用PBS洗涤细胞1次,加入150 μL细胞裂解液(含1.5 μLPMSF)。对细胞裂解液进行超声,于4℃、12 000 r·min-1离心15 min。收集上清液,检测裂解液的蛋白浓度然后进行蛋白制样。利用SDS-PAGE电泳分离蛋白样品,转膜,利用5%脱脂奶进行封闭。加入Bax、Bcl-2、cyclinD1和β-actin抗体4℃孵育过夜。次日,利用TBST洗膜3次,每次5 min后加入二抗,继续孵育1 h。最后利用ECL系统进行显色,利用IMAGE J软件对蛋白的表达水平进行量化分析。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.8 统计学分析采用Microsoft Excel和GraphPad Prism 6.0统计软件进行统计学分析。各组细胞存活率、细胞数、不同细胞周期TS576细胞百分比、细胞凋亡率以及细胞中Bax、Bcl-2和cyclinD1蛋白表达水平均以x±s表示,多组间样本均数比较采用因素方差分析,2组间比较采用t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组TS576细胞存活率作用24、48和72 h时,与对照组比较,0.25、0.50、1.00和2.00 μmol·L-1 SF2523组TS576细胞存活率明显降低(P < 0.01)。1和2 μmol·L-1SF2523作用于TS576细胞72 h时,细胞存活率降低最为明显,因此后续实验采用72 h这一时间点,且SF2523浓度选择1和2 μmol·L-1。见图 1。
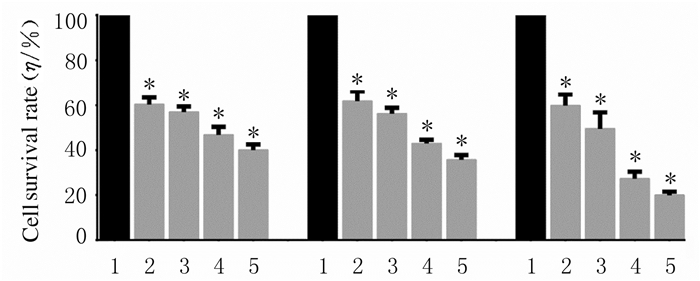
|
| *P < 0.01 vs control group; 1:Control group; 2-5:0.25, 0.50, 1.00, and 2.00 μmol·L-1 SF2534 groups. 图 1 SF2523作用不同时间后各组TS576细胞存活率 Fig. 1 Survival rates of TS576 cells after treated with SF2523 for different time in various groups |
|
|
作用24、48、72和96h时,与对照组比较,2 μmol·L-1 SF2523组TS576细胞数减少; 2 μmol·L-1 SF2523组作用48、72和96h时TS576细胞数明显低于对照组(P < 0.05或P < 0.01)。见图 2。
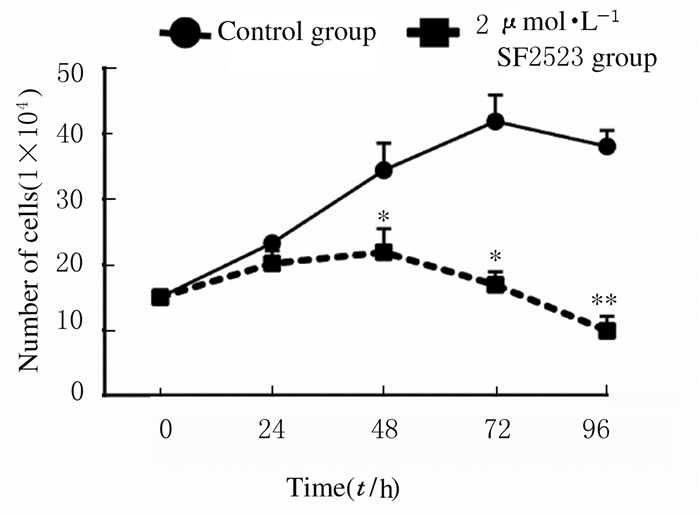
|
| *P < 0.05, **P < 0.01 vs control group. 图 2 SF2523作用不同时间后各组TS576细胞数 Fig. 2 Number of TS576 cells after treated with SF2523 for different timein various groups |
|
|
作用72 h时, 与对照组比较,1和2 μmol·L-1 SF2523组G1期TS576细胞百分比明显升高(P < 0.05),S期TS576细胞百分比明显降低(P < 0.05),G2期TS576细胞百分比差异无统计学意义(P>0.05)。见图 3和表 1。
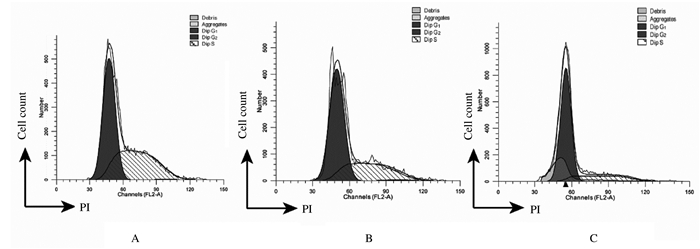
|
| A: Control group; B: 1 μmol·L-1 SF2523 group; C: 2 μmol·L-1 SF2523 group. 图 3 流式细胞术检测SF2523作用72 h后各组TS576细胞周期 Fig. 3 TS576 cellcycles after treated with SF2523 for 72 h in various groups detected by flow cytometry |
|
|
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Dose(μmol·L-1) | Percentage of TS576 cells | |||||||||||||||||||||||||||
| G1 | G2 | S | |||||||||||||||||||||||||||
| Control | 0 | 54.54±2.41 | 0±0 | 45.46±2.41 | |||||||||||||||||||||||||
| SF2523 | 1 | 64.03±1.93* | 1.37±0.72 | 34.60±1.26* | |||||||||||||||||||||||||
| 2 | 79.36±2.87* | 0±0.65 | 20.64±3.32* | ||||||||||||||||||||||||||
| * P < 0.05 vs control group. | |||||||||||||||||||||||||||||
作用72 h时,与对照组比较,1和2 μmol·L-1 SF2523组TS576细胞凋亡率明显升高(P < 0.01),并且TS576细胞凋亡率随着SF2523浓度的增加而升高。见图 4。
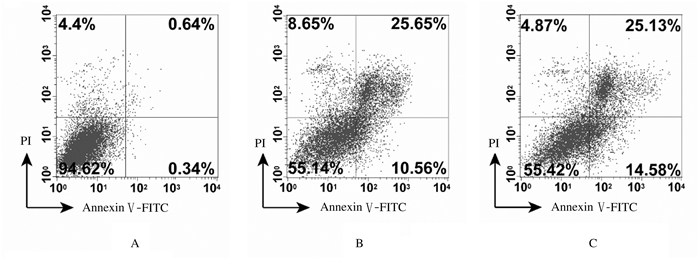
|
| A:Control group; B: 1 μmol·L-1SF2523 group; C: 2 μmol·L-1 SF2523 group. 图 4 流式细胞术检测SF2523作用72 h后各组TS576细胞凋亡率 Fig. 4 Apoptotic rates of TS576 cells after treated with SF2523 for 72 h in various groups detected by flow cytometry |
|
|
作用72 h时,与对照组比较,1和2 μmol·L-1 SF2523组TS576细胞中Bax蛋白表达水平明显升高(P < 0.05或P < 0.01),Bcl-2蛋白表达水平明显降低(P < 0.01),Bax/Bcl-2比值升高(P < 0.01),cyclinD1蛋白表达水平明显降低(P < 0.01)。见图 5和表 2。
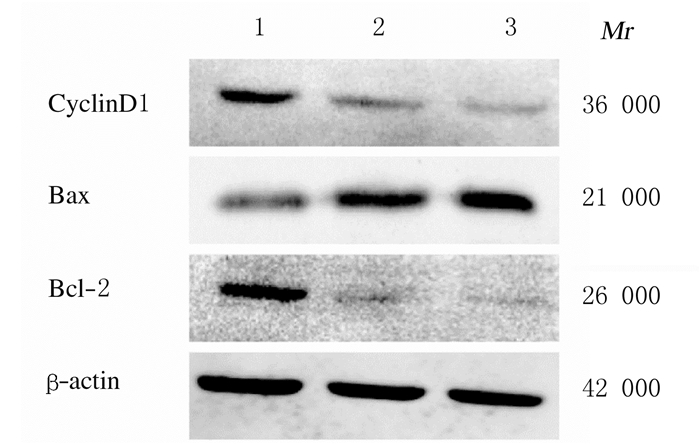
|
| Lane 1: Control group; Lane 2: 1 μmol·L-1 SF2523 group; Lane 3: 2 μmol·L-1 SF2523 group. 图 5 各组TS576细胞中cyclinD1、Bax和Bcl-2蛋白表达电泳图 Fig. 5 Electrophoregram of expressions of cyclinD1, Bax, and Bcl-2 proteins in TS576 cells in various groups |
|
|
| (n=3, x±s) | |||||||||||||||||||||||||||||
| Group | Dose(μmol·L-1) | CyclinD1 | Bax | Bcl-2 | Bax/Bcl-2 | ||||||||||||||||||||||||
| Control | 0 | 0.66±0.06 | 1.47±0.05 | 0.88±0.01 | 1.67±0.07 | ||||||||||||||||||||||||
| SF2523 | 1 | 0.53±0.03* | 2.80±0.15** | 0.44±0.04** | 6.40±0.39** | ||||||||||||||||||||||||
| 2 | 0.38±0.04** | 3.20±0.26** | 0.18±0.02** | 18.13±1.70** | |||||||||||||||||||||||||
| * P < 0.05,** P < 0.01 vs control group. | |||||||||||||||||||||||||||||
根据世界卫生组织分级,脑胶质瘤分为低级别脑胶质瘤和高级别脑胶质瘤,Ⅰ级和Ⅱ级脑胶质瘤属于低级别脑胶质瘤;Ⅲ级和Ⅳ级脑胶质瘤属于高级别脑胶质瘤。多形性胶质母细胞瘤为Ⅳ级脑胶质瘤,是最常见的原发性恶性脑肿瘤,具有高度异质性和致死率。低级别脑胶质瘤如果未得到及时有效的治疗会发展为高级别脑胶质瘤[6-7]。多形性胶质母细胞瘤患者的中位生存时间为14.6个月,其中只有3%患者的生存时间能够超过5年[2]。近些年来针对于多形性胶质母细胞瘤出现了许多治疗方法,包括手术切除肿瘤组织同时配合辅助放疗以及利用替莫唑胺进行药物治疗等,但是治疗效果均不理想,复发率较高,且对多形性胶质母细胞瘤患者的生存期并无明显的改善作用[8-9]。近年来的研究[10-11]表明:脑胶质瘤干细胞可能在脑胶质瘤的放化疗抵抗和耐药方面起到重要作用。
脑胶质瘤是一种高度异质性肿瘤,具有高细胞密度、肿瘤内坏死和血管增生等多种独特的组织学特性。脑胶质瘤的高度异质性也表现在微观层面上,其主要起源于脑胶质瘤干细胞[12-13]。脑胶质瘤干细胞具有自我更新能力、多向分化潜能和很强的致瘤能力。脑胶质瘤干细胞可以展现肿瘤的原始亚型和异质性,促进血管生成以及募集基质细胞以维持肿瘤的生长[1, 14]。脑胶质瘤干细胞可能是阻止药物发挥作用并使脑胶质瘤产生药物抵抗的元凶[12]。因此,脑胶质瘤干细胞是非常重要的治疗靶点。为了找到更有效的治疗脑胶质瘤的方法,本课题组需要进一步探索各种治疗策略对脑胶质瘤干细胞所发挥的作用。
近年来涌现出许多治疗脑胶质瘤的小分子靶向抑制剂, 例如JQ1、I-BET和SF2523等[15]。SF2523是一种有效的、具有高度选择性的BRD4和PI3K-AKT双重抑制剂,主要靶向PI3K-AKT-mTOR信号通路[16-17]。已有文献[3, 5, 18]报道:SF2523抑制剂在前列腺癌、视神经母细胞瘤和肾细胞癌等许多癌症中展现了很好的抗肿瘤作用,但是关于SF2523抑制剂在脑胶质瘤中尤其是多形性胶质母细胞瘤中作用的研究尚未见报道。因此,本实验针对SF2523对人源脑胶质瘤干细胞TS576发挥的作用及其机制进行探讨。
肿瘤细胞的异常增殖与细胞周期失调有密切关联[19]。本实验采用流式细胞术检测SF2523对TS576细胞周期产生影响的结果显示:与对照组比较,SF2523组G1期细胞百分比明显升高,S期细胞百分降低,产生了明显的G1期阻滞现象,说明SF2523可以促进TS576细胞的周期阻滞。此外,Western blotting法检测从蛋白层面上证明了SF2523诱导TS576细胞产生细胞周期阻滞的作用:与对照组比较,SF2523组细胞中cyclinD1蛋白表达水平明显降低,SF2523可能通过下调cyclinD1蛋白表达水平使TS576细胞周期产生阻滞。
细胞凋亡是一种重要的程序性细胞死亡途径,其对于维持组织内稳态、胚胎发育和免疫必不可少。细胞凋亡失调对于肿瘤的发生发展、神经退行性疾病和自身免疫性疾病具有重要作用。近年来,细胞凋亡因其生物学意义和治疗应用得到了广泛的研究[20]。Bcl-2家族中有18个家族成员,其中促凋亡效应蛋白Bax和抑制凋亡蛋白Bcl-2是2个重要的调控因子[21]。研究[22-23]表明:当Bax蛋白表达水平高于Bcl-2时,促进细胞中Bax-Bax同源二聚体的形成,促进细胞凋亡;反之,当Bcl-2蛋白表达水平高于Bax时,促进细胞中Bax-Bax同源二聚体解离,抑制细胞凋亡。因此,Bax/ Bcl-2比值在调节细胞凋亡中发挥着重要的作用。为了探讨SF2523对TS576细胞凋亡产生的影响,本研究采用流式细胞术Annexin Ⅴ/PI双染法检测1和2 μmol·L-1 SF2523作用72 h时TS576细胞凋亡率,结果显示:与对照组比较,SF2523组细胞凋亡率明显升高,证明SF2523能够有效地促进TS576细胞凋亡。此外,Western blotting法检测结果从蛋白层面上证明了SF2523对TS576细胞产生促凋亡的作用:与对照组比较,SF2523组细胞中Bax/Bcl-2比值明显升高,促凋亡因素占优势,使SF2523促进TS576细胞凋亡,从而抑制细胞增殖。
综上所述,SF2523能够有效地抑制TS576细胞增殖,并且具有一定的时间和药物剂量依赖性。SF2523可以诱导TS576细胞产生细胞周期阻滞和凋亡从而抑制TS576细胞增殖,其机制可能是SF2523通过下调cyclinD1表达和上调Bax/Bcl-2比值来实现诱导细胞周期阻滞和凋亡,从而起到抑制脑胶质瘤干细胞增殖的作用,但其相关信号通路和确切机制还需要进一步研究。
| [1] |
ZORZAN M, GIORDAN E, REDAELLI M, et al. Molecular targets in glioblastoma[J]. Future Oncol, 2015, 11(9): 1407-1420. DOI:10.2217/fon.15.22 |
| [2] |
PREUSSER M, DE RIBAUPIERRE S, WÖHRER A, et al. Current concepts and management of glioblastoma[J]. Ann Neurol, 2011, 70(1): 9-21. |
| [3] |
ANDREWS FH, SINGH AR, JOSHI S, et al. Dual-activity PI3K-BRD4 inhibitor for the orthogonal inhibition of MYC to block tumor growth and metastasis[J]. Proc Natl Acad Sci U S A, 2017, 114(7): E1072-E1080. DOI:10.1073/pnas.1613091114 |
| [4] |
ZHU J X, XIAO J R. SF2523 inhibits human chondrosarcoma cell growth in vitro and in vivo[J]. Biochem Biophys Res Commun, 2019, 511(3): 559-565. DOI:10.1016/j.bbrc.2019.02.080 |
| [5] |
SHEN G, JIANG M, PU J. Dual inhibition of BRD4 and PI3K by SF2523 suppresses human prostate cancer cell growth in vitro and in vivo[J]. Biochem Biophys Res Commun, 2018, 495(1): 567-573. DOI:10.1016/j.bbrc.2017.11.062 |
| [6] |
LOUIS D N, OHGAKI H, WIESTLER O D, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109. DOI:10.1007/s00401-007-0243-4 |
| [7] |
ALCANTARA LLAGUNO S R, PARADA L F. Cell of origin of glioma: biological and clinical implications[J]. Br J Cancer, 2016, 115(12): 1445-1450. DOI:10.1038/bjc.2016.354 |
| [8] |
STUPP R, HEGI M E, MASON W P, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-466. DOI:10.1016/S1470-2045(09)70025-7 |
| [9] |
HOMBACH-KLONISCH S, MEHRPOUR M, SHOJAEI S, et al. Glioblastoma and chemoresistance to alkylating agents: Involvement of apoptosis, autophagy, and unfolded protein response[J]. Pharmacol Ther, 2018, 184: 13-41. DOI:10.1016/j.pharmthera.2017.10.017 |
| [10] |
OSUKA S, VAN MEIR E G. Overcoming therapeutic resistance in glioblastoma: the way forward[J]. J Clin Invest, 2017, 127(2): 415-426. DOI:10.1172/JCI89587 |
| [11] |
RYSKALIN L, GAGLIONE A, LIMANAQI F, et al. The autophagy status of cancer stem cells in gliobastoma multiforme: from cancer promotion to therapeutic strategies[J]. Int J Mol Sci, 2019, 20(15): E3824. DOI:10.3390/ijms20153824 |
| [12] |
BAYIN N S, MODREK A S, PLACANTONAKIS D G. Glioblastoma stem cells: Molecular characteristics and therapeutic implications[J]. World J Stem Cells, 2014, 6(2): 230-238. DOI:10.4252/wjsc.v6.i2.230 |
| [13] |
LUDWIG K, KORNBLUM H I. Molecular markers in glioma[J]. J Neurooncol, 2017, 134(3): 505-512. DOI:10.1007/s11060-017-2379-y |
| [14] |
SINGH S K, HAWKINS C, CLARKE I D, et al. Identification of human brain tumour initiating cells[J]. Nature, 2004, 432(7015): 396-401. DOI:10.1038/nature03128 |
| [15] |
LEAL A S, WILLIAMS C R, ROYCE D B, et al. Bromodomain inhibitors, JQ1 and I-BET 762, as potential therapies for pancreatic cancer[J]. Cancer Lett, 2017, 394: 76-87. DOI:10.1016/j.canlet.2017.02.021 |
| [16] |
JOSHI S, SINGH A R, LIU K X, et al. SF2523: Dual PI3K/BRD4 inhibitor blocks tumor immunosuppression and promotes adaptive immune responses in cancer[J]. Mol Cancer Ther, 2019, 18(6): 1036-1044. DOI:10.1158/1535-7163.MCT-18-1206 |
| [17] |
SU J, LIU XG, ZHANG SL, et al. A theoretical insight into selectivity of inhibitors toward two domains of bromodomain-containing protein 4 using molecular dynamics simulations[J]. Chem Biol Drug Des, 2018, 91(3): 828-840. DOI:10.1111/cbdd.13148 |
| [18] |
ZHU H, MAO J H, WANG Y, et al. Dual inhibition of BRD4 and PI3K-AKT by SF2523 suppresses human renal cell carcinoma cell growth[J]. Oncotarget, 2017, 8(58): 98471-98481. |
| [19] |
URREGO D, TOMCZAK A P, ZAHED F, et al. Potassium channels in cell cycle and cell proliferation[J]. Philos Trans R Soc Lond B Biol Sci, 2014, 369(1638): 20130094. DOI:10.1098/rstb.2013.0094 |
| [20] |
KACZANOWSKI S. Apoptosis: its origin, history, maintenance and the medical implications for cancer and aging[J]. Phys Biol, 2016, 13(3): 031001. DOI:10.1088/1478-3975/13/3/031001 |
| [21] |
PENA-BLANCO A, GARCIA-SAEZ A J. Bax, Bak and beyond-mitochondrial performance in apoptosis[J]. FEBS J, 2018, 285(3): 416-431. DOI:10.1111/febs.14186 |
| [22] |
陈雪, 张玉影, 邵玉, 等. 五味子甲素对脑胶质瘤C6细胞生长的抑制作用及其机制[J]. 吉林大学学报:医学版, 2016, 42(4): 711-715. |
| [23] |
王莹, 宋凡. 富亮氨酸胶质瘤失活1蛋白抗体相关自身免疫性脑炎6例临床分析[J]. 中国实用内科杂志, 2018, 38(8): 749-752. |
 2019, Vol. 45
2019, Vol. 45


