扩展功能
文章信息
- 袁语泽, 马明星, 王国强, 关雪娃, 王紫嫣, 郭英俏, 郑敬彤, 章宏, 陈光, 王放
- YUAN Yuze, MA Mingxing, WANG Guoqiang, GUAN Xuewa, WANG Ziyan, GUO Yingqiao, ZHENG Jingtong, ZHANG Hong, CHEN Guang, WANG Fang
- 血栓性疾病个体化用药指导基因芯片试剂盒的制备和效果评价
- Preparation of gene chip detection kit for individualized treatment of thrombotic diseases and evaluation on its effectiveness
- 吉林大学学报(医学版), 2019, 45(06): 1267-1274
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1267-1274
- 10.13481/j.1671-587x.20190613
-
文章历史
- 收稿日期: 2019-02-18
2. 吉林寰基生物科技有限公司, 吉林 长春 130012;
3. 吉林大学基础医学院遗传学教研室, 吉林 长春 130021;
4. 吉林大学基础医学院生理学教研室, 吉林 长春 130021;
5. 吉林大学第一医院血管外科, 吉林 长春 130021
2. Jilin Huanji Biotechnology Co. Ltd., Changchun 130012, China;
3. Department of Genetics, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
4. Department of Physiology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
5. Department of Vascular Surgery, First Hospital, Jilin University, Changchun 130021, China
血栓性疾病(thrombotic diseases,TD)是一类由于血液中异常物质沉积在血管壁导致血管狭窄或闭塞而引发的疾病,已成为严重危害人类身体健康的一种循环系统疾病[1]。全球每年约有1 500万人死于TD,TD已成为全球总死亡率第一的疾病[2-3]。目前临床常用的抗血栓药物为华法林和氯吡格雷,除临床环境因素外,其代谢和作用通路上的基因遗传变异也在很大程度上影响抗栓药物的疗效[4-5]。氯吡格雷属于二磷酸腺苷(adenosine diphosphate, ADP)受体拮抗剂,通过阻止ADP与血小板受体的结合,从而抑制血小板聚集[6]。2010年美国FDA修改的氯吡格雷说明书中警示CYP2C19基因型检测结果应该作为临床调整治疗方案的参考[7-8]。CYP3A4酶是人体内重要的药物代谢酶之一,其相关的单核苷酸多态性有助于预测中国TD患者对氯吡格雷的耐药情况[9]。近年来分子生物学领域的研究人员明确了华法林用药剂量和抗凝效果均与肝脏细胞色素P450(CYP450)酶(CYP2C9 [10]和CYP4F2[11])、维生素K环氧化物还原酶复合体1(VKORC1)[12]、γ谷氨酰羧化酶(GGCX)[13]等基因多态性有关联。临床上常用血栓弹力图、PCR-焦磷酸测序法和血小板聚集检测等常规方法直接或间接地评价氯吡格雷及华法林的药物有效性,但存在检测费用高、操作复杂、灵敏度低和不能同时检测多种药物的作用效果等缺点。基因芯片技术可以将大量靶核苷酸探针有序、高密度地排列在芯片基片上,一次试验即可同时对多个样本、多种药物和多种基因进行准确高效的检测,具有简便快捷、敏感性高、特异性强和高通量等优点[14]。目前基因芯片应用于治疗TD个体化用药指导较少,而已报道的基因芯片研究多针对单药物代谢基因或单基因多态性为检测靶点。本研究依据大数据筛选了多种血栓药物代谢基因序列,研制了一种高通量检测氯吡格雷和华法林药物代谢基因的TD个体化用药指导基因芯片试剂盒,该技术通过对患者基因分型进行检测,可有效判定患者的药物代谢速率类型,操作简便,同时对于患者而言,节省了许多检测费用,具有重要的现实意义。
1 材料与方法 1.1 主要试剂和仪器微量核酸提取试剂盒和基因芯片点样缓冲液(昆明寰基生物芯片产业有限公司),10% SDS和3×SSC(美国Solarbio公司),PCR Mix(日本TaKaRa公司)。台式离心机(德国Eppendorf公司),酶标仪(美国BioTek公司),PCR扩增仪(德国Biometra公司),非接触式生物芯片点样仪(英国Arrayjet公司),生物芯片激光扫描仪(美国Axon公司)。
1.2 引物和探针的设计及合成根据国家卫计委公布的《药物代谢酶和药物作用靶点基因检测技术指南(试行)》及数据库信息,选定了如下与抗栓药物个体化用药相关的基因和检测位点:氯吡格雷药物代谢基因(CYP3A4、CYP2C19*17、CYP2C19*2和CYP2C19*3),华法林药物代谢基因(CYP4F2*3、GGCX、VKORC1-2、VKORC1-1、CYP2C9*2和CYP2C9*3)。
引物和探针的设计及筛选:利用GenBank数据库中发表的基因序列,根据直接杂交检测单核苷酸多态性的方法,通过Array Designer软件设计检测探针和引物,由上海生工生物工程有限公司进行合成。探针序列见表 1。探针合成后采用ArrayJet公司点样仪制备芯片。引物序列见表 2。下游引物由Cy3荧光基团修饰,以使特异扩增产物在芯片上杂交后产生荧光信号。以人类基因组为模板利用合成的引物进行PCR扩增,扩增产物进行琼脂糖凝胶电泳检测,找到能够高效扩增待测片段的引物组合。
| Subtype | RS number | Probe sequence(5′-3′) |
| CYP3A4-W-18-probe | rs4646437-C-pro | TTTTTTTTTTTTTTTCTGCTGTAGCGGTGCTCC |
| CYP3A4-M-18-probe | rs4646437-T-pro | TTTTTTTTTTTTTTTCTGCTGTAGTGGTGCTCC |
| CYP2C19*17-A-23-probe | rs12248560-A-pro | TTTTTTTTTTTTTTTGTTCTCAAAGAATCTCTGATGT |
| CYP2C19*17-T-23-probe | rs12248560-T-pro | TTTTTTTTTTTTTTTGTTCTCAAAGTATCTCTGATGT |
| CYP2C19*17-C-23-probe | rs12248560-C-pro | TTTTTTTTTTTTTTTGTTCTCAAAGCATCTCTGATGT |
| CYP2C19*2W-23-probe | rs4244285-G-pro | TTTTTTTTTTTTTTTGATTATTTCCCGGGAACCCATAA |
| CYP2C19*2M-23-probe | rs4244285-A-pro | TTTTTTTTTTTTTTTGATTATTTCCCAGGAACCCATAA |
| CYP2C19*3W-21-probe | rs4986893-G-pro | TTTTTTTTTTTTTTTACCTAGATCCAGGGGGTGCTT |
| CYP2C19*3M-21-probe | rs4986893-A-pro | TTTTTTTTTTTTTTTACCTAGATTCAGGGGGTGCTT |
| CYP4F2*3-W-19-probe | rs2108622-C-pro | TTTTTTTTTTTTTTTGCCACACAGCTGGGTTGTG |
| CYP4F2*3-M-19-probe | rs2108622-T-pro | TTTTTTTTTTTTTTTGCCACATAGCTGGGTTGTG |
| GGCX-W-21-probe | rs12714145-C-pro | TTTTTTTTTTTTTTTCCCCCTGCTCTGTTTCTCTGA |
| GGCX-M-21-probe | rs12714145-T-pro | TTTTTTTTTTTTTTTCCCCCTGCTTTGTTTCTCTGA |
| VKORC1-2-W-20-probe | rs9934438-G-pro | TTTTTTTTTTTTTTTATCATCGACCCTTGGACTAG |
| VKORC1-2-M-23-probe | rs9934438-A-pro | TTTTTTTTTTTTTTTGATCATCGACTCTTGGACTAGGA |
| VKORC1-1-W-17-probe | rs9923231-G-pro | TTTTTTTTTTTTTTTCATTGGCCGGGTGCGGT |
| VKORC1-1-M-17-probe | rs9923231-A-pro | TTTTTTTTTTTTTTTCATTGGCCAGGTGCGGT |
| CYP2C9*2-W-19-probe | rs1799853-C-pro | TTTTTTTTTTTTTTTATTGAGGACCGTGTTCAAG |
| CYP2C9*2-M-19-probe | rs1799853-T-pro | TTTTTTTTTTTTTTTATTGAGGACTGTGTTCAAG |
| CYP2C9*3-W-22-probe | rs1057910-A-pro | TTTTTTTTTTTTTTTAGAAGGTCAATGTATCTCTGG |
| CYP2C9*3-M-20-probe | rs1057910-C-pro | TTTTTTTTTTTTTTTGAAGGTCAAGGTATCTCTGG |
| Primer name | RS number | Fluorescence | Primer sequence (5′-3′) |
| CYP3A4-FP-1 | rs4646437-PriF | - | TCTATTTGCCCTTTTGGTTTC |
| CYP3A4-RP-1-CY3 | rs4646437-PriR-CY3 | CY3 | TCTATGACTTTTGCCCCTCTT |
| CYP2C19*17-FP-1 | rs12248560-PriF | - | GGGGCTGTTTTCCTTAGATA |
| CYP2C19*17-RP-1-CY3 | rs12248560-PriR-CY3 | CY3 | TGGCAGAACTGGGATTTG |
| CYP2C19*2-FP | rs4244285-PriF | - | CAACCAGAGCTTGGCATATTG |
| CYP2C19*2-RP | rs4244285-PriR-CY3 | CY3 | AGGGTTGTTGATGTCCATCG |
| CYP2C19*3-FP | rs4986893-PriF-CY3 | CY3 | TGTGATCCCACTTTCATCCTG |
| CYP2C19*3-RP | rs4986893-PriR | - | AATGTACTTCAGGGCTTGGTC |
| CYP4F2*3-AFP-1,2 | rs2108622-PriF | - | GTGACCTCTCCTTGATGTTCTC |
| CYP4F2*3-ARP-1-CY3 | rs2108622-PriR-CY3 | CY3 | TTCTCCTGACTGCTCCCTTC |
| GGCX-FP-2-CY3 | rs12714145-PriF-CY3 | CY3 | GAGGCAGCAGTGACCCATT |
| GGCX-RP-2 | rs12714145-PriR | - | CACATCTGTAAACCATTCCAAG |
| VKORC1-2-PFP-1,23 | rs9934438-PriF | - | GGGAGGATAGGGTCAGTG |
| VKORC1-2-PRP-2-CY3 | rs9934438-PriR-CY3 | CY3 | GGTGGAACCAGGTTAGGA |
| VKORC1-1-PFP-2 | rs9923231-PriF | - | TCACAGACGCCAGAGGA |
| VKORC1-1-PRP-2-CY3 | rs9923231-PriR-CY3 | CY3 | CAGGGTTCAAGTGGTTCTC |
| CYP2C9*2-AFP-3 | rs1799853-PriF | - | CCCTCCTAGTTTCGTTTCTCTTC |
| CYP2C9*2-ARP-3-CY3 | rs1799853-PriR-CY3 | CY3 | GTAGTCCAGTAAGGTCAGTGATATG |
| CYP2C9*3-AFP-1, 2-CY3 | rs1057910-PriF-CY3 | CY3 | AAGTCCAGGAAGAGATTGAACG |
| CYP2C9*3-ARP-2 | rs1057910-PriR | - | AAACAAACTTACCTTGGGAATGAG |
| “-”:No data. | |||
实验所用的生物芯片基片是在赖氨酸包被后连接醛基基团的基片,通过静电吸附和化学偶联的联合作用,提高了基片的稳定性。玻片依次采用等离子清洗机和质量浓度为98%浓硫酸清洗进行预处理,采用蒸馏水冲洗浸泡后包被多聚赖氨酸,蒸馏水冲洗浸泡,烘干后冷却至室温。将多聚赖氨酸包被的玻片浸泡在12.5%戊二醛中,摇床上60 r·min-1室温轻摇4 h,烘干后冷却至室温,得到生物芯片后采用活性醛基修饰生物芯片基片。
1.3.2 基因芯片设计方案根据设计的基因芯片探针建立了12×9微阵列(图 1),包括5个部分:BC为空白对照点,用于调整矩阵结构; NC为阴性对照点,用于监控非特异性杂交;IC为内对照点,用于监控PCR模板和PCR过程的有效性;HC为杂交对照点,用于监控杂交过程的有效性;其他位点为检测探针。CYP3A4、CYP2C19*17、CYP2C19*2和CYP2C19*3为氯吡格雷药物代谢基因的检测探针,CYP4F2*3、GGCX、VKORC1-2、VKORC1-1、CYP2C9*2和CYP2C9*3为华法林药物代谢基因的检测探针,每条探针有3个重复位点。
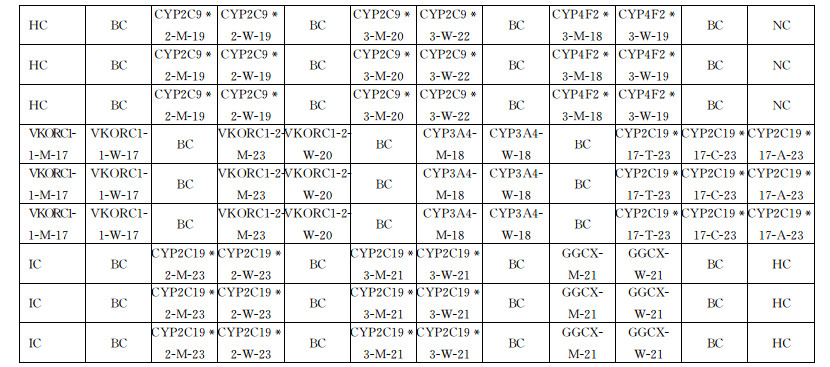
|
| BC: Blank control; NC: Negative reference; IC: Positive control reference; HC: Hybrid control. 图 1 基因芯片探针布局 Fig. 1 Probes layout of gene chip |
|
|
将所合成的探针定量加于384微孔板中,将微孔板安装于点样仪的样品托架上,在玻片托盘中装载适量活性醛基修饰的生物芯片基片,运行点样仪程序进行芯片点样。芯片点样后,将芯片从点样仪中取出,放入紫外交联仪中进行紫外交联,交联过程中DNA探针可以与多聚赖氨酸基片形成共价结合,使探针稳定地固定于基片上。
1.4 基因芯片试剂盒的检测方法 1.4.1 DNA提取采集口腔脱落细胞放入无菌采样管中; 加入1 mL无菌生理盐水,充分震荡混匀; 12 000 r·min-1离心5 min,弃上清; 采用微量核酸提取试剂盒(离心柱法)提取沉淀中的基因组DNA; 使用酶标仪对提取DNA的浓度和A(260)/A(280)值进行测定。
1.4.2 PCR扩增按下表配制PCR扩增反应体系(25 μL),反应条件:95℃、10 min; 94℃、30 s, 57℃、60 s, 72℃、60 s,30个循环; 94℃、30 s, 72℃、60 s,5个循环; 72℃、5 min; 4℃、∞。产物置于-20℃避光保存备用。
| Reaction system | Volume (V/μL) | Cycle parameter |
| Clinical sample | 5.0 | 95℃,10 min, ×1 cycle |
| PCR reagent mixture | 12.5 | 94℃,30 s→57℃, 60 s→72℃, 60 s, ×30 cycles |
| PCR primer mixture | 7.5 | 94℃ 30 s→72℃ 60 s, ×5 cycles |
| Total volume | 25.0 | 72℃,5 min, ×1 cycle→4℃, ∞ |
杂交:扩增良好的PCR产物置于PCR仪中95℃变性5 min后立即冰浴3 min。取75 μL经42℃预热的杂交缓冲液与25 μL经上述处理的PCR产物加至无菌离心管中充分混匀,将混合液小心地用移液器加至芯片点样区。随后将芯片放入杂交箱中置于42℃避光杂交60 min。
洗脱:避光37℃条件下,将杂交反应完毕的基因芯片浸泡在提前预热的洗脱液中进行洗涤。
扫描和结果判读:将干燥后的芯片置于生物芯片激光扫描仪中,使用532 nm波长激光扫描,获得扫描图谱和数据。对于任意探针位点,其荧光值中值≥1.5倍荧光背景中值,判定该位点为阳性,否则该位点判定为阴性。
1.5 基因芯片试剂盒的效果评价 1.5.1 灵敏性试验为了确定本研究所建立方法的灵敏性, PCR扩增产物采取10倍梯度法进行稀释,再按照1.4操作进行基因芯片检测。
1.5.2 重复性试验基因芯片点样及反应条件相同的情况下,对不同批次的3张芯片以及同一批次的10张芯片进行平行测定。
1.5.3 稳定性试验将制备的基因芯片装入真空袋中抽真空,置于室温避光保存,每隔30 d取出芯片进行杂交扫描。
1.5.4 临床样本检测试验研究对象:2016年8月-2017年5月于寰基生物芯片产业有限公司的吉林、河南和云南3个省的医学检验所分别收集动静脉血栓受试者60例、50例及40例,共计150例,其中男性92例,女性58例,平均年龄(40.35±3.82)岁。纳入标准:①经临床超声等检查确诊为动静脉血栓受试者; ②对研究用药无禁忌证或过敏史; ③自愿签署知情同意书入组研究; ④均已接受氯吡格雷或华法林的临床用药指导。排除标准:①恶性肿瘤受试者; ②肝、肾功能严重受损的受试者; ③妊娠期或哺乳期妇女; ④精神病受试者;⑤治疗依从性低者。
为了验证该芯片对抗栓药物基因个体化用药相关位点检测的准确性,取150例受试者的口腔脱落细胞进行基因芯片试剂盒的测试,结果以150例受试者的用药剂量和用药6个月后疾病恢复情况为标准,对该基因芯片检测试剂盒的有效性进行判定。
2 结果 2.1 TD靶基因片段的获取根据生物信息学的方法,设计并合成氯吡格雷药物代谢基因(CYP3A4、CYP2C19*17、CYP2C19*2和CYP2C19*3)和华法林药物代谢基因(CYP4F2*3、GGCX、VKORC1-2、VKORC1-1、CYP2C9*2和CYP2C9*3)的相关引物和探针,基因芯片检测结果见图 2A(插页三)。a处显示CYP2C9*2,野生型纯合子; b处显示CYP2C9*3,野生型纯合子; c处显示CYP4F2*3,突变型杂合子; d处显示VKORC1-1,突变型纯合子; e处显示VKORC1-2,突变型纯合子; f处显示CYP3A4,野生型纯合子; g处显示CYP2C19*17,杂合子; h处显示CYP2C19*2,突变型杂合子; i处显示CYP2C19*3,野生型纯合子; j处显示GGCX,突变型杂合子。取阴性参考品作为模板,对试剂盒进行检测,测定结果见图 2B(插页三)。HC和IC对照点为阳性,NC对照点为阴性,所有基因型检测结果均为阴性。已成功制备血栓性个体化用药指导基因芯片试剂盒,基因芯片扫描结果出现了良好的杂交信号。
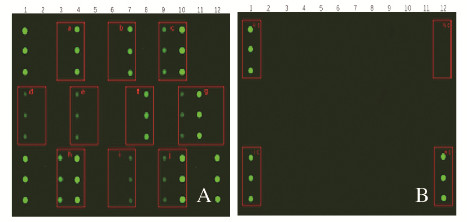
|
| 图 2 基因芯片检测结果示意图 Fig. 2 Schematic diagram of detection results of gene chips |
|
|
以10倍梯度稀释法稀释PCR扩增产物进行基因芯片检测,结果显示能形成杂交斑点的最低检测浓度为103 copies·mL-1。
2.3 基因芯片的重复性不同批次的3张芯片和同一批次的10张芯片的基因位置、杂交质控和有效性对照清晰可见,阴性质控均无信号,且芯片背景值较低,符合率为100%,以上结果均表明该芯片的重复性良好。
2.4 基因芯片的稳定性室温避光条件下保存6个月时,芯片稳定仍可正常进行基因芯片的检测。
2.5 临床样本的验证图 3中基因芯片扫描结果根据基因位点矩阵的排列划分为a、b、c、d、e、f、g、h、i和j共10个区域。分析氯吡格雷个体化用药情况时考虑其中的4个区域:与接受治疗后出现不良心血管事件有关的f区域CYP3A4、与药物代谢酶活性高低有关的CYP2C19基因的单核苷酸多态性位点g区域CYP2C19*17、h区域CYP2C19*2和i区域CYP2C19*3。分析华法林药物个体化用药情况时考虑剩余的6个区域:与被检测者血清中华法林浓度有关的c区域CYP4F2*3、与血液凝固障碍有关的j区域GGCX、与被检测者对华法林的抵抗力和敏感性有关的d区域VKORC1-2和e区域VKORC1-1、与药物代谢酶活性高低有关的CYP2C9基因的单核苷酸多态性位点a区域CYP2C9*2及b区域CYP2C9*3。结合以上基因位点的单核苷酸多态性及其作用,分析图 3中列出的4种典型的扫描结果例子。显示被检测者临床使用常规剂量的氯吡格雷效果不佳,服用华法林出血风险一般(图 3A,见插页四); 被检测者临床使用氯吡格雷效果较好,但需关注药物的不良感应,服用华法林出血风险一般(图 3B,见插页四); 被检测者临床使用常规剂量的氯吡格雷效果不佳,服用华法林出血风险较低(图 3C,见插页四); 被检测者临床使用氯吡格雷效果较好,但需关注药物的不良反应,服用华法林出血风险较低(图 3D,见插页四)。通过分析基因芯片的扫描结果判断150例受试者服用华法林或氯吡格雷个体化用药的剂量和不良反应,结合临床指导剂量及疾病恢复情况评价多中心检测基因芯片的有效性。150例受试者验证个体化用药基因芯片平均有效率为90.67%。见表 4。
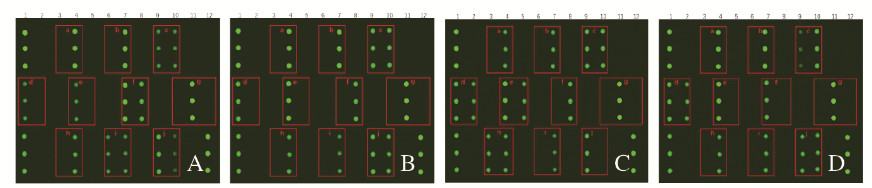
|
| A: CYP2C9*2; B: CYP2C9*3; C: CYP4F2*3; D: VKORC1-1. 图 3 临床样本验证试验中4种典型例子 Fig. 3 Four typical examples in clinical sample validation trials |
|
|
Sample source | Sample number | Positive number | Effective rate(η/%) |
| Jilin | 60 | 54 | 90.00 |
| Henan | 50 | 45 | 90.00 |
| Yunnan | 40 | 37 | 92.50 |
| Sum | 150 | 136 | 90.67 |
近年来,TD已成为严重危害人类健康、影响人们生活质量的重大疾病。对于此类疾病,临床医生所面临的重大难题是如何快速而准确地做出判断,并进一步做出适合患者症状的治疗决策[15]。药物疗效和不良反应的个体差异是目前TD药物治疗过程中的常见现象。由于药物代谢基因不同引起的个体差异,对氯吡格雷及华法林药物的反应有很大不同,药效差或出现严重的药物安全问题。氯吡格雷本身是“无活性前体”,需通过CYP450代谢后转化成为活性代谢产物从而产生血小板抑制效应。研究[16]表明CYP3A4和CYP2C19是氯吡格雷药物代谢涉及的主要酶,影响血小板的抑制程度。为了制订更加适合个体的氯吡格雷用药方案,研究和检测单核酸多态性尤为重要,这有利于预测患者疾病进程中对药物的反应。根据CYP2C19基因多态性不同将患者分为快、中和慢代谢型,中代谢型患者酶活性相对较弱,有氯吡格雷抵抗的风险[17-18],需增加用药剂量或联合用药,而慢代谢型患者则不建议使用氯吡格雷[7]。因此,基于CYP2C19 [19]等基因的检测是氯吡格雷个体化治疗的关键点。目前临床医生在使用华法林对患者进行治疗前需对患者进行CYP2C9和VKORC1基因检测,针对不同的基因类型调整药物剂量[20]。CYP2C9基因编码的蛋白,负责代谢80%~85%的左旋华法林(S-华法林),S-华法林被其代谢后更容易被排出体外[21]。VKORC1基因编码的蛋白是华法林作用的靶点,VKORC1蛋白负责激活维生素K,华法林通过影响VKORC1蛋白来抑制维生素K,从而干扰维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ的羧化,使这些凝血因子无法活化,从而达到抗凝血的目的[22]。然而由于基因突变等原因,不同人产生的VKORC1蛋白活性有差异,进而导致华法林的用药剂量因人而异。因此,基于CYP2C9和VKORC1等基因的检测是调整华法林用药的必要选择。从基因分子水平上探讨与基因代谢相关的药物的作用机制不仅为氯吡格雷和华法林用药的早期预测及干预提供了新思路,亦为TD患者的个体化用药提供了有力的科学依据。
随着科技进步,关于基因芯片检测方法的研究和应用越来越普遍和深入。基因芯片又称为DNA微阵列,是指在固相支持物上固化一定数量的按一定规则有序排列的作为探针的原位合成寡核苷酸,并生成二维DNA探针阵列[23]。将探针与扩增产物杂交,通过对杂交信号的检测分析,结合计算机软件进行数据比较和分析,达到对基因序列及功能进行大规模、高通量的检测。该技术不断发展和完善,在生命科学领域里发挥越来越重要的作用,有效地促进了临床检测和基因研究[24],其具有集成化、微型化和自动化的特点,可同时检测多种基因,操作简单,应用范围广泛。
本研究根据数据库上已经发表的抗栓药物代谢基因进行筛选,设计了针对氯吡格雷的4个多态性位点探针和针对华法林的6个多态性位点探针,合成荧光标记的引物,制备成检测氯吡格雷及华法林药物代谢基因的TD个体化用药指导基因芯片试剂盒。目前已知的2种药物的单核苷酸多态性位点有很多,且存在明显的种族和地域差异[25-27]。本研究收集来自中国东北、华中和西南3个地区的150例血栓受试者进行基因芯片的临床验证,验证有效率均在90%以上,证明了研制的基因芯片检测试剂盒具有较高的临床应用价值。
综上所述,由于每个人的遗传因素不同,同一种药物应用在不同个体的疗效和不良反应存在明显差异,因此临床上对TD患者进行药物治疗时,为了验证治疗的准确性和安全性,首先应检测相关的药物代谢酶和受体的基因型,然后选择合适的治疗药物。本研究制备的TD个体化用药指导基因芯片检测试剂盒取样简单,检测用时较短,操作方便,有助于抗栓药物个体化用药指导,但仍存在一定的不足之处,未来可进一步扩充基因芯片检测位点,以提升其检测不同血栓样本的准确性。后续研究中可进一步扩大临床样本的范围和数量,大规模多中心地对该基因芯片检测试剂盒的效果进行进一步评估。
| [1] |
刘丽, 季婷婷, 戴淑娟, 等. 血栓性疾病的药物治疗研究进展[J]. 齐齐哈尔医学院学报, 2018, 39(23): 2807-2808. DOI:10.3969/j.issn.1002-1256.2018.23.031 |
| [2] |
FURIE B, FLAUMENHAFT R. Thiol isomerases in thrombus formation[J]. Circ Res, 2014, 114(7): 1162-1173. DOI:10.1161/CIRCRESAHA.114.301808 |
| [3] |
刘莅欣, 胡桃红. 血栓性疾病抗栓治疗的研究进展[J]. 中国临床医生, 2013, 41(5): 15-17. DOI:10.3969/j.issn.1008-1089.2013.05.006 |
| [4] |
徐可.冠心病患者基因多态性、氯吡格雷反应性及临床预后的相关性研究[D].南京: 南京医科大学, 2018.
|
| [5] |
梅丹, 都丽萍, 刘昌伟. 基因多态性与华法林个体化用药[J]. 中华外科杂志, 2016, 54(2): 144-147. DOI:10.3760/cma.j.issn.0529-5815.2016.02.015 |
| [6] |
GRAHAM B R, MENON B K. Clopidogrel load reduces emboli in carotid artery stenosis with free-floating thrombus[J]. Can J Neurol Sci, 2017, 44(5): 594-596. DOI:10.1017/cjn.2017.48 |
| [7] |
张琳, 王丹. 氯吡格雷基因检测的临床应用分析[J]. 世界最新医学信息文摘, 2018, 18(76): 175. |
| [8] |
TAN S S N, FONG A Y Y, MEJIN M, et al. Association of CYP2C19*2 polymorphism with clopidogrel response and 1-year major adverse cardiovascular events in a multiethnic population with drug-eluting stents[J]. Pharmacogenomics, 2017, 18(13): 1225-1239. DOI:10.2217/pgs-2017-0078 |
| [9] |
LIU R, ZHOU Z Y, CHEN Y B, et al. Associations of CYP3A4, NR1I2, CYP2C19 and P2RY12 polymorphisms with clopidogrel resistance in Chinese patients with ischemic stroke[J]. Acta Phamaco Sin, 2016, 37(7): 882-888. DOI:10.1038/aps.2016.41 |
| [10] |
FLORA D R, RETTIE A E, BRUNDAGE R C, et al. CYP2C9 genotype-dependent warfarin pharmacokinetics: impact of CYP2C9 genotype on R- and S-warfarin and their oxidative metabolites[J]. J Clin Pharmacol, 2017, 57(3): 382-393. DOI:10.1002/jcph.813 |
| [11] |
SHENDRE A, BROWN T M, LIU N, et al. Race-specific influence of CYP4F2 on dose and risk of hemorrhage among warfarin users[J]. Pharmacotherapy, 2016, 36(3): 263-272. DOI:10.1002/phar.1717 |
| [12] |
GEMMATI D, BURINI F, TALARICO A, et al. The active metabolite of warfarin (3'-Hydroxywarfarin) and correlation with INR, warfarin and drug weekly dosage in patients under oral anticoagulant therapy: A pharmacogenetics study[J]. PLoS One, 2016, 11(9): e0162084. DOI:10.1371/journal.pone.0162084 |
| [13] |
KRISHNA KUMAR D, SHEWADE D G, LORIOT M A, et al. Effect of CYP2C9, VKORC1, CYP4F2 and GGCX genetic variants on warfarin maintenance dose and explicating a new pharmacogenetic algorithm in South Indian population[J]. Eur J Clin Pharmacol, 2014, 70(1): 47-56. DOI:10.1007/s00228-013-1581-x |
| [14] |
WANG J. From DNA biosensors to gene chips[J]. Nucleic Acids Res, 2000, 28(16): 3011-3016. DOI:10.1093/nar/28.16.3011 |
| [15] |
ORTEL T L, ERKAN D, KITCHENS C S. How I treat catastrophic thrombotic syndromes[J]. Blood, 2015, 126(11): 1285-1293. DOI:10.1182/blood-2014-09-551978 |
| [16] |
KAZUI M, NISHIYA Y, ISHIZUKA T, et al. Identification of the human cytochrome P450 enzymes involved in the two oxidative steps in the bioactivation of clopidogrel to its pharmacologically active metabolite[J]. Drug Metab Dispos, 2010, 38(1): 92-99. DOI:10.1124/dmd.109.029132 |
| [17] |
SAIZ-RODRIGUEZ M, ROMERO-PALACIAN D, VILLALOBOS-VILDA C, et al. Influence of CYP2C19 phenotype on the effect of clopidogrel in patients undergoing a percutaneous neurointervention procedure[J]. Clin Pharmacol Ther, 2019, 105(3): 661-671. DOI:10.1002/cpt.1067 |
| [18] |
ZHUO Z L, XIAN H P, LONG Y, et al. Association between CYP2C19 and ABCB1 polymorphisms and clopidogrel resistance in clopidogrel-treated Chinese patients[J]. Anatol J Cardiol, 2018, 19(2): 123-129. |
| [19] |
HOLMES M V, PEREL P, SHAH T, et al. CYP2C19 genotype, clopidogrel metabolism, platelet function, and cardiovascular events: a systematic review and meta-analysis[J]. JAMA, 2011, 306(24): 2704-2714. DOI:10.1001/jama.2011.1880 |
| [20] |
DEAN L. Warfarin therapy and the genotypes CYP2C9 and VKORC1[J]. Med Gene Summ, 2012, 2: 257-263. |
| [21] |
KULMYRZAEVA N, TATARUNAS V, SKIPSKIS V, et al. Gene polymorphism of CYP2C19*2, *3 and CYP3A4* 1B and early stent thrombosis: case reports and literature review[J]. Pers Med, 2016, 13(5): 423-428. DOI:10.2217/pme-2016-0041 |
| [22] |
GONZALEZ DELLA VALLE A, KHAKHARIA S, GLUECK C J, et al. VKORC1 variant genotypes influence warfarin response in patients undergoing total joint arthroplasty: a pilot study[J]. Clin Orthop Relat R, 2009, 467(7): 1773-1780. DOI:10.1007/s11999-008-0641-5 |
| [23] |
徐晓丽, 林娟, 鄢仁祥. 基因芯片与高通量测序技术的原理与应用的比较[J]. 中国生物化学与分子生物学报, 2018, 34(11): 1166-1174. |
| [24] |
SCHNEIDER A K, NIEMEYER C M. DNA Surface Technology: from gene sensors to integrated systems for life and materials sciences[J]. Angew Chem Int Ed Engl, 2018, 57(52): 16959-16967. DOI:10.1002/anie.201811713 |
| [25] |
周宏伟.Verigene基因芯片法检测与氯吡格雷代谢相关基因CYP2C19多态性[C].中华医学会(Chinese Medical Association), 中华医学会微生物学与免疫学分会.中华医学会第十二次全国临床微生物学术年会暨第十一次全球华人临床微生物学与感染症学术年会论文汇编.北京: 中华医学会(Chinese Medical Association), 中华医学会微生物学与免疫学分会, 2015: 1.
|
| [26] |
FEREIDOUNI M, MOOSSAVI M, KAZEMI T, et al. Association between polymorphisms of VKORC1 and CYP2C9 genes with warfarin maintenance dose in a group of warfarin users in Birjand city, Iran[J]. J Cell Biochem, 2019, 120(6): 9588-9593. DOI:10.1002/jcb.28235 |
| [27] |
石佳, 贾佳, 李国福. 危重症患者静脉血栓栓塞症风险评估及预防研究进展[J]. 中国实用内科杂志, 2019, 39(2): 185-188. |
 2019, Vol. 45
2019, Vol. 45


