扩展功能
文章信息
- 柴博文, 杨岳峰, 杨野仝, 周洋, 张叶茁, 刘华锋, 刘雅娟
- CHAI Bowen, YANG Yuefeng, YANG Yetong, ZHOU Yang, ZHANG Yezhuo, LIU Huafeng, LIU Yajuan
- 营养素复合物对酒精性肝病大鼠的保护作用及其机制
- Protective effect of nutrient complex on alcoholic liver disease rats and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1256-1260
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1256-1260
- 10.13481/j.1671-587x.20190611
-
文章历史
- 收稿日期: 2018-11-29
2. 吉林省疾病预防控制中心, 吉林 长春 130062;
3. 吉林省农业科学院, 吉林 长春 130033
2. Jilin Provincial Center for Disease Control and Prevention, Changchun 130062, China;
3. Jilin Provincial Academy of Agricultural Sciences, Changchun 130033, China
酒精性肝病(alcoholic liver disease,ALD)是一种临床常见的肝损伤形式,主要病因为长期、大量经胃肠道摄入乙醇,是一种肝脏损害的病变。随着我国经济快速发展和受“中国酒文化”的影响,ALD患病率不断升高,对人们的身体健康构成了严重威胁[1]。近年来,ALD不仅在中国,其在全球范围内均成为一个严重的公共卫生问题,危害公众健康,其患病率呈逐年升高趋势[2-4],ALD的发病进程为脂肪肝、肝炎至肝硬化,严重者发展为肝癌,在肝脏疾病发展之前尝试预防才是最佳的解决方法。研究[5-8]证实:营养素硒、苹果酸和B族维生素均具有较好的抗氧化功效。单一营养素的生理功能已明确,但目前尚无联合使用这些营养素对酒精性肝损伤保护作用的研究。本实验旨在探讨营养素复合物对酒精性肝损伤的保护作用,以期为研究新型辅助防治酒精性肝损伤的保健品提供理论依据。
1 材料与方法 1.1 实验动物、受试样品、主要试剂和仪器60只雄性Wistar大鼠,体质量160~190 g,购自辽宁长生生物技术有限公司,动物许可证号:SCXK(辽)2015-0001;动物饲养室温度为20℃~24℃,相对湿度为40%~70%;12 h照明/12 h黑暗交替的环境,保持安静通风,给予标准大鼠饲料,饮用水为自来水。受试样品营养素复合物由吉林大学卫生学院营养与食品卫生教研室自制。所含功效成分:硒、苹果酸和某些B族维生素。配制所用剂量依据《中国居民膳食营养素参考摄入量》(2013版)[9]。体积比为56%的牛栏山二锅头购自北京顺鑫农业股份有限公司,丙二醛(malonaldehyde,MDA)、还原型谷胱甘肽(reduced glutathione,GSH)和甘油三酯(triglyceride,TG)测定试剂盒购自南京建成生物工程研究所。分光光度计(722s型)、组织匀浆机、离心机、电子天平(型号ALC-110.4)和分析天平购自北京赛多利斯仪器系统有限公司,电热恒温水浴锅(批号1410146)购自北京意成东方科技有限公司。
1.2 动物分组和给药大鼠适应性喂养1周,60只雄性Wistar大鼠随机分为5组,每组12只,即空白对照组(蒸馏水+蒸馏水)、模型对照组(蒸馏水+30%酒精)、低剂量营养素复合物组(2.5 mL·kg-1·d-1复合物+30%酒精)、中剂量营养素复合物组(5.0 mL·kg-1·d-1复合物+30%酒精)和高剂量营养素复合物组(15.0 mL·kg-1·d-1复合物+30%酒精),分别相当于成人推荐摄入量的5、10和30倍。通过灌胃给予大鼠相应受试样品,每天灌胃2次,第1次灌胃各剂量复合物组大鼠给予配制好的复合物溶液,其余2组大鼠给予等量蒸馏水;第2次灌胃在间隔2 h后,复合物组和模型对照组大鼠给予30%白酒(15 mL·kg-1,采用蒸馏水稀释),空白对照组大鼠给予等量蒸馏水。动物每3d称质量1次,按体质量变化调整给药剂量,持续36 d。
1.3 各组大鼠体质量检测记录各组大鼠的初始体质量和终末体质量,计算体质量增长。体质量增长=终末体质量-初始体质量。
1.4 各组大鼠肝组织生化指标检测大鼠末次灌胃后禁食12 h后处死,取各组大鼠肝组织制备肝组织匀浆,取上清,按照试剂盒说明书要求检测肝组织匀浆中TG、GSH和MD水平。
1.5 各组大鼠肝组织病理形态表现观察另取相同部位肝组织,进行快速冰冻组织切片,苏丹Ⅲ染色后观察肝组织和肝细胞内脂滴数及肝组织中脂肪分布情况,在相应的视野范围内对切片进行观察,采用表 1评分标准对肝组织脂肪变性进行评分[10]。
| Scale | Score |
| Lipid droplets scattered in liver cells, rare or absent | 0 |
| Lipid-containing liver cells do not exceed 1/4 | 1 |
| Lipid-containing liver cells do not exceed 1/2 | 2 |
| Lipid-containing liver cells do not exceed 3/4 | 3 |
| Liver tissue is almost replaced by lipid droplets | 4 |
根据国家《保健食品检验与评价技术规范》2003年版[10]中保健食品功能学评价程序与检验方法规范以及对化学性肝损伤有辅助保护作用功能判定标准进行判定:①肝脏MDA、GSH和TG 3项检测指标结果阳性;②肝脏MDA、GSH和TG 3项指标中任2项指标检测结果呈阳性且病理组织学检查结果呈阳性。
1.7 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组大鼠体质量、肝组织匀浆中GSH、MDA和TG水平以x±s表示,计量资料组间比较采用单因素方差分析,组内两两比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠体质量灌胃前各组大鼠的初始体质量比较差异均无统计学意义(F=0.071,P=0.991);连续灌胃36 d后,空白对照组大鼠体质量略高于其他各组,但各组大鼠终末体质量和体质量增长比较差异均无统计学意义(F=1.402,P=0.247;F=1.689,P=0.168)。见表 2。
| (x±s, m/g) | |||||||||||||||||||||||||||||
| Group | Dose (mL·kg-1) |
n | Body weight | Weight increase | |||||||||||||||||||||||||
| Before experiment | After experiment | ||||||||||||||||||||||||||||
| Blank control | - | 12 | 195.53±6.09 | 256.41±22.43 | 60.88±23.11 | ||||||||||||||||||||||||
| Model control | - | 10 | 196.54±6.16 | 234.65±23.26 | 38.11±19.90 | ||||||||||||||||||||||||
| Nutrient complex | |||||||||||||||||||||||||||||
| Low dose | 2.5 | 9 | 196.72±2.27 | 248.28±23.67 | 51.56±23.92 | ||||||||||||||||||||||||
| Medium dose | 5.0 | 12 | 196.02±5.55 | 245.98±19.05 | 49.96±18.31 | ||||||||||||||||||||||||
| High dose | 15.0 | 11 | 196.39±7.47 | 246.91±19.88 | 50.52±17.01 | ||||||||||||||||||||||||
| “-”:No data. | |||||||||||||||||||||||||||||
模型对照组大鼠肝组织匀浆中GSH水平明显低于空白对照组(P < 0.05),中和高剂量营养素复合物组大鼠肝组织匀浆中GSH水平明显高于模型对照组(P < 0.05或P < 0.01),且呈明显量效关系。模型对照组大鼠肝组织匀浆中MDA水平明显高于空白对照组(P < 0.01);低、中和高剂量营养素复合物组大鼠肝组织匀浆中MDA水平均低于模型对照组(P < 0.01)。模型对照组大鼠肝组织匀浆中TG水平明显高于空白对照组(P < 0.01), 低、中和高剂量营养素复合物组大鼠肝组织匀浆中TG水平均低于模型对照组(P < 0.01)。见表 3。
| (x±s) | |||||||||||||||||||||||||||||
| Group | Dose (mL·kg-1) |
n | GSH [wB/(mg·g-1)] |
t | P | MDA [mB/(μmol·g-1)] |
t | P | TG [mB/(mol·g-1)] |
t | P | ||||||||||||||||||
| Blank control | - | 12 | 0.97±0.39 | 3.08±0.64 | 56.17±7.91 | ||||||||||||||||||||||||
| Model control | - | 10 | 0.68±0.16* | 3.944 | 0.012 | 5.73±0.88* | 58.552 | < 0.01 | 92.61±11.90* | 64.647 | < 0.01 | ||||||||||||||||||
| Nutrient complex | |||||||||||||||||||||||||||||
| Low dose | 2.5 | 9 | 0.73±0.11 | 0.629 | 0.668 | 2.82±0.38△△ | 82.447 | < 0.01 | 66.85±4.74△△ | 35.968 | < 0.01 | ||||||||||||||||||
| Medium dose | 5.0 | 12 | 0.91±0.12△ | 12.845 | 0.049 | 3.08±0.44△△ | 80.623 | < 0.01 | 68.99±9.19△△ | 25.101 | < 0.01 | ||||||||||||||||||
| High dose | 15.0 | 11 | 1.11±0.27△△ | 16.421 | < 0.01 | 3.63±0.89△△ | 26.183 | < 0.01 | 64.99±9.58△△ | 31.451 | < 0.01 | ||||||||||||||||||
| * P < 0.05 vs blank control group;△ P < 0.05,△△ P < 0.01 vs model control group.“-”:No data. | |||||||||||||||||||||||||||||
肉眼观察发现:空白对照组大鼠肝脏经解剖取出时为鲜红色,有光泽,表面光滑细腻;模型对照组大鼠肝脏呈暗红色,颜色暗淡,表面有众多颗粒聚集,淤血泛黄,体积增大;与模型对照组比较,各剂量营养素复合物组大鼠肝脏颜色较鲜红,具有良好的光泽。光镜下(苏丹Ⅲ染色)可见:①空白对照组大鼠肝组织中可见多个肝小叶,其形态结构正常,肝细胞内脂滴稀少或无,未见病理性改变(图 1A,见插页三);模型对照组大鼠肝组织和肝细胞内可见大量黄色脂滴,细胞核蓝色,发生脂肪肝的病理性改变(图 1B,见插页三),模型对照组大鼠肝组织脂肪变性病理评分与空白对照组比较差异有统计学意义(P < 0.05);低剂量营养素复合物组大鼠肝组织和肝细胞内脂滴数略有减少(图 1C,见插页三),大鼠肝组织脂肪变性病理评分与模型对照组比较差异无统计学意义(P>0.05);中和高剂量营养素复合物组大鼠肝组织和肝细胞内脂滴数明显减少(图 1D和E,见插页三),大鼠肝组织脂肪变性病理评分与模型对照组比较差异有统计学意义(P < 0.05)。见表 4。
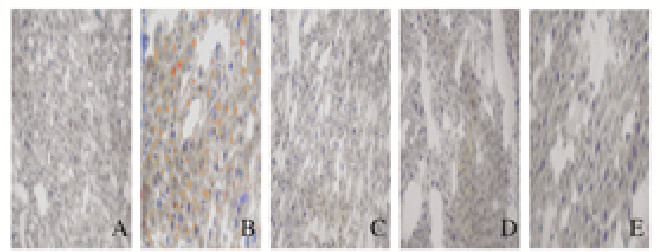
|
| A:Blank control group; B:Model control group; C:Low dose of nutrient complex group; D:Medium dose of mutrient complex group; E:High dose of nutrient complex group. 图 1 各组大鼠肝组织形态表现(苏丹Ⅲ, ×400) Fig. 1 Morphology of liver tissue of rats in various groups (Sudan Ⅲ, ×400) |
|
|
| Group | Dose (mL·kg-1) |
n | Pathological score | Total score | P | ||||
| 0 | 1 | 2 | 3 | 4 | |||||
| Blank control | - | 12 | 9 | 2 | 1 | - | - | 13 | |
| Model control | - | 10 | - | - | 4 | 1 | 5 | 31* | 0.001 |
| Nutrient complex | |||||||||
| Low dose | 2.5 | 9 | - | 1 | 2 | 2 | 4 | 27 | 0.421 |
| Medium dose | 5.0 | 12 | - | 5 | 5 | 0 | 2 | 23△ | 0.008 |
| High dose | 15.0 | 11 | - | 6 | 3 | - | 2 | 20△ | 0.006 |
| * P < 0.05 vs blank control group;△ P < 0.05 vs model control group; “-”:No data. | |||||||||
肝脏是酒精代谢的主要器官,长期、过量饮酒可以导致ALD,病程发展从酒精性脂肪肝、肝炎到肝硬化甚至肝癌。全球约0.9%病死者的死因是酒精性肝硬化,而肝硬化患者中,约48%患者患病原因是饮酒[11]。ALD发病机制复杂,长期、大量经胃肠道摄入乙醇需经肝脏氧化分解,导致肝脏内的乙醇和乙醛蓄积,使肝细胞发生脂肪变性、炎症和坏死[12-14]。ALD的发病机制涉及氧化应激、免疫损伤、内毒素介导的炎症反应、铁超负荷和细胞自噬等,其中氧化应激是其最重要机制之一[15-16]。进入机体的乙醇90%需在肝脏代谢,使机体氧化和抗氧化系统失衡,产生大量自由基,引起氧化应激。自由基与机体内不饱和脂肪酸反应生成MDA, MDA是脂质过氧化的终产物,对细胞有很强的毒性,MDA水平可间接反映机体受自由基损害程度。GSH可作为底物,在机体抗氧化酶的作用下清除活性氧自由基,具有较好的抗氧化作用,GSH水平可代表机体抗氧化能力[17];当机体产生氧化应激时,细胞中GSH水平降低[18-19]。此外,乙醇在转化为乙醛、乙醛转化为乙酸的过程中,消耗了大量的还原型辅酶Ⅰ,当机体内还原型辅酶Ⅰ水平降低时,脂肪的氧化受抑制,糖异生受阻,机体会出现脂肪堆积和低血糖等不良反应,并促进脂肪酸合成诱发组织中脂肪变性[20-21]。因此,TG水平可反映脂肪在肝细胞的沉积程度,也反映肝损伤的程度[22]。
本研究结果显示:服用营养素复合物的大鼠初始体质量和终末体质量比较差异均无统计学意义,说明使用一定剂量的营养素复合物不影响大鼠的生长发育。与空白对照组比较,模型对照组大鼠肝组织中MDA水平明显升高、GSH水平降低、TG水平升高,病理切片且呈现脂肪变性,提示大鼠饮用酒精诱发了肝脏损伤。中和高剂量营养素复合物组大鼠肝组织匀浆中GSH水平升高,MDA和TG水平降低,大鼠肝脏脂肪变性较轻,提示该营养素复合物能减少大鼠脂质过氧化的程度,增强肝脏中抗氧化因子活性,对酒精性肝损伤大鼠具有保护作用;其可能机制是该营养素复合物中含有微量营养素硒,硒本身具有清除自由基的功效,还可增加谷胱甘肽过氧化物酶的活性,清除自由基,减轻机体摄入过量乙醇所致的肝脏损伤;机体含有的苹果酸可作为载体携带乙醇代谢的中间产物进入线粒体呼吸链、进入三羧酸循环,氧化生成二氧化碳和水,促进乙醇的分解代谢,减少脂肪沉积程度[23-24]。B族维生素作为辅酶参与抗氧化作用并促进乙醇代谢,其中的维生素B2是黄素单核苷酸和黄素腺嘌呤二核苷酸辅酶,而黄素腺嘌呤二核苷酸作为谷胱甘肽还原酶的辅酶,可参与体内抗氧化防御系统,进一步维持GSH水平,增加抗氧化能力。B族维生素不仅能作为辅酶起到促进乙醇代谢的作用,还能作为机体需要的营养素对机体进行营养补充,减轻乙醇对机体的损害。因此,该营养素复合物可较好地起到辅助保护ALD的作用。
综上所述,本研究中营养素复合物能够降低ALD大鼠体内MDA和TG水平,提高还原性物质GSH水平和减轻肝脏脂肪变性,根据保健食品检验与评价技术规范,可以判断该营养素复合物对ALD大鼠具有辅助保护功能。
| [1] |
FAN J G. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J]. J Gastroen Hepatol, 2013, 28(Suppl 1): 11-17. |
| [2] |
SCHWARTZ J M, REINUS J F. Prevalence and natural history of alcoholic liver disease[J]. Clin Liver Dis, 2012, 16(4): 659. DOI:10.1016/j.cld.2012.08.001 |
| [3] |
赵锦. 酒精的代谢与危害[J]. 科技与生活, 2011(6): 195-195. |
| [4] |
张琦.中药复方对大鼠酒精性肝损伤的治疗作用[D].长春: 长春中医药大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10199-2007147000.htm
|
| [5] |
高林, 罗东升, 代梅, 等.富硒花生蛋白和硒化合物对小鼠亚急性酒精性肝损伤的体内干预[C].中国食品科学技术学会第十三届年会论文集.北京: 中国食品科学技术学会学术部, 2016. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGSP201611001104.htm
|
| [6] |
刘盼盼, 郑鹏程, 龚自明, 等. 不同品种青砖茶化学成分与抗氧化活性的比较分析[J]. 现代食品科技, 2018, 34(9): 83-93. |
| [7] |
李佳, 金文胜. 糖尿病长期酗酒致低镁血症误诊糖尿病神经病变1例报道[J]. 解放军医学院学报, 2018, 39(5): 454-457. DOI:10.3969/j.issn.2095-5227.2018.05.024 |
| [8] |
于珊珊, 王贤. 维生素B_1及维生素C对酒精引起的心功能损伤的预防及修复作用[J]. 聊城大学学报:自然科学版, 2006, 19(4): 49-52. |
| [9] |
中国营养学会. 中国居民膳食营养素参考摄入量(2013版)[M]. 北京: 科学出版社, 2013: 4.
|
| [10] |
中华人民共和国卫生部. 保健食品检验与评价技术规范[M]. 北京: 中华人民共和国卫生部印制, 2003.
|
| [11] |
吕卉, 盛吉芳. 酒精性肝病与肠道菌群失调研究进展[J]. 现代医药卫生, 2019, 35(2): 166-169. DOI:10.3969/j.issn.1009-5519.2019.02.003 |
| [12] |
程明亮, 杨长青. 肝纤维化的基础研究及临床[M]. 北京: 人民卫生出版社, 2002.
|
| [13] |
邱萍, 李相, 孔德松, 等. 酒精性肝病发病机制研究的新进展[J]. 中国药理学通报, 2014, 30(2): 160-163. DOI:10.3969/j.issn.1001-1978.2014.02.004 |
| [14] |
STEWART S F, DAY C P. The management of alcoholic liver disease[J]. J Hepatol, 2003, 38(1): 2-13. DOI:10.1016/S0168-8278(02)00395-1 |
| [15] |
PASTSENKE E, CHICCA A, PETRYUCCI V, et al. 4-O'-methylhonokiol protects from alcohol/carbon tetrachloride-induced liver injury in mice[J]. J Mol Med, 2017, 95(10): 1077-1089. DOI:10.1007/s00109-017-1556-y |
| [16] |
WU D, CEDERBAUM A I. Alcohol, oxidative stress and free radical damage[J]. P Nutr Soc, 2006, 65(3): 278-290. DOI:10.1079/PNS2006496 |
| [17] |
黄梅芳, 朱尤庆. 酒精性肝病发病机制的研究进展[J]. 医学新知杂志, 2003, 13(2): 104-105. DOI:10.3969/j.issn.1004-5511.2003.02.026 |
| [18] |
LAI Y, ZHOU C, HUANG P, et al. Polydatin alleviated alcoholic liver injury in zebrafish larvae through ameliorating lipid metabolism and oxidative stress[J]. J Pharmacol Sci, 2018, 138(1): 46-53. |
| [19] |
贠建蔚, 苌新明. 酒精性肝病研究进展[J]. 国际消化病杂志, 2012, 32(1): 44-47. DOI:10.3969/j.issn.1673-534X.2012.01.015 |
| [20] |
李海燕, 李夏, 金向群, 等. 黄芩苷对大鼠慢性酒精性肝损伤的影响[J]. 中国实验方剂学杂志, 2008, 14(6): 58-60. DOI:10.3969/j.issn.1005-9903.2008.06.021 |
| [21] |
杨美荣, 孟冬梅, 张国顺. Fibroscan在慢性乙型肝炎合并酒精性肝病肝纤维化诊断中的价值[J]. 山东医药, 2018(9): 47-49. DOI:10.3969/j.issn.1002-266X.2018.09.014 |
| [22] |
许文琦, 王生, 黄逸安, 等. 非酒精性脂肪肝与酒精性肝病大鼠肠道菌群比较研究[J]. 世界临床药物, 2018, 39(1): 35-42. |
| [23] |
秦科, 杨建平, 陈鲜鑫. L-苹果酸的生物合成及应用研究进展[J]. 兽医导刊, 2018(8): 55. |
| [24] |
CHIBATA I, TOSA T, TAKATA I. Continuous production of L-malic acid by immobilized cells[J]. Trends Biotechnol, 1983, 1(1): 9-11. DOI:10.1016/0167-7799(83)90019-7 |
| [25] |
李健, 郭晓林. 酒精性肝炎患者的肠道真菌生态失调和对真菌的全身免疫反应[J]. 临床肝胆病杂志, 2019, 35(9): 1974. |
| [26] |
杨君, 胡中杰, 朱跃科, 等. 糖皮质激素与己酮可可碱治疗重症酒精性肝病效果的Meta分析[J]. 临床肝胆病杂志, 2019, 35(7): 1546-1550. DOI:10.3969/j.issn.1001-5256.2019.07.025 |
 2019, Vol. 45
2019, Vol. 45


