扩展功能
文章信息
- 娄婷婷, 黄清霞, 李香艳, 赵大庆
- LOU Tingting, HUANG Qingxia, LI Xiangyan, ZHAO Daqing
- 人参提取物对棕榈酸诱导心肌细胞损伤的保护作用及其机制
- Protective effect of ginseng extract on cardiomyocyte injury induced by palmitic acidand its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1248-1255
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1248-1255
- 10.13481/j.1671-587x.20190610
-
文章历史
- 收稿日期: 2019-02-14
2. 长春中医药大学附属医院中医药研究中心, 吉林 长春 130021
2. Research Center of Traditional Chinese Medicine, Affiliated Hospital, Changchun University of Traditional Chinese Medicine, Changchun 130021, China
肥胖或高脂血症被认为是影响代谢综合征的主要因素[1]。在临床和动物实验[2]中都可见肥胖或高脂血症患者或实验动物心脏结构和功能发生改变,包括心肌肥厚、心肌纤维化和心肌细胞凋亡等。研究[3]表明:高血糖、高血脂和胰岛素抵抗不仅对心肌细胞有直接毒性,还可诱发代谢紊乱、神经内分泌系统激活和非酶促糖基化产物堆积等一系列级联反应。各机制间相互影响最终引起心肌受损和代谢疾病。人参(Ginseng Radix et Rhizoma)为五加科植物人参(Panax ginseng C. A. Mey.)的干燥根和根茎[4]。为我国名贵中药材,号称“百草之王”[5]。研究[6-7]证实:人参有明确的抗氧化应激作用,能直接抵抗高血糖和高血脂对心肌细胞的毒性。人参对动脉硬化指数有降低作用,不仅能降低血清中胆固醇和甘油三酯水平,还能升高高密度脂蛋白水平。人参对于高血脂、血栓和动脉硬化均可起到较好的治疗作用[8-9]。目前对人参提取物抗心肌细胞脂毒性损伤的研究少有报道,本研究选择棕榈酸(palmitic acid, PA)刺激大鼠心肌H9c2细胞诱导心肌细胞凋亡,模拟心肌损伤中的脂毒性损伤, 通过观察人参提取物对PA引起的细胞损伤的保护效果,阐明人参提取物对心肌细胞脂毒性的作用机制。
1 材料与方法 1.1 细胞、主要试剂和仪器大鼠心肌H9c2细胞购自中国科学院上海生命科学研究院细胞资源中心。PA(批号:MB7088)购于大连美仑生物技术有限公司,牛血清白蛋白(bovine serum albumin, BSA)(FFA-Free,批号:A23088)购于上海昂一生物科技有限公司,无水乙醇(批号:20180622)购于北京化工厂,细胞培养基(批号:1917320)购于美国Gibco公司,胎牛血清(批号:FB25015)购于美国CLARK Bioscience公司,油红O染液(批号:DO27)购于南京建成科技有限公司,FITC /PI双染试剂盒(批号:BB15121)购于上海贝博生物试剂公司,活性氧(reactive oxygen species, ROS)试剂盒(批号:S0033)和线粒体膜电位试剂盒(批号:C2006)购于上海碧云天生物试剂公司。二氧化碳培养箱(型号3111)购于美国Thermo公司,超净台(型号SW-CJ-2FD)购于苏州净化设备有限公司,低速离心机(型号LD5-2B)购于北京雷勃尔离心机有限公司,低温离心机(型号5804R)购于德国Eppendorf公司,倒置荧光显微镜(型号Ⅸ71)购于日本Olympus公司,流式细胞仪(型号FASCSAria Ⅱ)购于美国BD公司,电热恒温水浴锅(型号HWS12)购于上海一恒科学仪器有限公司。
1.2 细胞培养和实验药物的制备大鼠心肌H9c2细胞培养在含10%胎牛血清和100 U·mL-1双抗的高糖DMEM中,静置于37℃、5%CO2细胞培养箱中孵育24 h,细胞充分贴壁生长融合至80%时用含0.25% EDTA胰酶进行消化传代培养,取对数生长期的细胞进行本次实验。生晒参购于吉林省抚松市,经长春中医药大学姜大成教授鉴定为五加科人参。称取生晒参加10倍水浸泡60 min后煎煮3次,每次1.5 h,合并水煎液浓缩至适量,加乙醇使醇含量至75%,搅匀,静置过夜,滤过,滤液进行减压回流除去乙醇,冷冻干燥得到人参提取物粉末,使用前配制成所需浓度。取0.24 mL胎牛血清加入至23.75 mL DMEM培养液中,称取0.5 g BSA(FFA-Free)加入至含1%FBS的DMEM中,得到DMEM-BSA混合液。称取19.23 mgPA溶于0.5 mL无水乙醇中,得到75 mmol·L-1PA醇溶液。将PA醇溶液加入到DMEM-BSA混合液中,超声30 min后,55℃水浴15 min。室温冷却,过0.22 μm滤膜,即得到3 mmol·L-1PA储存液。使用前将PA储存液按所需采用DMEM培养液稀释使用。
1.3 油红O染色检测H9c2细胞脂代谢情况将对数期H9c2细胞胰酶消化后收集,计数,采用完全培养基重悬后,接种于96孔板。置于恒温恒湿培养箱培养24 h后,向每孔分别加入不同浓度(100、200和1 000 μmol·L-1)PA培养液,作为100、200和1 000 μmol·L-1 PA组。24 h后吸弃培养基,PBS洗涤2次。每孔加入油红O染液试剂一50 μL,染色40 min,蒸馏水洗涤2次。每孔加入油红O染液试剂二复染液50 μL,染色30 s。蒸馏水洗涤2次,加入50~100 μL蒸馏水封固,在倒置荧光显微镜20倍镜下观察,观察并拍照。随后每孔加入150 μL异丙醇进行油红O萃取,采用酶联免疫检测仪于510 nm波长处测定其吸光度(A)值。将对照组油红O定量设为100%,计算其余各组油红O染色定量,即脂滴水平,脂滴水平=(实验组平均A值/对照组平均A值)×100%。向每孔加入不同浓度(0.2、2.0和20.0 mg·L-1)人参提取物,作为0.2、2.0和20.0mg·L-1人参提取物组,按上述方法检测各组细胞的脂滴水平。
1.4 MTT法测定各组H9c2细胞存活率将对数期H9c2细胞胰酶消化后收集,计数,采用完全培养基重悬后,接种于96孔板。置于恒温恒湿培养箱培养24 h后,向每孔分别加入不同浓度(200、400、600和800 μmol·L-1)PA组PA培养液,作为200、400、600和800 μmol·L-1 PA组。24 h后每孔加入10 μL MTT,4 h后吸去培养基,每孔加入150 μL DMSO,震荡混匀30 s,使结晶完全溶解,采用酶联免疫检测仪于490 nm波长处测定其A值。对照组细胞存活率设为100%,计算其余各组细胞存活率,细胞存活率=(实验组平均A值/对照组平均A值)×100%。向每孔加入不同浓度(0.2、2.0和20.0 mg·L-1)人参提取物,作为0.2、2.0和20.0mg·L-1人参提取物组,按上述方法检测各组细胞存活率。
1.5 Annexin Ⅴ/PI双染法检测各组H9c2细胞凋亡率将对数期H9c2细胞胰酶消化后收集,计数,采用完全培养基重悬后,接种于6孔板。置于恒温恒湿培养箱培养24 h后,向每孔分别加入不同浓度(0.2, 2.0和20.0 mg·L-1)人参提取物,作为0.2、2.0和20.0 mg·L-1人参提取物组,培养48 h,去掉旧培养基,每孔加入200 μmol·L-1 PA培养液,24 h后收集细胞重悬于PBS液中洗涤2次。采用50 μL Annexin Ⅴ结合液悬浮细胞,在细胞悬浮液中加入3 μL Annexin Ⅴ-FITC染色液,轻轻混匀后室温避光孵育15 min,加入5 μL PI染色液后轻轻混匀室温避光孵育5 min。加入450 μL Annexin Ⅴ结合液,终止染色并立即采用流式细胞仪检测。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.6 各组H9c2细胞中ROS水平的测定将对数期H9c2细胞胰酶消化后收集,计数,采用完全培养基重悬后,接种于6孔板。置于恒温恒湿培养箱培养24 h后,向每孔分别加入不同浓度(0.2, 2.0和20.0 mg·L-1)人参提取物培养48 h,作为0.2、2.0和20.0 mg·L-1人参提取物组,去掉旧培养基,每孔加入200 μmol·L-1 PA培养液,24 h后收集细胞悬浮于稀释好的DCFH-DA中,37℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀,使探针和细胞充分接触。采用无血清培养液洗涤细胞3次,以充分除去未进入细胞中的DCFH-DA,再用500 μL无血清培养液重悬细胞,立即用流式细胞仪检测。将对照组H9c2细胞中ROS水平设定为100%,计算其余各组H9c2细胞中ROS水平,ROS水平=(实验组平均荧光强度/对照组平均荧光强度)×100%。
1.7 JC-1探针检测各组H9c2细胞中线粒体膜电位(MMP)将对数期H9c2细胞胰酶消化后收集,计数,采用完全培养基重悬后,接种于6孔板,置于恒温恒湿培养箱培养24 h后,向每孔分别加入不同浓度(0.2、2.0和20.0 mg·L-1)人参提取物培养48 h,作为0.2、2.0和20.0 mg·L-1人参提取物组,去掉旧培养基,每孔加入200 μmol·L-1 PA培养液,24 h后收集细胞重悬于500 μL细胞培养液中,加入500 μL JC-1染色工作液,颠倒数次混匀,置于细胞培养箱中37℃孵育20 min。600 g、4℃离心3~4 min,沉淀细胞,弃上清,采用JC-1染色缓冲液(1×)洗涤2次,再用500 μL JC-1染色缓冲液(1×)重悬细胞,立即用流式细胞仪检测。MMP以JC-1单体阳性细胞率(右下象限细胞百分比)表示。
1.8 统计学分析采用GraphPad Prism 5.0统计软件进行统计学分析。各组H9c2细胞中脂滴水平、H9c2细胞存活率、细胞凋亡率、ROS水平和MMP水平进行正态分布检验,正态分布数据以x±s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
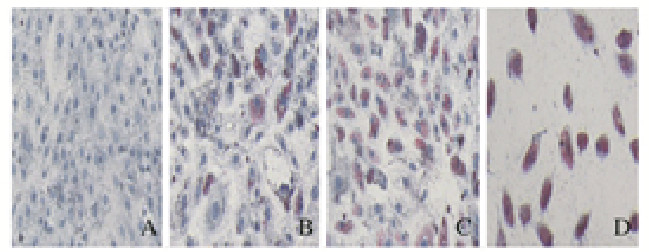
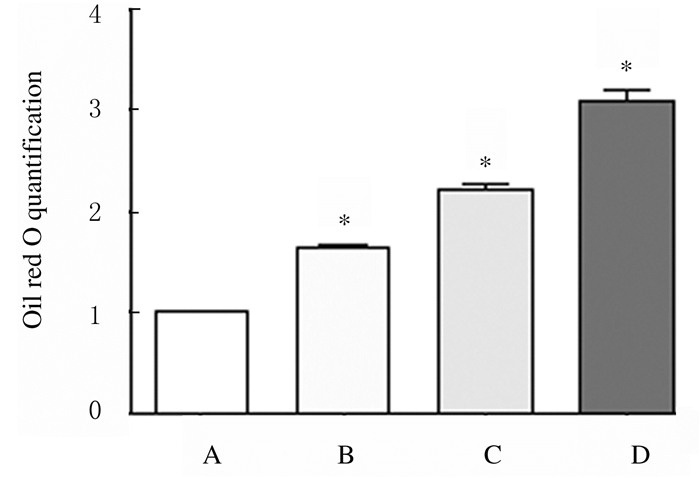
2 结果 2.1 各组H9c2细胞脂代谢情况加入PA 24 h后,100 μmol·L-1PA组H9c2细胞内有脂滴产生,200 μmol·L-1PA组H9c2细胞内有大量脂滴,且细胞明显胀大。油红O染色定量结果显示:与对照组比较,不同浓度PA组细胞中脂滴水平升高(P < 0.01)。见图 1(插页三)和2。
|
| A: Control group; B-D: 100, 200, and 1 000 μmol·L-1 PA groups. 图 1 各组H9c2细胞中脂滴形态表现(油红O,×20) Fig. 1 Morphology of lipid droplets in H9c2 cells in various groups(Oil red O, ×20) |
|
|
|
| A: Control group; B-D: 100, 200, and 1 000 μmol·L-1 PA groups. *P < 0.01 vs control group. 图 2 各组H9c2细胞中脂滴水平 Fig. 2 Levels of lipid drops in H9c2 cells in various groups |
|
|
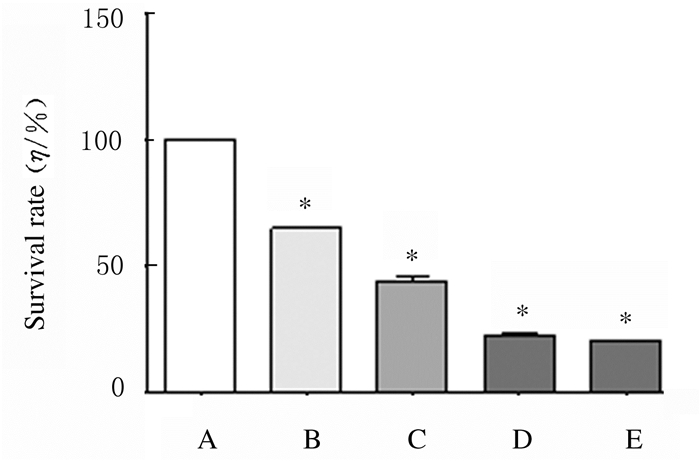
与对照组比较,加入PA 24 h后,200和400 μmol·L-1PA组均有部分H9c2细胞死亡,且存活细胞数递减。600和800 μmol·L-1PA组细胞死亡情况非常严重,更多的细胞变圆,细胞贴壁状态差,悬浮于培养基。MTT检测结果显示:与对照组比较,200、400、600和800 μmol·L-1 PA组细胞存活率降低(P < 0.01)。见图 3(插页三)和4。
|
| A: Control group; B-D: 200, 400, 600, and 800 μmol·L-1 PA groups. 图 3 各组H9c2细胞形态表现 Fig. 3 Morphology of H9c2 cells in various groups |
|
|
|
| A: Control group; B-D: 200, 400, 600, and 800 μmol·L-1 PA groups. *P < 0.01 vs control group. 图 4 各组H9c2细胞存活率 Fig. 4 Survival rates of H9c2 cells in various groups |
|
|
与对照组比较,加入PA 24 h后,200、400、600和800 μmol·L-1 PA组H9c2细胞凋亡率均升高(P < 0.01),且呈浓度依赖性。见图 5和6。
|
| A: Control group; B-D: 200, 400, 600, and 800 μmol·L-1 PA groups. 图 5 流式细胞术检测各组H9c2细胞凋亡率 Fig. 5 Apoptotic rates of H9c2 cells in various groups detected by flow cytometry |
|
|
|
| A: Control group; B-D: 200, 400, 600, and 800 μmol·L-1 PA groups. *P < 0.01 vs control group. 图 6 各组H9c2细胞凋亡率 Fig. 6 Apoptotic rates of H9c2 cells in various groups |
|
|
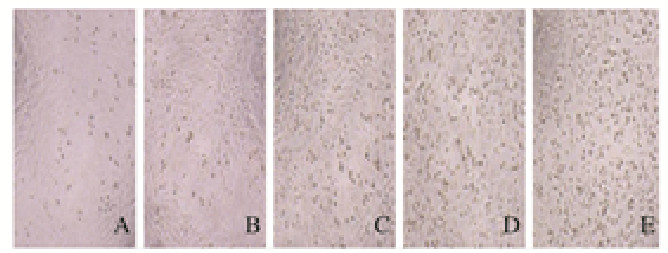
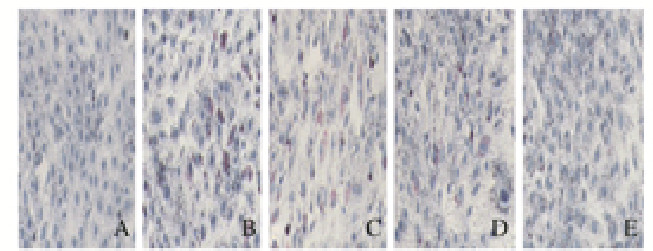
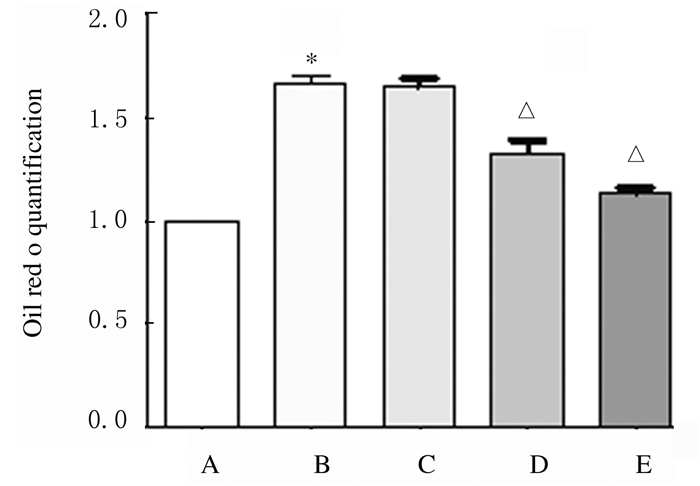
与对照组比较,24 h时,100 μmol·L-1PA组H9c2细胞有明显的脂滴蓄积现象;与100μmol·L-1PA组比较,24 h时2.0和20.0mg·L-1人参提取物组H9c2细胞中脂滴水平降低(P < 0.01)。见图 7(插页三)和8。
|
| A: Control group; B: 100 mmol·L-1PA group; C-E: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups. 图 7 人参提取物作用后各组H9c2细胞中脂滴形态表现 Fig. 7 Morphology of lipid droplets in H9c2 cells in various groups after treated with gienseng extract |
|
|
|
| A: Control group; B: 100 μmol·L-1PA group; C-D: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups.*P < 0.01 vs control group; △P < 0.01 vs 100 mmol·L-1 PA group. 图 8 人参提取物作用后各组H9c2细胞中脂滴水平 Fig. 8 Levels of lipid drops in H9c2 cells in various groups after treated with gienseng extract |
|
|
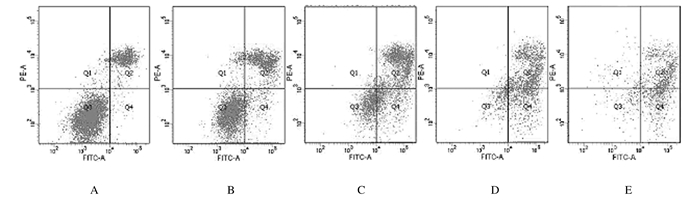
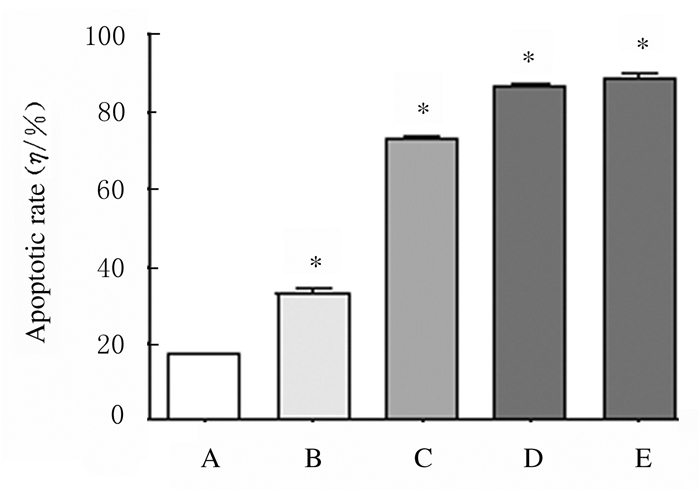
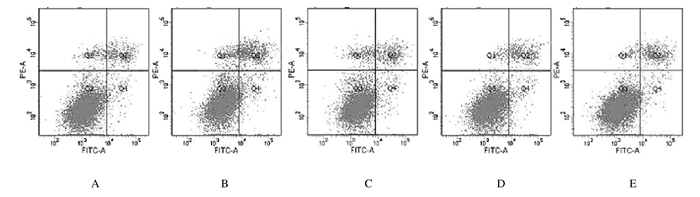
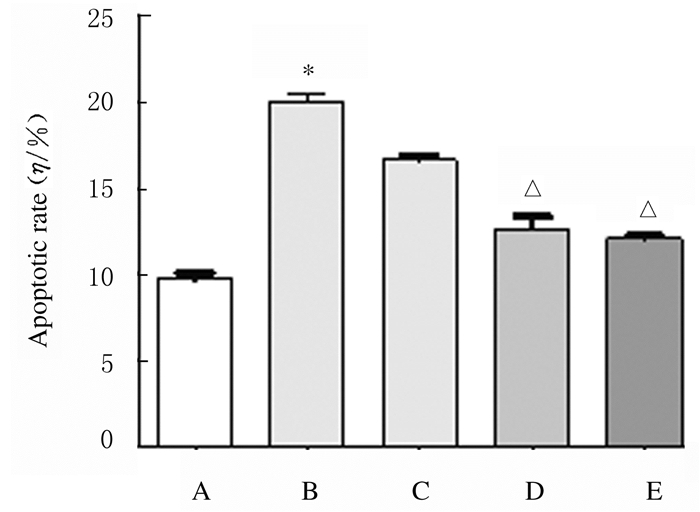
与对照组比较,人参提取物作用后24 h时,200 μmol·L-1PA组H9c2细胞凋亡率升高(P < 0.01);与200 μmol·L-1PA组比较,2.0和20.0μmol·L-1人参提取物组H9c2细胞凋亡率降低(P < 0.01)。见图 9和10。
|
| A: Control group; B: 200 μmol·L-1PA group; C-D: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups. 图 9 人参提取物作用后流式细胞术检测各组H9c2细胞凋亡率 Fig. 9 Apoptotic rates of H9c2 cells in various groups after treated with gienseng extract detected by flow cytometry |
|
|
|
| A: Control group; B: 200 μmol·L-1PA group; C-D: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups.*P < 0.01 vs control group; △P < 0.01 vs 200 μmol·L-1PA group. 图 10 人参提取物作用后各组H9c2细胞凋亡率 Fig. 10 Apoptotic rates in H9c2 cells in various groupsafter treated with gienseng extract |
|
|
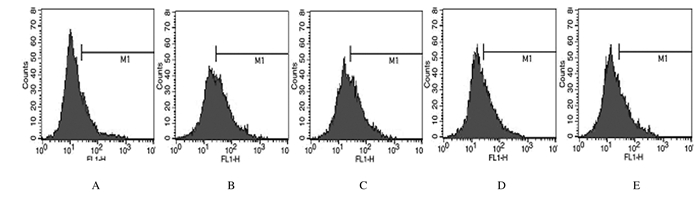
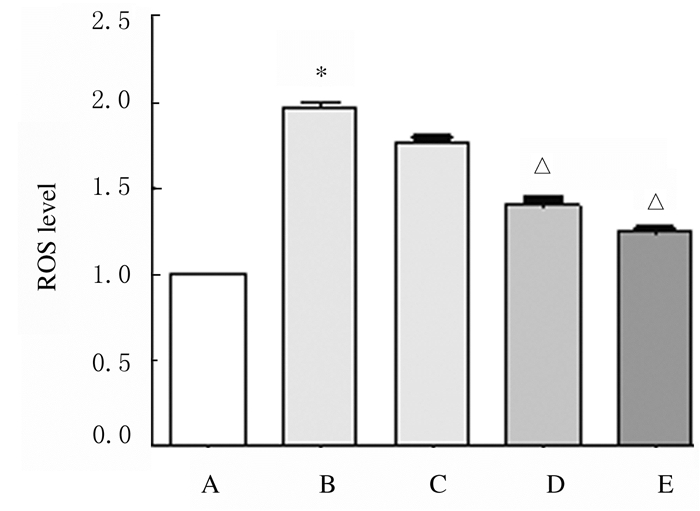
与对照组比较,人参提取物作用后24 h时, 200 μmol·L-1 PA组细胞中ROS水平升高(P < 0.01);与200 μmol·L-1 PA组比较,人参提取物作用后48 h时, 2.0和20.0mg·L-1人参提取物组H9c2细胞中ROS水平降低(P < 0.01)。见图 11和12。
|
| A: Control group; B: 200 μmol·L-1PA group; C-E: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups. 图 11 人参提取物作用后各组H9c2细胞中ROS水平 Fig. 11 ROS levels in H9c2 cells in various groups after treated with ginseng extract |
|
|
|
| A: Control group; B: 200 μmol·L-1PA group; C-E: 0.2, 2.0, and 20.0 mg·L-1ginseng extract groups.*P < 0.01 vs control group; △P < 0.01 vs 200 μmol·L-1 PA group. 图 12 人参提取物作用后各组H9c2细胞中ROS水平 Fig. 12 ROS levels in H9c2 cells in various groupsafter treated with ginseng extract |
|
|
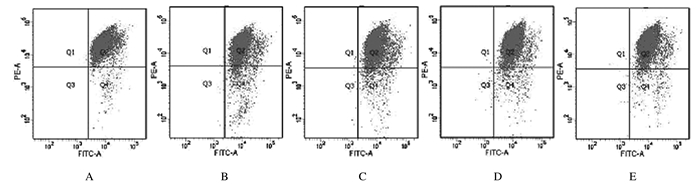
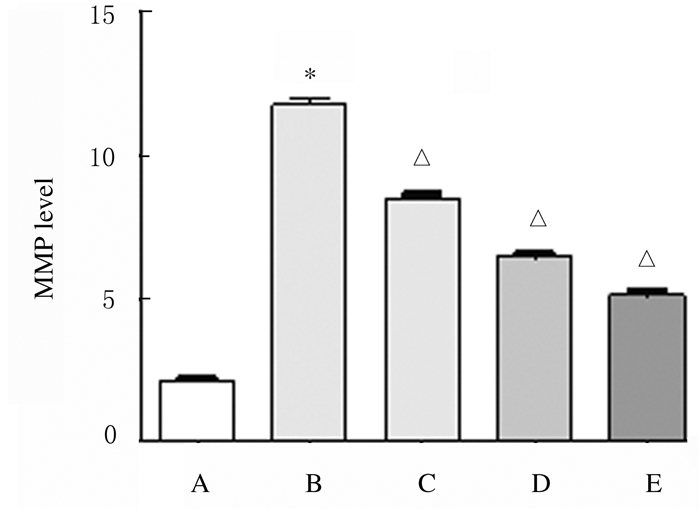
与对照组比较,24 h后200 mmol·L-1PA组H9c2细胞中MMP水平降低(P < 0.01);与200 mmol·L-1PA组比较,48 h后不同浓度人参提取物组H9c2细胞中MMP水平升高(P < 0.01),且随着浓度增高,效果更加明显。见图 13和14。
|
| A: Control group; B: 200 μmol·L-1PA group; C-E: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups. 图 13 人参提取物作用后各组H9c2细胞中MMP水平 Fig. 13 MMP levels in H9c2 cells in various groups after treated with ginseng extract |
|
|
|
| A: Control group; B: 200 μmol·L-1PA group; C-E: 0.2, 2.0, and 20.0 mg·L-1 ginseng extract groups.*P < 0.01 vs control group; △P < 0.01 vs 200 μmol·L-1PA group. 图 14 人参提取物作用后各组H9c2细胞中MMP水平 Fig. 14 MMP levels in H9c2 cells in various groups after treated with ginseng extract |
|
|
目前,肥胖和高脂血症患者持续增多。研究[10-12]表明:肥胖伴随的心脏病患者越来越多,高脂血症常常引起包括糖尿病、阿尔兹海默症、冠心病和癌症等一系列临床疾病。线粒体是细胞维持功能重要的细胞器,不仅参与能量代谢,还在信号传导、维持细胞稳态方面发挥重要的作用[13-14]。细胞内脂代谢紊乱是心肌细胞线粒体受损引发心脏疾病的重要原因之一[15]。当心肌细胞中脂质大量蓄积,远大于细胞实际的代谢需求时,会增加线粒体的负担导致脂质代谢产物和介质的堆积[16],最终导致线粒体功能受到损伤,ATP产生能力下降,细胞凋亡水平升高[17]。
正常情况下,除脂肪细胞外其他细胞内一般不见或仅见少量脂滴。在病理状态下如这些细胞中出现脂滴或脂滴明显增多,采用油红O染色即能将脂质清晰地显示出来[18]。本研究结果显示:H9c2细胞经PA处理后,心肌细胞中脂滴蓄积增多,细胞凋亡比例明显升高。机体内异常的细胞凋亡与很多疾病的发生发展关系密切,抑制这种细胞凋亡成为科学家们[19-20]研究的热点。本研究结果显示:经人参提取物处理后,细胞中脂滴数量明显减少,细胞凋亡率降低。以往研究[12]表明氧化应激是心脏功能降低的重要原因。高脂条件下,线粒体内的电子传递链平衡被破坏,造成“电子漏”,漏出的电子直接传递给氧气产生过多的ROS,ROS蓄积诱发了氧化应激[21-22]。细胞中95%以上的ROS产生于线粒体,当细胞中ROS水平过高时,线粒体首先会受到损伤。研究[23-26]显示:ROS可以影响线粒体的分裂和融合,通过影响线粒体的生物发生破坏线粒体功能。MMP水平降低会引起线粒体膜通透性的改变,导致细胞色素C释放触发caspase级联反应,从而诱发细胞凋亡[27-28]。本文作者推测人参提取物对PA诱导的细胞脂毒性的保护作用可能是通过减少ROS的产生、保护细胞线粒体和抑制细胞凋亡实现的。本研究结果显示:人参提取物可以减少PA引起的ROS水平升高,同时改善PA引起的MMP水平降低,与既往研究[22-23]结果相符。
本研究在细胞水平上证实了人参提取物对PA诱导的心肌细胞损伤有一定的保护作用,为人参的药物开发与使用提供了一定的理论依据。但仍存在一些不足之处,未来应该在动物实验和临床研究上进一步探讨人参提取物保护心肌细胞损伤的具体机制。
| [1] |
ABEL E D, LITWIN S E, SWEENEY G. Cardiac remodeling in obesity[J]. Physiol Rev, 2008, 88(2): 389-419. |
| [2] |
AURIGEMMA G P, DESIMONE G, FITZGIBBONS T P. Cardiac remodeling in obesity[J]. CircCardiovasc Imaging, 2013, 6(1): 142-152. |
| [3] |
周雯雯, 李母昌. 糖尿病性心肌病研究进展[J]. 心血管病学进展, 2009, 30(4): 615-618. DOI:10.3969/j.issn.1004-3934.2009.04.025 |
| [4] |
国家药典委员会. 中华人民共和国药典2015年版[M]. 北京: 中国医药科技出版社, 2015: 8-9.
|
| [5] |
王铁生. 中国人参[M]. 沈阳: 辽宁科学技术出版社, 2001: 10.
|
| [6] |
FU Y, JI L L. Chronic ginseng consumption attenuates age-associated oxidative stress in rats[J]. J Nutr, 2003, 133(11): 3603-3609. DOI:10.1093/jn/133.11.3603 |
| [7] |
LIM S W, JIN L, LUO K, et al. Ginseng extract reduces tacrolimus-induced oxidative stress by modulating autophagy in pancreatic beta cells[J]. Lab Invest, 2017, 97(11): 1271-1281. DOI:10.1038/labinvest.2017.75 |
| [8] |
杜莹莹, 郑毅男, 刘文丛, 等. 人参咖啡对实验型高血脂症小鼠的降血脂作用[J]. 吉林农业大学学报, 2014, 36(6): 666-669, 673. |
| [9] |
HUO K J, ZHONG W J, CHEN C, et al. Effect of baihu ginseng decoction on treatment of type 2 diabetes[J]. Biomed Res, 2017, 28(19): 8190-8194. |
| [10] |
HANSEN L, NETTERSTRØM M K, JOHANSEN N B, et al. Metabolically healthy obesity and ischemic heart disease: a 10-year follow-up of the inter99 Study[J]. J Clin Endocrinol Metab, 2017, 102(6): 1934-1942. DOI:10.1210/jc.2016-3346 |
| [11] |
AMANTI M, SCHUMANN L. Coronary artery disease: a link between hypertension, diabetes mellitus, hyperlipidemia, and obesity[J]. J Am Acad Nurse Pract, 1998, 10(2): 77-81;quiz82-84. DOI:10.1111/j.1745-7599.1998.tb00499.x |
| [12] |
梁酉, 石梅初, 梁艺华, 等. 高脂血症与癌症关系的相关性调查[J]. 中国肿瘤, 2003, 11(4): 220-221. |
| [13] |
RABINOVITCH R C, SAMBORSKA B, FAUBERT B, et al. AMPK maintains cellular metabolic homeostasis through regulation of mitochondrial reactive oxygen species[J]. Cell Reports, 2017, 21(1): 1-9. DOI:10.1016/j.celrep.2017.09.026 |
| [14] |
杨建, 高莹, 史慧妍, 等. 线粒体功能障碍与高血压[J]. 中国动脉硬化杂志, 2017, 25(10): 1061-1066. DOI:10.3969/j.issn.1007-3949.2017.10.017 |
| [15] |
周宇, 刘涛, 鲍翠玉. 棕榈酸诱导H9C2心肌细胞脂毒性损伤模型的建立[J]. 湖北科技学院学报:医学版, 2018, 32(2): 102-105. |
| [16] |
张志国.萝卜硫素对2型糖尿病小鼠心肌损伤的保护作用[D].长春: 吉林大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017015924.htm
|
| [17] |
XU S, NAM S M, KIM J H, et al. Palmitate induces ER calcium depletion and apoptosis in mouse podocytes subsequent to mitochondrial oxidative stress[J]. Cell Death Dis, 2015, 6(11): e1976. DOI:10.1038/cddis.2015.331 |
| [18] |
YU B C, CHANG C K, OU H Y, et al. Decrease of peroxisome proliferator-activated receptor delta expression in cardiomyopathy of streptozotocin-induced diabetic rats[J]. Cardiovasc Res, 2008, 80(1): 78-87. |
| [19] |
宋学立, 钱令嘉. 氧化应激和心肌损伤[J]. 国外医学:卫生学分册, 2000(1): 30-32, 56. |
| [20] |
KOUNTOURAS J, KOUKLAKIS G, ZAVOS C, et al. Apoptosis, inflammatory bowel disease and carcinogenesis: overview of international and Greek experiences[J]. Can J Gastroenterol, 2003, 17(4): 249-258. DOI:10.1155/2003/527060 |
| [21] |
李良德, 王定锋, 吴光远. 线粒体内活性氧产生靶标位点研究进展[J]. 生命科学研究, 2015, 19(6): 530-535. |
| [22] |
HUANG C C, LEE C C, LIN H H, et al. Autophagy-regulated ROS from xanthine oxidase acts as an early effector for triggering late mitochondria-dependent apoptosis in cathepsin s-targeted tumor Cells[J]. PLoS One, 2015, 10(6): e0128045. DOI:10.1371/journal.pone.0128045 |
| [23] |
田静, 吕嵘, 郭炜. 线粒体障碍在糖尿病性心肌病中的作用及中医药研究进展[J]. 中国中药杂志, 2018, 40(1): 8-14. |
| [24] |
LY J D, GRUBB D R, LAWEN A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update[J]. Apoptosis, 2003, 8(2): 115-128. DOI:10.1023/A:1022945107762 |
| [25] |
ZAMZAMI N, MARCHETTI P, CASTEDO M, et al. Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death[J]. J Exp Med, 1995, 182(2): 367-377. DOI:10.1084/jem.182.2.367 |
| [26] |
MARTÍNEZ-REYESI, DIEBOLD L P, KONG H, et al. TCA cycle and mitochondrial membrane potential are necessary for diverse biological functions[J]. Mol Cell, 2016, 61(2): 199-209. DOI:10.1016/j.molcel.2015.12.002 |
| [27] |
常青, 王晓良. 细胞色素C、线粒体与凋亡[J]. 中国药理学通报, 2003, 19(3): 241-244. DOI:10.3321/j.issn:1001-1978.2003.03.001 |
| [28] |
NARULA J, PANDEY P, ARBUSTINI E, et al. Apoptosis in heart failure: release of cytochrome c from mitochondria and activation of caspase-3 in human cardiomyopathy[J]. Proc Natl Acad Sci U S A, 1999, 96(14): 8144-8149. |
 2019, Vol. 45
2019, Vol. 45


