扩展功能
文章信息
- 张宸豪, 李瑶, 李正祎, 骆晓峰
- ZHANG Chenhao, LI Yao, LI Zhengyi, LUO Xiaofeng
- 原花青素B1对LPS诱导小鼠巨噬细胞RAW264.7损伤的保护作用及其机制
- Protective effect of procyanidine B1 on LPS-induced injury of mouse macrophages RAW264.7 and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1243-1247
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1243-1247
- 10.13481/j.1671-587x.20190609
-
文章历史
- 收稿日期: 2019-08-24
2. 吉林医药学院基础医学院生理学教研室, 吉林 吉林 132013
2. Department of Physiology, College of Basic Medical Sciences, Jilin Medical University, Jilin 132013, China
原花青素主要存在于植物的果实、种子、花和果皮中,是一类在植物界中广泛存在的双黄酮衍生物的天然多酚化合物,这类物质在酸性介质中加热,可经降解和氧化产生红色花青素,因而被称作原花青素。根据其二聚体的两个单体空间构象或键结合的位置不同,依次被分为B1~B8,其中原花青素B1(procyanidin B1, PB1)活性最强[1]。PB1是一种强还原剂,可以清除人体内有毒的自由基,保护细胞组织免受自由基的氧化损伤,具有广泛的药理作用, 其在抗氧化、抗炎、防治癌症、降脂、预防心血管疾病和糖尿病等领域的应用已有报道[2-3]。因此原花青素成为了天然药物研究中的热点,其药用价值更是得到了众多学者的肯定。目前关于PB1的研究较多倾向于细胞凋亡和抗血管生成等方面,在抗炎方面的研究甚少,其确切抗炎机制尚不清楚。因此本研究在构建稳定的细胞损伤模型基础上,进一步研究PB1的抗炎机制,为其应用于临床治疗提供新的理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器RAW264.7细胞由东北师范大学生命科学院提供。1640培养液购自北京迈晨科技有限公司,胎牛血清购自美国Hyclone公司,Annexin-Ⅴ-FITC/PI双染凋亡试剂盒购自美国eBiocience公司,脂多糖(lipopolysaccharid,LPS)购自美国Sigma公司,原花青素B1购自百灵威生物有限公司。EPICS-XL流式细胞仪购自美国贝克曼公司。
1.2 细胞培养和分组实验前1周从液氮中取出保存的RAW264.7细胞,复苏后培养于含10%血清的1640培养液中,每周传代2~3次,取对数生长期细胞用于实验。实验分为对照组(细胞不进行特殊处理)、LPS组(细胞给予2 mg·L-1LPS)、PB1组(细胞给予10 μmol·L-1 PB1),PB1+LPS组(细胞给予2 mg·L-1LPS+10 μmol·L-1 PB1)。处理后继续培养24 h,收集细胞完成后续实验,在倒置显微镜下观察各组细胞形态表现。
1.3 流式细胞术检测各组细胞中活性氧(active oxygenspecies,ROS)水平取各组RAW264.7细胞,每组细胞数为5×105个,PBS洗涤2次后,加入100 μL PBS重悬细胞,加入DCFH-DA储存液,使其终浓度为5 μmol·L-1,混匀后在37 ℃避光反应30 min,PBS洗涤2次后流式细胞术分析细胞中荧光强度。双氯荧光素乙酸乙酯(dichlorofluorescein diacetate, DCFH-DA)进入细胞后可被酯酶水解为DCFH,该物质被氧化后生成DCF,而DCF发射的荧光可通过流式细胞仪于525 nm通道(FL1)检测到,实验重复3次,取荧光强度的均值,即为细胞中ROS水平。
1.4 流式细胞术检测各组细胞凋亡率取各组RAW264.7细胞,每组细胞数为5×105个,采用PBS洗涤2次,取195 μL结合缓冲液重悬细胞,加入5 μL FITC-标记Annexin-Ⅴ,室温下避光反应30 min;结合缓冲液洗涤细胞2次,400 μL结合缓冲液重悬细胞,加入PI溶液5 μL,5 min后用流式细胞仪分析。实验重复3次,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.5 流式细胞术检测各组细胞表面膜分子表达水平各组取5×105个细胞,悬于100 μL PBS中,加入1 μg标记的抗CD40抗体及阴性对照抗体,4℃避光反应30 min。PBS洗涤2次后,采用400 μLPBS缓冲液重悬细胞,流式细胞仪检测PE荧光,以PE荧光值代表膜分子CD16/32、CD40、CD86和Toll样受体4(Toll-like receptor 4, TLR4)表达水平。
1.6 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组细胞中ROS水平、细胞凋亡率和各组细胞中膜分子CD16/32、CD40﹑CD86和TLR4表达水平以x±s表示,各组数据进行正态分布及总体方差齐性检测,符合正态分布且总体方差齐指标的比较采用单因素方差分析,不符合正态分布且总体方差不齐指标进行非参数Kruskal-Wallis H检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 倒置显微镜下各组细胞形态表现对照组和PB1组细胞生长状态良好,LPS组细胞体积缩小,变圆,连接消失,部分细胞聚集成团,而PB1+LPS组细胞生长状态较好,偶见个别变圆细胞。见图 1(插页三)。
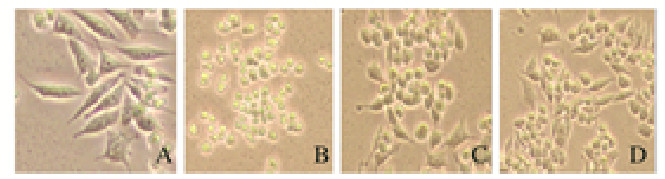
|
| A:Control group; B:LPS group; C:PB1 group; D:PB1+LPS group. 图 1 各组RAW264.7细胞形态表现(×400) Fig. 1 Morphology of RAW264.7 cells in various groups(×400) |
|
|
对照组、LPS组、PB1组和PB1+LPS组细胞中ROS水平分别为10.2±1.3、34.7±2.5、7.9±0.8和8.9±0.9。与对照组比较, LPS组细胞中ROS水平明显升高(P<0.05);与LPS组比较,PB1组细胞中ROS水平降低(P<0.05),PB1+LPS组细胞中ROS水平明显降低(P<0.05)。
2.3 各组RAW264.7细胞凋亡率采用PI和Annexin-Ⅴ试剂双染法检测细胞凋亡结果显示:与对照组比较,LPS组巨噬细胞早期和晚期细胞凋亡率升高(P<0.05),PB1组细胞未发生明显的凋亡或坏死;与LPS组比较,PB1+LPS组早期和晚期细胞凋亡率降低(P<0.05)。见表 1。
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | Rate of living cells | Early apoptotic rate | Late apoptotic rate | Necrotic rate of cells | |||||||||||||||||||||||||
| Control | 94.4±5.1 | 2.1±0.5 | 1.8±0.4 | 1.7±0.3 | |||||||||||||||||||||||||
| LPS | 69.9±4.6* | 14.3±2.7* | 8.7±1.8* | 7.1±2.5* | |||||||||||||||||||||||||
| PB1 | 94.9±4.1 | 1.8±0.6 | 2.2±0.5 | 1.1±0.4 | |||||||||||||||||||||||||
| PB1+LPS | 88.7±4.6△ | 4.2±1.9△ | 3.5±0.8△ | 3.6±0.7△ | |||||||||||||||||||||||||
| * P<0.05 compared with control group;△ P<0.05 compared with LPS group. | |||||||||||||||||||||||||||||
LPS作用小鼠巨噬细胞RAW264.7细胞后,与对照组比较,LPS组细胞中表面膜分子CD16/32、CD40、CD86和TLR4表达水平明显升高(P<0.05),PB1组细胞中表面膜分子CD16/32、CD40、CD86和TLR4表达水平差异无统计学意义(P>0.05);与LPS组比较,PB1+LPS组细胞中表面膜分子CD16/32、CD40、CD86和TLR4表达水平明显降低(P<0.05)。见表 2。
| (n=3, x±s, η/%) | |||||||||||||||||||||||||||||
| Group | LPS[ρB/(mg·L-1)] | ||||||||||||||||||||||||||||
| CD16/32 | CD40 | CD86 | TLR4 | ||||||||||||||||||||||||||
| Control | 38.9±4.7 | 61.6±3.9 | 55.9±4.5 | 6.1±1.1 | |||||||||||||||||||||||||
| LPS | 48.4±2.5* | 98.9±5.1* | 91.3±5.7* | 8.7±1.8* | |||||||||||||||||||||||||
| PB1 | 35.4±1.9 | 68.9±4.1 | 43.1±4.1 | 5.1±2.1 | |||||||||||||||||||||||||
| PB1+LPS | 40.8±3.7△ | 64.7±4.6△ | 49.2±3.9△ | 5.5±1.7△ | |||||||||||||||||||||||||
| * P<0.05 compared with control group;△ P<0.05 compared with LPS group. | |||||||||||||||||||||||||||||
炎症反应在正常生理学和病理学中发挥重要作用。长期炎症可导致许多慢性疾病,包括糖尿病、心血管疾病、癌症、关节炎和神经退行性疾病的发生[4]。长期以来,天然化合物被认为是治疗和预防各种人类疾病(包括炎性疾病)的药物活性成分中的主要来源。许多研究[5-9]表明:多酚类植物化合物质具有显著抗炎作用。原花青素是一类在植物界中广泛存在的双黄酮衍生物的天然多酚化合物,原花青素能作用于人类单核细胞,具有拮抗白细胞介素6、抑制白细胞介素1β产生等细胞因子作用,但原花青素参与机体急性期反应调节、机体炎症损伤和修复反应作用的具体机制仍不清楚。PB1可显著抑制LPS诱导的RAW264.7巨噬细胞中促炎介质和炎性细胞因子的表达及释放。本研究结果显示:LPS增加了TLR4的表达,而PB1明显抑制LPS诱导的TLR4分子的表达。TLR4作为一种重要的免疫模式识别受体,主要表达在巨噬细胞、中性粒细胞和肥大细胞上,以巨噬细胞上的TLR4数量最多。在炎症和先天免疫反应的启动和激活中调节作用最明显。LPS是革兰阴性菌细胞壁的主要致病成分,作为TLR4细胞外主要配体,与巨噬细胞表面模式识别受体TLR4结合启动免疫应答,介导巨噬细胞活化[10],并最终激活其在胞浆内的下游信号传导途径如核因子κB (NF-κB等)[11-13],导致大量细胞毒性因子和ROS等的过量产生。ROS被认为参与NF-κB信号传导途径的激活和炎症基因表达[13-15],巨噬细胞产生的ROS是炎症过程中最重要的特征之一。本研究结果显示:经LPS处理后RAW264.7细胞中ROS产生明显增加,而PB1明显抑制LPS诱导的ROS产生,提示PB1可能通过抑制TLR4表达和ROS产生,进一步抑制细胞中级联信号的起始,进而抑制NF-κB和促炎介质的活化。
巨噬细胞是体内主要的抗原提呈细胞,在机体中不仅执行固有免疫应答的效应功能, 而且通过提呈抗原启动适应性免疫应答。在组织微环境中, 巨噬细胞通过吞噬入侵病原体、体内变形坏死的细胞及碎片等外源性抗原提呈抗原给T淋巴细胞, 完成免疫防御功能,而且巨噬细胞是一种极具异质性的细胞群体,可受体内微环境中各种信号刺激进行经典M1表型或替代M2表型极化[16-18]。在受到LPS刺激时,巨噬细胞可呈M1极化表型,分泌大量促炎因子和表达相关M1型基因;当巨噬细胞受到IL-4和IL-13刺激时,巨噬细胞呈M2极化表型极化,分泌大量抗炎因子和表达相关M2型基因。M1表型极化可促使巨噬细胞表面CD16/32、CD40和CD86等膜分子表达水平明显增加,与T细胞作用增强,进而产生高水平促炎细胞因子以及ROS,有助于炎症反应的发生和持续[19-23]。因此,抑制M1表型巨噬细胞极化对于限制炎症反应进展至关重要。本研究结果显示:LPS诱导巨噬细胞后,巨噬细胞膜表面CD40、CD86和CD16/32的阳性表达水平明显升高,同时细胞凋亡率升高;而PB1明显拮抗了LPS对巨噬细胞的损伤,抑制了CD40、CD86和CD16/32的阳性表达水平, 降低了细胞凋亡率。因此本文作者认为PB1对炎症的抑制作用可能与影响巨噬细胞M1表型极化有关。
综上所述,PB1可以抑制炎症反应,其机制可能是通过抑制或阻止LPS与TLR4相互作用,进而降低膜分子表达水平,抑制巨噬细胞M1型极化,减轻细胞损伤,对LPS诱导的小鼠巨噬细胞RAW264.7损伤具有保护作用。本研究为探讨PB1的分子机制和抗炎药物的选择提供了新的线索。
| [1] |
周坦洋, 罗芙蓉, 白彬. 葡萄籽原花青素生物药理活性的研究进展[J]. 哈尔滨医科大学学报, 2012, 46(1): 94-96. DOI:10.3969/j.issn.1000-1905.2012.01.028 |
| [2] |
杨霞, 王利, 李少伟, 等. 花青素抗炎机制的研究进展[J]. 山东医药, 2017, 57(18): 106-108. DOI:10.3969/j.issn.1002-266X.2017.18.039 |
| [3] |
陈菲, 盛柳青, 麻佳蕾. 松针中原花青素的闪式提取及其抗氧化活性[J]. 中国医药工业杂志, 2014, 45(2): 120-123. |
| [4] |
周静, 王轶楠, 柳忠辉, 等. 脂多糖诱导小鼠巨噬细胞系RAW264.7细胞的活化凋亡作用[J]. 中国生物制品学杂志, 2009, 22(2): 136-138. |
| [5] |
王艳红, 葛斌, 杨社华, 等. 葡萄籽原花青素对复发性结肠炎大鼠结肠组织中细胞因子的影响[J]. 中国医院药学杂志, 2015, 35(16): 1453-1456. |
| [6] |
李文广, 张小郁, 吴勇杰, 等. 葡萄籽中原花青素的抗炎作用和机制[J]. 中国药理学报, 2001, 22(12): 1117-1120. |
| [7] |
陈晓玲. 植物药中原花青素的抗氧化作用[J]. 中国中药杂志, 2003, 28(8): 700-702. DOI:10.3321/j.issn:1001-5302.2003.08.003 |
| [8] |
MACKENZIE G G, DELFINO J M, KEEN C L, et al. Dimeric procyanidins are inhibitors of NF-kappaB-DNA binding[J]. Biochem Pharmacol, 2009, 78(9): 1252-1262. DOI:10.1016/j.bcp.2009.06.111 |
| [9] |
CHACÓN M R, CEPERUELO-MALLAFRÉ V, MAYMÓ-MASIP E, et al. Grape-seed procyanidins modulate inflammation on human differentiated adipocytes in vitro[J]. Cytokine, 2009, 47(2): 137-142. DOI:10.1016/j.cyto.2009.06.001 |
| [10] |
WU H C, JIANG K F, YIN N N, et al. Thymol mitigates lipopolysaccharide-induced endometritis by regulating the TLR4-and ROS-mediated NF-κB signaling pathways[J]. Oncotarget, 2017, 8(12): 20042-20055. |
| [11] |
MANDAL A, BHATIA D, BISHAYEE A. Anti-inflammatory mechanism involved in pomegranate-mediated prevention of breast cancer: the role of NF-κB and Nrf2 signaling pathways[J]. Nutrients, 2017, 9(5): 436. DOI:10.3390/nu9050436 |
| [12] |
GASPARRINI M, FORBES-HERNANDEZ T Y, GIAMPIERI F, et al. Anti-inflammatory effect of strawberry extract against LPS-induced stress in RAW 264.7 macrophages[J]. Food Chem Toxicol, 2017, 102: 1-10. DOI:10.1016/j.fct.2017.01.018 |
| [13] |
孙静文, 张伟. 复方苦参注射液对巨噬细胞内NF-kB作用的研究[J]. 现代检验医学杂志, 2005(5): 24-26. DOI:10.3969/j.issn.1671-7414.2005.05.010 |
| [14] |
MA Y F, TANG T, SHENG L L, et al. Aloin suppresses lipopolysaccharide-induced inflammation by inhibiting JAK1-STAT1/3 activation and ROS production in RAW264.7 cells[J]. Int J Mol Med, 2018, 42(4): 1925-1934. |
| [15] |
WEI Z, WANG J, SHI M, et al. Saikosaponin a inhibits LPS-induced inflammatory response by inducing liver X receptor alpha activation in primary mouse macrophages[J]. Oncotarget, 2016, 7: 48995-49007. |
| [16] |
周宪宾, 姚成芳. 巨噬细胞M1/M2极化分型的研究进展[J]. 中国免疫学杂志, 2012, 28(10): 957-960. DOI:10.3969/j.issn.1000-484X.2012.10.022 |
| [17] |
陈方圆, 袁祖贻, 周娟, 等. 姜黄素促进RAW264.7源性M1巨噬细胞向替代或激活M2表型极化[J]. 西安交通大学学报:医学版, 2015, 36(2): 257-262. |
| [18] |
PAN Y, SHEN B, GAO Q, et al. Caspase-1 inhibition attenuates activation of BV2 microglia induced by LPS-treated RAW264.7 macrophages[J]. Published Online, 2017, 26(6): 1633-1640. |
| [19] |
GASPARRINI M, FORBES-HERNANDEZ T Y, GIAMPIERI F, et al. Anti-inflammatory effect of strawberry extract against LPS-induced stress in RAW 264.7 macrophages[J]. Food Chem Toxicol, 2017, 102: 1-10. DOI:10.1016/j.fct.2017.01.018 |
| [20] |
KARWASRA R, KALRA P, GUPTA Y K, et al. Antioxidant and anti-inflammatory potential of pomegranate rind extract to ameliorate cisplatin-induced acute kidney injury[J]. Food Funct, 2016, 7(7): 3091-3101. DOI:10.1039/C6FO00188B |
| [21] |
XIANG JL, APEA-BAH F B, NDOLO V U, et al. Profile of phenolic compounds and antioxidant activity of finger millet varieties[J]. Food Chem, 2019, 275: 361-368. DOI:10.1016/j.foodchem.2018.09.120 |
| [22] |
帅维正, 刘剑飞, 吴成林, 等. 创伤弧菌溶细胞素对小鼠骨髓来源巨噬细胞坏死性凋亡的作用及机制[J]. 解放军医学杂志, 2018, 43(5): 419-423. |
| [23] |
刘若鸿, 刘春雨, 张誉凡, 等. 早期腹腔穿刺引流对重症急性胰腺炎大鼠腹腔巨噬细胞表型极化的影响[J]. 解放军医学杂志, 2018, 43(10): 834-839. DOI:10.11855/j.issn.0577-7402.2018.10.05 |
 2019, Vol. 45
2019, Vol. 45


