扩展功能
文章信息
- 刘秀花, 王满, 董欣洁, 刘京男, 韩薇, 关英慧
- LIU Xiuhua, WANG Man, DONG Xinjie, LIU Jingnan, HAN Wei, GUAN Yinghui
- 细丝蛋白A在宫颈癌患者癌组织中的表达及其临床意义
- Expression of filamin A in cancer tissue of cervical cancer patients and its clinical significance
- 吉林大学学报(医学版), 2019, 45(06): 1238-1242
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1238-1242
- 10.13481/j.1671-587x.20190608
-
文章历史
- 收稿日期: 2019-01-17
2. 吉林大学第一医院二部病理科, 吉林 长春 130031;
3. 吉林大学第一医院肿瘤中心, 吉林 长春 130021
2. Department of Pathology, First Hospital, Jilin University, Changchun 130031, China;
3. Tumor Center, First Hospital, Jilin University, Changchun 130021, China
宫颈癌是女性常见的恶性肿瘤之一,宫颈癌筛查和早期诊断可以降低宫颈癌发病率。但是,仍有三分之一的患者在5年内复发。因此,如何早期评估预后、预测复发转移风险和指导治疗策略成为研究的重点。细丝蛋白A(filaminA, FLNa)是细胞中的骨架蛋白,FLNa通过与多种蛋白和细胞因子的相互作用参与细胞运动、增殖、黏附、血管形成和转移等多种生物学活动[1-5];FLNa在多种恶性肿瘤中的表达存在差异,已有报道称其与乳腺癌[6]、肺癌[7]、黑色素细胞瘤[8]、肝癌[9]、胃癌[10]、结肠癌[11]和前列腺癌[12]等发生发展和侵袭转移有关。FLNa既可以促进肿瘤侵袭转移,又可以抑制肿瘤侵袭转移,出现上述不同作用,可能与FLNa存在的部位不同有关[13]。FLNa在宫颈癌组织中表达情况的相关报道比较少,国内尚未见相关报道。国外已有报道[14]称FLNa在宫颈癌组织中呈高表达,这与其预后差有关。但是由于FLNa对肿瘤的双重影响作用,其在宫颈癌组织中的表达情况其临床意义还有待进一步证实,FLNa影响宫颈癌发生发展的机制尚不清楚。本研究应用免疫组织化学方法和逆转录聚合酶链反应方法检测FLNa在宫颈癌组织及癌旁正常组织中的表达情况,探讨其临床意义,阐明FLNa与评估宫颈癌预后指标的关联性,评估FLNa是否可以作为评估宫颈癌预后的一项指标。
1 材料与方法 1.1 标本材料收集2016年1月-2017年1月吉林大学第一医院二部妇产科手术切除的宫颈癌组织和癌旁组织标本各55例。诊断标准:所有宫颈癌标本均经病理证实为宫颈癌,对组织标本进行双盲法复诊,确诊为宫颈癌55例,参照WHO病理分期进行病理分期。纳入标准:所有患者术前未接受过化疗、放疗和免疫治疗,无其他部位肿瘤。排除标准:有其他部位肿瘤和影响生存期的重大疾病,术前接受化疗、放疗及免疫治疗的患者。收集20例宫颈癌组织和癌旁新鲜组织置于-80℃冰箱,石蜡标本用于免疫组织化学法检测,新鲜冰冻标本用于RT-PCR检测。本研究通过本院伦理委员会许可并签署知情同意书。
1.2 主要试剂和仪器鼠抗人FLNa单克隆抗体MAB-1678购自美国Merck公司,免疫组织化学试剂盒(SP)购自北京中杉金桥生物公司,DAB试剂盒购自北京中杉金桥生物公司,TRIzol试剂盒购自美国Invitrogen公司,逆转录试剂盒购自美国Fermentas公司。光学显微镜购自日本Olympus公司,PCR仪购自杭州Bioer公司,-80℃超低温冰箱和低温超速离心机购自美国Thermo公司,凝胶成像系统购自美国Bio-Rad公司,电泳仪购自北京六一仪器厂。
1.3 免疫组织化学法检测宫颈癌患者宫颈癌组织中FLNa表达水平石蜡切片脱蜡至水,并用磷酸缓冲盐水(PBS)冲洗,采用微波炉进行抗原修复,采用0.3%双氧水阻断内源性过氧化物酶20 min;然后采用10%山羊血清室温孵育30 min;滴加FLNa抗体(鼠抗人FLNa单克隆抗体,MAB-1678,按1:100稀释),4℃过夜。滴加生物素标记的二抗工作液37℃、30 min,滴加辣根过氧化物酶标记的链酶卵白素工作液,室温孵育30 min,DAB显色,苏木素复染,中性树脂封片。正常宫颈组织作为阴性对照。
结果判定标准:FLNa阳性表达定位于细胞质,在显微镜下观察,以细胞阳性率和细胞染色强度得分的乘积进行判定。细胞阳性率分为4个等级:< 5%计0分,5%≤细胞阳性率≤25%计1分,25% < 细胞阳性率≤50%计2分,细胞阳性率>50%计3分;细胞染色强度评分标准:无染色计0分,染色弱(浅黄)计1分,染色中等(黄褐)计2分,染色强(棕黄)计3分。将两项评分相乘:< 2分,阴性(—);2~3分,弱阳性(+);4~5分,中等阳性(
采用TRIzol试剂盒提取组织中总RNA,测定浓度和纯度。取1 μg总RNA,按照逆转录试剂盒合成cDNA,反应体系为20 μL。PCR反应体系为50 μL, 按照试剂盒说明书进行操作,FLNa上游引物为5′-AGCCTCCACGAGACATCATC-3′,下游引物为5′-CCAGTGTGT ACTCCCCCTTG-3′[15-16],设定反应条件,按照预变性、变性、退火和延伸,35个循环。GAPDH mRNA作为内参。PCR产物行1%琼脂糖凝胶电泳,凝胶成像系统观察结果,分析条带亮度,得到FLNa基因与内参基因的吸光度(A)值,计算FLNa mRNA表达水平。FLNa mRNA表达水平=FLNa基因A值/内参基因A值。
1.5 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析。宫颈癌组织和癌旁正常组织中FLNa蛋白阳性表达率以百分比表示,组间比较采用χ2检验;宫颈癌组织和癌旁组织中FLNa mRNA表达水平以x±s表示,其分布符合正态分布,两组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
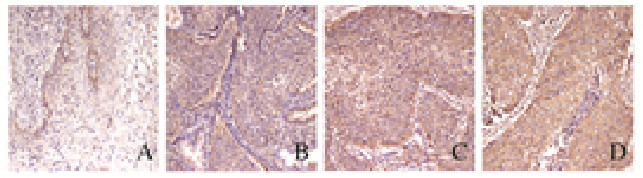
2 结果 2.1 宫颈癌患者宫颈癌组织中FLNa表达阳性率FLNa定位于细胞质,基底细胞表达阳性率高,细胞间质也有部分表达(图 1,见插页三)。FLNa在宫颈癌组织中高表达,在癌旁正常组织中不表达。宫颈癌组织中FLNa阳性表达率为54.55%,TNM分期(参照WHO病理分期)中Ⅰ+Ⅱ期宫颈癌组织中FLNa阳性表达率为40.00%,Ⅲ+Ⅳ期宫颈癌组织中FLNa阳性表达率为66.67%,组间比较差异有统计学意义(P < 0.05)。
|
| A: Stage Ⅰ cervical cancer tissue; B:Stage Ⅱ cervical cancer tissue; C: Stage Ⅲ cervical cancer tissue; D: Stage Ⅳ cervical cancer tissue. 图 1 各期宫颈癌患者癌组织中FLNa表达情况(免疫组织化学,×200) Fig. 1 Expressions of FLNa in cancer tissue of cervical cancer patients in different stages (Immunohistochemistry, ×200) |
|
|
宫颈癌组织中FLNa的表达情况与患者肿瘤分期、淋巴结转移和子宫旁浸润有关(P < 0.05),而与肿瘤大小、病理分型、年龄、肿瘤分化程度、神经脉管浸润和宫颈浸润深度无关联(P>0.05)。见表 1。
| Characteristic | n | FLNa+ | FLNa- | χ2 | P |
| Age(year) | |||||
| ≤50 > 50 |
26 29 |
16 14 |
10 15 |
0.97 | 0.13 |
| Tumor size(cm) | |||||
| ≤5 > 5 |
28 27 |
14 16 |
14 11 |
0.48 | 0.17 |
| Histology | |||||
| Adenocarcinoma Squamous carcinoma |
18 37 |
11 19 |
7 18 |
0.47 | 0.18 |
| Tumor stage | |||||
| Ⅰ+Ⅱ Ⅲ+Ⅳ |
25 30 |
10 20 |
15 10 |
3.91 | 0.03 |
| Lymph node metastasis | |||||
| Positive Negative |
33 22 |
22 8 |
11 14 |
4.89 | 0.02 |
| Parametrial invasion | |||||
| Positive Negative |
19 36 |
14 16 |
5 20 |
4.29 | 0.03 |
| Nerve-vascular invasion | |||||
| Positive Negative |
38 17 |
21 9 |
17 8 |
0.03 | 0.23 |
| Cervical invasion | |||||
| ≤1/3 > 1/3 |
16 39 |
7 23 |
9 16 |
1.06 | 0.14 |
| Differentiation | |||||
| Poor | 16 | 10 | 6 | 7.32 | > 0.05 |
| Moderate | 23 | 12 | 11 | ||
| High | 16 | 8 | 8 | ||
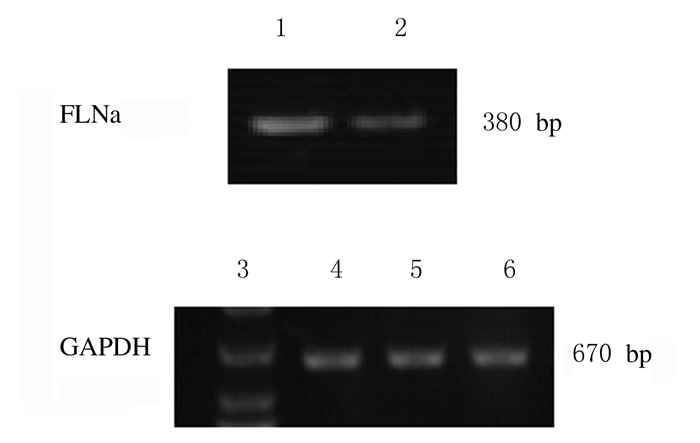
在20例宫颈癌组织中FLNa mRNA表达水平为0.519 3±0.101 0,在20例癌旁正常组织中FLNa mRNA表达水平为0.187 5±0.053 3,两者比较差异有统计学意义(t=14.243,P < 0.01),见图 2。RT-PCR检测结果与免疫组织化学结果一致。
|
| Lane 1:Cervical cancer tissue; Lane 2:Adjacent normal tissue; Lane 3:DNA marker; Lane 4:Cervical cancer tissue; Lane 5-6:Adjacent normal tissue. 图 2 RT-PCR法检测宫颈癌患者宫颈癌和癌旁组织中FLNa mRNA表达电泳图 Fig. 2 Electrophoregram of expressions of FLNa mRNA in cervical cancer tissue and adjacent normal tissue of cervical cancer patients detected by RT-PCR method |
|
|
FLNa是在非肌性细胞中发现的第一个肌动蛋白交联蛋白[17]。基因结构高度保守,表达广泛,可与90多种配体结合,发挥巨大的作用。FLNa大部分沿细胞浆周边分布,也可跨膜分布,甚至出现在细胞核内[18],这为FLNa在多部位发挥多种作用提供了条件。FLNa作为一种细胞骨架蛋白,通过自身结构中的肌动蛋白结合区与肌动蛋白结合,参与细胞的运动。同时,FLNa与细胞的增殖、浸润、黏附和迁徙等生物学行为息息相关,通过不同蛋白及细胞因子的相互作用,参与肿瘤的发生发展及浸润转移[19]。FLNa与BRCA1相互作用[20-21],调节DNA损伤敏感性,影响肿瘤发生发展,为肿瘤治疗提供靶点。李小翠等[22]研究证实:FLNa影响肿瘤细胞的凋亡,FLNa阳性表达可以使药物诱导的肿瘤凋亡作用减弱。
FLNa在许多肿瘤中高表达,参与肿瘤的侵袭转移[6-9],这与本研究结果一致。本文作者的前期研究[15]证实:FLNa在乳腺癌组织中表达存在差异,与乳腺癌患者的临床分期、淋巴结转移和分化程度呈正相关关系,乳腺癌组织中FLNa高表达,预后差,与乳腺癌侵袭转移相关。有研究[23]显示:沉默FLNa后,可通过上调14-3-3σ表达,抑制乳腺癌的侵袭迁移。FLNa参与肝细胞癌的转移,AI等[9]发现:FLNa和PGK1是肝癌发展的可能标志物。FLNa在肺神经内分泌肿瘤组织中呈高表达[2],可以通过调节Rap1影响肿瘤的进展,为肺癌诊断治疗提供了可能的新靶点。ZHANG等[24]应用人黑色素瘤细胞系异位表达和基因敲除技术建立小鼠移植瘤模型的研究证实:FLNa缺失可明显降低黑色素瘤细胞系的体外增殖、迁移和侵袭,并与体内异种移植模型中较小的肿瘤有关,提示FLNa表达水平高是黑色素细胞瘤不良预后因素。上述研究提示:FLNa通过不同途径参与肿瘤的发生发展和侵袭转移,本研究结果与上述研究结论一致。分期晚、存在淋巴结转移和子宫旁浸润的宫颈癌患者宫颈癌组织中FLNa表达水平升高,提示FLNa的表达情况与宫颈癌侵袭转移密切相关。在肿瘤组织中与癌旁正常组织中FLNa的表达存在差异[25-26],与本研究结果一致,提示FLNa有望成为评估肿瘤预后的一项指标,为肿瘤早期诊治提供依据。
本研究结果证实:FLNa在宫颈癌组织中的表达水平较癌旁正常组织升高。免疫组织化学检测结果提示:FLNa定位于细胞质,基底细胞中其阳性表达率高,细胞间质中也有部分表达,推测FLNa与宫颈癌侵袭转移有关。宫颈癌组织中FLNa的表达与TNM分期、淋巴结转移和子宫旁浸润有关联,提示FLNa表达程度与宫颈癌预后评价的指标有关联,其在一定程度上可以提示预后情况,有望成为评估预后的指标,但FLNa参与肿瘤侵袭转移的机制尚需进一步研究。
| [1] |
WANG Z, LI C, JIANG M, et al. Filamin A (FLNA) regulates autophagy of bladder carcinoma cell and affects its proliferation, invasion and metastasis[J]. Int Urol Nephrol, 2018, 50(2): 263-273. DOI:10.1007/s11255-017-1772-y |
| [2] |
VITALI E, BOEMI I, ROSSO L, et al. FLNA is implicated in pulmonary neuroendocrine tumors aggressiveness and progression[J]. Oncotarget, 2017, 8(44): 77330-77340. |
| [3] |
CHIANG T S, WU H F, LEE F S. ADP-ribosylation factor-like 4C binding to filamin-A modulates filopodium formation and cell migration[J]. Mol Biol Cell, 2017, 28(22): 3013-3028. DOI:10.1091/mbc.e17-01-0059 |
| [4] |
HU J, LU J, GOYAL A, et al. Opposing FlnA and FlnB interactions regulate RhoA activation in guiding dynamic actin stress fiber formation and cell spreading[J]. Hum Mol Genet, 2017, 26(7): 1294-1304. DOI:10.1093/hmg/ddx047 |
| [5] |
SHAO Q Q, ZHANG T P, ZHAO W J, et al. Filamin a: insights into its exact role in cancers[J]. Pathol Oncol Res, 2016, 22(2): 245-252. DOI:10.1007/s12253-015-9980-1 |
| [6] |
刘秀花, 高航, 刘晓亮, 等. 细丝蛋白A在乳腺癌组织中的表达及其临床意义[J]. 吉林大学学报:医学版, 2012, 38(1): 102-105. |
| [7] |
ZHANG Y, ZHU T, LIU J, et al. FLNa negatively regulated proliferation and metastasis in lung adenocarcinoma A549 cells via suppression of EGFR[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(2): 164-170. |
| [8] |
CAMPOS L S, RODRIGUEZ Y I, LEOPOLDINO A M, et al. Filamin A expression negatively regulates sphingosine-1-phosphate-induced NF-kappaB activation in melanoma cells by inhibition of akt signaling[J]. Mol Cell Biol, 2015, 36(2): 320-329. |
| [9] |
AI J, HUANG H, LV X, et al. FLNA and PGK1 are two potential markers for progression in hepatocellular carcinoma[J]. Cell Physiol Biochem, 2011, 27(3/4): 207-216. |
| [10] |
SUN G G, SHENG S H, JING S W, et al. An antiproliferative gene FLNA regulates migration and invasion of gastric carcinoma cell in vitro and its clinical significance[J]. Tumour Biol, 2014, 35(3): 2641-2648. DOI:10.1007/s13277-013-1347-1 |
| [11] |
TIAN Z Q, SHI J W, WANG X R, et al. New cancer suppressor gene for colorectal adenocarcinoma: filamin A[J]. World J Gastroenterol, 2015, 21(7): 2199-2205. DOI:10.3748/wjg.v21.i7.2199 |
| [12] |
SUN G G, LU Y F, ZHANG J, et al. Filamin A regulates MMP-9 expression and suppresses prostate cancer cell migration and invasion[J]. Tumour Biol, 2014, 35(4): 3819-3826. DOI:10.1007/s13277-013-1504-6 |
| [13] |
SAVOY R M, GHOSH P M. The dual role of filamin A in cancer: can't live with (too much of) it, can't live without it[J]. Endocr Relat Cancer, 2013, 20(6): R341-R356. DOI:10.1530/ERC-13-0364 |
| [14] |
JIN Y Z, PEI C Z, WEN L Y. FLNA is a predictor of chemoresistance and poor survival in cervical cancer[J]. Biomark Med, 2016, 10(7): 711-719. DOI:10.2217/bmm-2016-0056 |
| [15] |
TIAN H M, LIU X H, HAN W, et al. Differential expression of filamin A and its clinical significance in breast cancer[J]. Oncol Lett, 2013, 6(3): 681-686. DOI:10.3892/ol.2013.1454 |
| [16] |
史建伟, 于跃明, 王士杰, 等. 细丝蛋白A抑制人结肠癌SW480细胞体外侵袭转移能力[J]. 基础医学与临床, 2011, 31(9): 1000-1005. |
| [17] |
HARTWIG J H, STOSSEL T P. Isolation and properties of actin, myosin, and a new actinbinding protein in rabbit alveolar macrophages[J]. J Biol Chem, 1975, 250(14): 5696-5705. |
| [18] |
ZHOU X, BOREN J, AKYUREK L M. Filamins in cardiovascular development[J]. Trends Cardiovas Med, 2007, 17(7): 222-229. DOI:10.1016/j.tcm.2007.08.001 |
| [19] |
FENG Y, WALSH C A. The many faces of filamin: a versatile molecular scaffold for cell motility and signalling[J]. Nat Cell Biol, 2004, 6(11): 1034-1038. DOI:10.1038/ncb1104-1034 |
| [20] |
VELKOVA A, CARVALHO M A, JOHNSON J O, et al. Identification of Filamin A as a BRCA1-interacting protein required for efficient DNA repair[J]. Cell Cycle, 2010, 9(7): 1421-1433. DOI:10.4161/cc.9.7.11256 |
| [21] |
GUO Y, LI M, BAI G, et al. Filamin A inhibits tumor progression through regulating BRCA1 expression in human breast cancer[J]. Oncol Lett, 2018, 16(5): 6261-6266. |
| [22] |
李小翠, 袁博, 刘秀花, 等. 细丝蛋白A对药物诱导的乳腺癌细胞凋亡的影响[J]. 吉林大学学报:医学版, 2012, 37(6): 1070-1074. |
| [23] |
JI Z M, YANG L L, NI J, et al. Silencing filamin A inhibits the invasion and migration of breast cancer cells by up-regulating 14-3-3sigma[J]. Current medical science, 2018, 38(3): 461-466. DOI:10.1007/s11596-018-1901-6 |
| [24] |
ZHANG K, ZHU T, GAO D, et al. Filamin A expression correlates with proliferation and invasive properties of human metastatic melanoma tumors: implications for survival in patients[J]. J Cancer Res Clin Oncol, 2014, 140(11): 1913-1926. DOI:10.1007/s00432-014-1722-3 |
| [25] |
杨婧, 王延洲, 梁志清. 组蛋白乙酰化修饰在骨髓间充质干细胞向平滑肌细胞分化中的作用[J]. 解放军医学杂志, 2019, 44(5): 369-374. |
| [26] |
侯娟妮, 杜劲, 李秀川, 等. 线粒体外膜转运蛋白70在高糖高脂诱导的心脏微血管内皮细胞损伤中的作用[J]. 解放军医学杂志, 2018, 43(4): 283-288. |
 2019, Vol. 45
2019, Vol. 45


