扩展功能
文章信息
- 张恒, 郭彬, 田浩, 李兰, 吴静, 门秀丽
- ZHANG Heng, GUO Bin, TIAN Hao, LI Lan, WU Jing, MEN Xiuli
- 氯化锂对地塞米松诱导的大鼠胰岛β细胞凋亡的影响及其机制
- Effect of lithium chloride on apoptosis of islet β cells in rats induced by dexamethasone and its mechanism
- 吉林大学学报(医学版), 2019, 45(06): 1231-1237
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1231-1237
- 10.13481/j.1671-587x.20190607
-
文章历史
- 收稿日期: 2019-01-10
生理剂量糖皮质激素在体内广泛存在,并且在调节细胞生长发育、机体糖盐代谢平衡和应激反应等多方面起重要作用。超生理剂量的糖皮质激素有抗炎、抗休克和免疫抑制的作用[1],因此被临床广泛应用于各种炎症和免疫性疾病的治疗[2-3],但是长时间、大剂量使用糖皮质激素会增加一些患者发生糖尿病的风险[4-5],其发病率为10%~20%[6]。近年来糖尿病发病率的逐年升高引起了人们的广泛关注。但是目前临床上除停药外尚无其他有效治疗手段[7]。有研究[8-9]表明:胰岛β细胞可表达糖皮质激素受体,糖皮质激素可以直接诱导胰岛β细胞发生凋亡,这可能是导致胰岛素分泌降低的主要原因,这种细胞凋亡不会被停用糖皮质激素所逆转。另有研究[10-11]显示:糖原合成酶激酶3β(glycogen synthase kinase-3β, GSK-3β)在激素诱导人骨肉瘤细胞和神经元凋亡过程中发挥关键作用。GSK-3β是一种多功能丝/苏氨酸激酶,是多种信号通路的关键调节因子,参与多种细胞功能例如糖原合成、细胞周期调节和增殖。GSK-3β在细胞静息时是激活的,Ser9磷酸化使GSK-3β活性受到抑制,但有关GSK-3β在激素诱导胰岛β细胞凋亡过程中作用的报道较少。氯化锂(LiCl)是一种情绪稳定剂[12],可选择性抑制GSK-3β[13-14]。近年来越来越多的实验[15-16]证明锂离子具有抗氧化应激和抗缺血缺氧的作用,但其对地塞米松(dexamethasone, Dex)诱导胰岛β细胞凋亡的影响鲜见报道。本实验建立Dex诱导的胰岛β细胞凋亡模型,观察GSK-3β在激素诱导胰岛β细胞凋亡中的作用,并初步探讨GSK-3β活性与氧化应激的关系,为临床防治类固醇性糖尿病提供新的实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器大鼠胰岛细胞瘤INS-1细胞系由北京中日友好医院病理生理学实验室惠赠。细胞超氧化物歧化酶(superoxide dismutase, SOD)、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、NADPH氧化酶4(Nox4)、NADPH oxidase(又称p47phox)、GSK-3β和LiCl试剂(美国Sigma公司),RPMI-1640(美国Gibco公司),逆转录试剂盒(美国Promega公司),BCA蛋白测定试剂盒(中国北京碧云天生物公司),RNA提取试剂盒(美国Qiagen公司),活性氧(ROS)检测试剂盒(美国Genmed公司),Annexin Ⅴ/PI检测试剂盒(美国Becton Dickinson公司),TUNEL试剂盒(瑞士Roche公司),兔抗GSK-3β多克隆抗体和兔抗p-GSK3β(ser9)多克隆抗体(美国Cell Signaling Technology公司),兔抗iNOS多克隆抗体和兔抗Nox4单克隆抗体(英国Abcam公司),抗线粒体超氧化物岐化酶抗体(美国Upstate公司)。CO2培养箱(美国Thermo公司),离心机(日本Kubota公司),7500Real-timePCR仪(美国Bio-Rad公司), 酶标仪Athnos2010(澳大利亚Salzburg公司),蛋白垂直电泳仪、蛋白电泳转膜仪和SDS-PAGE电泳槽(美国Bio-Rad公司),凝胶成像系统(美国Innotech公司)。
1.2 GSK-3β抑制剂LiCl的配制和细胞分组首先配制2种条件培养基:一是将10 mmol·L-1LiCl加入含有0.1 μmol·L-1Dex的药物培养基中,配制成10 mmol·L-1 LiCl+0.1 μmol·L-1Dex培养基;二是将10 mmol·L-1 LiCl加入含有3%FCS的完全培养基中,配制成单纯LiCl培养基。当INS-1细胞达到60%融合时,加入配制好的单纯LiCl培养基放入孵箱进行预处理30 min,之后弃掉单纯LiCl培养基,加入10 mmol·L-1 LiCl+0.1 μmol·L-1 Dex的培养基即为LiCl+0.1μmol·-1Dex组;不用单纯LiCl培养基预处理,直接换成含0.1 μmol·L-1Dex的培养基即为0.1 μmol·L-1Dex组;对照组仅以含3%FCS的培养基培养,作用48 h后于规定时间检测各组细胞的各项指标。
1.3 TUNEL法检测各组INS-1细胞凋亡率TUNEL试剂盒检测各组细胞凋亡情况。INS-1细胞接种于96孔板中,每孔加入量为150 μL,细胞数约为2×104个,每组设5个平行孔,实验重复3次。阳性对照:向孔细胞通透加入DNase Ⅰ混合液(3 000U·mL-1 DNase Ⅰ,50 mmol·L-1 Tris-HCl,pH=7.5,10 mmol·L-1 MgCl2,1 g·L-1BSA),室温下孵育10 min。阴性对照:仅加入标记液。最后以PBS清洗3次,倒置显微镜下观测细胞着色情况并拍照储存,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.4 Annexin Ⅴ/PI染色流式细胞术检测各组INS-1细胞凋亡率将INS-1细胞接种于6孔板中,每孔加入量为150 μL,细胞数约为3.8×105个。培养24 h待细胞贴壁存活后,分别使用相应培养基培养48 h后,收集细胞,按照试剂盒说明进行Annexin Ⅴ-PI双染,经C6流式细胞仪检测各组细胞凋亡率。
1.5 Real-time PCR法检测各组INS-1细胞中SOD、iNOS、Nox4和p47phoxmRNA表达水平将INS-1细胞接种于6孔板中,每孔细胞数约为3.8×105个。培养24 h待细胞贴壁后换成相应的条件培养基收集细胞,按照试剂盒提取细胞总RNA,测定核酸浓度后按照Promega逆转录试剂盒说明进行操作,将提取的总RNA逆转录为cDNA。反应条件:逆转录反应(42℃、60min),灭活酶活性(95℃、5 min),之后进行Real-time PCR。95℃预变性1 min,94℃、15 s,60℃、30 s,72℃、30 s,40个循环。反应结束后,确认Real-time PCR的扩增曲线和熔解曲线,以2-ΔCt方法计算SOD、iNOS、Nox4和p47phoxmRNA表达水平。PCR反应的引物序列和产物长度见表 1。
| Amplified fragment | Primer sequence | Length of product(bp) |
| β-actin | Upstream:5′-GACATCCGTAAAGACCTCTATGCC-3′ Downstream:5′-ATAGAGCCACCAATCCACACAGAG-3′ |
173 |
| GSK-3β | Upstream:5′-CACCTCTGGCTACCATCCTTAT-3′ downstream:5′-ATTATTGGTCTGTCCACGGTCT-3′ |
119 |
| iNOS | Upstream:5′-GTCTGGCGAAGAACAATCC-3′ Downstream:5′-TCCCGAAACGCTACACTT-3′ |
314 |
| Nox4 | Upstream:5′-TAGCTGCCCACTTGGTGAACG-3′ Downstream:5′-TGTAACCATGAGGAACAATACCACC-3′ |
245 |
| NADPH oxidase(p47phox) | Upstream:5′-ATAATGTAGCTGACATCATG-3′ Downstream:5′-ATGCTCTGTGCATTGCGGAT-3′ |
495 |
| SOD | Upstream:5′-CGACCTTGCTCCTTATTG-3′ Downstream:5′-TGACCTGCCTTACGACTA-3′ |
387 |
将INS-1细胞接种于T25的培养瓶中,每瓶细胞数约为5×105个。培养24 h,待细胞贴壁后换成相应的条件培养基,继续培养48 h后收集细胞,加入蛋白裂解液,提取蛋白,采用蛋白定量试剂盒测定总蛋白浓度(BCA法)。取60 μg细胞总蛋白,于100 ℃水浴3 min,上样进行SDS-PAGE电泳。电泳结束后,湿转移法将蛋白条带转移至PVDF膜上(Millipore),50 g·L-1脱脂奶粉封闭后,分别加入GSK-3β、p-GSK-3β、SOD、iNOS、Nox4和p47phox一抗(美国Cell Signaling Technology公司) (1:300)和β-actin一抗(美国Sigma公司) (1:1 000)置于4 ℃冰箱振荡孵育过夜。TBST洗膜后,加入HRP标记的二抗(1: 20 000)室温反应1 h。TBST洗涤后,ECL化学发光试剂于暗室中显影,X线胶片曝光,拍照。采用Gel Image Syste4.2软件测量各条带面积和灰度值。以β-actin为内参,以GSK-3β、p-GSK-3β、SOD、iNOS、Nox4和p47phox蛋白条带灰度值与β-actin条带灰度值之比表示目的蛋白表达水平。
1.7 各组INS-1细胞中ROS水平检测将INS-1细胞接种于96孔板中,每孔加入量为150 μL,细胞数约为2×104个。培养24 h,待细胞贴壁后换成相应的条件培养基,继续培养48 h,通过GENMED试剂盒检测细胞中ROS水平。使用荧光酶标仪进行定量检测,激发波长为485 nm,发射波长为538 nm。相对荧光单位(relative fluorescence unit, RFU)增高表明ROS水平升高。
1.8 各组INS-1细胞中NO水平的检测采用Griess法检测加入LiCl前后细胞中NO水平,将INS-1细胞接种于24孔板中,调整细胞密度为1.2×106mL-1,培养24 h,待细胞贴壁后换成相应的条件培养基,继续培养48 h,收集细胞培养上清液,在酶标仪540 nm处检测吸光度(A)值,以NaNO2值作为标准曲线,按照试剂盒说明书检测细胞中NO水平。
1.9 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组INS-1细胞中ROS水平,NO水平,细胞凋亡率,细胞中SOD、iNOS、Nox4、p47phox和GSK3βmRNA表达水平, 细胞中GSK-3β、p-GSK-3β、SOD、iNOS和Nox4蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间均数两两比较采用t检验。以α=0.05为检验水准。
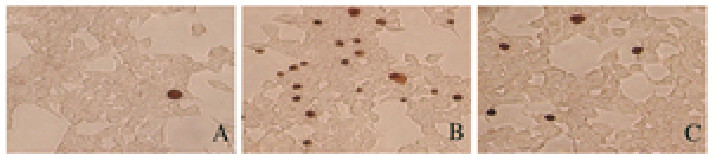
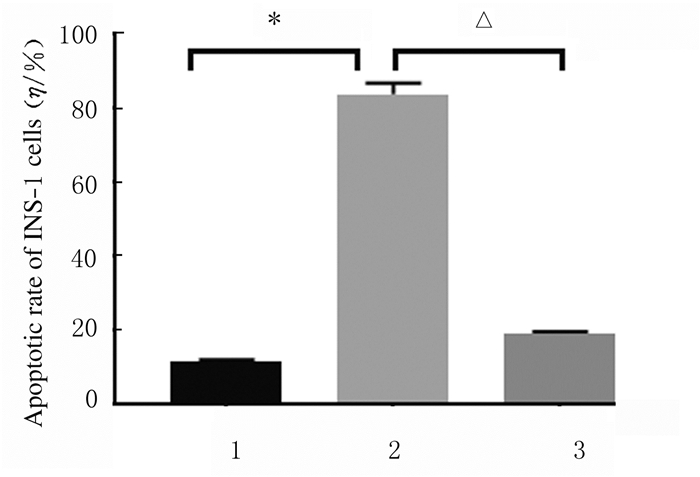
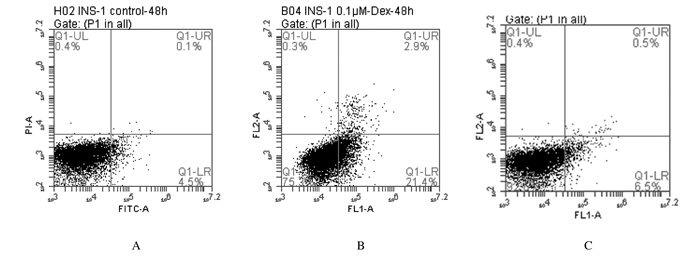
2 结果 2.1 各组INS-1细胞凋亡率TUNEL染色结果和AnnexinⅤ-PI染色流式细胞术检测结果均显示:与对照组比较,0.1 μmol·L-1Dex组INS-1细胞凋亡率升高(P < 0.05);与0.1 μmol·L-1Dex组比较,LiCl+0.1 μmol·L-1 Dex组INS-1细胞凋亡率降低(P < 0.05)。TUNEL染色结果见图 1(插页二),细胞凋亡率检测结果见图 2和3。
|
| A:Control group B:0.1 μmol·L-1 Dex group C:LiCl+0.1 μmol·L-1 Dex group. 图 1 各组INS-1细胞凋亡形态表现(TUNEL,×400) Fig. 1 Apoptotic morphology of INS-1 cells in various groups (TUNEL, ×400) |
|
|
|
| 1:Control group; 2:0.1μmol·L-1Dex group; 3:LiCl+0.1μmol·L-1Dex group; *P < 0.05 vs control group; △ P < 0.05 vs 0.1 μmol·L-1 Dex group. 图 2 各组INS-1细胞凋亡率 Fig. 2 Apoptotic rates of INS-1 cells in various groups |
|
|
|
| A:Control group; B:0.1μmol·L-1Dex group; C:LiCl+0.1μmol·L-1 Dex group. 图 3 流式细胞术检测各组INS-1细胞的凋亡率 Fig. 3 Apoptotic rates of INS-1 cells in various groups detected by flow cytometry |
|
|
与0.1μmol·L-1Dex组比较,LiCl+0.1 μmol·L-1 Dex组INS-1细胞中iNOS、Nox4和p47phox mRNA表达水平降低(P<0.05或P<0.01),SOD mRNA表达水平升高(P<0.05)。见表 2。
| (n=5, x±s) | |||||||||||||||||||||||||||||
| Group | SOD | iNOS | Nox4 | p47phox | |||||||||||||||||||||||||
| Control | 1 | 1 | 1 | 1 | |||||||||||||||||||||||||
| 0.1 μmol·L-1 Dex | 0.40±0.14 | 4.98±0.44 | 2.86±0.43 | 2.58±0.48 | |||||||||||||||||||||||||
| LiCl+0.1 μmol·L-1 Dex | 1.07±0.12* | 1.72±0.33** | 1.49±0.29* | 1.21±0.21** | |||||||||||||||||||||||||
| * P<0.05 ** P<0.01 vs 0.1 μmol·L-1Dex group. | |||||||||||||||||||||||||||||
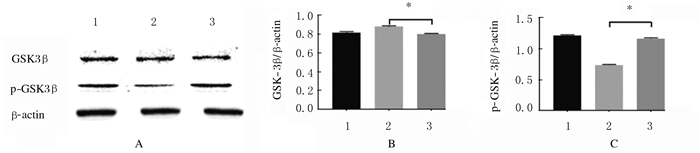
Western blotting法检测结果显示:与对照组比较,0.1 μmol·L-1Dex组INS-1细胞中GSK-3β蛋白表达水平升高;LiCl+0.1μmol·L-1 Dex组INS-1细胞中GSK-3β蛋白表达水平低于0.1 μmol·L-1Dex组(P < 0.05);与对照组比较,0.1 μmol·L-1Dex组INS-1细胞中p-GSK-3β蛋白表达水平降低,但差异无统计学意义P>0.05);LiCl+0.1μmol·L-1 Dex组INS-1细胞中p-GSK-3β蛋白表达水平高于0.1 μmol·L-1Dex组(P < 0.05)。见图 4。
|
| Lane 1:Control group; Lane 2:0.1μmol·L-1Dex group; Lane 3:LiCl+0.1μmol·L-1Dex group.1:Control group; 2:0.1μmol·L-1Dex group; 3: LiCl+0.1μmol·L-1Dex group; n=5, *P < 0.05 vs 0.1 μmol·L-1Dex group. 图 4 各组INS-1细胞中GSK-3β和p-GSK-3β蛋白表达电泳图(A)和直条图(B,C) Fig. 4 Electrophoregram(A) and histogram(B, C) of expressions of GSK-3β and p-GSK-3β proteins in INS-1 cells in various groups |
|
|
与对照组比较,0.1 μmol·L-1Dex组INS-1细胞中SOD蛋白表达水平降低(P < 0.05),iNOS和Nox4蛋白表达水平升高(P < 0.05);与0.1 μmol·L-1Dex组比较,LiCl+0.1 μmol·L-1 Dex组INS-1细胞中SOD蛋白表达水平升高(P < 0.05),iNOS和Nox4蛋白表达水平明显降低(P < 0.05或P < 0.01)。见图 5。
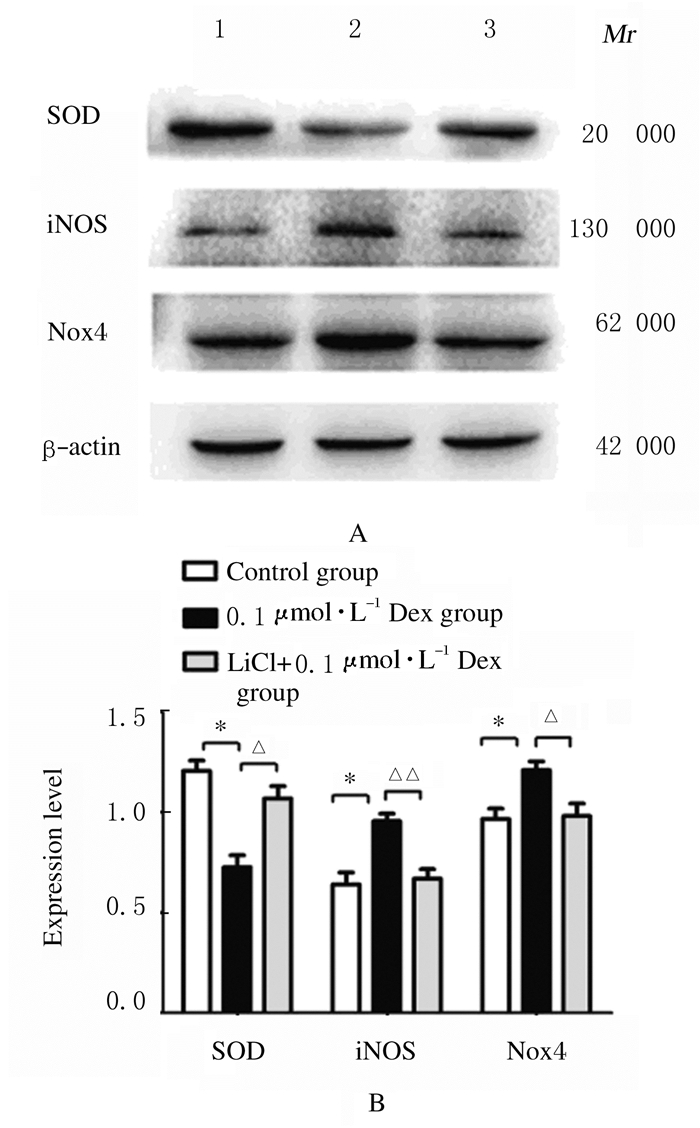
|
| Lane 1:Control group; Lane 2:0.1 μmol·L-1Dex group; Lane 3:LiCl+0.1 μmol·L-1Dex group.*P < 0.05 vs control group; △ P < 0.05, △△ P < 0.01 vs 0.1 μmol·L-1Dex group(n=5). 图 5 各组INS-1细胞中SOD、iNOS和Nox4蛋白表达电泳图(A)和直条图(B) Fig. 5 Electrophoregram(A) and histogram(B) of expressions of SOD, iNOS and Nox4 proteins in INS-1 cells in various groups |
|
|
与0.1μmol·L-1 Dex组比较,24 h后LiCl+0.1 μmol·L-1 Dex组INS-1细胞中ROS水平明显降低(P<0.05)。见图 6。
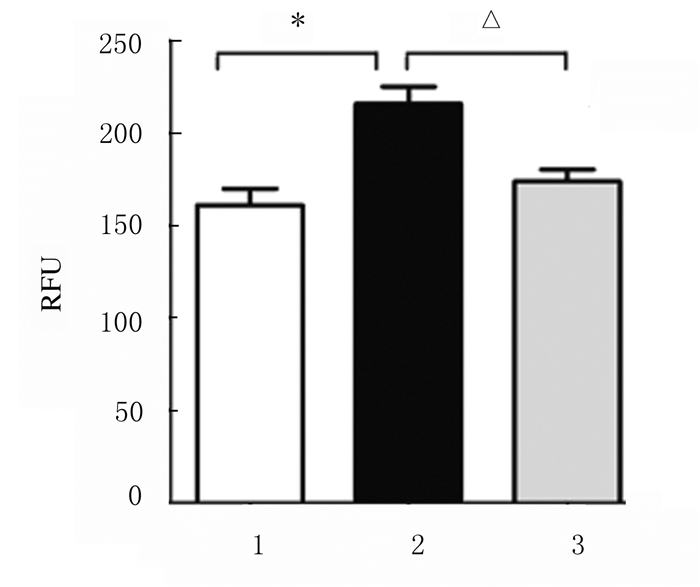
|
| 1:Control group; 2:0.1μmol·L-1Dex group; 3:LiCl+0.1μmol·L-1Dex group; *P < 0.05 vs control group; △P < 0.05 vs 0.1 μmol·L-1Dex group(n=5). 图 6 各组INS-1细胞中ROS水平 Fig. 6 ROS levels in INS-1 cells in various groups |
|
|
与0.1 μmol·L-1 Dex组比较,48 h后LiCl+ 0.1μmol·L-1Dex组INS-1细胞中NO水平明显降低(P<0.05)。见图 7。
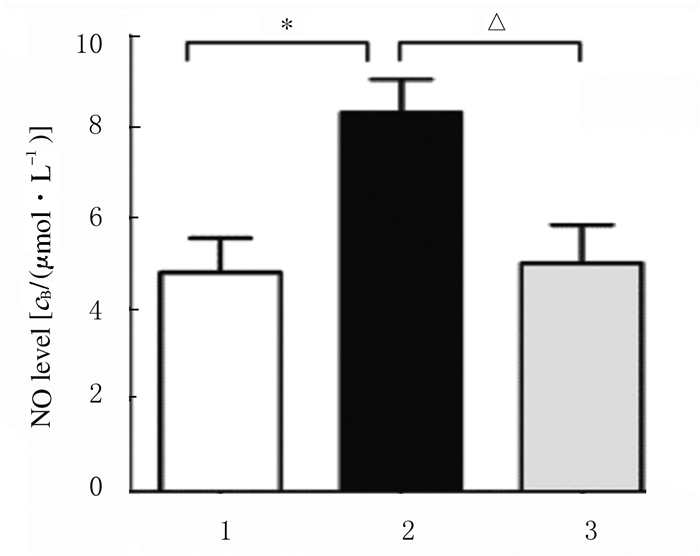
|
| 1:Control group; 2:0.1μmol·L-1Dex group; 3: LiCl+0.1μmol·L-1Dex group; *P < 0.05 vs control group; △P < 0.05 vs 0.1 μmol·L-1 Dex group (n=5). 图 7 各组INS-1细胞中NO水平 Fig. 7 NO levels in INS-1 cells in various groups |
|
|
GSK-3β是一种多功能丝氨酸/苏氨酸激酶,可参与细胞凋亡和增殖及糖原的合成等过程。有学者[17]发现糖尿病患者和动物模型中GSK-3水平明显升高,随后的小鼠胰岛素抵抗模型[14]中也证实敲除GSK-3β或使用GSK-3β抑制剂可以保护胰岛β细胞,预防糖尿病的发生[14]。LiCl是一种情绪稳定剂。早在1996年研究者就提出了LiCl可以选择性抑制GSK-3β。锂可以通过增加GSK-3β丝氨酸抑制性位点的磷酸化、降低GSK-3β Tyr-216位点的磷酸化抑制其活性[18]。但关于LiCl对Dex诱导的胰岛β细胞凋亡影响的报道较少。
本研究在Dex诱导的INS-1细胞凋亡过程中,将LiCl加入到含有Dex的培养基中,配制成LiCl-Dex混合培养基,观察胰岛β细胞凋亡情况。结果显示:LiCl+0.1μmol·L-1Dex组相对于0.1μmol·L-1Dex组细胞凋亡率明显降低,说明LiCl可抑制Dex诱导的INS-1细胞凋亡, 为了进一步验证GSK-3β在此凋亡中的作用,本课题组从基因和蛋白水平分别检测了LiCl加入前后细胞中GSK-3β表达的变化,结果显示LiCl可在一定程度上提高Dex诱导的GSK-3β磷酸化程度,从而抑制GSK-3β的活性。这与GOMEZ-SINTES等[19]在体内和体外实验中发现其抗凋亡的结论相一致, 说明LiCl可通过抑制GSK-3β的活性,在一定程度上减轻Dex诱导的胰岛β细胞凋亡。
研究[20-22]表明:糖尿病者胰岛β细胞功能性衰竭与氧化应激密切相关。采用抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine, NAC)作用于db/db小鼠胰腺β细胞,结果发现抗氧化剂治疗组小鼠胰岛凋亡细胞数明显减少[23]。可见氧化应激在胰岛β细胞凋亡中起到重要作用。本研究结果显示:氧化应激参与Dex诱导的胰岛β细胞凋亡,Dex诱导后INS-1细胞中iNOS表达水平上调使NO产生增加;并且该细胞促ROS生成的Nox4和p47phox水平升高,抗氧化酶SOD水平减少,提示Dex可使INS-1细胞的氧化应激反应增强,说明Dex诱导胰岛β细胞凋亡可能与GSK-3β活性升高和氧化应激反应增强有关。本研究观察了GSK-3β活性抑制剂LiCl对Dex诱导的INS-1细胞氧化应激的影响,结果显示:LiCl+0.1μmol·L-1Dex组INS-1细胞中SOD mRNA表达水平上调,Nox4,p47phox和iNOS mRNA表达水平下调,ROS和NO产生减少,进一步提示抑制GSK-3β活性可减少胰岛β细胞凋亡,且该机制与降低氧化应激反应有关。
综上所述,LiCl可通过促进GSK-3β磷酸化抑制GSK-3β的活性,在一定程度上使Dex诱导的胰岛β细胞凋亡减少,其机制可能与减轻氧化应激反应有关,但确切机制有待于进一步探讨。
| [1] |
MYLKA V, DECKERS J, RATMAN D, et al. The autophagy receptor SQSTM1/p62 mediates anti-inflammatory actions of the selective NR3C1/glucocorticoid receptor modulator compound A (CpdA) in macrophages[J]. Autophagy, 2018, 14(12): 2049-2064. DOI:10.1080/15548627.2018.1495681 |
| [2] |
IBRAHIM A, DAHLQVIST P, OLSSON T, et al. The clinical course after glucocorticoid treatment in patients with inflammatory bowel disease is linked to suppression of the hypothalamic-pituitary-adrenal axis: a retrospective observational study[J]. Therap Adv Gastroenterol, 2017, 10(11): 829-836. DOI:10.1177/1756283X17730748 |
| [3] |
TAMECHIKA SY, SASAKI K, HAYAMI Y, et al. Patient satisfaction and efficacy of switching from weekly bisphosphonates to monthly minodronate for treatment and prevention of glucocorticoid-induced osteoporosis in Japanese patients with systemic rheumatic diseases: a randomized, clinical trial[J]. Arch Osteoporos, 2018, 13(1): 67. |
| [4] |
SCHULTZ H, ENGELHOLM S A, HARDER E, et al. Glucocorticoid-induced diabetes in patients with metastatic spinal cord compression[J]. Endocr Connect, 2018, 7(5): 719-726. DOI:10.1530/EC-18-0088 |
| [5] |
YATA Y, HOSOJIMA M, KABASAWA H, et al. The assessment of the efficacy of dipeptidyl peptidase-4 inhibitors in patients with glucocorticoid-induced diabetes by continuous glucose monitoring[J]. Int Med, 2017, 56(19): 2555-2562. DOI:10.2169/internalmedicine.8296-16 |
| [6] |
TANABE K, LIU Z H, PATEL S, et al. Genetic deficiency of glycogen synthase kinase-3β corrects diabetes in mouse models of insulin resistance[J]. PLoS Biol, 2008, 6(2): e37. DOI:10.1371/journal.pbio.0060037 |
| [7] |
MORIN C, FARDET L. Systemic glucocorticoid therapy: risk factors for reported adverse events and beliefs about the drug.A cross-sectional online survey of 820 patients[J]. Clin Rheumatol, 2015, 34(12): 2119-2126. DOI:10.1007/s10067-015-2953-7 |
| [8] |
HARADA N, KATSUKI T, TAKAHASHI Y, et al. Androgen receptor silences thioredoxin-interacting protein and competitively inhibits glucocorticoid receptor-mediated apoptosis in pancreatic β-cells[J]. J Cell Biochem, 2015, 116(6): 998-1006. DOI:10.1002/jcb.25054 |
| [9] |
XIA Y C, RADWAN A, KEENAN C R, et al. Glucocorticoid insensitivity in virally infected airway epithelial cells is dependent on transforming growth factor-β activity[J]. PLoS Pathog, 2017, 13(1): e1006138. DOI:10.1371/journal.ppat.1006138 |
| [10] |
NISHIMURA H, NAKAMURA O, YAMAGAMI Y, et al. GSK-3 inhibitor inhibits cell proliferation and induces apoptosis in human osteosarcoma cells[J]. Oncol Rep, 2016, 35(4): 2348-2354. |
| [11] |
CHANG F, LIU J, FU H, et al. GSK-3β promotes PA-induced apoptosis through changing β-arrestin 2 nucleus location in H9c2 cardiomyocytes[J]. Apoptosis, 2016, 21(9): 1045-1055. DOI:10.1007/s10495-016-1272-z |
| [12] |
QUARTINI A, IANNITELLI A, BERSANI G. Lithium: from mood stabilizer to putative cognitive enhancer[J]. Neural Regen Res, 2016, 11(8): 1234-1235. DOI:10.4103/1673-5374.189175 |
| [13] |
WON E, KIM Y K. An oldie but goodie: lithium in the treatment of bipolar disorder through neuroprotective and neurotrophic mechanisms[J]. Int J Mol Sci, 2017, 18(12): E2679. DOI:10.3390/ijms18122679 |
| [14] |
PARK C H, LEE B H, AHN S G, et al. Serine 9 and tyrosine 216 phosphorylation of GSK-3β differentially regulates autophagy in acquired cadmium resistance[J]. Toxicol Sci, 2013, 135(2): 380-389. DOI:10.1093/toxsci/kft158 |
| [15] |
VALVASSORI S S, RESENDE W R, DAL-PONT G, et al. Lithium ameliorates sleep deprivation-induced mania-like behavior, hypothalamic-pituitary-adrenal (HPA) axis alterations, oxidative stress and elevations of cytokine concentrations in the brain and serum of mice[J]. Bipolar Disord, 2017, 19(4): 246-258. |
| [16] |
SILACHEV D N, PLOTNIKOV E Y, BABENKO V A, et al. Protection of neurovascular unit cells with lithium chloride and sodium valproate prevents brain damage in neonatal ischemia/hypoxia[J]. Bull Exp Biol Med, 2016, 160(3): 313-318. DOI:10.1007/s10517-016-3159-y |
| [17] |
NGUYEN H M, MEJIA E M, CHANG W G, et al. Reduction in cardiolipin decreases mitochondrial spare respiratory capacity and increases glucose transport into and across human brain cerebral microvascular endothelial cells[J]. J Neurochem, 2016, 139(1): 68-80. DOI:10.1111/jnc.13753 |
| [18] |
SUN H, JIANG Y J, YU Q S, et al. The effect of Li+ on GSK-3 inhibition: Molecular dynamics simulation[J]. J Mol Model, 2011, 17(2): 377-381. DOI:10.1007/s00894-010-0738-0 |
| [19] |
GÓMEZ-SINTES R, LUCAS J J. Neuronal apoptosis and motor deficits in mice with genetic inhibition of GSK-3 are Fas-dependent[J]. PLoS One, 2013, 8(8): e70952. DOI:10.1371/journal.pone.0070952 |
| [20] |
HASNAIN S Z, PRINS J B, MCGUCKIN M A. Oxidative and endoplasmic reticulum stress in β-cell dysfunction in diabetes[J]. J Mol Endocrinol, 2016, 56(2): R33-R54. |
| [21] |
MOON J S, KARUNAKARAN U, ELUMALAI S, et al. Metformin prevents glucotoxicity by alleviating oxidative and ER stress-induced CD36 expression in pancreatic beta cells[J]. J Diabetes Complicat, 2017, 31(1): 21-30. DOI:10.1016/j.jdiacomp.2016.09.001 |
| [22] |
LIU C G, MA Y P, ZHANG X J. Effects of mulberry leaf polysaccharide on oxidative stress in pancreatic β-cells of type 2 diabetic rats[J]. Eur Rev Med Pharmacol Sci, 2017, 21(10): 2482-2488. |
| [23] |
刘萍, 农晰婷, 刘晓霞, 等. Vaspin通过胰岛素信号通路改善地塞米松诱导的3T3-L1脂肪细胞的胰岛素抵抗[J]. 西安交通大学学报:医学版, 2018, 39(3): 366-370. |
 2019, Vol. 45
2019, Vol. 45


