扩展功能
文章信息
- 李胜男, 陈吴海, 陈少凤, 邓福, 朱佩仪, 李友
- LI Shengnan, CHEN Wuhai, CHEN Shaofeng, DENG Fu, ZHU Peiyi, LI You
- RHBDF2-shRNA慢病毒载体的构建和Neuro-2a-RHBDF2-shRNA稳转细胞系的建立
- Construction of RHBDF2-shRNA lentiviral vector and establishment of stably transfected Neuro-2a-RHBDF2-shRNAcell line
- 吉林大学学报(医学版), 2019, 45(06): 1224-1230
- Journal of Jilin University (Medicine Edition), 2019, 45(06): 1224-1230
- 10.13481/j.1671-587x.20190606
-
文章历史
- 收稿日期: 2019-03-29
2. 中国热带农业科学院农产品加工研究所, 广东 湛江 524001;
3. 广东医科大学附属医院神经病学研究所, 广东 湛江 524001
2. Agricultural Products Processing Research Institute, Chinese Academy of Tropical Agricultural Sciences, Zhanjiang 524001, China;
3. Institute of Neurology, Affiliated Hospital, Guangdong Medical University, Zhanjiang 524001, China
菱形蛋白酶最早在果蝇中被发现[1],由膜整合丝氨酸蛋白酶位点及其无活性的同源物组成[2],哺乳动物的菱形蛋白家族包括14个蛋白成员[3],均具有6或7个跨膜结构域,通过切割表皮生长因子受体(epidermal growth factor receptor,EGFR)的配体Spitz,在EGFR信号传导中发挥重要作用[4]。非活性菱形蛋白(inactive rhomboid proteins,iRhoms)是菱形蛋白超家族的非蛋白酶成员[5],分为iRhom1(又称RHBDF1)和iRhom2(又称RHBDF2)2种蛋白,均在不同物种之间高度保守,但是因不具有其他菱形蛋白酶所包含的关键催化基序[2],其在进化过程中失去了蛋白酶活性。iRhoms是肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)转化酶(TNF-α convertase,TACE,又称ADAM17)的主要调节因子[6-7],其中RHBDF2仅在巨噬细胞中高表达,在皮肤或其他组织中均不表达[8]。当病原体入侵时,巨噬细胞分泌大量的TNF-α,这时RHBDF2与TACE相互作用,促进TNF-α从TACE上脱落[9],使活化的TNF-α从内质网排出[6, 10],因此RHBDF2对于TACE的成熟和向造血细胞表面的运输至关重要。RHBDF2敲除小鼠具有特异性的炎症缺陷,因其不能释放有活性的TNF-α以响应脂多糖或特定病原体的免疫激活[11]而影响对病原体的全身免疫应答。因此RHBDF2促进TNF-α分泌的特定作用也为炎症的调节提供了新的靶点[11]。
研究[12]表明:在大脑发育早期,RHBDF2基因甲基化状态的改变会影响阿尔茨海默病(Alzheimer’ s disease,AD)的病理进程。RHBDF2与AD易感基因PTK2B有紧密联系,PTK2B是参与调节小胶质细胞和巨噬细胞活化的信号级联关键元件[12-13]。研究[12, 14-15]显示:在骨髓细胞中,RHBDF2与PTK2B连接对于TACE从细胞表面释放TNF-α的转运过程是必需的,且AD患者大脑组织中RHBDF2基因的去甲基化会引起RHBDF2表达的增加,从而导致TNF-α的TACE依赖性释放增强,进而加剧AD的炎症反应,说明RHBDF2-PTK2B/ TACE/TNF-α可能是AD后期的关键调节通路。研究表明:抑制小胶质细胞中RHBDF2-PTK2B/TACE/TNF-α信号通路可能为AD的治疗提供新的思路[16]。本研究构建FV067-RHBDF2-shRNA干扰慢病毒载体,建立Neuro-2a-RHBDF2-shRNA稳转细胞株,旨在为进一步研究阻断RHBDF2/TACE/TNF-α通路能否抑制β淀粉样蛋白(amyloid β-protein, Aβ)斑块的激活及AD的预防和治疗奠定基础。
1 材料与方法 1.1 细胞系、质粒、主要试剂和仪器人肾上皮细胞系(HEK 293T)和小鼠神经瘤母细胞系(mouse neuroblastoma N2a cells,Neuro-2a)均购于中国科学院上海细胞库。载体质粒FV067-RNAi-EGFP-Puro(FV067 Vector)、辅助质粒psPAX2(pHelper1)和辅助质粒pMD2G(pHelper2)均购于上海复百澳公司。TOP10感受态细胞(北京鼎国生物公司),限制性内切酶EcoRⅠ、AgeⅠ和T4 DNA连接酶Lipofectamine 2000和DNase Ⅰ (Rnase-free)及DNA聚合酶(美国NEB公司),10×Annealing Buffer(美国OriGene公司),质粒抽提试剂盒和胶回收试剂盒(天根生物公司),PBS、DMEM高糖培养基、0.05% Trypsin-EDTA(1×)、MEM培养基胎牛血清、Opti-MEM反转录试剂盒(Revert Acid First Strand cDNA Synthesis Kit)和蛋白定量试剂盒(Pierce BSA Protein Assay Kit,美国Thermo Scientific公司),总RNA提取试剂(日本宝生物公司),2×RealStar Green Power Mixture试剂盒(北京康润生物公司),Puromycin(美国Sigma公司),一抗Anti-RHBDF2 Antibody(英国Biorbyt公司),一抗Anti-β-actin、二抗Anti-rabbit IgG HRP-Linked Antibidy和二抗Anti-mouse IgG HRP-Linked Antibidy(美国CST公司)。Roche LightCycler96实时荧光定量PCR仪(美国罗氏公司),Mini-PROTEIN垂直蛋白电泳仪(美国BioRad公司),PCR仪(型号AB2720,美国Applied Biosystems公司)。
1.2 引物设计和合成在NCBI上查找目的基因RHBDF2(Gene ID:217344)的序列(Rhomboid 5 homolog 2, 又称iRhom2)[Musmusculus (house mouse)],根据RNAi序列的设计原则,通过http://sirna.wi.mit.edu/网站得到siRNA序列,并设计出靶基因干扰序列,其中RHBDF2-shRNA:5′-GCATCTCCATCATCTTCATCC-3′,EGFP-shRNA:5′-TTCTCCGAACGTGTCACG- T-3′。根据干扰序列设计RHBDF2-shRNA-oligo和对照组EGFP-shRNA-oligo这2对干扰引物(表 1)。本实验所使用的引物均由上海生工生物工程公司合成。
| Primer | 5′Sequence | Target sequence (Forward) | Stemloop | Target sequence (Reverse) | 3′Sequence |
| RHBDF2-shRNA-oligo-F | CCGG | GCATCTCCATCATCTTCATCC | CTCGAG | GGATGAAGATGATGGAGATGC | TTTTTG |
| RHBDF2-shRNA-oligo-R | AATTCAAAAA | GCATCTCCATCATCTTCATCC | CTCGAG | GGATGAAGATGATGGAGATGC | |
| EGFP-shRNA-oligo-F | CCGG | TTCTCCGAACGTGTCACGT | CTCGAG | ACGTGACACGTTCGGAGAA | TTTTTG |
| EGFP-shRNA-oligo-R | AATTCAAAAA | TTCTCCGAACGTGTCACGT | CTCGAG | ACGTGACACGTTCGGAGAA |
将合成的RHBDF2干扰引物加入PCR退火体系中,RHBDF2-shRNA-RNAi-oligo-F 1 μL,RHBDF2-shRNA-RNAi-oligo-R 1 μL,10×Anealing Buffer 5 μL,ddH2O 43 μL,共50 μL。PCR程序:37℃、30 min,95℃、5 min,然后按照每分钟降低5℃的速度降至25℃。酶切并回收FV067 Vector,酶切体系:FV067 Vector 1 μL (0.5~1.0 μg),10×NEB Buffer #1 3 μL,AgeⅠ1 μL,EcoRⅠ1 μL,ddH2O 14 μL,共20 μL。将反应体系置于37 ℃水浴锅,孵育4 h。使用胶回收试剂盒回收酶切好的载体。随后将退火产物和FV067 Vector进行连接:ddH2O 6.5 μL,FV067 Vector 1 μL,退火产物5 μL,10×T4 DNA Ligase Buffer 1.5 μL,T4 DNA Ligase 1 μL,共15 μL。16 ℃连接过夜,将连接产物转化至大肠杆菌TOP中,次日挑取单克隆,进行菌落PCR鉴定。鉴定体系:ddH2O 9.2 μL,2×Taq Plus Master Mix 10 μL,PCR-F (10 μmol·L-1)0.4 μL,PCR-R (10 μmol·L-1) 0.4 μL,挑取单菌落加入上述体系中。菌落PCR鉴定引物:上游引物5′-CCATGATTCCTTCATATTTGC-3′,下游引物5′-AATCGCCGAGAAGGGACTAC-3′;PCR反应条件:94 ℃、3 min,94 ℃、30 s,55 ℃、30 s,72 ℃、1 min,72 ℃、5 min,共22个循环。将鉴定成功的阳性克隆摇菌,送上海生工生物工程公司进行测序。抽提测序成功的质粒用于以下实验。
1.4 FV067-RHBDF2- shRNA慢病毒的包装和收集将HEK293T细胞置于4个直径为100 mm的细胞培养皿中,次日进行细胞转染。转染体系分为Mixture A: 750 μL Opti-MEM+10 μg FV067-RHBDF2-shRNA+5 μg psPAX2+5 μg pMD2G;Mixture B: 750 μL Opti-MEM+15 μL Lipofectamine 2000;将A和B体系分别混匀,室温避光静置5 min,随后将B体系转移到A体系中,混匀后室温避光孵育20 min。期间,将100 mm培养皿中的HEK293T细胞生长培养基换成3 mL Opti-MEM。20 min后,将转染混合物轻轻滴加到100 mm培养皿中,混匀后置于37℃细胞培养箱中转染4 h。4 h后,换100 mm培养皿中的无血清转染体系,加入15 mL HEK293T细胞生长培养基继续培养48 h。在荧光显微镜下观察转染效率,待转染效率达80%左右时,即可收集上清培养液,使用0.45 μm的滤膜过滤后,低温超高速离心,弃上清,采用预冷的DPBS溶解病毒沉淀。
1.5 FV067-RHBDF2-shRNA慢病毒滴度的测定和Neuro-2a-FV067-RHBDF2-shRNA稳转细胞系的建立传代时将Neuro-2a细胞以每孔1×104个的密度接种于96孔板中,次日准备4个1.5 mL EP管并标记为1~4号,分别加入90 μL新配置的Neuro-2a生长培养基,在1号管中加入10 μL FV067-RHBDF2-shRNA慢病毒原液。混匀后吸取1号管中10 μL病毒混合液加入2号管中,2号管混匀后再吸取10 μL病毒混合液于3号管中。以此类推每次稀释10倍,做4个10倍稀释梯度。吸去96孔板中的生长培养基,将混匀的4个EP管病毒混合液分别加入标记为10、1、10-1、10-2的96孔板中,每个梯度设置5个重复。置于37℃培养箱中培养72 h,观察96孔板中绿色荧光蛋白的比例, 计算病毒滴度。病毒滴度(TU·mL-1)=绿色荧光细胞的数目/相应的慢病毒原液加入量。将Neuro-2a细胞按照每孔1×105个的密度接种于24孔板中,次日设置4组病毒最佳感染复数(multiplicity of infection, MOI):25、50、75和100。根据病毒滴度和MOI值分别计算出所需的慢病毒原液量,并进行细胞感染。将不同体积的慢病毒分别加入标记好的24孔板中,每组设置3个重复。慢病毒感染72 h后观察4组细胞中携带绿色荧光的细胞,当MOI=50时,成功感染慢病毒且生长状态良好的细胞数达90%以上,因此选择MOI=50进行随后的慢病毒感染实验。确定病毒滴度和MOI后,计算每次实验所需的病毒量。实验所需病毒量=MOI×铺板细胞数/病毒滴度。设置5个嘌呤霉素筛选浓度(0、0.5、1.0、2.0和4.0 mg·L-1),当嘌呤霉素的工作浓度为2.0 mg·L-1时,细胞于1周内全部死亡,故选择2.0 mg·L-1嘌呤霉素作为最低致死浓度筛选成功感染慢病毒的Neuro-2a细胞系。待筛选2周后,以0.5 mg·L-1嘌呤霉素作为维持筛选浓度继续培养细胞。
1.6 实时荧光定量PCR法检测2组细胞中RHBDF2 mRNA表达水平收集对照组FV067 Vector和实验组FV067-RHBDF2-shRNA稳转细胞系,使用TRIzol裂解细胞,随后加入氯仿分离出上层水相,加入等体积的异丙醇沉淀RNA,使用75%乙醇洗涤RNA沉淀。选择高纯度的RNA,检测其吸光度(A)值,使得A(260)/A(280)比值为1.8~2.0,采用DNase Ⅰ去除杂质DNA后进行随后的逆转录实验。在PCR管中加入1 μg RNA、8 μL DEPC-H2O和1 μL oligo-dT,总体积为10 μL;PCR仪上70℃变性5 min,之后迅速将PCR管置于冰上冷却;准备下列试剂的混合物:5×Reaction Buffer 4 μL、2.5 mmol·L-1 dNTP Mixture 4 μL、RNase Inhibitor 1 μL、MMLV Reverse Transcriptase 1 μL。将以上混合液(10 μL)加入PCR管中,轻轻吹打混匀;PCR仪上42℃、1 h,70℃、5 min。采用2×RealStar Green Power Mixture检测对照组FV067 Vector和实验组FV067-RHBDF2-shRNA稳转细胞系中RHBDF2 mRNA表达水平。实时荧光定量PCR反应体系:cDNA(10~100 ng)0.4 μL,RHBDF2/GAPDH上游引物(10 μmol·L-1)0.4 μL,RHBDF2/GAPDH下游引物(10 μmol·L-1)0.4 μL,2×RealStar Green Fast Mixture 10 μL,采用RNase-free H2O补足至20 μL。采用实时荧光定量PCR扩增程序:95℃、2 min,95℃、15 s,60℃、30 s,72℃、30 s,40个循环。该反应中RHBDF2和GAPDH的RT-PCR引物:RHBDF2上游引物5′- TGCTGCTATGACCCCGTTTT-3′,RHBDF2下游引物5′-CTCACGAGTCCACGGACAAA-3′;GAPDH上游引物5′-AGGTCAATGAAGGGGTCGTT-3′,GAPDH下游引物5′- AAATGGTGAAGGTCGGTGTG-3′。以GAPDH为内参,分别检测2种Neuro-2a慢病毒稳转细胞系中RHBDF2 mRNA表达水平。通过2-ΔΔCt法计算RHBDF2 mRNA表达水平,实验重复3次。ΔCt=目的基因(RHBDF2)的Ct平均值-内参基因(GAPDH)的Ct平均值,ΔΔCt=实验组ΔCt-对照组ΔCt。
1.7 免疫印记法检测2组细胞中RHBDF2蛋白表达水平分别收集Neuro-2a-FV067 Vector(对照组)和Neuro-2a-FV067-RHBDF2-shRNA慢病毒(实验组)稳转细胞系,采用新配置的RIPA裂解液冰上裂解细胞20 min后,4 ℃、12 000 r·min-1离心10 min,吸取上清后采用BCA法进行蛋白定量,取每孔40 μg蛋白上样,电泳恒压50 V、30 min;恒压90 V、120 min。跑胶完成后,将PVDF膜在甲醇中活化1 min,恒流200 mA,转膜90 min。T-BST洗膜3次,以5%牛奶4 ℃封闭过夜,次日将膜用T-BST洗涤3次后分别置于使用5% BSA配置的Anti-RHBDF2(1:1 000)或Anti-β-actin(1:1 000)一抗稀释液中,室温孵育1.5 h后,T-BST洗膜3次,再使用二抗稀释液Anti-rabbit IgG HRP-Linked Antibidy(1:2 000)和Anti-mouse IgG HRP-Linked Antibidy(1:2 000)室温孵育1.5 h,T-BST洗膜3次后通过免疫印记法检测2组稳转细胞系中RHBDF2蛋白表达水平,采用Image J软件分析,以目标蛋白条带与内参蛋白条带灰度值的比值表示RHBDF2蛋白的表达水平,取3次独立实验结果的均值。
1.8 统计学分析采用Graphpad Prism 5.0统计软件进行统计学分析。2组稳转细胞系中RHBDF2 mRNA和蛋白表达水平以x±s表示,采用Kolmogorov-Smirnov法进行正态性检验,如果P>0.1,则表示呈正态分布,多组间样本均数比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
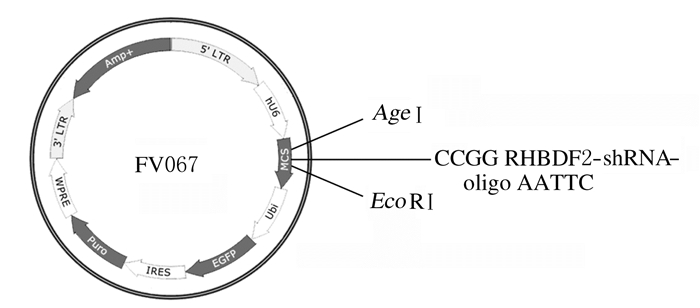
2 结果 2.1 FV067-RHBDF2-shRNA干扰慢病毒载体的构建将RHBDF2-shRNA-oligo退火后连接至FV067载体中,选取FV067-RHBDF2-shRNA的阳性克隆送样测序。将测序结果与设计的RHBDF2-shRNA-oligo进行比对分析,发现在测序结果的发夹结构中,干扰序列与之前设计合成的目的片段完全一致(图 1,见插页二),说明已经成功地将RHBDF2基因的干扰片段克隆至FV067 Vector载体中,FV067-RHBDF2-shRNA干扰慢病毒载体构建成功(图 2)。
|
| 图 1 FV067-RHBDF2-shRNA重组慢病毒载体测序结果 Fig. 1 Sequencing results of FV067-RHBDF2-shRNA recombinant lentiviral vector |
|
|
|
| 图 2 FV067-RHBDF2-shRNA干扰慢病毒载体的构建 Fig. 2 Construction of FV067-RHBDF2-shRNA interference lentiviral vector |
|
|
将FV067 Vector和FV067-RHBDF2-shRNA分别与辅助质粒共转染至HEK 293T细胞中,转染48 h后收集并浓缩慢病毒,检测出FV067 Vector慢病毒的滴度为5×108 TU·mL-1,FV067-RHBDF2-shRNA慢病毒的滴度为3×108 TU·mL-1(图 3,见插页二)。选择MOI=50的慢病毒感染Neuro-2a细胞,使用2 mg·L-1嘌呤霉素筛选未被慢病毒感染的Neuro-2a细胞,成功筛选出Neuro-2a-FV067 Vector(对照组)和Neuro-2a-FV067-RHBDF2-shRNA(实验组)慢病毒稳转细胞系(图 4,见插页二)。

|
| 图 3 不同浓度慢病毒感染293T细胞后细胞中绿色荧光蛋白表达(×100) Fig. 3 Expressions of green fluorescent protein in 293T cells after infected with different concentrations of lentivirus(×100) |
|
|

|
| A-C:FV067 Vector; D-F:FV067-RHBDF2-shRNA; A, D:Phase; B, E:GFP; C, F:Merge. 图 4 FV067 Vector和FV067 -RHBDF2-shRNA稳转细胞株的筛选(×20) Fig. 4 Screening of FV067 Vector and FV067-RHBDF2-shRNA stable cell lines (×20) |
|
|
采用TRIzol裂解FV067 Vector和FV067-RHBDF2-shRNA稳转细胞系并提取RNA,通过反转录和RT-PCR,检测Neuro-2a-FV067 Vector和Neuro-2a-FV067-RHBDF2-shRNA慢病毒稳转细胞系中RHBDF2 mRNA表达水平。RT-qPCR结果显示:与对照组(1.10400±0.02778)比较,实验组稳转细胞系中RHBDF2 mRNA的表达水平(0.52700±0.08526)降低了52.26%(t=11.44,P=0.0076)。
2.4 2组稳转细胞系中RHBDF2蛋白表达水平收取FV067 Vector和FV067-RHBDF2-shRNA稳转细胞系的蛋白,以β-actin作为内参,采用免疫印记法进行检测;与对照组(1.3270±0.2812)比较,实验组(0.7033±0.1397)稳转细胞系中RHBDF2蛋白表达水平降低了47%(t=6.374,P=0.0078)。见图 5。

|
| Lane 1:Control group; Lane 2:Experiment group. 图 5 稳转细胞系中RHBDF2蛋白表达电泳图 Fig. 5 Electrophoregram of expressions of RHBDF2 protein in stably transfected cell lines |
|
|
AD是一种起病隐匿、进展缓慢、与神经炎性反应密切相关的神经退行性疾病,可能会严重影响大脑的正常活动[16]。据不完全统计,目前全世界总共有超过4 000万AD患者[17]。AD的病理学主要特征是Aβ斑块和由Tau蛋白组成的神经原纤维缠结(NFT)。研究[18]表明:炎性反应在AD发病机制的后期发挥重要的作用,其中反应性神经胶质增生是AD大脑中的特征性事件。Aβ可以激活小胶质细胞[15],还会引起相关星形胶质细胞的增生[19],反应性星形胶质细胞可以包围Aβ斑块和Tau缠结,进而处于持续激活状态,促进神经炎症反应,导致不同细胞因子如白细胞介素和TNF-α的合成[20]。在这种情况下,神经胶质细胞就失去了其原本的稳态功能,过度释放炎症因子,进一步导致了神经元的损伤,也加重了AD的病理进程[21]。因此,找到能够恢复神经胶质细胞生理功能并能进一步控制神经炎症的靶点为AD的治疗提供了新的方向[18]。
研究[2]表明:作为一类具有独特结构域并且无催化活性基序的Rhomboid家族独特成员,RHBDF2主要在免疫系统的巨噬细胞和大脑胶质细胞等免疫细胞中表达[16]。研究[22]显示:尽管RHBDF2无蛋白酶活性,却可以与TACE相互作用,激活小胶质细胞中TACE依赖性促炎细胞因子TNF-α的释放,在神经炎症和神经退行性疾病中起重要的作用[16]。研究[12-13]显示:AD与大脑中RHBDF2甲基化变化之间存在着紧密的联系。在发生AD时,RHBDF2基因的甲基化水平发生了变化,并且RHBDF2的表达水平也明显提高。DE等[12]的研究表明:RHBDF2可以与AD易感基因PTK2B结合,在AD后期PTK2B参与调控小胶质细胞和巨噬细胞的活化。RHBDF2与PTK2B的关系进一步表明RHBDF2可能与活化的小胶质细胞和巨噬细胞在AD病理过程中的作用有关[12],这为AD的治疗提供了新的方向。如果RHBDF2/TACE/TNF-α途径确实能够抑制Aβ的激活,并且阻断该途径可以改善AD动物模型的认知障碍,RHBDF2很可能成为预防神经炎症引起的认知衰退疾病新的靶标[16]。
综上所述,本研究成功构建了FV067-RHBDF2-shRNA干扰慢病毒载体,并成功建立Neuro-2a-FV067-RHBDF2-shRNA稳转细胞株。通过实时荧光定量PCR和免疫印记法双重验证了稳转细胞株中RHBDF2的干扰效率,证明本研究成功包装了FV067-RHBDF2-shRNA干扰慢病毒,为今后深入研究RHBDF2-PTK2B/TACE/TNF-α信号通路在AD病理进程中的机制奠定了基础,也为AD的有效治疗提供了新的靶点和方向。
| [1] |
STURTEVANT M A, ROARK M, BIER E. The Drosophila rhomboid gene mediates the localized formation of wing veins and interacts genetically with components of the EGF-R signaling pathway[J]. Genes Dev, 1993, 7(6): 961-973. DOI:10.1101/gad.7.6.961 |
| [2] |
FREEMAN M. The rhomboid-like superfamily: molecular mechanisms and biological roles[J]. Annu Rev Cell Dev Biol, 2014, 30(7): 235-254. |
| [3] |
BERGRBOLD N, LEMBERG M K. Emerging role of rhomboid family proteins in mammalian biology and disease[J]. Biochim Biophys Acta, 2013, 1828(12): 2840-2848. DOI:10.1016/j.bbamem.2013.03.025 |
| [4] |
HOSUR V, FARLEY M L, BURZENSKI L M, et al. ADAM17 is essential for ectodomain shedding of the EGF-receptor ligand amphiregulin[J]. FEBS Open Biol, 2018, 8(4): 702-710. DOI:10.1002/2211-5463.12407 |
| [5] |
CHRISTOVA Y, ADRAIN C, BAMBROUGH P, et al. Mammalian iRhoms have distinct physiological functions including an essential role in TACE regulation[J]. EMBO Rep, 2013, 14(10): 884-890. DOI:10.1038/embor.2013.128 |
| [6] |
CHEN X G, MIN X X, YU T Q, et al. iRhom2 loss alleviates renal injury in long-term PM2.5-exposed mice by suppression of inflammation and oxidative stress[J]. Redox Biol, 2018, 19: 147-157. DOI:10.1016/j.redox.2018.08.009 |
| [7] |
GEESALA R, SCHANZ W, BIGGS M, et al. Loss of RHBDF2 results in an early-onset spontaneous murine colitis[J]. J Leukoc Biol, 2019, 105(4): 767-781. DOI:10.1002/JLB.4A0718-283RR |
| [8] |
LICHTENTHALER S F. iRHOM2 takes control of rheumatoid arthritis[J]. J Clin Invest, 2013, 123(2): 560-562. |
| [9] |
CHAO H C, WEI H, HONG F W, et al. iRhom2 promotes atherosclerosis through macrophage inflammation and induction of oxidative stress[J]. Biochem Biophys Res Commun, 2018, 503(3): 1897-1904. DOI:10.1016/j.bbrc.2018.07.133 |
| [10] |
LEE M Y, KANG J S, GO R E, et al. Collagen-induced arthritis analysis in rhbdf2 knockout mouse[J]. Biomol Ther (Seoul), 2018, 26(3): 298-305. DOI:10.4062/biomolther.2017.103 |
| [11] |
SIGGS O M, XIAO N, WANG Y, et al. iRhom2 is required for the secretion of mouse TNF-a[J]. Blood, 2012, 119(24): 5769-5771. |
| [12] |
DE J P, SRIVASTAVA G, LUNNON K, et al. Alzheimer's disease: early alterations in brain DNA methylation at ANK1, BIN1, RHBDF2 and other loci[J]. Nat Neurosci, 2014, 17(9): 1156-1163. DOI:10.1038/nn.3786 |
| [13] |
LUNNON K, SMITH R, HANNON E, et al. Methylomic profiling implicates cortical deregulation of ANK1 in Alzheimer's disease[J]. Nat Neurosci, 2014, 17(9): 1164-1170. DOI:10.1038/nn.3782 |
| [14] |
ADRAIN C, ZETTL M, CHRISTOVA Y, et al. Tumor necrosis factor signaling requires iRhom2 to promote trafficking and activation of TACE[J]. Science, 2012, 335(6065): 225-228. DOI:10.1126/science.1214400 |
| [15] |
HEPPENER F L, RANSOHOFF R M, BECHER B. Immune attack: the role of inflammation in Alzheimer disease[J]. Nat Rev Neurosci, 2015, 16(6): 358-372. DOI:10.1038/nrn3880 |
| [16] |
LICHTENTHALER S F, HARA B F, BLOBEL C P. iRhoms in the brain-a new frontier[J]. Cell Cycle, 2015, 14(19): 3003-3004. DOI:10.1080/15384101.2015.1084187 |
| [17] |
LOERA V R, PIRAS A, ISMAIL M, et al. Targeting Alzheimer's disease with gene and cell therapies[J]. J Intern Med, 2018, 284(1): 2-36. DOI:10.1111/joim.12759 |
| [18] |
BRONZUOLI M R, IACOMINO A, STEARDO L, et al. Targeting neuroinflammation in Alzheimer's disease[J]. J Inflamm Res, 2016, 9(11): 199-208. |
| [19] |
SERRANO P A, MATTEW P F, ELIEZERl M, et al. Neuropathological alterations in Alzheimer disease[J]. Cold Spring Harb Perspect Med, 2011, 1(1): a006189. |
| [20] |
VON B R, TICHAUER J E, EUGENIN J. Aging-dependent changes of microglial cells and their relevance for neurodegenerative disorders[J]. J Neurochem, 2010, 112(5): 1099-1114. DOI:10.1111/j.1471-4159.2009.06537.x |
| [21] |
BLOCK M L, HONG J S. Microglia and inflammation-mediated neurodegeneration: multiple triggers with a common mechanism[J]. Prog Neurobiol, 2005, 76(2): 77-98. DOI:10.1016/j.pneurobio.2005.06.004 |
| [22] |
LEE M Y, NAM K H, CHOI K C. iRhoms; its functions and essential roles[J]. Biomol Ther (Seoul), 2016, 24(2): 109-114. DOI:10.4062/biomolther.2015.149 |
 2019, Vol. 45
2019, Vol. 45


